O implante de valva aórtica transcateter (TAVI) é uma alternativa para pacientes com estenose aórtica de alto risco cirúrgico e para muitos daqueles considerados inoperáveis. Apesar de sua característica minimamente invasiva, podem ocorrer complicações relacionadas ao procedimento. Obstrução coronária durante o TAVI é uma complicação rara, com incidência inferior a 1%, mas potencialmente letal. Em nosso país, essa complicação foi encontrada em 0,72% dos procedimentos 3 de 418 casos do Registro Brasileiro de Implante de Bioprótese Aórtica por Cateter com mortalidade hospitalar de 100%. Apresentamos, neste relato de caso, medidas de prevenção e tratamento de oclusão coronária após o TAVI.
Transcatheter aortic valve implantation (TAVI) is an alternative for patients with aortic stenosis at high surgical risk and for many of those considered inoperable. Despite its minimally invasive features, complications related to the procedure may occur. Coronary obstruction during TAVI is a rare (incidence rate of less than 1%) but potentially lethal complication. In Brazil, this complication was found in 0.72% of procedures – three of 418 cases from the Brazilian Transcatheter Aortic Valve Implantation Registry – with an in‐hospital mortality rate of 100%. This case report presents prevention and treatment measures for coronary occlusion after TAVI.
O implante de valva aórtica transcateter (TAVI) é o tratamento de escolha para pacientes inoperáveis com estenose aórtica, desde que a expectativa de vida seja superior a 12 meses. TAVI é ainda uma alternativa à cirurgia para pacientes de alto risco, conforme o escore da Society of Thoracic Surgeons (STS) de > 8 e < 15.1 Apesar de menos invasivo, o TAVI se caracteriza por taxa expressiva de complicações graves, fatais e não fatais, dentre as quais se destaca a oclusão coronariana (OC). As diretrizes europeias consideram que o risco de OC é alto quando há calcificação assimétrica da válvula, óstio coronariano baixo e seio de Valsalva pequeno. Um risco alto de oclusão é contraindicação relativa para TAVI.2
A OC durante o TAVI é um evento raro, ocorrendo em menos de 1% dos casos nos registros e ensaios clínicos mais recentes. No entanto, é uma complicação potencialmente letal.3–6 No Registro Brasileiro de Implante de Bioprótese Aórtica por Cateter (RIBAC), a OC ocorreu em 3 (0,72%) dos 418 procedimentos, com mortalidade hospitalar de 100%.4,5
Desde o primeiro relato de OC relacionada ao TAVI em humanos em 2006,7 há um esforço dos investigadores para identificar fatores preditores da complicação. No entanto, quando mesmo nos casos de maior risco de OC decide‐se por realizar o TAVI, algumas medidas podem ser adotadas para evitar e tratar a OC, como as que apresentamos neste relato de caso.
Relato de casoPaciente de 78 anos, do sexo feminino, apresentava insuficiência cardíaca tipo funcional III por estenose valvar aórtica grave. Tinha como antecedentes clínicos doença arterial coronariana tratada com angioplastia e implante de dois stents convencionais em 2010; implante de marca‐passo definitivo em 2002; hipertensão arterial sistêmica; doença cerebrovascular com estenose carotídea assintomática (lesão de 65% na artéria carótida interna direita); lúpus eritematoso sistêmico; hepatite crônica por vírus C; e prótese total de quadril esquerdo em 2009.
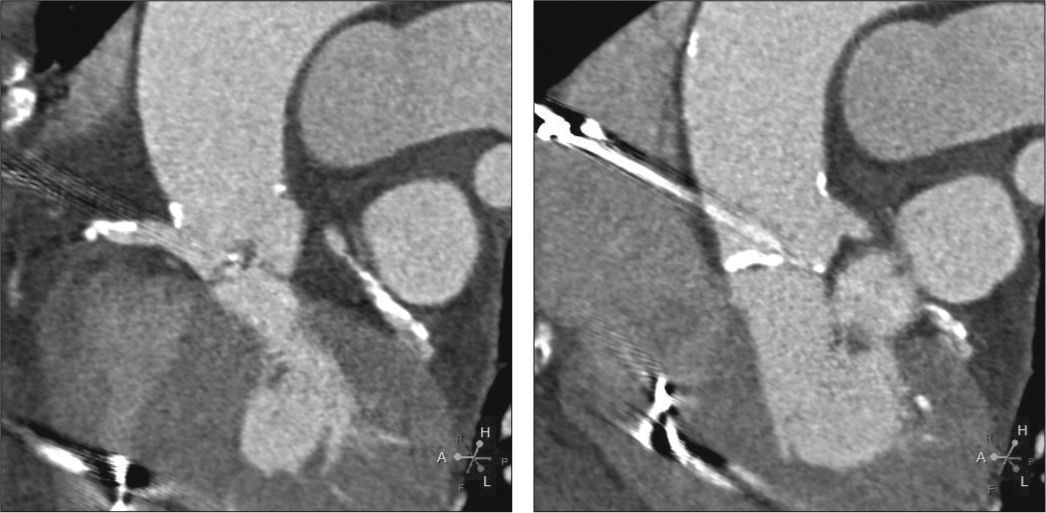
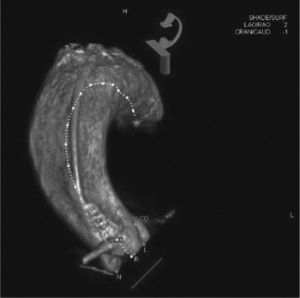
A ecocardiografia mostrou válvula aórtica tricúspide com importante calcificação, mobilidade reduzida, leve refluxo e área de 0,55cm, gradientes transvalvar máximo e médio de 70mmHg e de 43mmHg, respectivamente, e função sistólica do ventrículo esquerdo (VE) normal. A cineangiocoronariografia evidenciou reestenose intra‐stent de 90% na artéria coronária direita (ACD) e de 70% na artéria descendente anterior (ADA), além de estenose segmentar de 90% na artéria circunflexa (ACX). A angiotomografia mostrou anel aórtico de 21mm de diâmetro, seio de Valsalva de 27mm de diâmetro, relação entre diâmetro do seio de Valsalva/diâmetro do anel de 1,29mm, altura do óstio da ACD de 8,6mm e do tronco da artéria coronária esquerda (ACE) de 10mm. O comprimento da cúspide coronariana esquerda mediu 11mm, e a da direita, 11,5mm (fig. 1). Os exames laboratoriais eram normais, com uma dosagem de creatinina de 1,1mg/dL e taxa de filtração glomerular estimada em 49mL/min. A estimativa de risco de morte pelo escore STS foi de 12,5%.
Tomografia computadorizada com sincronização eletrocardiográfica. A distância do anel até a artéria coronária direita foi de 8,6mm, e o comprimento do folheto direito, de 11,5mm. Observa‐se extensa calcificação na válvula aórtica, particularmente no folheto não coronariano e no coronariano direito.
Diante do alto risco de cirurgia de substituição valvar aórtica e da preferência da paciente, a decisão terapêutica foi por TAVI após tratamento percutâneo das lesões coronarianas.
O TAVI foi realizado em sala híbrida Artis Zeego (Siemens Healthcare Sector, Forchheim, Alemanha), sob anestesia geral e monitorado com ecocardiografia transesofágica. O acesso arterial femoral direito foi obtido por dissecção. Acesso venoso femoral esquerdo foi obtido por via percutânea para colocação de marca‐passo temporário no ventrículo direito (VD). Acesso arterial femoral esquerdo foi estabelecido com bainha 6 F para colocação de cateter‐guia, e arterial radial direito também com bainha 6 F, para colocação de cateter pigtail.
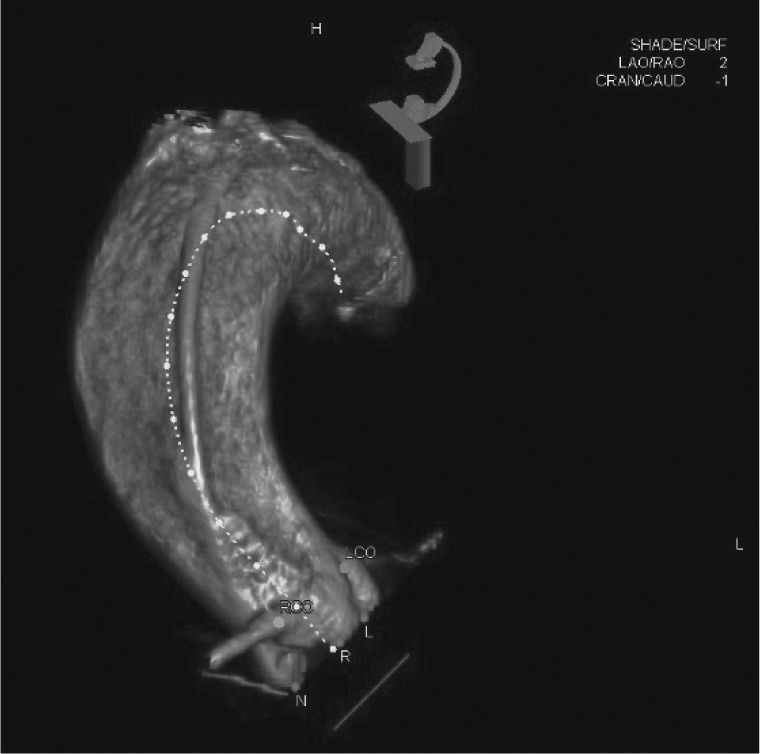
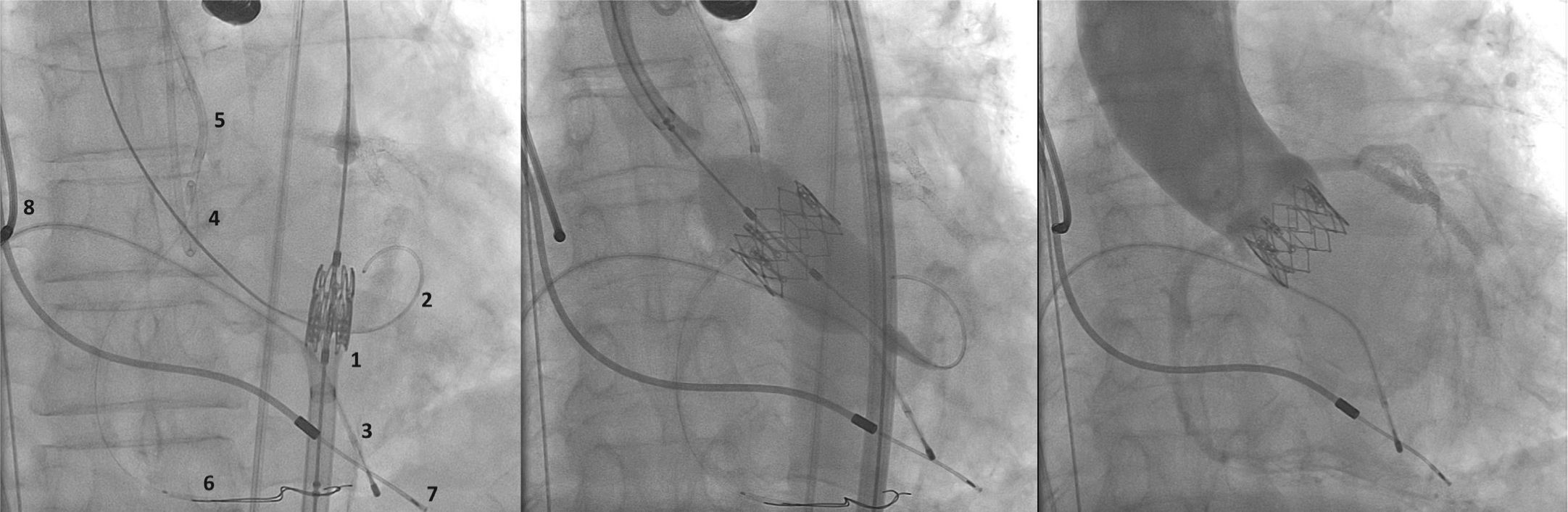
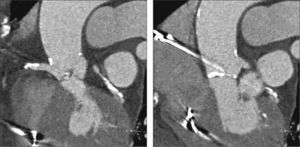
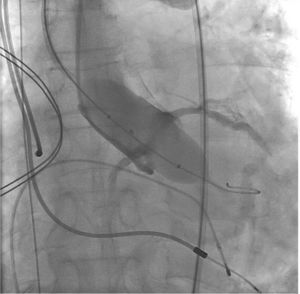
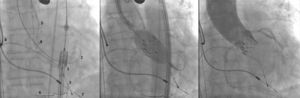
Aortografia rotacional com reconstrução tridimensional foi obtida para identificação da projeção com alinhamento das três cúspides no mesmo plano (fig. 2), a qual foi utilizada para a liberação da prótese. O gradiente transvalvar aórtico pico‐pico basal foi 43mmHg. Um fio‐guia rígido 0,035” Amplatz Super Stiff® (Boston Scientific Corporation, Natick, EUA) foi mantido no VE e, sobre esse fio‐guia, um balão de valvuloplastia Cristal 20mm/40mm (Balt, Montmorency, França) foi avançado, posicionado na válvula aórtica e insuflado até seu diâmetro nominal, sob taquicardia induzida pelo marca‐passo. Nesse momento, foi realizada uma aortografia com o cateter pigtail posicionado no seio coronariano direito. Não houve comprometimento do fluxo coronariano direito nem esquerdo durante a insuflação máxima do balão (fig. 3). Mesmo assim, decidimos adotar uma estratégia de proteção da ACD. A ACD foi cateterizada com um cateter‐guia JR4 6 F (Medtronic, Minneapolis, EUA), e dois fios‐guia BHW 0,014” (Abbott Vascular, Santa Clara, EUA) foram posicionados distalmente na ACD. Um stent Liberté 4,5mm/12mm (Boston Scientific Co., Natick, EUA) foi posicionado distalmente na ACD, garantindo estabilidade ao sistema de angioplastia coronariana e pronto posicionamento e liberação no óstio, se necessário. O cateter‐guia foi recuado e posicionado logo acima do seio de Valsalva para o TAVI (fig. 4A). Uma bioprótese aórtica SAPIEN XT número 23 (Edwards Lifesciences, Califórnia, EUA) foi avançada sobre o fio‐guia rígido e posicionada na valva aórtica, com o intuito de liberar a prótese mais baixa (60% ventricular e 40% aórtica) que o habitual (60% aórtica e 40% ventricular). Após angiografias para ajuste fino de posicionamento, a prótese foi liberada sob frequência cardíaca de 180 batimentos por minuto, com insuflação plena do balão (fig. 4B). Na angiografia de controle, observamos mínimo refluxo para o VE e contrastação normal de ambas as artérias coronárias (fig. 4C). O sistema de angioplastia coronariana foi então retirado sem dificuldade. A manometria final revelou ausência de gradiente transvalvar. O ecocardiograma transesofágico de controle mostrou refluxo aórtico periprotético leve e gradiente máximo de 10mmHg. A paciente foi extubada na sala e transferida para a unidade de terapia intensiva clinicamente e hemodinamicamente estável.
(A) À esquerda, demonstração do arsenal terapêutico: sistema de liberação da prótese balão‐expansível na aorta descendente (1) sobre fio‐guia Amplatz SuperStiff® com extremidade no ventrículo esquerdo (2); eletrodo de marca‐passo temporário no ventrículo direito (3); cateter pigtail no seio coronariano direito (4); cateter‐guia JR 6 F (5) acima do seio de Valsalva; dois fios‐guia 0,014” extrassuporte e stent coronariano posicionados distalmente na coronária direita (6); eletrodos de marca‐passo definitivo no ventrículo e átrio direitos (7 e 8). (B) Liberação da prótese valvar aórtica expansível por balão, com o sistema de angioplastia coronariana posicionado na artéria coronária direita. (C) Aortografia de controle evidenciando artérias coronarianas direita e esquerda pérvias e regurgitação mínima aórtica.
A OC após TAVI é um evento raro e de mortalidade superior a 40%. Essa complicação pode ser razoavelmente antecipada a partir de detalhes anatômicos derivados da angiotomografia e de aortografia durante pré‐dilatação da válvula com balão. Embora a literatura ainda seja escassa, há informações que indicam fatores de risco. Os principais preditores são sexo feminino, prótese expansível por balão, seio de Valsava < 28mm, altura do óstio coronariano < 10mm e TAVI para tratar disfunção de bioprótese (valve‐in‐valve).
Dentre os mecanismos para OC citam‐se: (1) cobertura do óstio por prótese mal posicionada, ou bem posicionada, mas em paciente com óstio baixo; (2) deslocamento de folheto com calcificação grosseira em direção ao óstio; (3) debris de cálcio; (4) dissecção de aorta; (5) migração do folheto para o óstio por avulsão; e (6) deslocamento de folheto móvel e de maior comprimento em relação ao seio de Valsalva.8 No maior registro de obstrução coronariana durante o TAVI, Ribeiro et al.6 analisaram 44 casos (0,66%) de 6.688 procedimentos em 81 centros de 4 continentes. A ACE esteve envolvida em 88,6% dos casos, com a maioria dos pacientes apresentando sinais agudos de hipotensão grave, alterações de segmento ST e arritmias ventriculares. Em três pacientes (6,8%), o óbito ocorreu em poucos minutos, não permitindo quaisquer procedimento de revascularização. Foi realizada angioplastia em 75% dos casos, com uma taxa de sucesso de 81,8%. As taxas de mortalidade global em 30 dias e 12 meses foram de 40,9 e 45,5%, respectivamente. A mortalidade dos pacientes nos quais a angioplastia foi bem‐sucedida foi de 22,2%, e de 100% naqueles nos quais ocorreu insucesso. Para aqueles pacientes em que se optou pela cirurgia de revascularização miocárdica (14%), a mortalidade foi de 50%. Suporte circulatório foi necessário em 36% dos pacientes. Não houve casos de trombose de stent e nem necessidade de revascularização da lesão‐alvo num seguimento médio de 12 meses.
No mesmo estudo de Ribeiro et al.6, foram identificados preditores para obstrução coronariana: sexo feminino, procedimento valve‐in‐valve, implante de prótese balão‐expansível (0,81% vs. 0,31% de ocorrência com as próteses autoexpansíveis), diâmetro do seio de Valsalva < 30mm e altura do óstio da coronária esquerda < 12mm. Com relação à medida da altura do óstio da ACE, a média foi de 11mm dentre aqueles com obstrução coronariana pós‐TAVI, e de 13mm naqueles sem a complicação. Nas mulheres, a média foi ainda menor (10mm), sendo que 96% daquelas que apresentaram obstrução tinham altura da ACE < 12mm. A obstrução da ACD foi incomum (somente 11% dos casos) fato provavelmente relacionado à sua origem frequentemente mais alta, porém não foi possível estimar algum ponto de corte seguro no estudo, devido à pequena quantidade de casos.
Outros possíveis preditores são a obstrução coronariana observada durante valvuloplastia aórtica por balão com aortografia simultânea,9 e uma relação entre a medida do folheto e do comprimento da curva do seio de Valsalva > 1, conforme demonstrado por Okuyama et al.8
Apesar de não descrevermos um caso de obstrução coronariana tratado pela técnica de segurança empregada, o risco para a complicação justifica a medida adotada, visto se tratar de paciente do sexo feminino com altura do óstio da ACD < 10mm e diâmetro do seio de Valsalva de 27mm. Utilizamos um balão para pré‐dilatação da valva com relação de 1 para 1 para o anel valvar, para avaliação do fluxo coronariano durante a insuflação. Não houve comprometimento do fluxo coronariano nem direito nem esquerdo. A aortografia durante a pré‐dilatação com balão de diâmetro inferior ao diâmetro do anel pode subestimar o risco de OC, por não deslocar os folhetos totalmente, como após o implante da prótese. Os dois fios‐guia 0,014 extrassuportes e o stent posicionados distalmente na ACD mantiveram perfeita estabilidade do sistema com o cateter‐guia recuado durante o posicionamento e a liberação da prótese. Uma das recomendações baseadas na opinião de especialistas para manejo desses pacientes de maior risco para OC no TAVI é deixar um fio‐guia de angioplastia na artéria coronária,6,9 porém não encontramos publicação com recomendação de posicionamento de stent distal na artéria coronária de interesse, exceto para valve‐in‐valve.10 Essa manobra proporciona rápida reversão de eventual OC. Outra medida foi liberar a prótese mais baixa (60% ventricular e 40% aórtica) que o habitual, visando evitar a cobertura dos óstios coronariano com as hastes metálicas da bioprótese.
Acreditamos também que a colocação e o posicionamento de fio‐guia teflonado 0,035” na veia cava superior e na artéria femoral contralateral, para o caso de necessidade de iniciar suporte circulatório, sejam justificáveis nos pacientes de maior risco de instabilidade hemodinâmica. Por fim, a escolha de próteses reposicionáveis ou recapturáveis pode proporcionar maior segurança para esses pacientes.
Fonte de financiamentoNão há.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
A revisão por pares é da responsabilidade Sociedade Brasileira de Hemodinâmica e Cardiologia Intervencionista.