A fibrilação atrial (FA) aumenta o risco de eventos tromboembólicos por êmbolos originados em apêndice atrial esquerdo (AAE). Métodos mecânicos para a oclusão do AAE foram desenvolvidos como alternativa à anticoagulação oral. O objetivo deste trabalho foi apresentar uma experiência inicial com o AMPLATZER® Cardiac Plug.
MétodosIncluímos pacientes com FA permanente ou paroxística, que apresentavam contraindicações ou complicações derivadas da anticoagulação oral. Pacientes com anatomia e medidas do AAE compatíveis com o oclusor, e sem trombos foram selecionados por meio de ecocardiograma transesofágico.
ResultadosForam realizados 14 procedimentos em 13 pacientes (5M:8F), com média de idade de 66,7 anos. Sangramento significativo e acidentes vasculares cerebrais prévios foram encontrados em 69,2% e em 53,8%, respectivamente. A FA era permanente em 84,6% e paroxística no restante da amostra. Os diâmetros médio do óstio e da zona alvo mediram 23,9mm e 20,8mm, respectivamente. AAE bilobulados foram observados em 76,9%. Os procedimentos foram possíveis em todos os casos. Dezesseis dispositivos foram usados em 13 pacientes, numa razão de 1,2:1, e apenas 1 paciente precisou de um segundo dispositivo para oclusão do AAE. O tempo médio de acompanhamento foi de 12,2 meses. Todos os AAE permanecem fechados e sem defeito residual até o momento. Houve apenas um óbito tardio não relacionado ao procedimento.
ConclusõesA oclusão do AAE com o dispositivo de AMPLATZER® Cardiac Plug mostrou ser segura e eficaz nesta pequena série de pacientes. Os resultados iniciais são encorajadores e apontam para o fechamento transcateter do AAE como alternativa para a anticoagulação oral em pacientes selecionados.
Atrial fibrillation (AF) increases the risk of thromboembolic events caused by emboli originating in the left atrial appendage (LAA). Mechanical methods for LAA occlusion have been developed as an alternative to oral anticoagulation. The aim of this study was to present an initial experience with the AMPLATZER® Cardiac Plug.
MethodsPatients with permanent or paroxysmal AF and with contraindications or complications of oral anticoagulation were included. Patients with LAA anatomy and measures compatible with the occluder, and without thrombi, were selected through transesophageal echocardiography.
ResultsA total of 14 procedures were performed in 13 patients (5M:8F), with mean age of 66.7 years. Significant bleeding and previous strokes were found in 69.2% and 53.8%, respectively. AF was permanent in 84.6% and paroxysmal in the remainder. The mean diameters of the ostium and the landing zone were 23.9mm and 20.8mm, respectively. Bilobulated LAA was observed in 76.9%. Procedures were possible in all cases. Sixteen devices were used in 13 patients, a ratio of 1.2:1, and only one patient required a second device for LAA occlusion. The mean follow‐up was 12.2 months. All LAA remain closed, with no residual defect to date. There was only one late death, unrelated to the procedure.
ConclusionsLAA occlusion using the AMPLATZER® Cardiac Plug device was shown to be safe and effective in this small series of patients. The initial results are encouraging and indicate the transcatheter closure of the LAA as an alternative to oral anticoagulation therapy in selected patients.
A fibrilação atrial (FA) de origem não valvar é uma das arritmias mais comuns e acomete 1 a 2% da população adulta em geral.1 Está presente em até 14% dos pacientes acima de 65 anos e dobra sua incidência a cada década.2 Associada a alto risco de eventos cardioembólicos, principalmente acidentes vasculares cerebrais (AVC), a FA é responsável por aproximadamente 15% de todos os AVC isquêmicos.3 O risco de AVC nos portadores de FA aumenta em até cinco vezes quando comparado a pacientes em ritmo sinusal.4
A prevenção dos fenômenos embólicos da FA é realizada tradicionalmente com uso permanente de anticoagulantes orais (ACO). Os mais utilizados têm sido os antagonistas da vitamina K, que são eficazes, reduzindo a incidência de AVC em até 60% e óbito em até 25% dos pacientes que se mantêm na faixa terapêutica.5 O uso continuado desses fármacos traz uma série de dificuldades e inconvenientes para os pacientes, que resultam em um grande número de não tratados. Os principais problemas relatados são o risco de sangramento ou episódios prévios de sangramentos significativos em indivíduos portadores de condições predisponentes; a extrema fragilidade; a baixa taxa de aderência ao tratamento; as interações medicamentosas prejudiciais; a oscilação dos níveis terapêuticos do medicamento; e os efeitos colaterais indesejados.6–9
O conhecimento de que mais de 90% dos êmbolos na FA são originados de trombos formados no apêndice atrial esquerdo (AAE) levou ao desenvolvimento de opções para obliteração mecânica dessa estrutura como terapêutica alternativa, que prescindisse da ACO para a prevenção de fenômenos tromboembólicos cerebrais.10–12
Neste manuscrito, os autores apresentam sua experiência inicial com a oclusão dos AAE, em um único centro, utilizando a primeira das próteses dedicadas desenvolvidas para esse fim e liberada para uso clínico no Brasil.
MétodosForam analisados, retrospectivamente, registros de todos os pacientes encaminhados para oclusão percutânea do AAE no Setor de Cardiologia Intervencionista dos Defeitos Congênitos e Estruturais do Hospital Federal dos Servidores do Estado, na cidade do Rio de Janeiro (RJ).
Foram selecionados pacientes com FA permanente ou paroxística e que apresentassem alguma contraindicação ou complicações derivadas do uso permanente da ACO. A seleção para o procedimento foi feita por meio de ecocardiograma transesofágico (ETE), sendo incluídos os pacientes cujos apêndices atriais apresentassem características anatômicas e diâmetros compatíveis com o oclusor padronizado em nosso serviço (12,6mm a 28,5mm)13 e que não apresentassem trombos no interior do AAE.
A prótese utilizada foi o AMPLATZER® Cardiac Plug (ACP, AGA Medical Corp., Minneapolis, EUA), que é um dispositivo autoexpansível, fabricado com nitinol, com retalhos de poliéster em seu interior. É composto por um lobo cilíndrico, disponível em diâmetros de 16 a 30mm, em incrementos de 2mm, e que corresponde ao tamanho nominal da prótese. Ligado a ele por um pino conector flexível existe um disco 4mm maior do que o lobo nas próteses 16 a 22mm, e 6mm maior nas próteses 24 a 30mm.
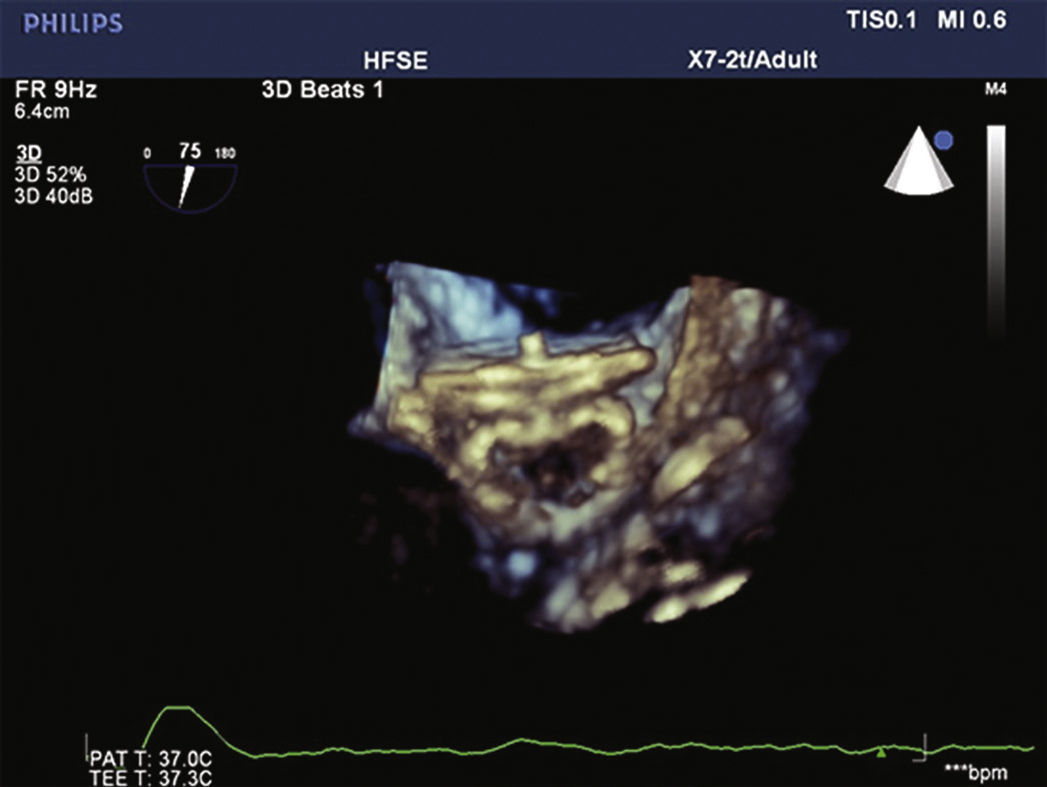
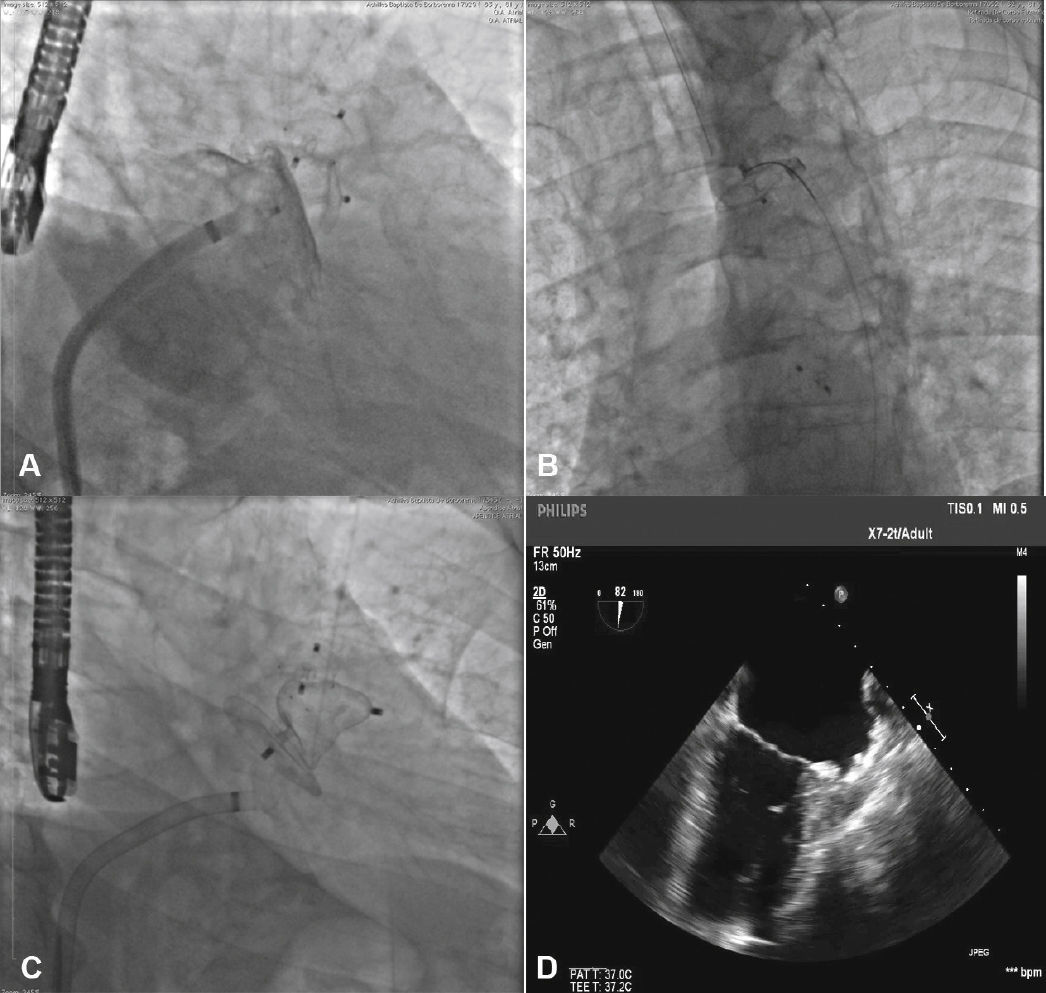
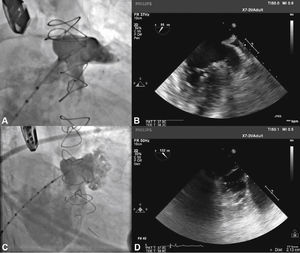
Para aumentar a segurança do procedimento e reduzir o risco de deslocamento do dispositivo, seis pares de finos ganchos estabilizadores são presos ao lobo, identificados por marcas radiopacas, e servem para ajudar a fixar o lobo ao corpo do AAE na zona alvo (fig. 1).
Todos os procedimentos foram realizados sob anestesia geral e intubação orotraqueal, após jejum mínimo de 8 horas, sob monitoração fluoroscópica e ecocardiografia transesofágica no laboratório de cardiologia intervencionista.
Heparina não fracionada foi administrada nas doses de 5.000 a 10.000 UI após ter sido obtido o acesso transeptal. Doses suplementares de 2.500 a 5.000 UI foram administradas a cada 30 minutos, sempre que os procedimentos ultrapassassem a primeira hora. Profilaxia antimicrobiana com 2g de cefazolina venosa foi rotineiramente administrada. Os pacientes foram submetidos a cateterismo cardíaco direito e esquerdo por meio de punção de veia femoral. O acesso atrial esquerdo foi obtido por punção transeptal com a técnica habitual com agulhas de Brockenbrough.
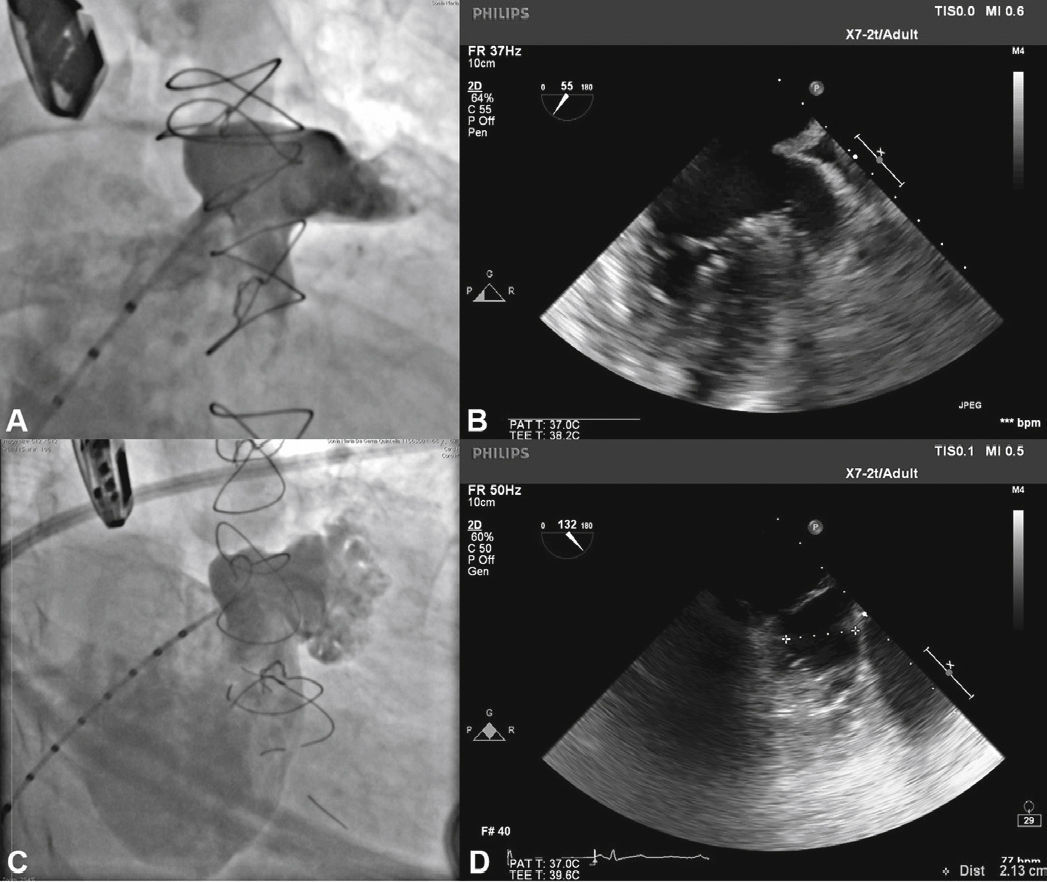
Com auxílio de cateter pigtail 5 F centimetrado, foi cateterizado o AAE e foram realizadas injeções em incidência oblíqua anterior direita (OAD), com inclinação cranial e caudal, para determinação do tipo anatômico e para realização de medidas do óstio e da zona alvo (landing zone) de implante do lobo do dispositivo oclusor. As medidas e a anatomia foram comparadas com as obtidas com o ETE, sendo selecionadas as maiores medidas obtidas para a escolha da prótese a ser implantada (fig. 2).
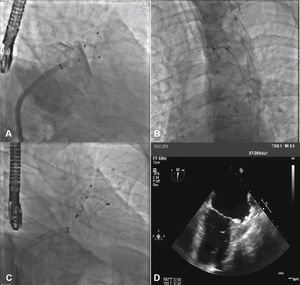
Correspondência entre as imagens angiográficas e ecocardiográficas. Em A, o apêndice atrial esquerdo visualizado em incidência oblíqua anterior direita cranial guarda semelhança com a imagem ecocardiográfica obtida com o transdutor a 55° em B. Em C, a angiografia do apêndice em oblíqua anterior direita com angulação caudal mostra melhor a porção trabecular, mais terminal, do apêndice atrial esquerdo, que se vê também em D, na imagem ecocardiográfica a 132°.
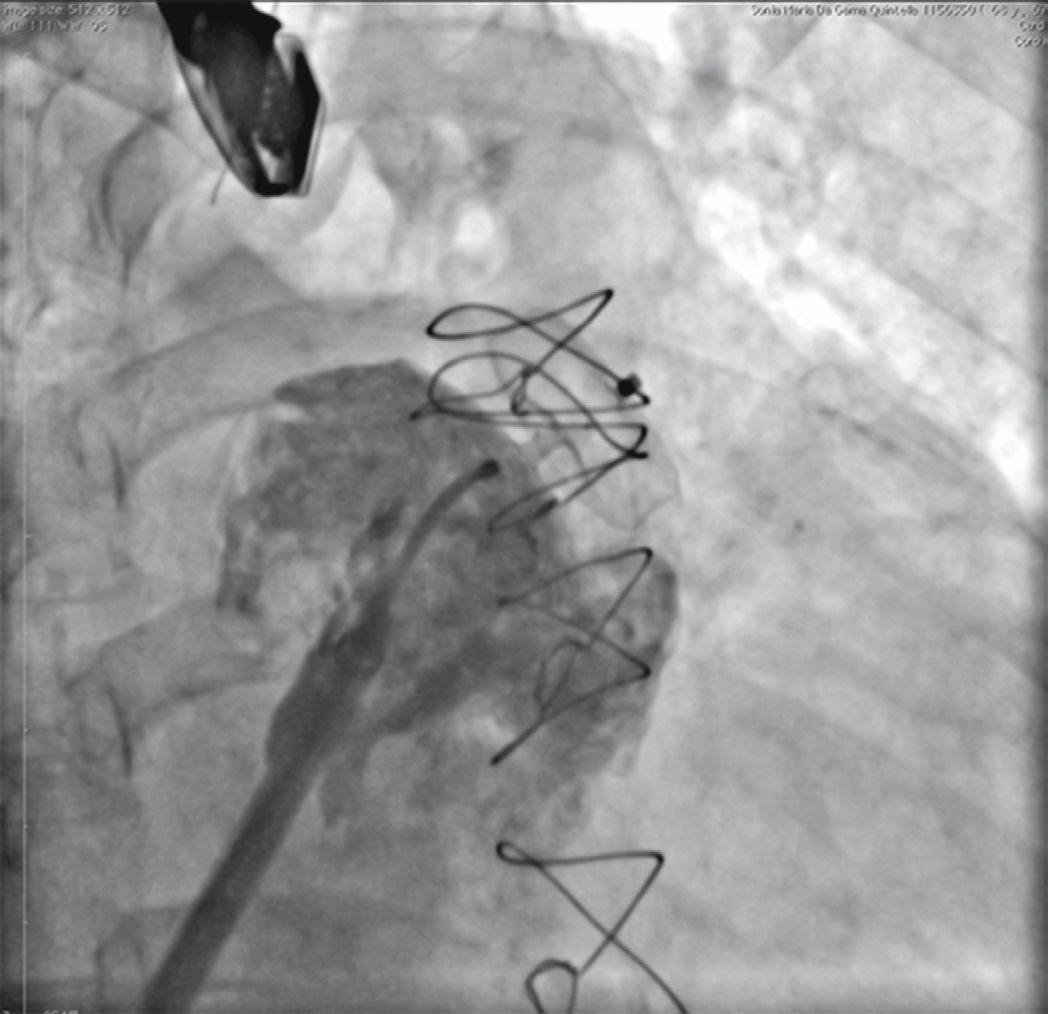
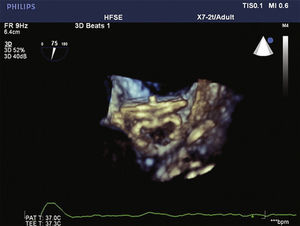
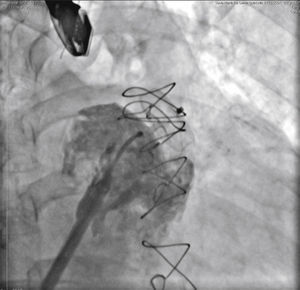
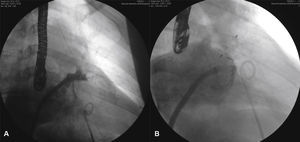
O cateter pigtail foi retirado e substituído por uma guia longa (com 260cm) de ponta curva (jota), rígida ou super‐rígida, no interior do AAE. Sobre ela, foi introduzida bainha longa AGA, de dupla curvatura, com diâmetro compatível ao do oclusor escolhido. A bainha foi posicionada o mais coaxialmente possível ao eixo do AAE, tendo sua posição avaliada por meio de injeções manuais de contraste, pela via lateral da válvula hemostática do sistema introdutor. Pelo interior da bainha, foi introduzido o dispositivo escolhido, previamente carregado no sistema de entrega, cujo diâmetro do lobo fosse de 2 a 4mm superior à maior medida obtida da área alvo de implante. O lobo do dispositivo foi implantado, idealmente mantendo dois terços de sua espessura em posição distal à localização da artéria coronária circunflexa, visualizada ao ETE. Em seguida, mantendo leve tração sobre o cabo de entrega, a bainha foi recuada exteriorizando o disco, de forma a ocluir o óstio do AAE. A tensão sob o cabo foi mantida durante alguns minutos (tug test) até certificar que o dispositivo estava bem aderido ao corpo do AAE, minimizando o risco de embolização ou deslocamento do mesmo. Os sinais de bom posicionamento avaliados foram o grau de compressão do lobo do oclusor, a separação entre o disco e o lobo, a forma côncava do disco e seu posicionamento na entrada do óstio, e o posicionamento do lobo com pelo menos dois terços de sua espessura situados além da artéria circunflexa (fig. 3).
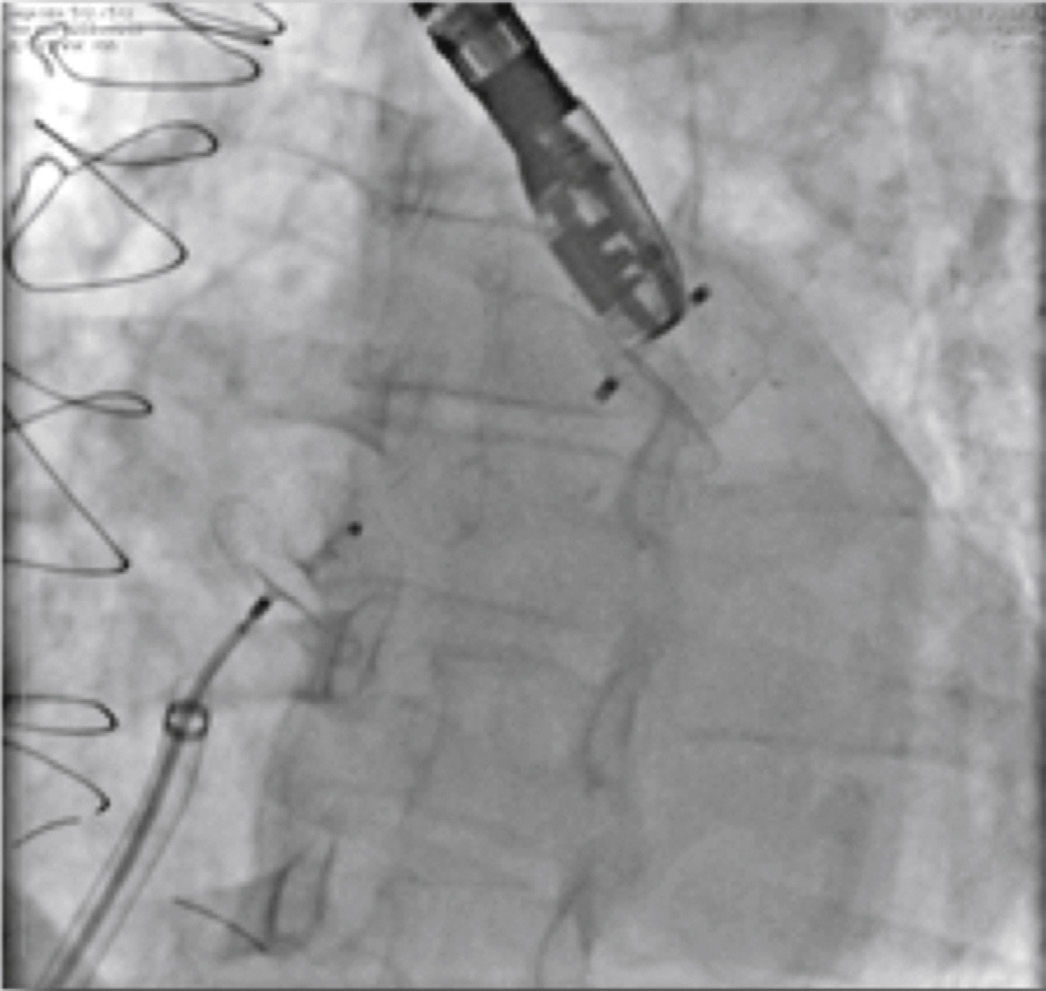
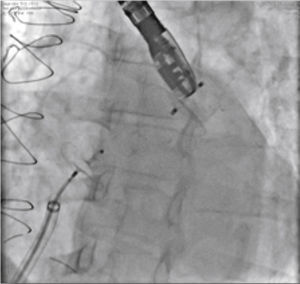
Novas injeções foram realizadas pela via lateral do sistema introdutor, para confirmar o correto posicionamento do dispositivo com a completa oclusão do óstio do AAE (fig. 4). Considerado satisfatório, a prótese foi liberada do cabo de entrega, desenroscando‐a do sistema introdutor. Imediatamente após o implante, a ausência de fluxos residuais periprotéticos e de derrame pericárdico foram verificados pelo ETE.
Os pacientes foram acordados na sala de exame e conduzidos à unidade coronariana para o cuidado pós‐operatório imediato. Foi administrada mais uma dose de 1g de cefazolina 6 horas após o procedimento. As altas dos pacientes foram dadas no dia seguinte ao do implante, após ecocardiograma transtorácico (ETT) de controle.
No seguimento, todos os pacientes foram orientados a utilizar dupla antiagregação plaquetária, com 200mg de ácido acetilsalicílico e 75mg de bissulfato de clopidogrel. Avaliações médicas seguidas de exames ecocardiográficos foram realizadas após 1 e 3 meses, quando foi suspenso o clopidogrel. Após 6 meses, foram realizados ETE de controle, e os pacientes mantiveram o uso contínuo do ácido acetilsalicílico.
ResultadosDe março de 2014 a agosto de 2015, foram realizados 14 procedimentos de oclusão percutânea dos AAE em 13 pacientes. Oito eram do sexo feminino. As idades variaram de 46 a 83 anos (66,7 ± 11,8 anos).
Sangramento significativo em uso de ACO foi encontrado em nove (69,2%) pacientes. Hemorragia digestiva foi identificada em seis pacientes, retiniana em um, geniturinária em um e intracraniana em outro.
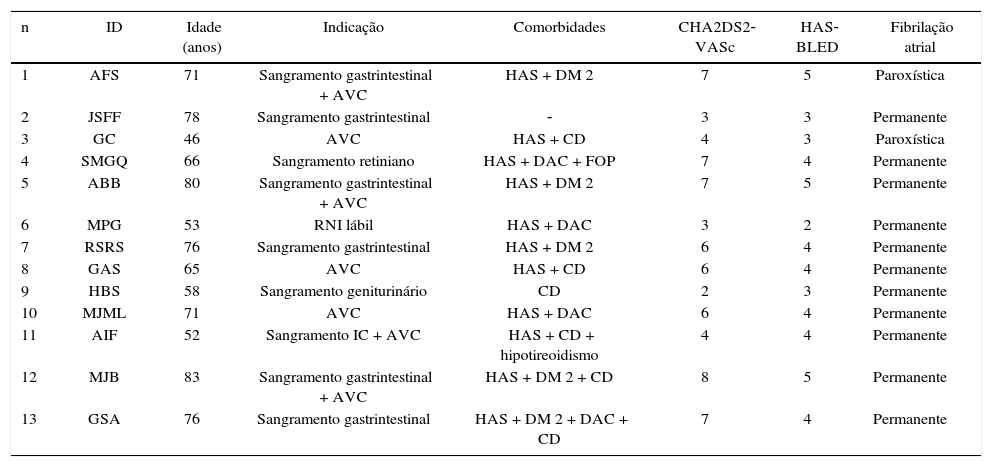
Sete (53,8%) pacientes tinham sofrido AVC prévio. A maioria (84,6%) dos pacientes apresentava FA permanente e, nos demais, a arritmia era paroxística. Os dados clínicos e as principais comorbidades encontradas são descritos na tabela 1.
Dados clínicos dos pacientes submetidos à oclusão do apêndice atrial esquerdo
| n | ID | Idade (anos) | Indicação | Comorbidades | CHA2DS2‐VASc | HAS‐BLED | Fibrilação atrial |
|---|---|---|---|---|---|---|---|
| 1 | AFS | 71 | Sangramento gastrintestinal + AVC | HAS + DM 2 | 7 | 5 | Paroxística |
| 2 | JSFF | 78 | Sangramento gastrintestinal | ‐ | 3 | 3 | Permanente |
| 3 | GC | 46 | AVC | HAS + CD | 4 | 3 | Paroxística |
| 4 | SMGQ | 66 | Sangramento retiniano | HAS + DAC + FOP | 7 | 4 | Permanente |
| 5 | ABB | 80 | Sangramento gastrintestinal + AVC | HAS + DM 2 | 7 | 5 | Permanente |
| 6 | MPG | 53 | RNI lábil | HAS + DAC | 3 | 2 | Permanente |
| 7 | RSRS | 76 | Sangramento gastrintestinal | HAS + DM 2 | 6 | 4 | Permanente |
| 8 | GAS | 65 | AVC | HAS + CD | 6 | 4 | Permanente |
| 9 | HBS | 58 | Sangramento geniturinário | CD | 2 | 3 | Permanente |
| 10 | MJML | 71 | AVC | HAS + DAC | 6 | 4 | Permanente |
| 11 | AIF | 52 | Sangramento IC + AVC | HAS + CD + hipotireoidismo | 4 | 4 | Permanente |
| 12 | MJB | 83 | Sangramento gastrintestinal + AVC | HAS + DM 2 + CD | 8 | 5 | Permanente |
| 13 | GSA | 76 | Sangramento gastrintestinal | HAS + DM 2 + DAC + CD | 7 | 4 | Permanente |
ID: identificação do paciente; AVC: acidente vascular cerebral; HAS: hipertensão arterial sistêmica: DM 2: diabetes melito tipo 2; CD: cardiomiopatia dilatada; DAC: doença arterial coronariana; FOP: forame oval patente; RNI: razão normalizada internacional.
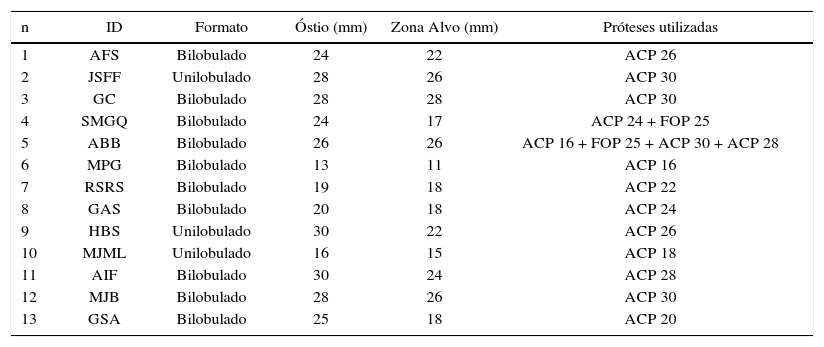
Quanto à forma, apêndices bilobulados estavam presentes em 76,9% dos casos, e os demais apresentaram apenas um lobo. O diâmetro dos óstios variou de 13 a 30mm (23,9 ± 5,4mm) e a zona alvo, de 11 a 28mm (20,8 ± 5,1mm).
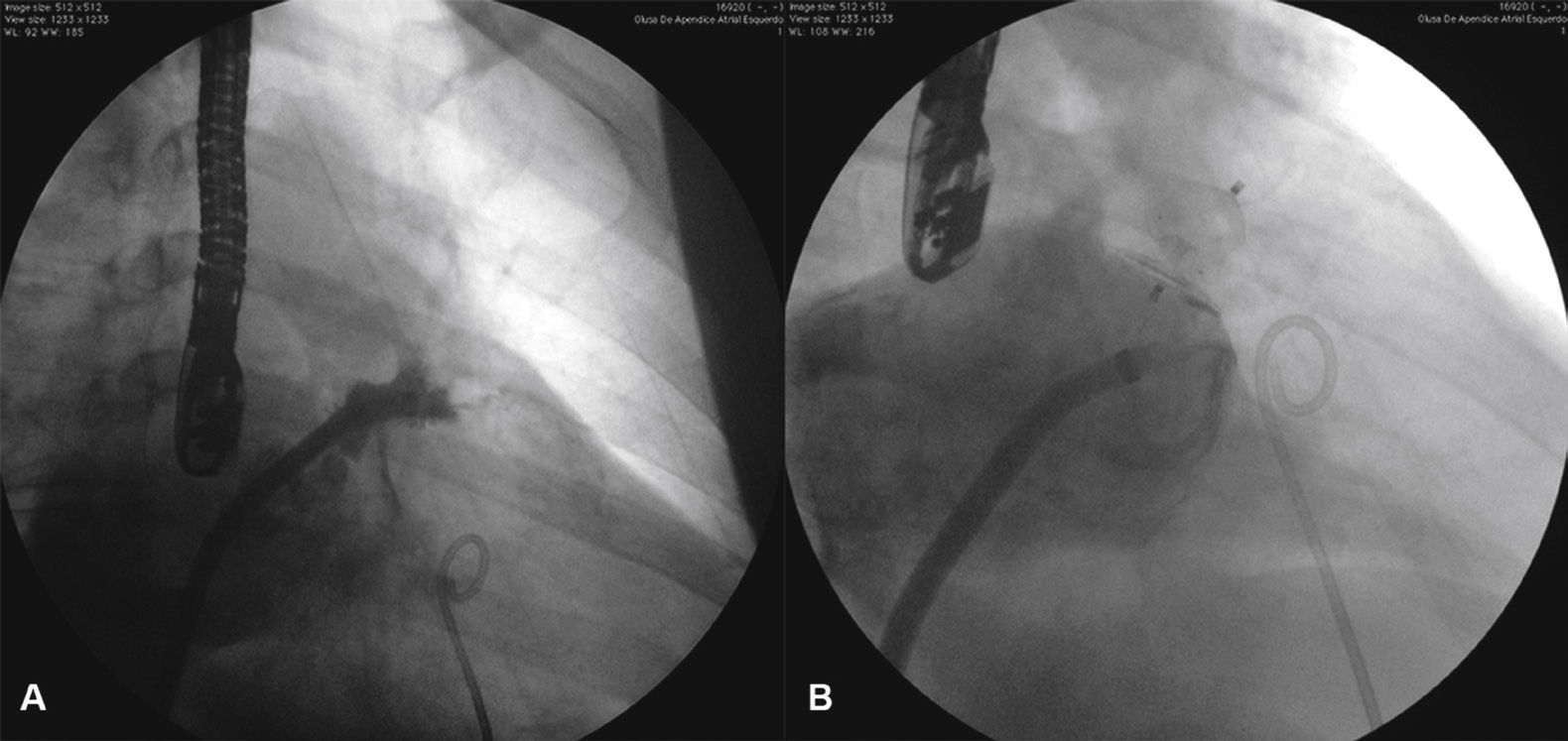
O procedimento foi bem‐sucedido em todos os casos. Foram utilizados 16 dispositivos para oclusão nos 13 pacientes numa relação de 1,2 dispositivo por paciente. A outra prótese AMPLATZER® PFO Occluder (PFO) de 25mm foi utilizada para ocluir o forame oval da paciente (SMGQ, caso 4) que não necessitou de punção transeptal e teve seu AAE ocluído com ACP através do forame oval (fig. 5).
Imagens do caso 4. Visualizam‐se o AMPLATZER® Cardiac Plug 24mm ocluindo o apêndice atrial esquerdo e a prótese AMPLATZER® PFO Occluder 25mm posicionada através do forame oval da paciente. Para o implante da prótese AMPLATZER® PFO Occluder, foi utilizada a mesma bainha de dupla curvatura usada para o implante do AMPLATZER® Cardiac Plug.
Apenas um único paciente necessitou de mais de uma prótese para ocluir o AAE (ABB, caso 5). Ele teve seu procedimento de oclusão realizado como caso ao vivo durante o Rio.Interv 2014. Na ocasião, foi ocluído um lobo acessório proximal, em posição anterossuperior, com ACP de 16mm e, para o restante do corpo do apêndice, foi utilizada uma prótese PFO de 25mm, obtendo sucesso imediato. Depois de 2 dias, a prótese PFO migrou para a aorta transversa, de onde foi retirada, por via percutânea, com cateter laço. Como o corpo principal do apêndice ficara descoberto após a embolização da prótese PFO, um segundo procedimento foi oferecido e realizado 5 meses após o procedimento índice. Inicialmente, foi feita uma tentativa de oclusão do AAE com ACP de 30mm, que se mostrou superdimensionado e foi finalmente substituído por um ACP de 28mm, que ocluiu adequadamente o apêndice (fig. 6). Nos demais pacientes, o AAE foi ocluído com apenas um dispositivo. Foram usadas 15 próteses ACP para oclusão dos AAE e duas próteses PFO (tabela 2).
Imagens do caso 5. Em A, vê‐se o lobo acessório ocluído com AMPLATZER® Cardiac Plug 16mm e o corpo do apêndice ocluído com a prótese AMPLATZER® PFO Occluder 25mm. Em B, vê‐se a prótese AMPLATZER® PFO Occluder embolizada para o arco aórtico, sendo capturada pelo cateter laço. Em C, ao final do procedimento, o lobo acessório completamente ocluído pelo AMPLATZER® Cardiac Plug 16mm e o corpo do apêndice atrial esquerdo pelo segundo AMPLATZER® Cardiac Plug 28mm. Em D, imagem ecocardiográfica de controle após o procedimento, mostrando o óstio do apêndice atrial esquerdo ocluído pelo AMPLATZER® Cardiac Plug 28. Observe‐se o aumento de densidade ecocardiográfica no interior do apêndice atrial esquerdo correspondendo ao AMPLATZER® Cardiac Plug 16, que é mal visualizado nesta imagem.
Características dos apêndices ocluídos e próteses utilizadas
| n | ID | Formato | Óstio (mm) | Zona Alvo (mm) | Próteses utilizadas |
|---|---|---|---|---|---|
| 1 | AFS | Bilobulado | 24 | 22 | ACP 26 |
| 2 | JSFF | Unilobulado | 28 | 26 | ACP 30 |
| 3 | GC | Bilobulado | 28 | 28 | ACP 30 |
| 4 | SMGQ | Bilobulado | 24 | 17 | ACP 24 + FOP 25 |
| 5 | ABB | Bilobulado | 26 | 26 | ACP 16 + FOP 25 + ACP 30 + ACP 28 |
| 6 | MPG | Bilobulado | 13 | 11 | ACP 16 |
| 7 | RSRS | Bilobulado | 19 | 18 | ACP 22 |
| 8 | GAS | Bilobulado | 20 | 18 | ACP 24 |
| 9 | HBS | Unilobulado | 30 | 22 | ACP 26 |
| 10 | MJML | Unilobulado | 16 | 15 | ACP 18 |
| 11 | AIF | Bilobulado | 30 | 24 | ACP 28 |
| 12 | MJB | Bilobulado | 28 | 26 | ACP 30 |
| 13 | GSA | Bilobulado | 25 | 18 | ACP 20 |
ID: identificação do paciente; ACP: AMPLATZER® Cardiac Plug; FOP: forame oval patente.
Uma única complicação periprocedimento ocorreu (MPG, caso 6). A paciente possuía um apêndice estreito e raso, que foi perfurado com a guia hidrofílica, no início do procedimento. Apresentou derrame pericárdico, que foi prontamente drenado no laboratório de hemodinâmica. Após a estabilização hemodinâmica da paciente, o procedimento foi continuado, e o AAE foi ocluído com ACP de 16mm (fig. 7). O derrame foi contido após a oclusão do apêndice, e a paciente foi encaminhada para a unidade de terapia intensiva em boas condições para os cuidados pós‐procedimento. No seguimento, ela apresentou pericardite persistente tratada com colchicina e corticosteroides, obtendo a remissão do processo após 30 dias e permanecendo assintomática desde então.
Imagens do caso 6. Em A, angiografia realizada através da bainha de dupla curvatura mostra a pequena perfuração na extremidade do apêndice atrial esquerdo com passagem de contraste para a cavidade pericárdica. Em B, após a estabilização hemodinâmica da paciente por meio da drenagem do derrame pericárdico com cateter pigtail, observa‐se o apêndice atrial esquerdo totalmente ocluído com AMPLATZER® Cardiac Plug 16.
O seguimento foi obtido em todos os casos. O tempo médio foi 12,2 meses (5 a 19 meses) e, no momento do encerramento deste estudo, apenas um paciente ainda não atingira os 6 meses de seguimento. Todos os apêndices atriais permaneceram fechados, e nenhum paciente apresentou vazamentos periprotéticos e nem eventos tromboembólicos até essa data.
Houve apenas um óbito, tardio, não relacionado ao procedimento. O paciente (GC, caso 3), portador de cardiomiopatia dilatada grave, faleceu por insuficiência cardíaca refratária 11 meses após o procedimento de oclusão. A prótese permaneceu corretamente posicionada e não apresentou refluxos periprotéticos.
DiscussãoA primeira e fundamental etapa do procedimento de oclusão é a obtenção do acesso ao átrio esquerdo. Normalmente, isso é realizado por meio de punção transeptal com agulha de Brockenbrough.14 Para acessar e manipular a bainha longa, coaxialmente, no interior do AAE, é importante que a agulha transeptal cruze o septo interatrial em posição posteroinferior.13 A visualização pelo ETE permite que se faça a punção transeptal precisamente no local desejado, favorecendo o êxito do procedimento.15 Adicionalmente, a obtenção do acesso ao átrio esquerdo, por meio de defeitos do septo atrial, tem sido descrita para oclusão dos AAE. A punção transeptal é evitada, e a técnica não inviabiliza a realização dos procedimentos na maioria dos casos.16,17
A anatomia e a localização espacial dos AAE são extremamente variáveis, implicando em descrições singulares (cauliflower, cactus, chicken wing, windsock),13 que não foram utilizadas nesse manuscrito. A análise anatômica dos AAE, em nossa casuística, foi realizada com a ecocardiografia transesofágica e a angiografia. Observou‐se correlação entre as imagens ecocardiográficas obtidas com o transdutor posicionado entre zero e 60o e as angiografias realizadas em OAD cranial, enquanto as imagens obtidas com o transdutor posicionado em cortes entre 90o e 130o se correlacionaram melhor com as angiografias obtidas em OAD caudal, que delineiam de forma mais precisa a parte terminal da porção trabecular dos apêndices. Na pequena experiência relatada neste artigo, utilizamos preferencialmente a incidência OAD caudal para o implante dos dispositivos. É nela que têm sido obtidos os maiores valores de medida e é por eles que tem sido orientada a escolha das próteses utilizadas.
O apêndice atrial, a par de sua grande variabilidade anatômica, é uma estrutura extremamente delicada e muito friável, que pode explicar a incidência de derrames pericárdicos observados nos procedimentos de oclusão, variando de 1,2 a 3,7%.18–21
Extrema delicadeza deve ser exercida no seu manuseio e algumas regras básicas necessitam ser seguidas, como utilizar apenas fios‐guia de ponta arredondada (jota) e tentar manter a bainha longa de entrega o mais coaxial possível ao maior eixo do apêndice, afastada de suas paredes. Deve‐se atentar, em todos os momentos do procedimento, para os limites do AAE, evitando a todo custo atingir sua extremidade com o dilatador ou a bainha longa. A curva de aprendizado desse procedimento é significativa e tem sido demonstrado que o número de complicações procedurais diminui à medida que a equipe ganha familiaridade com a técnica de oclusão.22,23
O ACP é composto por um lobo e um disco conectados por um pino flexível, que articula e permite angulação entre os mesmos. O lobo, que é implantado no corpo do AAE, possui 12 pequenos ganchos para estabilização do dispositivo. É de suma importância que, para evitar a embolização das próteses, o lobo sofra algum grau de compressão, para promover o contato dos ganchos com as paredes do AAE. Para esse fim, é importante que se utilizem as maiores medidas obtidas, escolhendo dispositivos 4 e 6mm maiores do que a zona alvo. No entanto, o uso de próteses muito maiores do que a região de implante provoca a expulsão do dispositivo, como aconteceu no caso 5. Um dispositivo excessivamente superdimensionado deforma o lobo, modificando o posicionamento dos ganchos, retraindo‐os e causando a perda de contato deles com a parede do AAE. O mesmo ocorre se o dispositivo escolhido for muito pequeno, menor do que a zona alvo, situação na qual também não ocorre o contato dos ganchos com a parede do AAE.
O implante da prótese deve promover a oclusão do corpo do apêndice, isolando toda sua porção trabeculada, cuja superfície irregular cria condições para a formação dos trombos encontrados na FA. A presença do disco, posicionado de forma a obliterar o óstio do AAE, age como um segundo elemento oclusor, aumentando a segurança do procedimento. É importante que o disco mantenha uma forma côncava e se adapte perfeitamente ao óstio, evitando espaços que possam ser fonte de trombos ou mesmo sede de refluxos periprotéticos.
Presume‐se que fluxos residuais periprotéticos possam ser causa de novos acidentes isquêmicos cerebrais, devendo portanto ser evitados, embora haja alguma controvérsia na literatura.24,25 Atualmente, consideram‐se como significativos fluxos residuais com diâmetros ≥ 5mm26 que, quando existentes, devem ser ocluídos com um segundo dispositivo. A utilização de mais de um dispositivo para a oclusão dos AAE tem sido realizada com sucesso e parece estar relacionada a resultados favoráveis no seguimento dos pacientes.27
ConclusõesA oclusão dos apêndice atrial esquerdo nesta pequena série de casos se mostrou segura e eficaz, apesar da complexidade e das comorbidades apresentadas pelos pacientes incluídos neste estudo.
Os resultados iniciais obtidos são encorajadores e, apesar do curto prazo de seguimento desse grupo de pacientes, confirmam que a oclusão percutânea dos apêndice atrial esquerdo pode se transformar em uma alternativa válida para a anticoagulação oral nos pacientes que não puderem implementá‐la.
Fonte de financiamentoNão há.
Conflitos de interesseEnio Guérios é consultor e proctor da St. Jude Medical
A revisão por pares é de responsabilidade da Sociedade Brasileira de Hemodinâmica e Cardiologia Intervencionista.