No estudo BIOACTIVE, avaliamos as respostas vasculares após implante do stent eluidor de biolimus A9 (SEB; BioMatrix®) e o stent eluidor de everolimus (SEE; XIENCE V®). Apresentamos a análise de tomografia de coerência óptica (OCT) 6 meses pós‐intervenção.
MétodosOs pacientes foram randomizados para tratamento com SEB (n = 22) ou SEE (n = 18). O desfecho primário foi a frequência de hastes não cobertas e mal apostas pela OCT.
ResultadosA OCT foi realizada em 26 pacientes (SEB: n = 15; SEE: n = 11) e foram analisadas 749 imagens tomográficas e 7.725 hastes de stent. SEB e SEE apresentaram áreas luminais e dos stents semelhantes. A área de hiperplasia neointimal, a espessura neointimal e o porcentual de obstrução intra‐stent (8,44 ± 5,10% vs. 9,21 ± 6,36%; p = 0,74) foram similares. As taxas de hastes não cobertas (SEB: 2,10 ± 3,60% vs. SEE: 2,46 ± 2,15%; p = 0,77) e mal apostas (SEB: 0,48 ± 1,48% vs. SEE 0,44 ± 1,05%; p = 0,94) foram baixas e semelhantes. A frequência de frames com sinais compatíveis com infiltrado inflamatório peri‐haste foi baixa e similar entre SEB (15,53 ± 20,77%) e SEE (11,70 ± 27,51%; p = 0,68).
ConclusõesStents farmacológicos de segunda geração SEB e SEE se mostraram igualmente eficientes em suprimir a formação neointimal aos 6 meses, com respostas vasculares favoráveis. A frequência de frames com sinais de infiltrado peri‐haste por paciente foi baixa, e menor do que a historicamente observada com os stents farmacológicos de primeira geração.
In BIOACTIVE study, we evaluated vascular responses after the implant of biolimus A9‐eluting stent (BES; BioMatrixTM) and the everolimus‐eluting stent (EES; XIENCE VTM). In this study, we present the optical coherence tomography analysis (OCT) 6 months post‐intervention.
MethodsPatients were randomized to treatment with BES (n = 22) or EES (n = 18). The primary outcome was the frequency of non‐covered, poorly positioned struts by OCT.
ResultsOCT was performed in 26 patients (BES: n = 15; EES: n = 11) and 749 tomographic images and 7,725 stent struts were analyzed. BES and EES showed similar luminal and stent areas. Neointimal hyperplasia area, neointimal thickness and the percentage of in‐stent obstruction (8.44 ± 5.10% vs. 9.21 ± 6.36%; p = 0.74) were similar. The rates of not covered struts (BES: 2.10 ± 3.60% vs. ESS: 2.46 ± 2.15%, p = 0.77) and poorly positioned struts (BES: 0.48 ± 1.48% vs. EES 0.44 ± 1.05%, p = 0.94) were similarly low. The frequency of frames with signs consistent with peri‐strut inflammatory infiltrate was low and similar between BES (15.53 ± 20.77%) and EES (11.70 ± 27.51%; p = 0.68).
ConclusionsThe second‐generation drug‐eluting stents BES and EES were equally effective at suppressing the neointimal formation after 6 months, with favorable vascular responses. The frequency of frames with peri‐strut infiltrate signals per patient was low, and lower than that observed historically with first‐generation drug‐eluting stents.
Os stents farmacológicos (SF), concebidos sob o conceito de aplicar, de forma controlada, um agente antiproliferativo localmente na parede vascular, cumpriram seu objetivo primário de reduzir a formação neointimal excessiva, comumente observada após angioplastia coronária com balão e implante de stents metálicos não farmacológicos1,2 (SNF). Elevada eficácia antiproliferativa resultou em expressiva redução nas taxas de reestenose e na necessidade de novas revascularizações coronárias em uma grande variedade de cenários clínicos e anatômicos,3–8 elevando o implante de SF à estratégia padrão de tratamento durante procedimentos de intervenção coronária percutânea (ICP) em muitas regiões geográficas ao redor do globo.
No entanto, o uso mais disseminado dos SF e o tempo mais prolongado de seguimento dos pacientes tratados com essa tecnologia revelaram incidências de trombose tardia e muito tardia significativamente maiores do que as observadas após o implante de SNF.9–11
Embora a trombose tardia/muito tardia de stents seja um fenômeno multifatorial, cicatrização incompleta das hastes por atraso na formação de matriz celular e endotélio funcionante, reações inflamatórias crônicas na parede do vaso, remodelamento vascular e má aposições tardias adquiridas foram demonstrados após implante das primeiras gerações de SF.12–16 De maneira geral, esses SF eram compostos por plataformas metálicas de aço inoxidável com hastes relativamente espessas, que liberavam altas doses de sirolimus ou paclitaxel, por meio de carreadores poliméricos duráveis distribuídos ao redor de toda sua superfície metálica. Em especial, os polímeros duráveis dos SF de primeira geração – em contato permanente com a parede do vaso – foram associados com reações locais de hipersensibilidade.12
Estes achados motivaram o desenvolvimento de novos SF, visando reduzir a toxicidade na parede vascular e aumentar a biocompatibilidade desses dispositivos, porém, sem perda da eficácia antiproliferativa apresentada pelos SF de primeira geração. Nesse sentido, uma série de modificações foi implementada: plataformas com novas ligas metálicas; hastes mais finas; melhora dos sistemas de entrega; novos fármacos antiproliferativos; aplicação de menores doses de fármacos; novas matrizes poliméricas, mais finas, mais biocompatíveis, e até mesmo bioabsorvíveis; aplicação direcionada do polímero apenas nas faces abluminais das hastes dos stents; e carreamento e liberação dos fármacos por plataformas não poliméricas etc.17
No estudo BIOACTIVE, visamos avaliar as respostas vasculares após implante de dois SF de segunda geração – BioMatrix® (eluidor de biolimus A9 por meio de um polímero biodegradável) e XIENCE V® (eluidor de everolimus por meio de um fluoropolímero durável e biocompatível), que incorporaram uma ou mais das características acima mencionadas. Para este fim, utilizamos imagens de tomografia de coerência óptica (OCT), que, por meio de imagens tomográficas de alta resolução, permitem acurada avaliação do processo de reparo vascular após implante de stents coronários.18,19 Objetivamos apresentar aqui a análise de OCT 6 meses após a intervenção.
MétodosDesenho e população do estudoO BIOACTIVE é um estudo de iniciativa dos investigadores, prospectivo, randomizado, conduzido em dois centros (Instituto Dante Pazzanese de Cardiologia e Hospital Santa Marcelina), localizados em São Paulo (SP), que visou avaliar a resposta vascular coronária 6 meses após implante dos SF de segunda geração BioMatrix® e XIENCE V®. O objetivo primário do estudo foi composto pela avaliação combinada de dois desfechos no seguimento de 6 meses: (1) avaliação da função endotelial coronária – quantificada pela angiografia coronária quantitativa (QCA) por meio das variações do diâmetro luminal peri‐stent (5mm proximais e distais às bordas do stent) entre os períodos de repouso, durante estimulação sequencial com marca‐passo cardíaco e após administração de nitroglicerina intracoronária; e (2) quantificação do porcentual de cobertura das hastes dos stents por meio da OCT. Os objetivos secundários consistiram nas avaliações de eficácia por meio de QCA, ultrassom intracoronário (USIC) e OCT no seguimento invasivo de 6 meses.
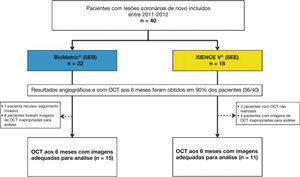
Foram incluídos pacientes portadores de lesões coronárias de novo, com comprimento máximo de 20mm, localizadas em artérias coronárias nativas, com diâmetro entre 3,0 e 3,5mm. Foram excluídos pacientes diabéticos e aqueles tratados nas primeiras 72 horas de um infarto agudo do miocárdio (IAM) com elevação do segmento ST. Pacientes com disfunção renal (creatinina sérica > 2,0mg/dL ou clearance de creatinina estimado < 30mL/min) ou disfunção ventricular esquerda (fração de ejeção do ventrículo esquerdo < 30%) graves também foram excluídos. Os principais critérios angiográficos de exclusão foram lesões ostiais em bifurcações no tronco da coronária esquerda, ou com presença de trombos ou calcificação importante.
O estudo BIOACTIVE foi aprovado pelo Comitê de Ética em Pesquisa das instituições participantes, e todos os pacientes incluídos forneceram Termo de Consentimento Livre e Esclarecido assinado antes da randomização.
Características dos stents investigadosO stent BioMatrix® (Biosensors International, Singapura) possui uma plataforma de aço inoxidável, com hastes de 120μm de espessura, recobertas por um primer durável (parylene C) com espessura de 10μm e um polímero de ácido polilático (PLA) de 11μm de espessura, distribuído apenas na superfície abluminal das hastes. Esse polímero carreia o fármaco antiproliferativo biolimus A9 e é pro‐gramado para realizar uma liberação rápida inicial de cerca de 40% do fármaco. Posteriormente, é coliberado com o restante do fármaco ao longo de 6 a 9 meses. Ultimamente, o polímero é degradado em gás carbônico e água.
O stent XIENCE V® (Abbott Vascular, Santa Clara, Estados Unidos) é composto por uma plataforma de cromo‐cobalto, com hastes de fina espessura (81μm), recobertas por um fluoropolímero durável e altamente biocompatível, distribuído ao redor de toda a superfície das hastes. Esse polímero carreia o fármaco antiproliferativo everolimus na dose de 100μm/mm2 e é programado para liberar 80% da dose total do fármaco nos primeiros 30 dias após o implante.
ProcedimentosOs procedimentos de ICP foram realizados conforme as rotinas das instituições e de acordo com as recomendações vigentes.20,21 Pré‐tratamento com dose de ataque de aspirina (300mg) e clopidogrel (300 ou 600mg) foi administrado pelo menos 24 horas antes da ICP, para os pacientes que não estavam em uso crônico dessas medicações. No início do procedimento, anticoagulação com heparina não fracionada (100 UI/kg) foi realizada, com administração de bólus adicionais, sempre que necessário, para manutenção de um tempo de coagulação ativado ≥ 250 segundos.
Após posicionamento adequado da corda‐guia 0,014” no leito distal do vaso‐alvo, os pacientes foram randomizados na proporção 1:1 para receber os stents BioMatrix® ou XIENCE V®. A pré‐dilatação das lesões‐alvo não era mandatória, e o implante direto dos dispositivos era permitido. A indicação de pós‐dilatação dos stents ficou a critério do operador e, quando realizada, deveria ser feita com balões preferencialmente não complacentes, de comprimento menor que o comprimento nominal do stent implantado, visando evitar insuflações fora do segmento tratado.
Seguimento e objetivosTodos os pacientes foram avaliados por consulta presencial em consultório ou por ligações telefônicas nos períodos de 1, 6 e 12 meses após a ICP índice. Reestudo angiográfico, com realização de USIC e OCT, foi realizado aos 6 meses.
Na presente análise, apresentamos a comparação das avaliações da resposta vascular pela OCT, cujo desfecho primário foi a diferença do porcentual de hastes não cobertas por tecido neointimal nos dois grupos de tratamento. Os desfechos secundários da análise de OCT consistiram em: frequência de hastes mal apostas, área de tecido neointimal, porcentual de obstrução dos stents pelo tecido neointimal e espessura da neoíntima. A ocorrência de eventos cardíacos adversos maiores (morte, infarto do miocárdio não fatal e revascularização do vaso‐alvo) ao final de 12 meses também foi computada como desfecho secundário.
Todos os eventos adversos foram adjudicados e classificados por um comitê de adjudicação independente e cego para o tipo de stent recebido pelos pacientes.
Aquisição e análise das imagens de tomografia de coerência ópticaAs imagens de OCT foram adquiridas com os sistemas Time‐Domain OCT (M3 System, LightLab Imaging, Westford, Estados Unidos) ou Frequency Domain Optical Coherence Tomography (C7 XR, St. Jude Medical, St. Paul, Estados Unidos) comercialmente disponíveis. As técnicas para aquisição das imagens com ambas as tecnologias de OCT já foram descritas em detalhe previamente.22,23 Todas as imagens foram armazenadas em mídia digital e enviadas para análise em um laboratório central independente (Cardiovascular Research Center, São Paulo, SP, Brasil). As análises foram realizadas em um programa dedicado e previamente validado24 (QIVUS versão 3.0, Medis Medical Imaging, Leiden, Holanda), com os operadores cegos para o tipo de stent recebido por cada paciente.
Após ajustes para as diferentes velocidades de pullback dos cateteres de imagem fornecidas pelos dois tipos de equipamento de OCT utilizados, as análises das imagens tomográficas do vaso foram feitas em intervalos de 0,6mm, no sentido longitudinal, ao longo de todo o segmento tratado.
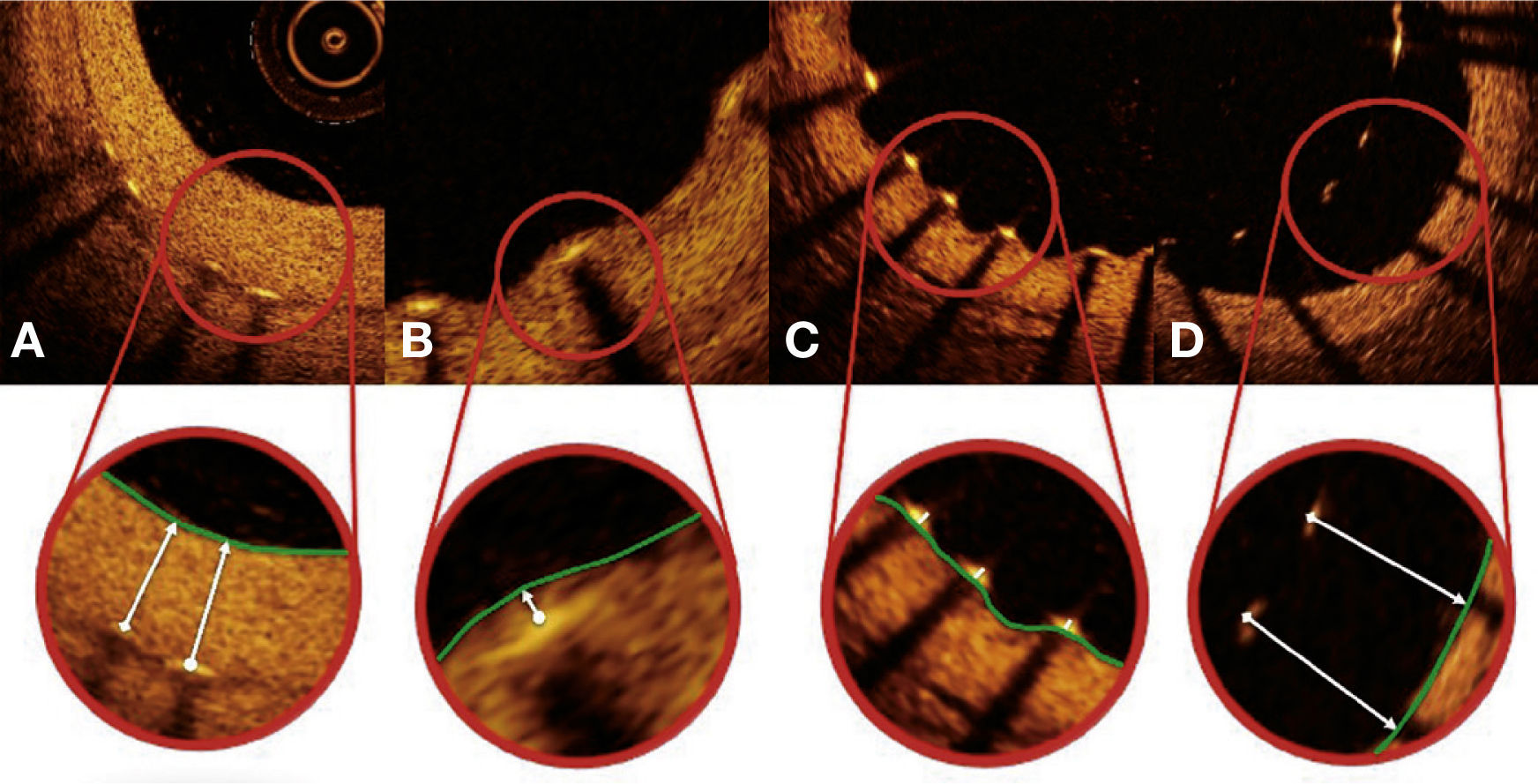
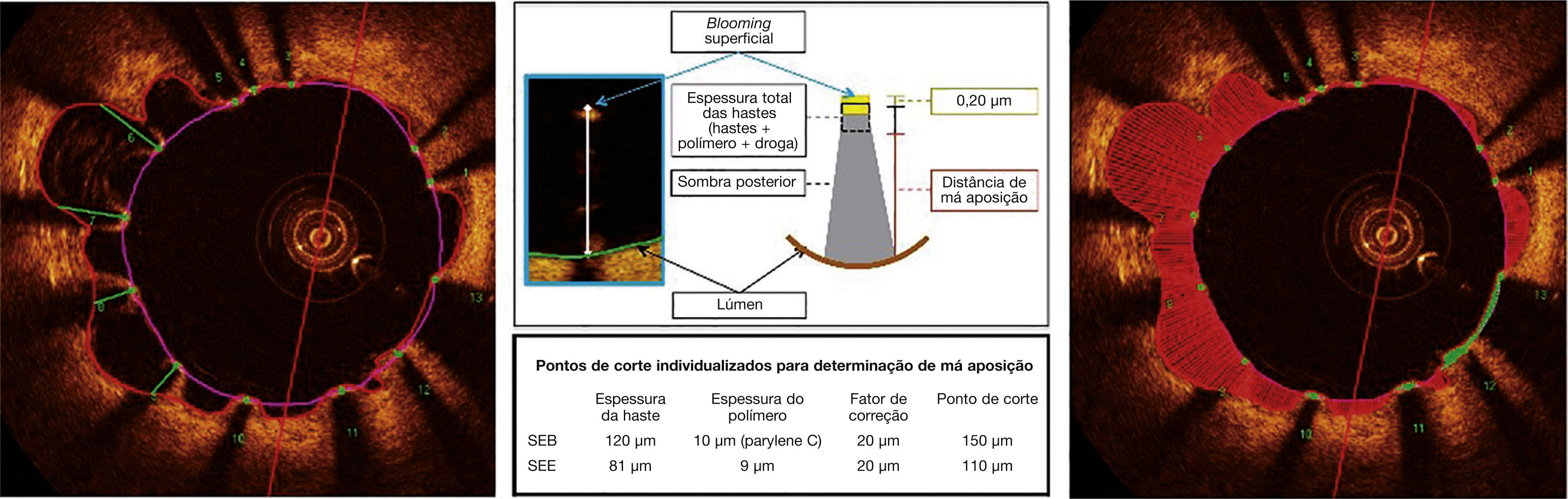
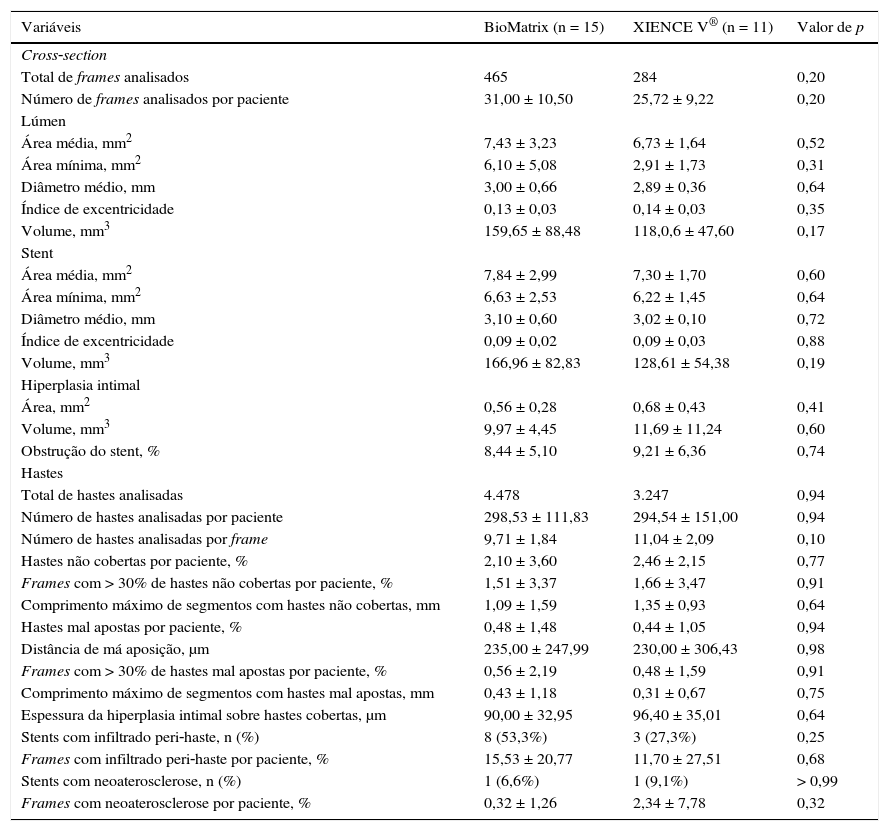
Segmentação automática do contorno luminal (borda entre o lúmen e a camada íntima do vaso) foi realizada pelo programa de análise, dentro do segmento previamente estabelecido, com ajustes manuais realizados, caso necessário. Hastes de stents metálicos aparecem na OCT como pequenas estruturas pontuais, arredondadas ou afiladas, que promovem alta reflexão do sinal luminoso emitido pelo cateter de OCT (brilho intenso) e sombra posterior. Desse modo, uma haste era considerada para análise apenas quando apresentasse o binômio brilho intenso + sombra posterior. Um algoritmo de detecção automática das hastes foi utilizado, e correções de falsos‐positivos ou falsos‐negativos foram realizadas manualmente. O número de hastes analisadas em cada imagem transversal ao longo do segmento de interesse foi, então, automaticamente computado. O contorno traçado ao longo da superfície interna de cada haste foi realizado automaticamente e definiu a área do stent em cada frame analisado. Por fim, a distância entre o ponto central da face luminal de cada haste até o contorno luminal foi determinada automaticamente por linhas orientadas para o centro de gravidade do vaso (fig. 1). Nos casos em que essa distância foi positiva, as hastes foram classificadas como cobertas. Os valores positivos da distância entre a haste do stent e o contorno luminal determinaram a espessura neointimal sobre cada haste individual. Em caso de distâncias negativas, as hastes foram classificadas como não cobertas (fig. 2). Caso a distância negativa fosse maior do que a somatória da espessura da haste + espessura do polímero (quando presente) + um fator de correção para a resolução axial mínima do OCT, essa haste era classificada como mal aposta. Com isso, os pontos de corte para definição de hastes mal apostas variaram de acordo com as características de cada stent (BioMatrix® = 150μm, e XIENCE V® = 110μm) (fig. 3).
Análise de tomografia de coerência óptica. O contorno luminal é segmentado automaticamente, seguindo a borda entre o lúmen e a camada íntima (linha vermelha). Em seguida, as hastes do stent – estruturas altamente reflexivas da luz, com sombra posterior – são identificadas por meio de um algoritmo automatizado. Os pontos localizados na sua superfície luminal são conectados para determinação da área do stent (linha rosa). As distâncias entre a superfície luminal de cada haste até o contorno luminal são automaticamente determinadas por um trajeto direcionado para o centro do vaso (linhas verdes).
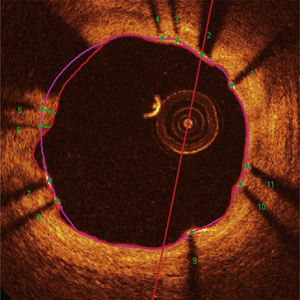
Padrão de cobertura das hastes. Cada haste do stent – presente em cada frame analisado em intervalos de 0,6mm do segmento tratado – foi avaliada. Quando a distância entre o ponto central da haste em sua superfície luminal em relação ao contorno do lúmen vascular foi positiva, a haste foi classificada como coberta, e a espessura de tecido que a recobria foi determinada pelo valor da distância em micrômetros (painéis A e B). Quando a distância foi negativa, as hastes foram classificadas como não cobertas (painéis C e D). Caso essa distância negativa fosse superior à somatória da espessura da haste + espessura do polímero + fármaco, essa haste era classificada adicionalmente como mal aposta (painel D).
Má aposição. As hastes metálicas refletem toda a luz que incide sobre sua superfície e produzem um hipersinal único, que aparece como um brilho (blooming) intenso seguido por sombra dorsal. Para a determinação do estado de aposição, utilizamos a distância da superfície luminal da haste até o contorno do lúmen vascular. Quando essa distância é maior que a espessura total da haste (haste metálica + espessura do polímero + fármaco), acrescida de um fator de correção de 20μm, que corrige para a real localização da superfície da haste, a mesma é classificada como mal aposta (painel central), e a distância de má aposição é computada para cada haste individual (painel esquerdo). Má aposições são também quantificadas como área em cada frame em que for identificada ao longo do segmento tratado (painel direito; região hachurada em vermelho). SEB: stent eluidor de biolimus A9 (Bio‐Matrix®); SEE: stent eluidor de everolimus (XIENCE V®).
A área neointimal foi determinada a partir da mensuração da espessura da neoíntima, localizada entre a área do stent e o contorno luminal. Regiões ao redor da circunferência do vaso, com distância negativa entre os contornos do stent e do lúmen (ausência de cobertura tecidual), não foram incluídas para quantificação da neoíntima (fig. 3). Com a área neointimal determinada, o porcentual de obstrução do stent foi computado em cada frame analisado pela divisão da área neointimal pela área do stent. A homogeneidade da distribuição circunferencial e longitudinal da hiperplasia neointimal ao longo de todo o segmento tratado foi avaliada pela exploração visual de gráficos de dispersão criados para cada caso.
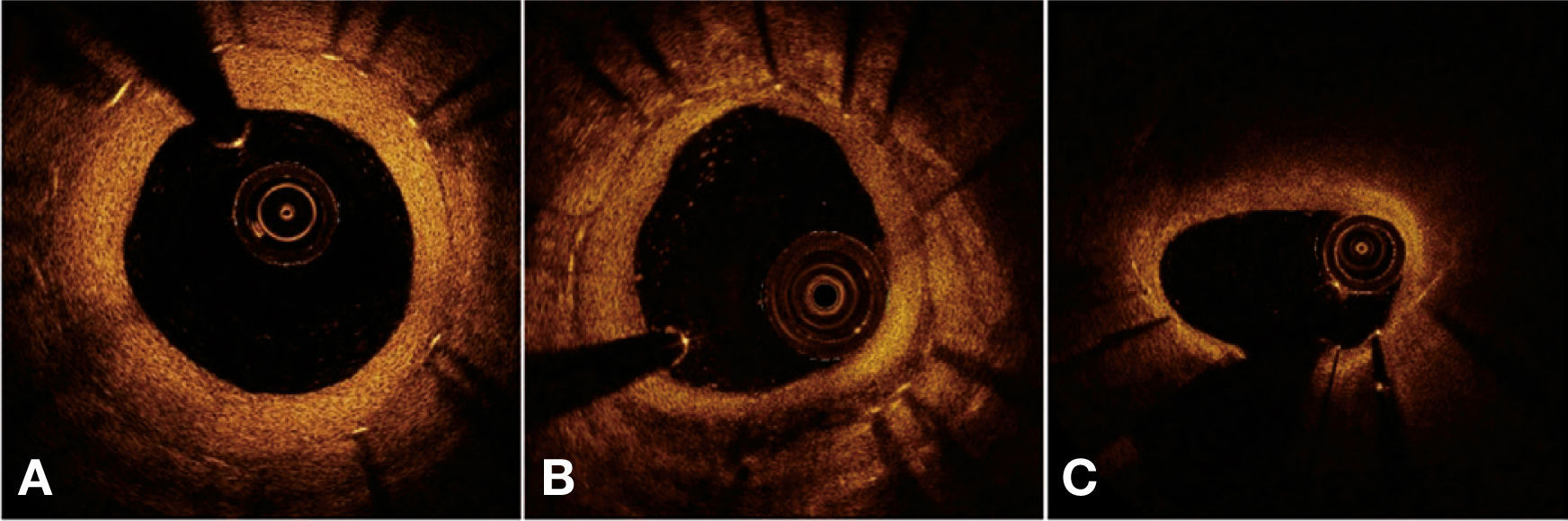
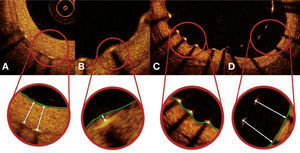
Por fim, foi realizada uma avaliação qualitativa do tecido neointimal formado sobre as hastes dos stents. Regiões de infiltrado peri‐haste foram definidas como áreas homogêneas, que refletiam o sinal óptico com menor intensidade do que o tecido adjacente, mas sem promover atenuação da luz.25 Neoaterosclerose foi definida como a presença de infiltrado lipídico ou calcificação da neoíntima.26 A figura 4 ilustra exemplos de avaliação qualitativa do tecido neointimal formado sobre as hastes dos stents.
Avaliação qualitativa do tecido neointimal. Em A, uma imagem transversa ilustra padrão de cicatrização vascular “normal”, caracterizado por uma neoíntima de aspecto óptico de alta intensidade e homogênea. Em B, exemplo de infiltrado peri‐haste entre 4 e 7 horas, caracterizado como região bem delimitada, homogênea e que promove baixa reflexão do sinal óptico, com menor intensidade que o tecido adjacente, mas sem promover atenuação da luz (permite visualização das estruturas posteriores). Em C, exemplo de neoaterosclerose, representado por infiltração lipídica do tecido neointimal entre 10 e 2 horas. Note importante atenuação do sinal óptico, que impede a visualização das estruturas posteriores naquela região, incluindo as hastes do stent.
As análises estatísticas foram realizadas com os programas Statistical Package for the Social Science (SPSS), versão 20.0 (IBM Corp., Armonk, Estados Unidos), e R, versão 3.1.1 (The R Foundation for Statistical Computing, Viena, Áustria).
As variáveis contínuas foram apresentadas como média e desvio padrão, e as categóricas como frequências e porcentuais. As variáveis categóricas foram analisadas pelos testes qui quadrado ou exato de Fisher, e as contínuas pelos testes t de Student e Mann‐Whitney U, dependendo da distribuição das variáveis.
O modelo de equações de estimativa generalizada (GEE, sigla do inglês generalized estimation equations model), com estrutura de covariância autorregressiva de primeira ordem, foi utilizado para ajustar as análises de acordo com a natureza agrupada dos dados em cada paciente (por exemplo: um paciente com um stent implantado em um vaso possui dezenas de frames e centenas de hastes analisadas). Dessa forma, um paciente que recebeu um stent longo, com mais frames e hastes analisadas, foi computado com peso diferente de outro paciente que recebeu um stent curto, com menos frames e hastes analisadas.
Todas as análises foram bicaudais, e valor de p < 0,05 foi considerado estatisticamente significativo.
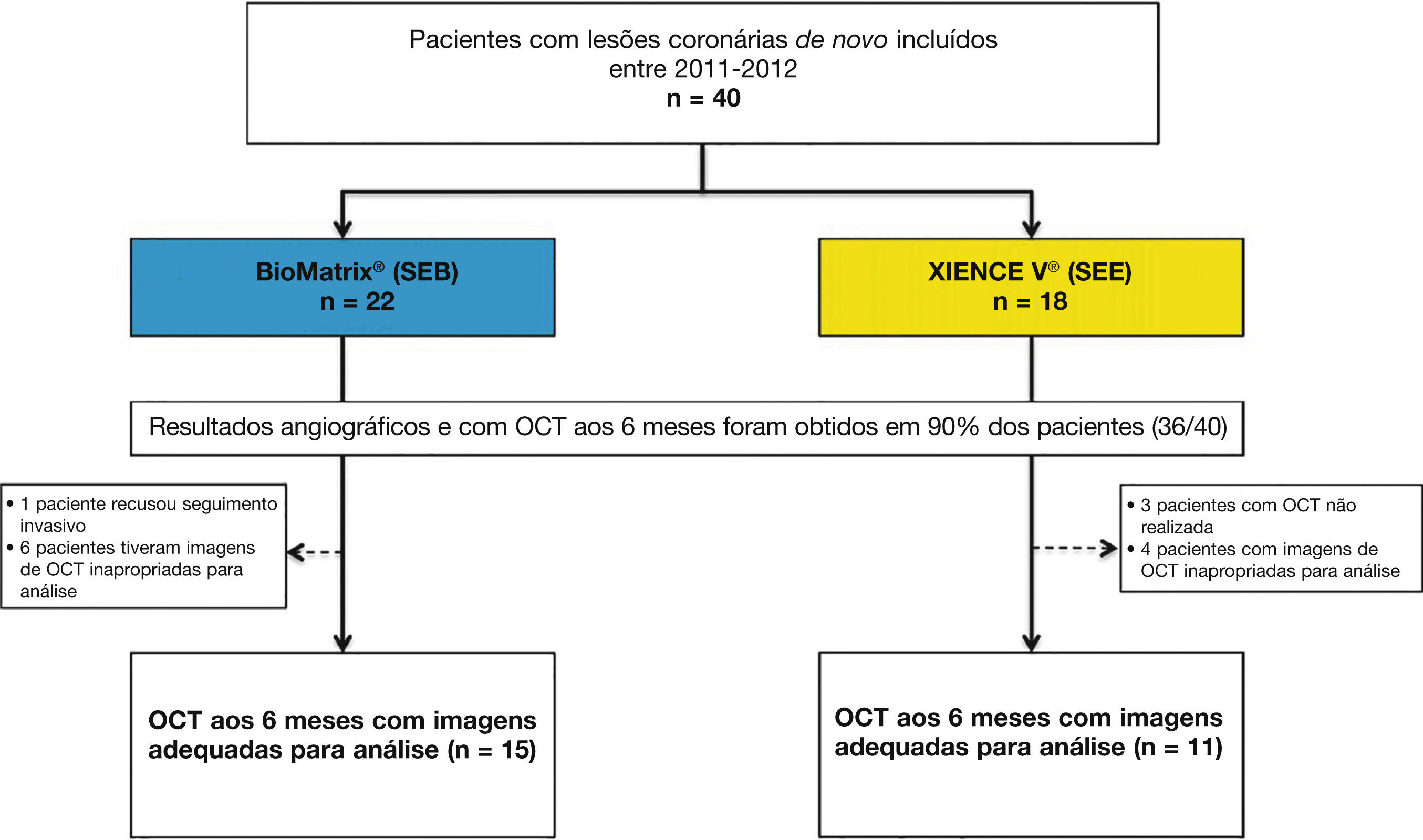
ResultadosCaracterísticas da população e dos procedimentosEntre julho de 2011 e abril de 2012, um total de 40 pacientes foi incluído no estudo BIOACTIVE e randomizado para receber o stent BioMatrix® (n = 22) ou o XIENCE V® (n = 18). Destes, reestudo angiográfico aos 6 meses com USIC e OCT foi realizado em 36 (90%) pacientes. Após avaliação qualitativa das imagens de OCT pelo core lab, um total de 26 pacientes foi incluído para avaliação dos desfechos de OCT (15 com stents BioMatrix® e 11 com stents XIENCE V®). Fluxograma detalhando a inclusão dos pacientes no estudo é apresentado na figura 5.
Fluxograma do estudo. Inclusão dos pacientes no estudo, a identificação do grupo para o qual foram alocados e número de pacientes submetidos à avaliação com tomografia de coerência óptica (OCT). SEB: stent eluidor de biolimus A9 (BioMatrix®); SEE: stent eluidor de everolimus (XIENCE V®).
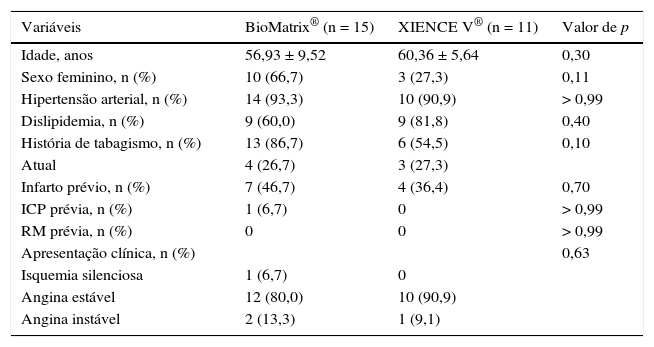
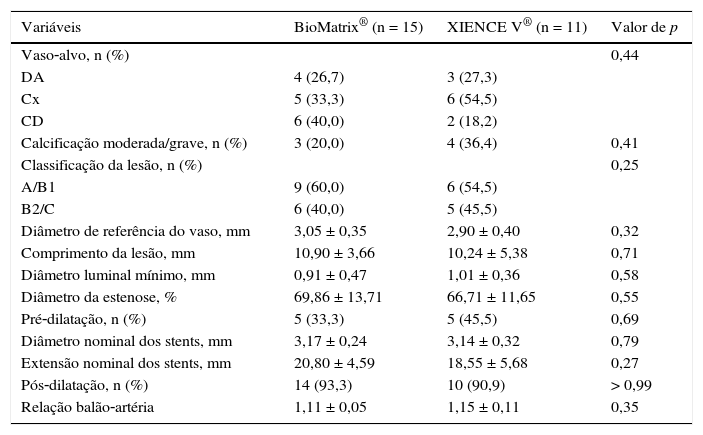
A tabela 1 apresenta as características demográficas de base, enquanto as variáveis angiográficas e do procedimento são apresentadas na tabela 2. A média das idades nos dois grupos foi 58,38 ± 8,15 anos, e 50% dos pacientes incluídos eram do sexo feminino. Angina estável foi a forma de apresentação clínica predominante nos dois grupos. Houve distribuição equilibrada entre os vasos‐alvo, e lesões tipo B2/C representaram 42,3% das lesões tratadas. O diâmetro de referência dos vasos‐alvo mediu 2,99 ± 0,38mm, e o comprimento das lesões, 10,63 ± 4,39mm. Pré‐dilatação das lesões foi realizada em apenas cinco pacientes em cada grupo, enquanto a pós‐dilatação foi realizada em mais de 90% dos casos em ambos os grupos, alcançando uma relação balão‐artéria de 1,13 ± 0,09.
Características demográficas de base
| Variáveis | BioMatrix® (n = 15) | XIENCE V® (n = 11) | Valor de p |
|---|---|---|---|
| Idade, anos | 56,93 ± 9,52 | 60,36 ± 5,64 | 0,30 |
| Sexo feminino, n (%) | 10 (66,7) | 3 (27,3) | 0,11 |
| Hipertensão arterial, n (%) | 14 (93,3) | 10 (90,9) | > 0,99 |
| Dislipidemia, n (%) | 9 (60,0) | 9 (81,8) | 0,40 |
| História de tabagismo, n (%) | 13 (86,7) | 6 (54,5) | 0,10 |
| Atual | 4 (26,7) | 3 (27,3) | |
| Infarto prévio, n (%) | 7 (46,7) | 4 (36,4) | 0,70 |
| ICP prévia, n (%) | 1 (6,7) | 0 | > 0,99 |
| RM prévia, n (%) | 0 | 0 | > 0,99 |
| Apresentação clínica, n (%) | 0,63 | ||
| Isquemia silenciosa | 1 (6,7) | 0 | |
| Angina estável | 12 (80,0) | 10 (90,9) | |
| Angina instável | 2 (13,3) | 1 (9,1) |
ICP: intervenção coronária percutânea; RM: revascularização miocárdica cirúrgica.
Características angiográficas e do procedimento
| Variáveis | BioMatrix® (n = 15) | XIENCE V® (n = 11) | Valor de p |
|---|---|---|---|
| Vaso‐alvo, n (%) | 0,44 | ||
| DA | 4 (26,7) | 3 (27,3) | |
| Cx | 5 (33,3) | 6 (54,5) | |
| CD | 6 (40,0) | 2 (18,2) | |
| Calcificação moderada/grave, n (%) | 3 (20,0) | 4 (36,4) | 0,41 |
| Classificação da lesão, n (%) | 0,25 | ||
| A/B1 | 9 (60,0) | 6 (54,5) | |
| B2/C | 6 (40,0) | 5 (45,5) | |
| Diâmetro de referência do vaso, mm | 3,05 ± 0,35 | 2,90 ± 0,40 | 0,32 |
| Comprimento da lesão, mm | 10,90 ± 3,66 | 10,24 ± 5,38 | 0,71 |
| Diâmetro luminal mínimo, mm | 0,91 ± 0,47 | 1,01 ± 0,36 | 0,58 |
| Diâmetro da estenose, % | 69,86 ± 13,71 | 66,71 ± 11,65 | 0,55 |
| Pré‐dilatação, n (%) | 5 (33,3) | 5 (45,5) | 0,69 |
| Diâmetro nominal dos stents, mm | 3,17 ± 0,24 | 3,14 ± 0,32 | 0,79 |
| Extensão nominal dos stents, mm | 20,80 ± 4,59 | 18,55 ± 5,68 | 0,27 |
| Pós‐dilatação, n (%) | 14 (93,3) | 10 (90,9) | > 0,99 |
| Relação balão‐artéria | 1,11 ± 0,05 | 1,15 ± 0,11 | 0,35 |
DA: descendente anterior; Cx: circunflexa; CD: coronária direita.
De um total de 823 frames disponíveis para análise (respeitando o intervalo entre frames de 0,6mm), 75 foram excluídos da análise pelas seguintes razões: imagem com mais de 45° da circunferência fora do campo de visão (n = 29 frames); presença de sangue residual em quantidade significativa, impedindo a visualização da camada íntima do vaso (n = 28 frames); e artefatos eletrônicos (n = 18 frames). Todos os 75 frames excluídos foram adquiridos com o equipamento de primeira geração TD‐OCT. Nos 748 frames analisados, 7.725 hastes de stent foram avaliadas de forma individualizada. A tabela 3 apresenta os resultados da análise de OCT.
Resultados da tomografia de coerência óptica
| Variáveis | BioMatrix (n = 15) | XIENCE V® (n = 11) | Valor de p |
|---|---|---|---|
| Cross‐section | |||
| Total de frames analisados | 465 | 284 | 0,20 |
| Número de frames analisados por paciente | 31,00 ± 10,50 | 25,72 ± 9,22 | 0,20 |
| Lúmen | |||
| Área média, mm2 | 7,43 ± 3,23 | 6,73 ± 1,64 | 0,52 |
| Área mínima, mm2 | 6,10 ± 5,08 | 2,91 ± 1,73 | 0,31 |
| Diâmetro médio, mm | 3,00 ± 0,66 | 2,89 ± 0,36 | 0,64 |
| Índice de excentricidade | 0,13 ± 0,03 | 0,14 ± 0,03 | 0,35 |
| Volume, mm3 | 159,65 ± 88,48 | 118,0,6 ± 47,60 | 0,17 |
| Stent | |||
| Área média, mm2 | 7,84 ± 2,99 | 7,30 ± 1,70 | 0,60 |
| Área mínima, mm2 | 6,63 ± 2,53 | 6,22 ± 1,45 | 0,64 |
| Diâmetro médio, mm | 3,10 ± 0,60 | 3,02 ± 0,10 | 0,72 |
| Índice de excentricidade | 0,09 ± 0,02 | 0,09 ± 0,03 | 0,88 |
| Volume, mm3 | 166,96 ± 82,83 | 128,61 ± 54,38 | 0,19 |
| Hiperplasia intimal | |||
| Área, mm2 | 0,56 ± 0,28 | 0,68 ± 0,43 | 0,41 |
| Volume, mm3 | 9,97 ± 4,45 | 11,69 ± 11,24 | 0,60 |
| Obstrução do stent, % | 8,44 ± 5,10 | 9,21 ± 6,36 | 0,74 |
| Hastes | |||
| Total de hastes analisadas | 4.478 | 3.247 | 0,94 |
| Número de hastes analisadas por paciente | 298,53 ± 111,83 | 294,54 ± 151,00 | 0,94 |
| Número de hastes analisadas por frame | 9,71 ± 1,84 | 11,04 ± 2,09 | 0,10 |
| Hastes não cobertas por paciente, % | 2,10 ± 3,60 | 2,46 ± 2,15 | 0,77 |
| Frames com > 30% de hastes não cobertas por paciente, % | 1,51 ± 3,37 | 1,66 ± 3,47 | 0,91 |
| Comprimento máximo de segmentos com hastes não cobertas, mm | 1,09 ± 1,59 | 1,35 ± 0,93 | 0,64 |
| Hastes mal apostas por paciente, % | 0,48 ± 1,48 | 0,44 ± 1,05 | 0,94 |
| Distância de má aposição, μm | 235,00 ± 247,99 | 230,00 ± 306,43 | 0,98 |
| Frames com > 30% de hastes mal apostas por paciente, % | 0,56 ± 2,19 | 0,48 ± 1,59 | 0,91 |
| Comprimento máximo de segmentos com hastes mal apostas, mm | 0,43 ± 1,18 | 0,31 ± 0,67 | 0,75 |
| Espessura da hiperplasia intimal sobre hastes cobertas, μm | 90,00 ± 32,95 | 96,40 ± 35,01 | 0,64 |
| Stents com infiltrado peri‐haste, n (%) | 8 (53,3%) | 3 (27,3%) | 0,25 |
| Frames com infiltrado peri‐haste por paciente, % | 15,53 ± 20,77 | 11,70 ± 27,51 | 0,68 |
| Stents com neoaterosclerose, n (%) | 1 (6,6%) | 1 (9,1%) | > 0,99 |
| Frames com neoaterosclerose por paciente, % | 0,32 ± 1,26 | 2,34 ± 7,78 | 0,32 |
Não houve diferenças significativas entre os grupos acerca da análise morfométrica quantitativa planar em nível de cross‐section, assim como na análise detalhada em nível de hastes. Com relação aos desfechos de eficácia, os dois tipos de stent apresentaram acentuada potência antiproliferativa, conforme demonstrado pelas pequenas áreas (0,56 ± 0,28mm2 vs. 0,68 ± 0,43mm2; p = 0,41) e espessuras (90,00 ± 32,75μm vs. 96,40 ± 35,01μm; p = 0,64) da hiperplasia neointimal, o que promoveu pequeno porcentual de obstrução dos stents em ambos os grupos (8,44 ± 5,10% vs. 9,21 ± 6,36%; p = 0,74). Ressalta‐se que, a despeito da pequena quantidade de tecido neointimal formado ao final de 6 meses, sua distribuição se fez de forma homogênea ao longo de todo o segmento tratado (fig. 6). De fato, o porcentual de hastes não cobertas por paciente (desfecho primário substituto de segurança) foi baixo e semelhante entre os grupos BioMatrix® e XIENCE V® (2,10 ± 3,60% vs. 2,46 ± 2,15%; p = 0,77). Da mesma forma, a incidência de hastes mal apostas foi extremamente baixa e semelhante entre os grupos (0,48 ± 1,48% vs. 0,44 ± 1,05%; p = 0,94), assim como a distância da má aposição de cada haste individual até a parede do vaso (235,00 ± 247,99μm vs. 230,00 ± 306,43μm; p = 0,98). De forma importante, o comprimento longitudinal máximo de segmentos com hastes não cobertas (1,09 ± 1,59mm vs. 1,35 ± 0,93mm; p = 0,64) ou mal apostas (0,43 ± 1,18mm vs. 0,31 ± 0,67mm; p = 0,75) foi pequeno e semelhante entre os grupos. A figura 7 apresenta exemplos do bom perfil de cicatrização dos tipos de stent.
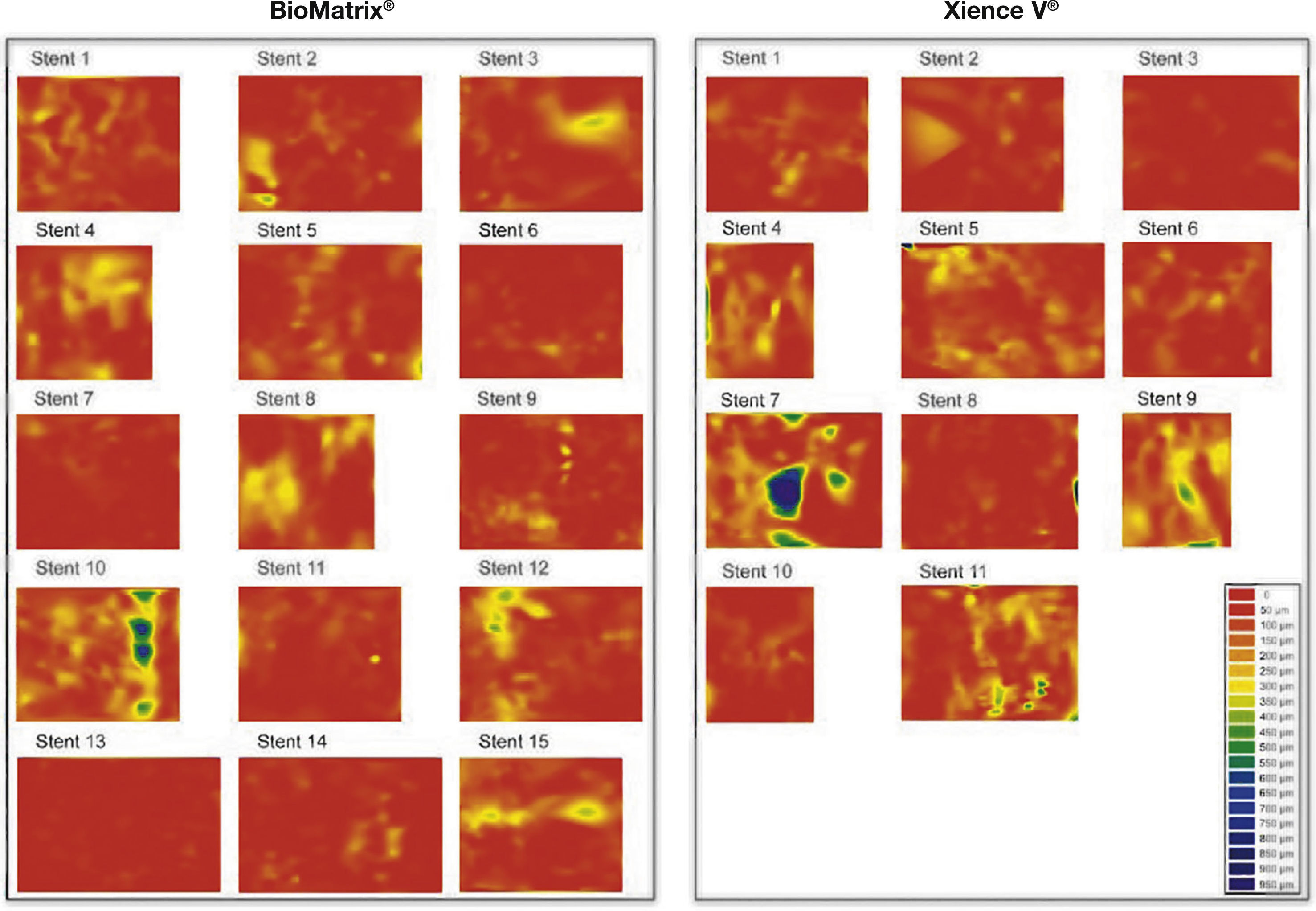
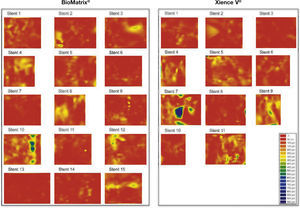
Dispersão da topografia neointimal. A espessura do tecido neointimal foi calculada ao redor dos 360° da circunferência, em cada frame analisado ao longo do segmento tratado, e sua distribuição é apresentada nos sentidos circunferencial e longitudinal de cada stent avaliado. Os gráficos representam o stent cortado no sentido longitudinal ao longo do ângulo zero da circunferência do vaso e disposto sobre superfície plana. O eixo horizontal representa o comprimento dos stents, e o eixo vertical os 360° de sua circunferência. A quantidade de tecido neointimal é representada por mapa de cores, de acordo com a menor (vermelho) ou maior (azul) espessura. Observa‐se que ambos os tipos de stent apresentaram pequena espessura do tecido neointimal, com distribuição homogênea. Apenas dois casos – um em cada grupo – apresentaram maior acúmulo focal de tecido neointimal, identificado pelas regiões azuis. Estes dois pacientes apresentaram reestenose grave intrassegmento e foram submetidos à nova revascularização.
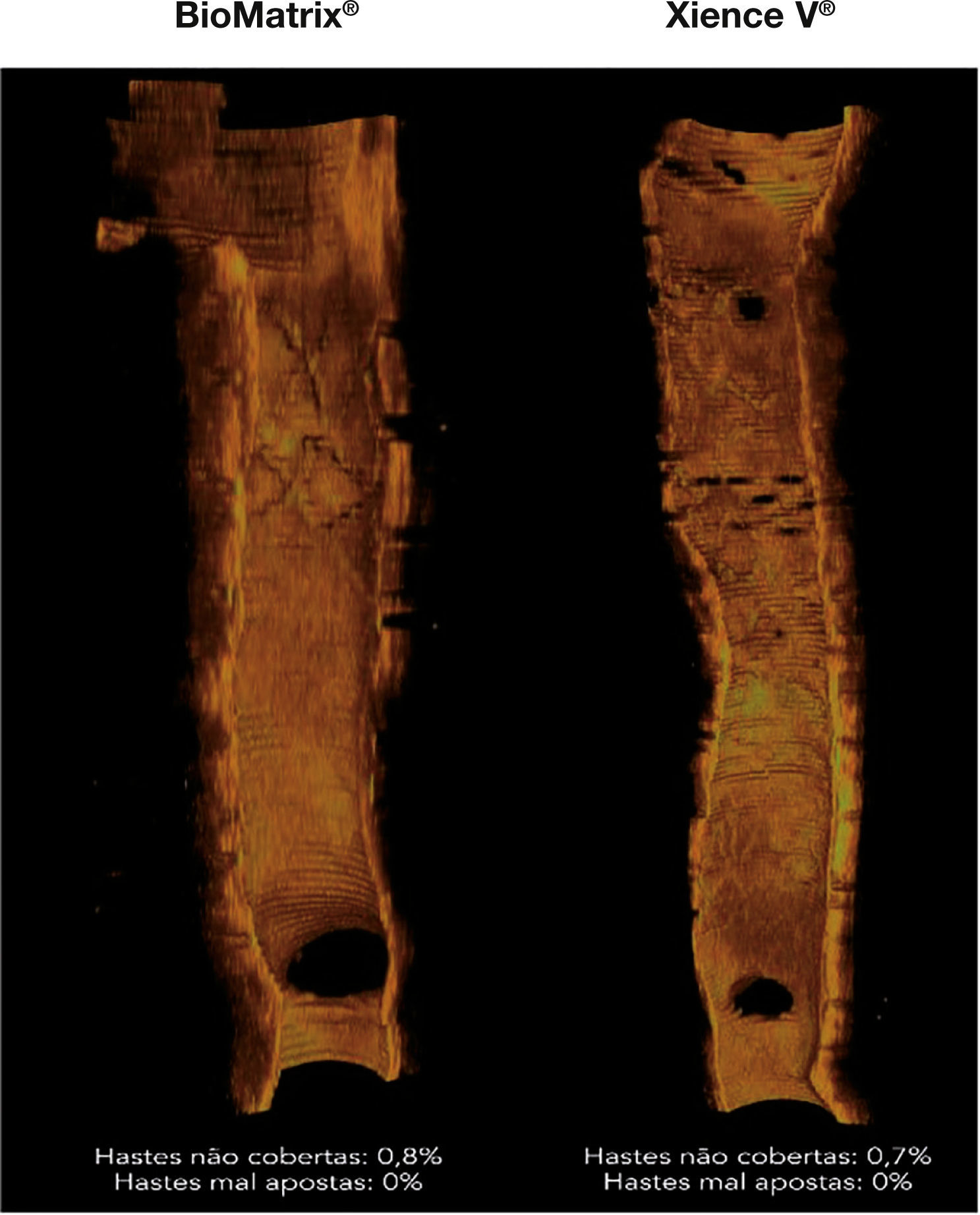
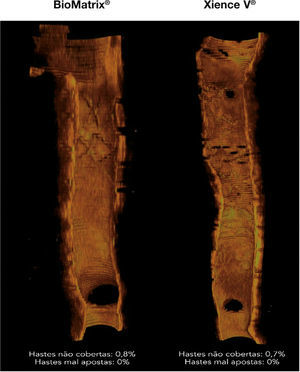
Perfil de cicatrização dos stents. Reconstruções tridimensionais, no sentido longitudinal, dos stents BioMatrix® e XIENCE V®, ilustrando o perfil de cicatrização desses dispositivos no seguimento de 6 meses. Nota‐se a presença de fina camada de tecido neointimal recobrindo todo o segmento tratado, com mínimo porcentuais de hastes desnudas.
Na análise sobre a qualidade do tecido neointimal formado sobre os stents, o achado de infiltrados peri‐hastes foi relativamente raro, ocorrendo em 15,53% dos frames analisados no grupo BioMatrix® e em 11,70% dos frames analisados no grupo XIENCE V® (p = 0,68). Neoaterosclerose foi observada apenas em um stent de cada grupo.
Desfechos clínicosNão houve casos de óbito ou infarto durante o seguimento de 1 ano. Ocorreram duas revascularizações da lesão‐alvo – uma em cada grupo. Um paciente do grupo XIENCE V® apresentava angina estável e, na ocasião do reestudo, aos 6 meses, apresentou reestenose intra‐stent grave, com achados de neoaterosclerose pela OCT, tendo sido submetido à revascularização da lesão‐alvo. Um outro paciente – do grupo BioMatrix® – também apresentava angina estável à ocasião do reestudo de 6 meses, que revelou reestenose grave na borda distal do stent previamente implantado e foi, então, submetido à nova revascularização.
DiscussãoDebates acerca da segurança dos SF são recorrentes, porém, ainda contemporâneos. No presente estudo, utilizamos a OCT para avaliar a eficácia antiproliferativa de dois tipos diferentes de SF de segunda geração e, por meio de desfechos substitutos, inferir sua segurança em médio prazo. Os principais achados foram: a incidência de hastes não cobertas por tecido ou mal apostas foi baixa e semelhante nos dois grupos ao final de 6 meses; a eficácia antiproliferativa foi mantida nos dois grupos, com mínima formação neointimal homogeneamente distribuída ao longo dos segmentos tratados, promovendo baixos porcentuais de obstrução; ambos os SF, com tecnologias diferentes, promoveram cicatrização com aspecto óptico “saudável”, com baixa incidência de infiltrados peri‐hastes.
Embora os SF tenham logrado êxito em seu propósito primário de minimizar a formação neointimal e de reduzir as taxas de reestenose e novas revascularizações, o excesso de ocorrência de eventos trombóticos tardios e muito tardios desses dispositivos deflagrou um sinal de alerta acerca da sua segurança em longo prazo. Embora a trombose tardia de stents seja um fenômeno multifatorial, foi demonstrado que os polímeros utilizados nos SF para carrear e controlar a liberação dos agentes antiproliferativos localmente na parede vascular tinham papel central na gênese e perpetuação de processos inflamatórios locais, potencialmente induzindo à formação de remodelamentos vasculares tardios e ao atraso na cicatrização.12,14,16
Com o objetivo de minimizar os efeitos deletérios dos polímeros existentes nos SF de primeira geração, uma série de modificações foi promovida na confecção de novas gerações de SF. Dentre essas modificações, destacam‐se: novas ligas metálicas, com hastes mais finas; polímeros mais biocompatíveis, aplicados apenas na superfície abluminal das hastes (reduzindo, assim, sua espessura); polímeros bioabsorvíveis; tecnologias de carreamento de fármacos não polimérica; e até mesmo stents totalmente bioabsorvíveis.17
Incorporando algumas dessas evoluções tecnológicas, o stent BioMatrix® possui um polímero bioabsorvível de PLA montado na superfície abluminal das hastes de aço inoxidável da plataforma do stent, que carreia e libera o fármaco biolimus A9. Os benefícios desse novo SF de segunda geração foram demonstrados no estudo LEADERS (Limus Eluted from A Durable Versus ERodable Stent Coating), que comparou, de forma randomizada, os desfechos clínicos do stent BioMatrix® com os do SF de primeira geração, CYPHER®, liberador de sirolimus por meio de um polímero durável. Ao final de 5 anos, o grupo de pacientes tratados com o stent BioMatrix® apresentou uma tendência à menor incidência de eventos cardíacos adversos maiores (22,3% vs. 26,1%; p = 0,071), além de significativa redução nas taxas de trombose tardia após o primeiro ano (0,66% vs. 2,5%; p = 0,003).27 A subanálise de OCT desse estudo revelou melhor perfil de cicatrização do stent BioMatrix®, com menor porcentual de hastes desnudas em comparação com o stent CYPHER® (0,6% vs. 2,1%; p = 0,04) ao final de 9 meses.28
Da mesma forma, o SF de segunda geração XIENCE V® também foi comparado ao stent CYPHER®, no estudo randomizado SORT OUT IV (Scandinavian Organization for Randomized Trials with Clinical Outcome IV). Ao final de 9 meses, a ocorrência do desfecho primário (morte cardíaca, infarto, trombose definitiva dos stents e revascularização do vaso‐alvo) foi semelhante entre os dois tipos de SF (4,9% vs. 5,2%, p = 0,01 para não inferioridade).29 Esses resultados foram mantidos até o final de 2 anos de seguimento (8,3% vs. 8,7%; p = 0,66).30 De forma importante, o stent XIENCE V®, que, assim como o stent CYPHER®, possui polímero durável, porém menos espesso e mais biocompatível, apresentou forte tendência à menor incidência de trombose definitiva dos stents aos 9 meses (0,1% vs. 0,7%; p = 0,05)29; fato que se confirmou de forma significativa ao final de 2 anos (0,2% vs. 0,9%; p = 0,02).30
Após a comprovação da não inferioridade dos SF de segunda geração em comparação com os SF de primeira geração acerca da sua eficiência antiproliferativa, porém com melhor perfil de segurança,31 não tardou muito para surgirem as primeiras comparações cabeça a cabeça entre SF de segunda geração.
O estudo COMPARE‐II (Comparison of the Everolimus Eluting with the Biolimus A9 Eluting Stent) confrontou, de forma randomizada (2:1), 2.707 pacientes para tratamento com stents Nobori (n = 1.795, Terumo, Tóquio, Japão), que, à semelhança dos stents BioMatrix®, liberam biolimus A9 por meio de um polímero bioabsorvível, ou com stents liberadores de everolimus, por meio de um fluoropolímero durável (XIENCE V® ou XIENCE PRIME; n = 912). A ocorrência do desfecho primário (morte cardíaca, infarto não fatal e revascularização do vaso‐alvo guiada por isquemia) aos 12 meses ocorreu de forma semelhante nos dois grupos (Nobori: 5,2% vs. XIENCE: 4,8%; p < 0,0001 para não inferioridade).32 Estes resultados encontram eco na avaliação por OCT desses dois tipos de stent conduzida por Tada et al., que não encontraram diferenças significativas acerca do porcentual de cobertura das hastes entre os SF de segunda geração Nobori e XIENCE V® (Odds Ratio OR: 1,54; intervalo de confiança de 95% IC95%: 0,63‐3,79; p = 0,34) ao final de 6 a 8 meses.
No presente estudo, confirmamos o excelente perfil de cicatrização dos stents XIENCE V® e BioMatrix®, que demonstraram potente supressão na intensidade de formação neointimal, porém, sem afetar o perfil de cicatrização, conforme demonstrado pelos baixos porcentuais de hastes não cobertas por tecido. No entanto, seguimento mais longo é necessário para avaliação dos potenciais benefícios dos SF com polímeros duráveis.
Evolução na avaliação de novos stents farmacológicos e a contribuição da tomografia de coerência óptica
A evolução dos métodos de imagem invasivos tem caminhado pari passu com os avanços tecnológicos da Cardiologia Intervencionista. Ao longo da história, os métodos de imagem intravasculares têm contribuído para a compreensão dos mecanismos de ação de diferentes dispositivos, auxiliado a entender eventuais mecanismos de falência e permitido o avanço tecnológico dos mesmos.
Historicamente, a performance tardia de um stent coronário era avaliada por sua eficiência em suprimir a formação de tecido neointimal – geralmente avaliada por meio da perda luminal tardia na angiografia e pela quantificação, ao USIC, do volume de hiperplasia neointimal e do quanto esse tecido obstrui a área do stent (o chamado porcentual de obstrução). No entanto, a demonstração, por meio de estudos anatomopatológicos, de que a ausência ou o atraso na cicatrização das hastes dos stents estavam entre os preditores patológicos mais potentes para a ocorrência de trombose tardia desses dispositivos,13,16 induziu a uma reflexão sobre a forma de avaliação in vivo dos stents coronários. O foco deixou de estar apenas na verificação da potência antiproliferativa dos stents e migrou, também, para a quantificação de marcadores morfométricos indicativos de segurança. Com isso, o porcentual de cobertura e aposição das hastes de stents coronários passou a ser utilizado como desfecho primário em uma série de estudos randomizados, desenhados para avaliar a performance de diferentes SF em períodos variáveis.33
Enquanto os SNF costumam desenvolver uma cobertura circunferencial de tecido neointimal com espessura média de 500μm (perda luminal tardia de cerca de 1mm) – facilmente identificada e quantificada por meio da angiografia e USIC, os SF atrasam e até mesmo anulam a resposta hiperplásica de forma intensa, de modo que suas hastes frequentemente são cobertas por fina camada de tecido, com espessura bem abaixo dos limites de detecção da angiografia e do USIC. Em razão da sua alta resolução axial (dez vezes maior do que a fornecida pelo USIC), a OCT mostrou‐se mais sensível e acurada que o USIC em identificar cobertura e má aposição das hastes de stents,34–36 exibindo boa correlação com a histologia18,36–38 e alta reprodutibilidade.18,38 Dessa forma, a OCT permite avaliação da complexa interação stent‐vaso in vivo com nível de detalhes sem precedentes, tornando‐se a modalidade de imagem padrão para avaliação da resposta vascular após implante de stents em uma série de estudos randomizados.33 No presente estudo, a espessura média do tecido neointimal formado ao final de 6 meses foi menor que 100μm e esteve abaixo dos limites de detecção do USIC.
Além da acurada avaliação quantitativa descrita acima, a OCT permite ainda identificação da qualidade do tecido neointimal formado. No início das avaliações de SF com OCT, não era rara a observação de áreas de baixa intensidade do sinal óptico no tecido neointimal ao redor das hastes dos stents. Estes achados, chamados de infiltrado peri‐haste (ou PLIA, do inglês de peri‐strut low intensity areas), mostraram correspondência, na avaliação histológica, com regiões hipocelulares e presença de material fibrinoide e proteoglicanos, circundadas por uma resposta cicatricial polimórfica com macrófagos e linfócitos.25 Um estudo patológico conduzido por van Beusekom et al. demonstrou presença de áreas acelulares após implante de SF de primeira geração não existentes com os SNF.39 Esses achados foram confirmados in vivo, em uma avaliação de 36 stents, na qual infiltrados peri‐haste foram mais frequentemente identificados em SF (65%) do que em SNF (19%; p < 0,001), sugerindo uma reação adversa local ao fármaco e/ou ao polímero.25 Neoaterosclerose é um fenômeno que se refere à formação de nova placa aterosclerótica no interior de uma neoíntima já formada. A degeneração de uma neoíntima normal, com desenvolvimento de placas vulneráveis, e, eventualmente, a ruptura das mesmas já foram identificadas recentemente como causa de falência tardia de stents – novamente, mais frequentemente identificadas após implante de SF.40 No presente estudo, a incidência de infiltrados peri‐haste foi menor que aquela observada pós‐implante de SF de primeira geração, sugerindo, em teoria, uma resposta vascular mais benigna após implante dos SF de segunda geração. O real impacto clínico desses achados ainda deve ser investigado em estudos maiores e com período de acompanhamento mais longo. Na presente população, a incidência de neoaterosclerose foi baixa, representada por um caso em cada grupo. No entanto, esteve associada com proliferação neointimal mais exacerbada em um caso, que necessitou nova revascularização.
LimitaçõesAlgumas limitações do presente estudo merecem ser mencionadas. Em primeiro lugar, embora a população incluída tenha fornecido dados suficientes (749 frames e 7.725 hastes analisadas) para avaliação de desfechos substitutos de eficácia e segurança pela OCT, o número de pacientes incluídos foi insuficiente para a avaliação do impacto clínico dos achados à OCT. Segundo, a não realização da OCT após o procedimento índice impediu uma classificação temporal das má aposições observadas, não sendo possível saber se uma má aposição identificada aos 6 meses é apenas residual de uma má aposição aguda, ou se foi adquirida tardiamente. No entanto, a baixa incidência e a magnitude das má aposições observadas, no contexto de uma cicatrização favorável dos stents, sugeriram que as poucas má aposições vistas no presente estudo não representavam reações vasculares locais desfavoráveis. Terceiro, o tempo de avaliação de 6 meses pareceu curto para a detecção de potenciais diferenças entre as duas tecnologias de stents avaliadas. Não se sabe se as respostas vasculares favoráveis observadas no presente estudo se manterão no seguimento de longo prazo. Quarto, a população incluída na presente análise foi composta predominantemente de pacientes estáveis, não diabéticos e com lesões relativamente curtas em vasos calibrosos. Essa seleção visou minimizar a inclusão de pacientes com doença mais avançada que pudessem interferir nas avaliações da função endotelial – um dos desfechos primários do estudo BIOACTIVE. Dessa forma, a extrapolação dos resultados aqui apresentados para populações de maior complexidade deve ser feita com cautela.
ConclusõesOs stents farmacológicos de segunda geração BioMatrix® e XIENCE V® apresentaram resposta vascular favorável ao final de 6 meses. Os dois tipos de stents farmacológicos demonstraram excelente perfil de eficácia, com eficiente supressão da formação neointimal e baixo porcentual de obstrução intra‐stent, sem causar atraso no processo de cicatrização das hastes, conforme demonstrado pelas baixas e comparáveis taxas de hastes não cobertas e mal apostas. Ademais, a qualidade da cicatrização também foi favorável, com taxas reduzidas de infiltrados peri‐haste e neoaterosclerose.
Fonte de financiamentoNão há.
Conflitos de interessesOs autores declaram não haver conflitos de interesse.