Identificar y caracterizar los eventos adversos (EA) en el servicio de Medicina Interna de un hospital comarcal mediante el uso de la herramienta Global Trigger Tool (GTT) ampliada, analizando su validez diagnóstica.
Material y métodosEstudio observacional, analítico, descriptivo y retrospectivo de altas de pacientes en 2013 en un servicio de Medicina Interna para la detección de EA mediante la identificación de triggers (evento relacionado frecuentemente con EA). Los triggers y los EA se localizaron mediante la revisión sistemática de la documentación clínica. Una vez detectado el EA, se procedió a su caracterización.
ResultadosSe detectaron 149EA en 291 altas durante el año 2013, de los cuales el 75,3% fueron puestos en evidencia directamente por la herramienta, mientras que el resto no tuvieron asociado un trigger. El porcentaje de altas que presentó al menos un EA fue del 35,4%. El EA más frecuentemente hallado fue la úlcera por presión (12%), seguido de delirium, estreñimiento, infección respiratoria nosocomial y alteración del nivel de conciencia por fármacos. El 47,6% de los EA estuvieron relacionados con el uso de fármacos. Se consideraron evitables el 32,2% de EA. La herramienta demostró tener una sensibilidad del 91,3% (IC95%: 88,9-93,2) y una especificidad del 32,5% (IC95%: 29,9-35,1). Presentaron un valor predictivo positivo del 42,5% (IC95%: 40,1-45,1) y un valor predictivo negativo del 87,1% (IC95%: 83,8-89,9).
ConclusionesLa herramienta empleada en este trabajo es válida, útil y reproducible para la detección de EA. Asimismo, sirve para determinar tasas de daño y observar su evolución en el tiempo. En este estudio se ha hallado una frecuencia elevada tanto de EA como de eventos evitables.
To identify and characterize adverse events (AE) in an Internal Medicine Department of a district hospital using an extension of the Global Trigger Tool (GTT), analyzing the diagnostic validity of the tool.
MethodsAn observational, analytical, descriptive and retrospective study was conducted on 2013 clinical charts from an Internal Medicine Department in order to detect EA through the identification of ‘triggers’ (an event often related to an AE). The ‘triggers’ and AE were located by systematic review of clinical documentation. The AE were characterized after they were identified.
ResultsA total of149 AE were detected in 291 clinical charts during 2013, of which 75.3% were detected directly by the tool, while the rest were not associated with a trigger. The percentage of charts that had at least one AE was 35.4%. The most frequent AE found was pressure ulcer (12%), followed by delirium, constipation, nosocomial respiratory infection and altered level of consciousness by drugs. Almost half (47.6%) of the AE were related to drug use, and 32.2% of all AE were considered preventable. The tool demonstrated a sensitivity of 91.3% (95%CI: 88.9-93.2) and a specificity of 32.5% (95%CI: 29.9-35.1). It had a positive predictive value of 42.5% (95%CI: 40.1-45.1) and a negative predictive value of 87.1% (95%CI: 83.8-89.9).
ConclusionsThe tool used in this study is valid, useful and reproducible for the detection of AE. It also serves to determine rates of injury and to observe their progression over time. A high frequency of both AE and preventable events were observed in this study.
En la actualidad la comunidad médica es más consciente del impacto negativo que tienen los eventos adversos (EA) y los errores médicos en la asistencia sanitaria gracias a diversos estudios, como el realizado por el Instituto de Medicina de Estados Unidos en 19991. La atención a la seguridad del paciente forma parte de la práctica médica y se están realizando esfuerzos para mejorar la detección de los EA con el objetivo de establecer mejoras para poder prevenirlos.
En estudios efectuados en varios países, los EA presentan una frecuencia entre el 3,7 y el 16,6% de las hospitalizaciones2. Asimismo, producen un importante impacto en vidas y costes. En el Harvard Medical Practice Study, el 6,6% de los EA conllevó el fallecimiento de los pacientes3. Así, en Estados Unidos, país con múltiples estudios sobre seguridad del paciente, se ha estimado que anualmente se producen alrededor de 93.000muertes y se gastan unos 4.000millones de dólares en asistencia sanitaria por errores médicos4. Además, un metaanálisis sugería que los EA constituían entre la cuarta y la sexta causas de muerte en Estados Unidos5, por delante de las ocasionadas por accidentes de vehículos a motor, cáncer de mama o sida. Se considera que hasta el 20-30% de los pacientes reciben cuidados contraindicados6. Además, existe un coste intangible; se trata de la pérdida de confianza en el sistema por los pacientes y también por los profesionales1.
En España, el estudio ENEAS7 detectó que la frecuencia de EA relacionados directamente con la hospitalización fue de 8,4% (IC95%: 7,7-9,1%), siendo el 42% de los EA evitables, en función de los criterios prefijados.
Actualmente no se dispone de un gold standard para la detección de EA en pacientes hospitalizados8, aunque existen distintos métodos para ello, siendo los principales los siguientes: notificación de incidentes, revisiones sistemáticas y protocolizadas de historias clínicas, observación directa, uso de sistemas electrónicos y la herramienta, promovida principalmente por el Institute for Healthcare Improvement (IHI), mediante la metodología Global Trigger Tool (GTT)9.
El concepto de herramienta trigger (pista o palabra centinela) para identificar EA fue introducido en 1974. Supone la búsqueda en la historia clínica de triggers, que son eventos previamente definidos y que están muy frecuentemente relacionados con EA y que son útiles para detectarlos. Es importante conocer que este método no pretende identificar todos y cada uno de los EA existentes en una historia clínica, sino que, debido a la limitación de tiempo que supone la revisión de historias clínicas, esta herramienta está diseñada para detectar indirectamente la presencia de EA. La herramienta trigger ha sido utilizada en los últimos 5años en distintos ámbitos de la atención sanitaria con éxito, como en cirugía10,11, en pediatría12,13, en cuidados intensivos14,15 y en atención primaria16,17. Los resultados sobre su utilización han mostrado que los EA eran más frecuentes que lo previamente calculado con otros métodos8. Un proceso centrado en el uso de triggers específicos se ha demostrado más eficiente, dado que requiere menos tiempo que la revisión de las historias clínicas de manera convencional, siendo, además, reproducible18,19. La herramienta GTT es adecuada para un entorno de tiempo limitado10 y puede ser utilizada por personal sanitario con un entrenamiento sencillo20. Así, ha sido usada por organizaciones para la mejora de la calidad asistencial y otras agencias reguladoras, como el Departamento de Salud y Servicios Humanos de Estados Unidos (HHS), que la empleó en un estudio para estimar la incidencia de EA en pacientes de Medicare hospitalizados21.
El objetivo principal del presente estudio es analizar la validez diagnóstica de la herramienta en la detección de EA, así como identificar y caracterizar los EA en una muestra aleatoria de altas del Servicio de Medicina Interna del Hospital Santa Bárbara (Puertollano, Ciudad Real, España).
Material y métodosEstudio observacional, analítico, descriptivo y retrospectivo de una muestra aleatorizada de informes clínicos asociados a un proceso de hospitalización mediante búsqueda de triggers incluidos en una lista previamente elaborada para encontrar EA relacionados.
Para la búsqueda de triggers y EA se revisaron diversos documentos de la historia clínica que se detallan posteriormente. En caso de detectar EA, este se caracterizó analizando la gravedad, la evitabilidad y su relación con otras variables que se refieren a continuación.
Sujetos de estudio y obtención de la muestraLa muestra se obtuvo a partir de las altas dadas por el Servicio de Medicina Interna del Hospital Santa Bárbara (Puertollano, Ciudad Real) desde el 1 de enero al 31 de diciembre de 2013. Del total de 2.929 altas realizadas en ese periodo se realizó un muestreo aleatorizado simple de 291, asumiendo una probabilidad esperada según la incidencia de otros estudios del 30%8,17,22, un nivel de confianza del 95% y una precisión del 5%. Se incluyeron historias completas y cerradas al alta, estancia hospitalaria de al menos 24h y pacientes de 18años o mayores.
VariablesLa variable principal del estudio fue el EA. Se ha definido EA como el daño físico no intencionado que es causado por los cuidados sanitarios más que por la enfermedad subyacente del paciente1. Sus consecuencias pueden ser una incapacidad en el momento del alta, muerte, hospitalización prolongada o posterior hospitalización. Asimismo, se considera que un EA es un hecho inintencionado que ha producido un daño desde el punto de vista del paciente, es decir, tiene que haber causado una molestia objetiva al paciente.
Otras variables determinadas para caracterizar los EA fueron las variables demográficas, así como específicamente el número de fármacos de cada paciente, el diagnóstico al alta, el índice de comorbilidad de Charlson23, para ajustar al riesgo según la carga de comorbilidad presente en cada caso y los días de hospitalización del último ingreso registrado.
Procedimiento y determinación de un evento adversoLa revisión fue realizada por un médico que previamente había sido formado y entrenado según el documento que publica las bases del GTT por parte del IHI9, que incluía una serie de casos resueltos, y accesoriamente realizó como entrenamiento una revisión de 20 casos de pacientes reales procedentes del mismo hospital (excluidos de la base de datos final).
La revisión de la historia clínica fue realizada mediante un procedimiento sistemático de revisión de la historia clínica. Los EA detectados sin trigger asociado, fruto de la revisión sistemática de la historia clínica, fueron igualmente incluidos en el registro y categorizados.
La revisión de la historia clínica comenzaba por el informe de alta, y se analizaron los apartados de codificación al alta, los resultados de laboratorio, la hoja de prescripción, los informes radiológicos y las notas de evolución médica y de enfermería. Salvo la hoja de prescripción, el resto de los documentos estaban disponibles en formato electrónico.
Cuando se detectó un trigger, se procedió a la revisión de las partes pertinentes de la historia clínica para determinar si un EA ocurrió o no. Si no había ocurrido un EA, el revisor pasaba a buscar otros triggers.
Cuando se detectó un EA, este se categorizó según su gravedad de acuerdo con una adaptación la escala del National Coordinating Council for Medication Error Reporting and Prevention (NCCMERP)24, que gradúa de categoría desde E a la I (tabla 3), y se registra su evitabilidad o no, su presencia o no al ingreso, y si el EA fue codificado al alta por el Servicio de Codificación, y si está o no relacionado con fármacos.
Evento adverso según procedencia del método de detección
| Método trigger | Sin método trigger | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nombre del evento adverso (EA) | Número total (149) | Número de detecciones | E | F | G | H | I | Número de detecciones | E | F | G | H | I |
| Úlcera por presión | 18 | 16 | 9 | 1 | 6 | 2 | 1 | 1 | |||||
| Delirium hospitalizado | 15 | 14 | 14 | 1 | 1 | ||||||||
| Estreñimiento hospitalizado | 10 | 10 | 10 | 0 | |||||||||
| Infección respiratoria nosocomial | 9 | 8 | 4 | 4 | 1 | 1 | |||||||
| Alteración del nivel conciencia por fármacos | 9 | 8 | 5 | 3 | 1 | 1 | |||||||
| Hemorragia por anticoagulantes orales o antiinflamatorios no esteroideos | 6 | 6 | 2 | 4 | 0 | ||||||||
| Flebitis | 6 | 6 | 6 | 0 | |||||||||
| Hipotensión por fármacos | 5 | 3 | 3 | 2 | 2 | ||||||||
| Hipoglucemia por fármacos | 5 | 0 | 5 | 5 | |||||||||
| Retención aguda urinaria | 5 | 5 | 5 | 0 | |||||||||
| Resto de EA | 61 | 37 | 18 | 15 | 0 | 2 | 2 | 24 | 12 | 10 | 0 | 1 | 1 |
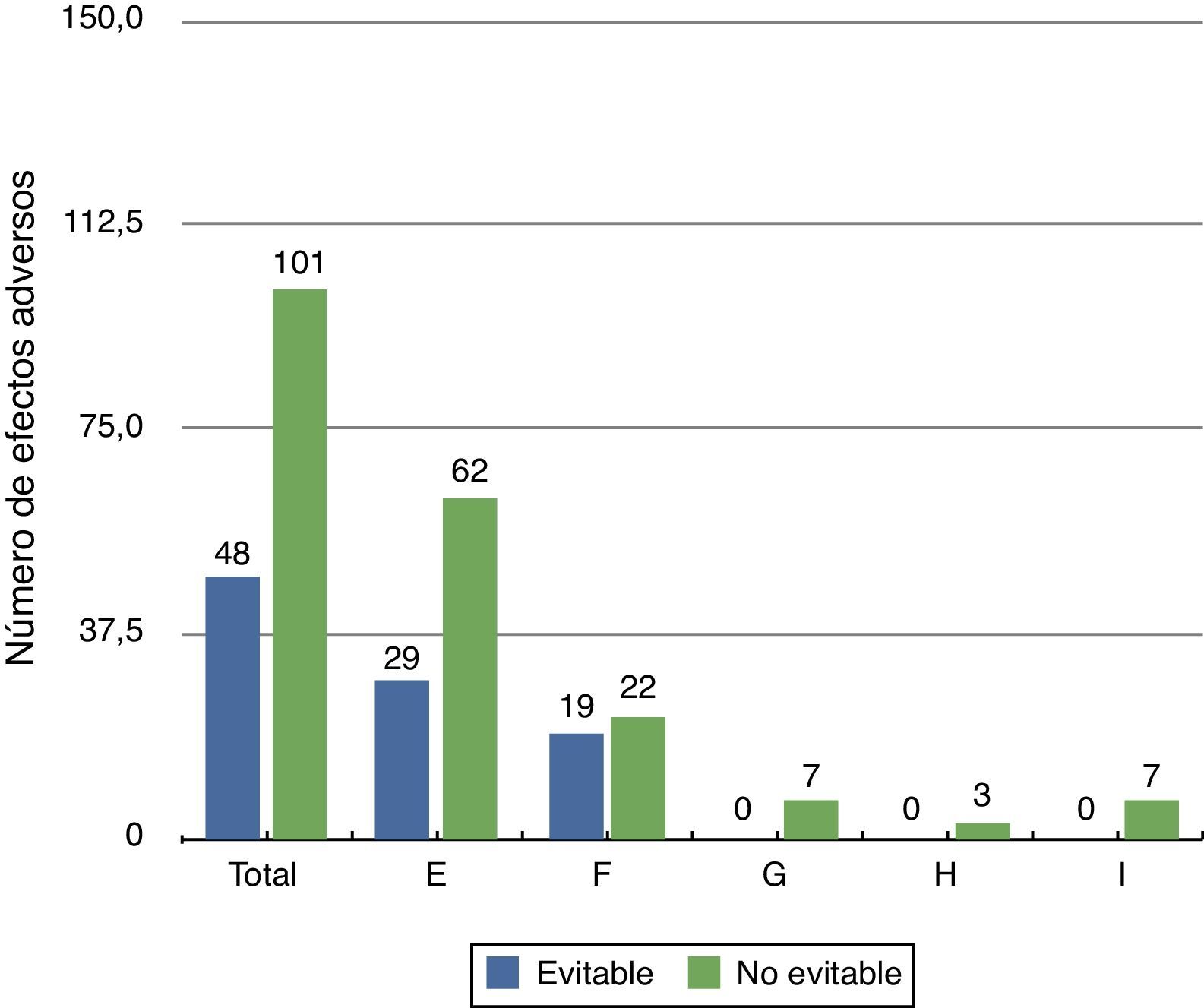
Categorías de daño (NCC MERP): E: daño temporal al paciente que requirió intervención; F: daño temporal al paciente que requirió hospitalización inicial o prolongada; G: daño permanente al paciente; H: intervención requerida para mantener al paciente con vida; I: daño que provoca la muerte del paciente.
El trigger «muerte» fue tratado como EA solo cuando se demostraba su origen en causas derivadas de procesos no propios de la historia habitual de ese proceso o enfermedad.
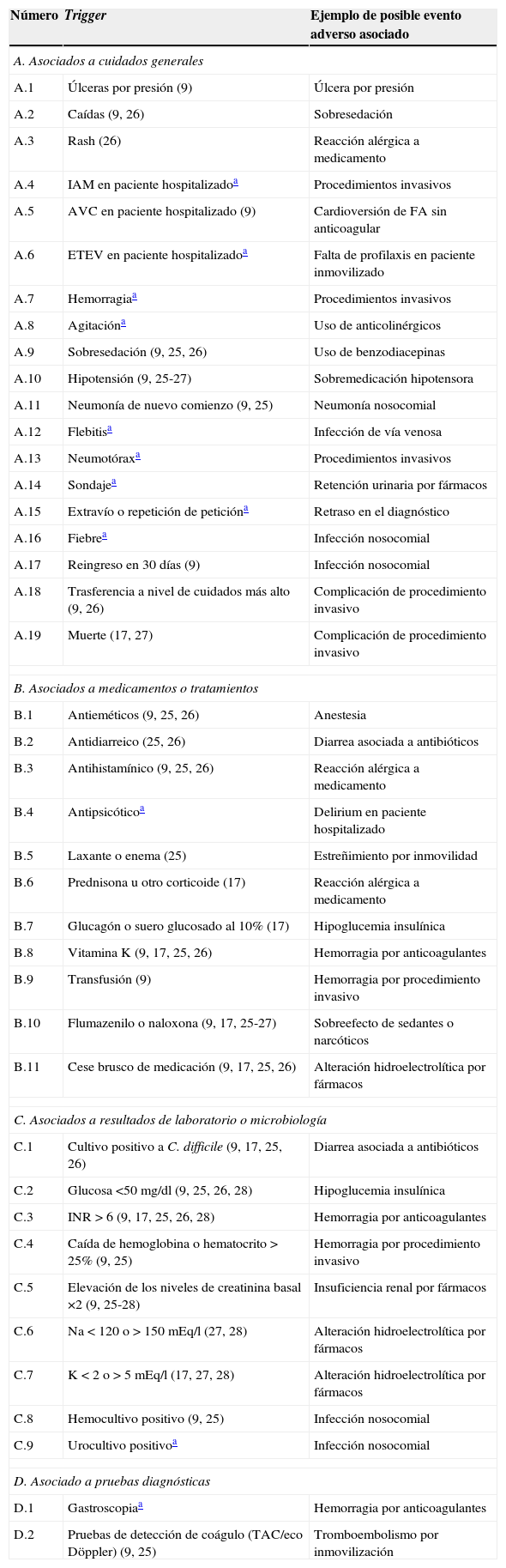
Listado de triggersSe elaboró una herramienta de detección de EA mediante un panel de 41 términos considerados como triggers. La selección de los triggers se hizo para detectar específicamente los EA más frecuentemente encontrados en nuestro país7, y por ello se utilizaron principalmente los triggers propuestos en el GTT, elaborado por el IHI9, añadiendo algunos de otras publicaciones9,17,25-28, y se completó el listado con nuevos triggers que fueron incluidos para cubrir EA que quedaban fuera del espectro de detección de los triggers publicados. En la tabla 1 se anota la procedencia de cada trigger.
Listado de triggers
| Número | Trigger | Ejemplo de posible evento adverso asociado |
|---|---|---|
| A. Asociados a cuidados generales | ||
| A.1 | Úlceras por presión (9) | Úlcera por presión |
| A.2 | Caídas (9, 26) | Sobresedación |
| A.3 | Rash (26) | Reacción alérgica a medicamento |
| A.4 | IAM en paciente hospitalizadoa | Procedimientos invasivos |
| A.5 | AVC en paciente hospitalizado (9) | Cardioversión de FA sin anticoagular |
| A.6 | ETEV en paciente hospitalizadoa | Falta de profilaxis en paciente inmovilizado |
| A.7 | Hemorragiaa | Procedimientos invasivos |
| A.8 | Agitacióna | Uso de anticolinérgicos |
| A.9 | Sobresedación (9, 25, 26) | Uso de benzodiacepinas |
| A.10 | Hipotensión (9, 25-27) | Sobremedicación hipotensora |
| A.11 | Neumonía de nuevo comienzo (9, 25) | Neumonía nosocomial |
| A.12 | Flebitisa | Infección de vía venosa |
| A.13 | Neumotóraxa | Procedimientos invasivos |
| A.14 | Sondajea | Retención urinaria por fármacos |
| A.15 | Extravío o repetición de peticióna | Retraso en el diagnóstico |
| A.16 | Fiebrea | Infección nosocomial |
| A.17 | Reingreso en 30 días (9) | Infección nosocomial |
| A.18 | Trasferencia a nivel de cuidados más alto (9, 26) | Complicación de procedimiento invasivo |
| A.19 | Muerte (17, 27) | Complicación de procedimiento invasivo |
| B. Asociados a medicamentos o tratamientos | ||
| B.1 | Antieméticos (9, 25, 26) | Anestesia |
| B.2 | Antidiarreico (25, 26) | Diarrea asociada a antibióticos |
| B.3 | Antihistamínico (9, 25, 26) | Reacción alérgica a medicamento |
| B.4 | Antipsicóticoa | Delirium en paciente hospitalizado |
| B.5 | Laxante o enema (25) | Estreñimiento por inmovilidad |
| B.6 | Prednisona u otro corticoide (17) | Reacción alérgica a medicamento |
| B.7 | Glucagón o suero glucosado al 10% (17) | Hipoglucemia insulínica |
| B.8 | Vitamina K (9, 17, 25, 26) | Hemorragia por anticoagulantes |
| B.9 | Transfusión (9) | Hemorragia por procedimiento invasivo |
| B.10 | Flumazenilo o naloxona (9, 17, 25-27) | Sobreefecto de sedantes o narcóticos |
| B.11 | Cese brusco de medicación (9, 17, 25, 26) | Alteración hidroelectrolítica por fármacos |
| C. Asociados a resultados de laboratorio o microbiología | ||
| C.1 | Cultivo positivo a C. difficile (9, 17, 25, 26) | Diarrea asociada a antibióticos |
| C.2 | Glucosa <50mg/dl (9, 25, 26, 28) | Hipoglucemia insulínica |
| C.3 | INR>6 (9, 17, 25, 26, 28) | Hemorragia por anticoagulantes |
| C.4 | Caída de hemoglobina o hematocrito >25% (9, 25) | Hemorragia por procedimiento invasivo |
| C.5 | Elevación de los niveles de creatinina basal ×2 (9, 25-28) | Insuficiencia renal por fármacos |
| C.6 | Na<120 o >150 mEq/l (27, 28) | Alteración hidroelectrolítica por fármacos |
| C.7 | K <2 o >5 mEq/l (17, 27, 28) | Alteración hidroelectrolítica por fármacos |
| C.8 | Hemocultivo positivo (9, 25) | Infección nosocomial |
| C.9 | Urocultivo positivoa | Infección nosocomial |
| D. Asociado a pruebas diagnósticas | ||
| D.1 | Gastroscopiaa | Hemorragia por anticoagulantes |
| D.2 | Pruebas de detección de coágulo (TAC/eco Döppler) (9, 25) | Tromboembolismo por inmovilización |
AVC: accidente cerebrovascular; ETEV: enfermedad tromboembólica venosa; IAM: infarto agudo de miocardio; INR: international normalized ratio.
Entre paréntesis: referencias de la procedencia del trigger.
Se utilizaron estadísticos descriptivos de todas las variables, con determinación de medidas de centralización (media y porcentaje) y dispersión (desviación estándar [DE] e IC95%).
Para medir la validez de la herramienta para detectar la presencia de un EA se utilizaron los parámetros de sensibilidad, especificidad, valor predictivo positivo (VPP) y valor predictivo negativo (VPN), con sus intervalos de confianza al 95%.
La distribución de los EA entre los distintos grupos según variables demográficas se analizó mediante la prueba de chi-cuadrado para la verificación de diferencias significativas.
Se obtuvieron: a)indicadores de EA de prevalencia expresados en porcentajes, que fueron considerados globalmente una vez revisadas todas las historias, y b)la incidencia de EA mediante el parámetro de densidad de incidencia, expresado en número de EA/persona-día.
La base de datos se realizó con Microsoft Excel (v14.4.7) y el programa estadístico utilizado fue SPSS Statistics (v20.0). Se consideró que las diferencias fueron estadísticamente significativas cuando p<0,05.
ResultadosDatos demográficosSe obtuvo una muestra representativa de 291 historias clínicas. La mayor parte de las altas procedían de la Sección de Medicina Interna (87,6%), siendo el resto de las secciones de Digestivo (11,3%) y Cardiología (1,1%). La distribución por sexos fue: 52,3% hombres y 47,7% mujeres. La edad media fue de 73,6años (IC95%: 71,8-75,3). El diagnóstico al alta fue principalmente cardiológico (23,1%), seguido del neumológico (22%), digestivo (14,2%) y neurológico (10,4%).
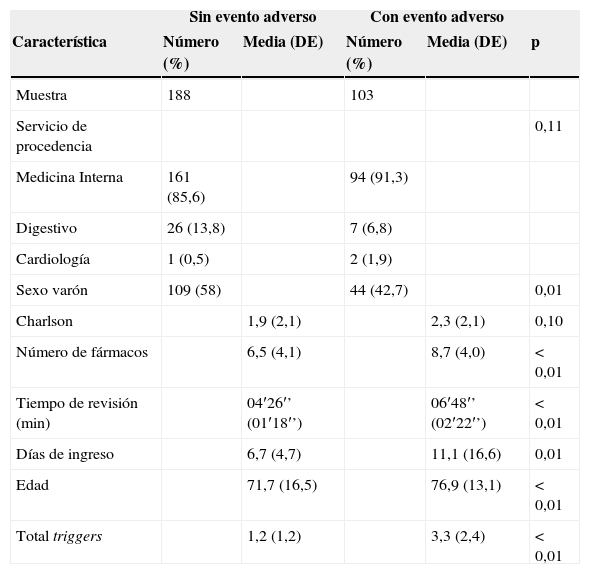
Cuando se compararon las características basales de la muestra teniendo en cuenta la aparición o no de EA (tabla 2) se pudo constatar que, salvo por el servicio de procedencia y por el índice de Charlson, hubo diferencias estadísticamente significativas entre ambos grupos, siendo llamativa la mayor presencia de triggers entre aquellos pacientes que finalmente presentaron un EA (3,3 frente a 1,2; p<0,001; IC95%: 1,6-2,6). Los pacientes del grupo con EA eran, además, mayores, tenían más fármacos, estuvieron más tiempo ingresados y se tardó más en su revisión.
Características por evento adverso
| Sin evento adverso | Con evento adverso | ||||
|---|---|---|---|---|---|
| Característica | Número (%) | Media (DE) | Número (%) | Media (DE) | p |
| Muestra | 188 | 103 | |||
| Servicio de procedencia | 0,11 | ||||
| Medicina Interna | 161 (85,6) | 94 (91,3) | |||
| Digestivo | 26 (13,8) | 7 (6,8) | |||
| Cardiología | 1 (0,5) | 2 (1,9) | |||
| Sexo varón | 109 (58) | 44 (42,7) | 0,01 | ||
| Charlson | 1,9 (2,1) | 2,3 (2,1) | 0,10 | ||
| Número de fármacos | 6,5 (4,1) | 8,7 (4,0) | < 0,01 | ||
| Tiempo de revisión (min) | 04′26′’ (01′18′’) | 06′48′’ (02′22′’) | < 0,01 | ||
| Días de ingreso | 6,7 (4,7) | 11,1 (16,6) | 0,01 | ||
| Edad | 71,7 (16,5) | 76,9 (13,1) | < 0,01 | ||
| Total triggers | 1,2 (1,2) | 3,3 (2,4) | < 0,01 | ||
El promedio de tiempo empleado en la revisión de las historias fue de 4′26′′ (DE: 1′18′′) para los que no presentaban EA, y de 6′48′′ (DE: 2′22′′) para los que sí lo tuvieron.
Presencia de eventos adversosLa prevalencia de pacientes con EA fue del 35,4%. El número de EA por cada 100 ingresos fue de 52. La densidad de incidencia fue de 63 por cada 1.000 días-paciente. Del total de los 149EA detectados, 113 (75,3%) lo fueron mediante la herramienta trigger, mientras que los restantes lo fueron por la revisión sistemática de la historia clínica.
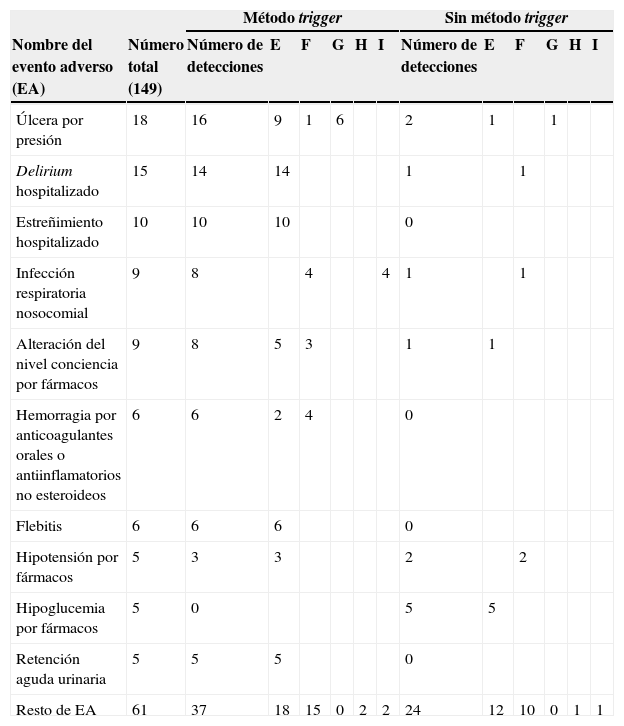
Tipos de eventos adversosMediante la revisión sistematizada de las historias clínicas pudo detectarse un número amplio y variado de EA de distinta gravedad (tabla 3). El EA más frecuentemente hallado lo constituyó la úlcera por presión (12%), seguido por delirium, estreñimiento, infección respiratoria nosocomial y alteración del nivel de conciencia por fármacos. Estos EA suman un total de 61, el 41% del total. La mayoría de los EA fueron de escasa gravedad, categoríaE (58%), lo que supuso un daño temporal al paciente que requirió meramente una hospitalización prolongada, sin generar un daño permanente ni riesgo vital. La infección respiratoria nosocomial (generalmente detectado por el trigger «fiebre») se asoció frecuentemente con fallecimiento del paciente y representó algo más de la mitad del total de fallecimientos por EA. Estos EA que conllevaron la muerte del paciente fueron el 10%.
La mitad de los casos de EA estuvieron relacionados con fármacos (47,6%), siendo los grupos de analgésicos/AINE/corticoides y anticoagulantes/antiagregantes los más frecuentemente implicados (8,7 y 7,4%, respectivamente).
La herramienta trigger detectó la mayoría de los EA graves, que sumaron 14EA de las categoríasG, H e I (82,4%), frente a aquellos detectados sin que hubiera trigger (3EA, 17,7%).
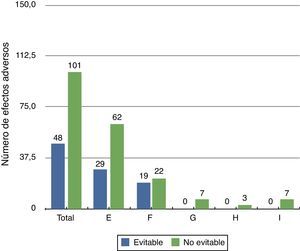
Evitabilidad del evento adversoLos EA detectados fueron no evitables en el 67,8%, principalmente para el grupo de EA de menor gravedad (categoríaE). En las categorías más graves de EA (categoríasG a I) no hubo ninguno que pudiese ser considerado evitable (fig. 1).
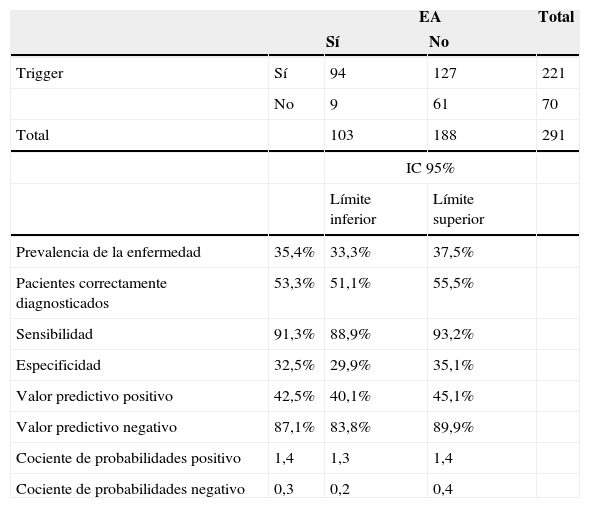
Caracterización de la validez diagnóstica de la herramienta triggerLa herramienta trigger mostró tener una sensibilidad del 91,3% (IC95%: 88,9-93,2%) y una especificidad del 32,5% (IC95%: 29,9-35,1%). Presentó un VPP de 42,5% (IC95%: 40,1-45,1%) y un VPN de 87,1% (IC95%: 83,8-89,9%). El cociente de probabilidades positivo fue de 1,4 (IC95%: 1,3-1,4) y el cociente de probabilidades negativo, de 0,3 (IC95%: 0,2-0,4) (tabla 4).
Distribución de los triggers y los eventos adversos (EA)
| EA | Total | |||
|---|---|---|---|---|
| Sí | No | |||
| Trigger | Sí | 94 | 127 | 221 |
| No | 9 | 61 | 70 | |
| Total | 103 | 188 | 291 | |
| IC 95% | ||||
| Límite inferior | Límite superior | |||
| Prevalencia de la enfermedad | 35,4% | 33,3% | 37,5% | |
| Pacientes correctamente diagnosticados | 53,3% | 51,1% | 55,5% | |
| Sensibilidad | 91,3% | 88,9% | 93,2% | |
| Especificidad | 32,5% | 29,9% | 35,1% | |
| Valor predictivo positivo | 42,5% | 40,1% | 45,1% | |
| Valor predictivo negativo | 87,1% | 83,8% | 89,9% | |
| Cociente de probabilidades positivo | 1,4 | 1,3 | 1,4 | |
| Cociente de probabilidades negativo | 0,3 | 0,2 | 0,4 | |
Cuando se analiza la validez diagnóstica, esta herramienta presenta una baja especificidad, pero su elevada sensibilidad puede hacerla útil como herramienta de cribado de EA, sobre todo teniendo en cuenta su enorme rendimiento en cuanto al costo en tiempo (revisión en menos de 10min) o tiempo en la detección de EA. Además, es de destacar que los EA presentan una prevalencia elevada (35,4%), y aunque en la mayoría de casos se trata de EA de escasa gravedad y no evitables, sigue habiendo un elevado número de EA evitables. Los EA asociados a fármacos fueron aproximadamente la mitad de los EA detectados.
Como otros test de cribado, esta herramienta tiene una alta sensibilidad y una especificidad relativamente baja. De manera análoga, otros estudios, como el desarrollado en Canadá, en el ámbito de pediatría han mostrado una sensibilidad de del 88% (IC95%: 79-94%) y una especificidad del 44% (IC95%: 39-48%)29.
Existen otros métodos de detección de EA, entre los cuales la revisión pormenorizada retrospectiva de la historia clínica es el método que más se acerca a un gold standard. Esta metodología se utilizó en el Harvard Medical Practice Study30, pero este y otros estudios retrospectivos han sido criticados por la necesidad excesiva de recursos y de tiempo para ser llevados a cabo25,31. Los métodos más tradicionales para identificar y cuantificar el daño en los pacientes —registros individuales de historias clínicas, notificaciones de incidencias y el examen de datos administrativos— han demostrado, en general, escasa eficacia1,25, por presentar una detección sesgada de eventos graves y aportar, en general, un registro bajo de notificaciones32.
En el presente estudio se han obtenido resultados de prevalencia similares a la mayoría de las publicaciones internacionales9, rondando un 30% de ingresos que experimentan algún EA33, siendo llamativo que también el porcentaje de EA evitables —en torno al 40%— fuera similar34. Esta concordancia entre distintos sistemas, ámbitos de aplicación y países precisamente apunta a que los errores no son cuestión de fallos atribuibles únicamente al individuo, sino que están ocasionados por fallos en sistemas, procesos y condiciones que llevan a cometer errores o fallar en su prevención1.
Los estudios sobre daño al paciente realizados en nuestro país han estado preferentemente relacionados con los fármacos, y muy escasamente con la utilización de la herramienta trigger, siendo destacable un estudio en un hospital de 200 camas donde se realizó un análisis de los eventos y EA ocurridos a través de diferentes sistemas de notificación, concluyendo que en el 43,3% de los pacientes ingresados se producía algún EA, pero la herramienta trigger solo aportó el 12% del total de EA detectados35. Otro estudio nacional utilizó la herramienta trigger para analizar las características y los factores asociados de las caídas, y la efectividad de la disminución de la altura de las camas para reducir la frecuencia y los daños por caídas en un hospital de agudos geriátricos36. Más recientemente se ha publicado la experiencia de la detección de EA de manera retrospectiva en un periodo de 6años mediante la herramienta trigger, con un resultado de 29,4EA por cada 100ingresos. El estudio de la evolución temporal de los EA permitió comprobar que estos iban disminuyendo con el tiempo, apuntándose a una serie de factores favorecedores como el registro electrónico, cambios en los tipos de camas y políticas de prevención de úlceras por presión y lavado de manos, principalmente37.
La publicación más reciente aparecida en nuestro país fue sobre el uso de la herramienta trigger para detectar EA en cirugía, con un resultado de frecuencia de EA muy similar al del presente estudio (36,8%), pero con una especificidad sustancialmente mejor (93,6%) y una sensibilidad similar (86%)38.
Limitaciones del estudioNuestro estudio ha demostrado, como otras publicaciones29, una alta sensibilidad y una relativa baja especificidad. La baja especificidad de la herramienta podría atribuirse al elevado número de triggers utilizado.
Por otro lado, en otros estudios13,17,20 sobre la utilización de la herramienta trigger, la recogida de datos se había realizado entre 2investigadores, con un tercero (generalmente un médico) que servía para consensuar allí donde no existía acuerdo. En este estudio solo ha habido un revisor, pero hay un estudio que apunta a que un proceso de revisión de los registros con 2 médicos por cada registro, incluyendo un procedimiento de consenso para evaluar los EA, no es más fiable que un proceso de revisión de los registros con un único médico39.
De una manera no directamente relacionada con la metodología empleada en este trabajo hay que tener en cuenta que la utilidad de cualquier revisión de una historia clínica (usando o no la herramienta) depende de la calidad de la información contenida en la misma40, y aún más importante es el hecho de la falta de un acuerdo universal para aceptar un método para conocer la tasa real de EA, es decir, falta un gold standard para detectar todos los EA existentes.
Posibles estudios a desarrollar para mejorar la herramienta triggerA pesar de los medios humanos y materiales usados en la búsqueda de EA mediante métodos de detección tradicionales, estos solo detectan una parte de los EA o son costosos en medios humanos y materiales para ser llevados a cabo8; por ello nuevas herramientas, como la desarrollada por el IHI para cribar EA mediante triggers, se abren paso demostrando ser eficientes en cuanto al uso de tiempo y medios, y pueden ser utilizadas mediante un entrenamiento modesto20.
La utilidad de una herramienta es particularmente dependiente de la sensibilidad y de la especificidad global y de cada uno de los ítems que lo componen. Si es validada adecuadamente mediante la búsqueda de los triggers más idóneos que tengan una capacidad elevada de detectar EA, una herramienta es tan sensible como la revisión de las historias y considerablemente más que la notificación de incidentes. Dependiendo de la validez de los triggers, cuanto mayor es el VPP, mejor equilibrio entre el esfuerzo de revisión y la detección de EA41. Por ello, una reducción del número de triggers, seleccionando aquellos con mejor VPP, conseguiría mejorar la especificidad con poco impacto en la sensibilidad. En un estudio, una selección de 9triggers de un total de 39 utilizados acumularon el 94% de los EA farmacológicos detectados17, lo cual permitiría construir una herramienta resumida mejor.
En comparación con otros sistemas, la herramienta trigger utilizada en este estudio puede funcionar como método de cribado para examinar la frecuencia y los tipos de problemas relacionados con EA y permitir de manera sencilla y rápida una reevaluación a lo largo del tiempo que permita monitorizar los EA. El uso de la herramienta es más eficiente que otros métodos y requiere menos tiempo que la revisión de la historia convencional. Existe, además, la posibilidad de diseñar modelos de triggers simplificados que acaparen un porcentaje elevado de EA, aumentando la versatilidad de la herramienta17.
El abordaje de la detección de EA requiere una actuación multidisciplinaria. Sin el estudio epidemiológico y la comprensión de factores sistémicos que pueden influir en la producción de EA, el análisis del problema carece de utilidad42. Sumado a su alta frecuencia, los EA son un problema de gran magnitud, trascendencia clínica, económica, legal y mediática. Por ello es importante identificarlos y corregirlos, así como monitorizarlos, ya que la mejora de la calidad asistencial ha de ser una meta en cualquier sistema sanitario.
Como conclusión, la herramienta empleada en este trabajo es válida, útil y reproducible para la detección de EA. Asimismo, sirve para determinar tasas de daño y observar su evolución en el tiempo. En este estudio se ha hallado una frecuencia elevada tanto de EA como de eventos evitables.
FinanciaciónEste trabajo no ha recibido ninguna ayuda financiera.
Conflicto de interesesNo existe conflicto de intereses de ninguno de los autores.
Agradecemos al Dr. Pérez Lázaro sus consejos y ayuda en el manuscrito final, así como a la Dra. Silvia Vázquez, de la Unidad de Investigación del Hospital 12 de Octubre, su ayuda en el análisis estadístico.