Evaluar la calidad del contenido de la hoja de información al paciente (HIP) y del consentimiento informado (CI) en los ensayos clínicos.
Material y métodosEstudio observacional retrospectivo. Se evaluaron 50 HIP de ensayos clínicos iniciados entre 2010 y 2011.
La calidad de las hojas de información fue evaluada a través de las Guías de Buena Práctica Clínica presentes en la CPMP/ICH/135/95 de la Agencia Europea de Medicamentos. Se aplicaron índices de legibilidad a las HIP y al CI.
ResultadosEl 10% de las HIP presentaban correctos todos los apartados; 5 fueron correctos en todas: el ensayo supone una investigación, objetivos del ensayo, participación voluntaria, personal del estudio con acceso al historial médico y confidencialidad de los datos del paciente. Los apartados menos presentes fueron responsabilidades del sujeto y alternativas disponibles.
Las 50 hojas analizadas requirieron una media de 4,24 (DE=1,87) modificaciones para su autorización por parte del Comité Ético de Investigación Clínica (CEIC).
Las HIP y el CI presentaron buenos resultados en los índices de legibilidad, siendo considerados con legibilidad aceptable en el 98% de los casos.
ConclusionesEl grado de cumplimiento de los diferentes aspectos que se han de reflejar en las HIP es alto. Sin embargo, las responsabilidades del sujeto y las posibles alternativas al ensayo clínico son puntos de mejora. La complejidad de lectura de las HIP y del CI es adecuada para la población media. La revisión de la HIP por parte del CEIC garantiza a los pacientes el acceso a una información completa y adecuada.
To assess the quality of the written informed consent form (WICF) in clinical trials.
Material and methodsRetrospective observational study was performed on 50 WICF of clinical trials started between 2010 and 2011.
The quality of the content of the WICF was assessed using the “Guideline for Good Clinical Practice” contained in the CPMP/ICH/135/95 of the European Medicines Agency. Legibility indexes were applied to the WICF.
ResultsThe WICF was correct in all aspects in 10% of the clinical trial; five sections were correct in all WICF: “trial involves research”, “trials goals”, “participation is voluntary and the subject may withdraw at any time without penalty”, “study personnel with access to medical records” and “documents that identify the patient are confidential”.
Aspects less present were “the subject's responsibilities” and “available alternatives”. All WICF required clarification by the Ethics Committee (EC), with a mean of 4.24 (SD=1.87) changes per WICF.
The WICF showed good results in the indices of readability. Almost all (98%) of WICF were considered with an acceptable readability.
ConclusionsCompliance with different aspects that must appear in the WICF is high. Aspects to improve are the subject's responsibilities and available alternatives to the clinical trial. The complexity of reading the WICF is suitable for the average population. The review of the WICF by the EC guarantees the access to comprehensive and appropriate information.
El derecho a la autonomía de los pacientes actualmente es considerado un derecho fundamental y está respaldado por el artículo 10 de la Constitución Española en lo referente a la dignidad y al libre desarrollo de la persona1,2. En los ensayos clínicos (EC) el derecho de autonomía viene reflejado a través del consentimiento informado (CI) de los sujetos participantes.
En España, la regulación de los EC sigue lo establecido en el Real Decreto 223/2004, de 6 de febrero, por el que se regulan los EC con medicamentos1. Según lo establecido en este Real Decreto, se debe obtener y documentar el CI de cada uno de los sujetos del ensayo, libremente expresado, antes de su inclusión en el mismo. Este consentimiento se documentará a través de la hoja de información al paciente (HIP) y la hoja del CI. La hoja de información contendrá únicamente la información relevante, expresada en términos claros y comprensibles para los sujetos.
En este Real Decreto también se establece que para la obtención del CI se deben tener en cuenta las recomendaciones europeas sobre la solicitud del CI que se recogen en las instrucciones para la realización de EC en España o, en su caso, en las directrices de la Unión Europea.
Las directrices de la Unión Europea en materia de EC vienen recogidas en la Directiva 2001/20/CE del Parlamento Europeo y del Consejo, de 4 de abril de 20013, que regula la aproximación de las disposiciones legales, reglamentarias y administrativas de los Estados miembros sobre la aplicación de buenas prácticas clínicas en la realización de ensayos clínicos de medicamentos de uso humano.
La Guías de Buena Práctica Clínica (GBPC) constituyen un estándar ético y científico de calidad para los EC que involucran a seres humanos. El cumplimiento de estos estándares asegura que los derechos, la seguridad y el bienestar de los sujetos participantes en un ensayo son protegidos con los principios que tuvieron su origen en la declaración de Helsinki y que, además, los resultados de los estudios son creíbles. Estas guías establecen una serie de apartados correspondientes a la información que debe contemplar la HIP para garantizar una completa información al sujeto.
Los objetivos del presente trabajo son, por una parte, evaluar el cumplimiento de las recomendaciones de las GBPC en la información escrita que reciben los pacientes antes de comenzar un EC y, por otra, establecer el grado de legibilidad formal de las hojas de información que el paciente recibe cuando se solicita su participación en un EC.
Material y métodosSe diseñó un estudio observacional retrospectivo en el cual se recogieron las HIP de todos los EC aprobados por el Comité Ético de Investigación Clínica (CEIC) e iniciados en el Servicio de Farmacia del Hospital Universitari i Politècnic La Fe entre marzo de 2010 y enero de 2011.
Para evaluar la calidad de la HIP y el cumplimiento de las GBPC, se utilizó el documento «Guideline for Good Clinical Practice» recogido en el CPMP/ICH/135/95 de la Agencia Europea de Medicamentos4. En esta guía se indica que la HIP que se entrega a los sujetos que participan en un EC debe recoger 20 apartados, como son los objetivos del EC, tratamientos y procedimientos, entre otros (detallados en la tabla 1).
Apartados que deben reflejarse en la HIP según las Guías de Buena Práctica Clínica CPMP/ICH/135/95 de la EMA3
| 1- El ensayo supone una investigación |
| 2- Objetivos del ensayo |
| 3- Tratamientos del ensayo y la probabilidad de ser aleatorizado a cada tratamiento |
| 4- Procedimientos del ensayo, incluyendo procedimientos invasivos |
| 5- Responsabilidad de los sujetos |
| 6- Aspectos experimentales del ensayo |
| 7- Riesgos razonables o inconvenientes para el sujeto |
| 8- Beneficios razonables esperados |
| 9- Tratamientos o procedimientos alternativos que podría tener el sujeto |
| 10- Compensación o tratamiento que recibirá el sujeto en caso de daño |
| 11- Pagos anticipados al sujeto por participar en el estudio |
| 12- Gastos anticipados al sujeto por participar en el estudio |
| 13- Participación voluntaria del sujeto y posibilidad de retirarse en cualquier momento sin ningún tipo de penalización o pérdida de beneficio |
| 14- Médicos, auditores, CEIC y autoridades reguladoras podrán tener acceso al historial médico del sujeto, sin violar la confidencialidad del mismo |
| 15- Confidencialidad de los datos y resultados del paciente |
| 16- Los sujetos participantes recibirán en un tiempo adecuado la nueva información que pueda ser relevante en su decisión de continuar en el estudio |
| 17- Persona de contacto para mayor información durante el estudio y con quien contactar en caso de daño relacionado con el estudio |
| 18- Causas previsibles por las que la participación del sujeto en el ensayo pueda finalizar |
| 19- Duración estimada del ensayo |
| 20- Número aproximado de sujetos en el ensayo |
La variable principal del estudio fue el grado de cumplimiento de las GBPC expresado como el porcentaje de apartados de dicha guía presentes en cada HIP y la media de apartados no incluidos. Se cumplimentó en cada caso un cuestionario elaborado con estos 20 apartados (tabla 1). Se consideró que la HIP presentaba un buen cumplimiento de las GBPC cuando recogía al menos el 80% de los apartados. Además, se recogió si en la hoja del CI se indicaba que el individuo había leído y comprendía la HIP.
El análisis de cada HIP para determinar qué apartados incluía lo realizaron 2 evaluadores, recurriendo a un tercero en aquellos apartados en los que había discrepancia. Los evaluadores al no pertenecer al CEIC han firmado una declaración de confidencialidad.
Por otro lado, se estudió la legibilidad de cada una de las HIP. Las estadísticas de legibilidad se obtuvieron a través de la aplicación de legibilidad del programa Word Perfect X5. Se recogieron el número de páginas del CI y el número de palabras. Se calcularon los siguientes índices de legibilidad:
- •
Fórmula de García López5: está basada en los mismos criterios que los establecidos en el índice de Flesch (cuantifica la dificultad del texto en función de la longitud de las palabras y frases), pero adaptada al castellano y aplicable a textos en el campo de la salud. Obtiene un resultado, denominado PAL, que toma valores de 55 a -25. Este resultado se asocia a una edad a la que le corresponde un determinado nivel de estudios que debe tener un individuo para que el contenido de un folleto le resulte legible, siendo considerados aceptables para un ciudadano medio valores inferiores a 15, correspondientes a una edad de 12 años.
- •
Fórmula de perspicuidad de Szigriszt6: es la fórmula considerada de referencia en el análisis de legibilidad de la lengua española. Se trata de una modificación de la fórmula de Flesch, modificando las constantes de la fórmula y adaptando la escala de Flesch. Según la escala de Szigriszt, un texto tiene una legibilidad normal cuando tiene puntuaciones entre 50 y 65 y se irá haciendo más difícil según se aproxime a valores cercanos a 0.
- •
Índice de legibilidad integrada (LEGIN)7: se calcula a través de la fórmula LEGIN= 100+IF (índice de Flesch)-ICO (índice de complejidad oracional basado en la estructura sintáctica de las oraciones). Su escala varía de 0 (legibilidad mínima) a 200 (legibilidad máxima). Se da un grado aceptable de legibilidad a los textos con LEGIN mayor de 70.
Por último, se revisaron las aclaraciones solicitadas por el CEIC del Hospital Universitari i Politècnic La Fe para las hojas de información estudiadas. Estas aclaraciones se contabilizaron como el número de modificaciones recomendadas y el número de revisiones necesarias para que el CEIC diese el visto bueno a la HIP evaluada.
Las HIP se clasificaron por el servicio clínico para evaluar posibles diferencias en el grado de cumplimiento de las GBPC y la legibilidad de las mismas según el servicio participante en el ensayo. Para algunas de las comparaciones entre los servicios se realizó una agrupación de los mismos basada en las áreas de gestión clínica del hospital con algunos ajustes debido a la naturaleza del estudio. Por ejemplo, los EC pertenecientes al Servicio de Reumatología, al tener como enfermedad a estudio la artritis reumatoide juvenil, se unificaron con un ensayo del Servicio de Pediatría.
La descripción de las variables cualitativas (grado de cumplimiento de las GBPC) se expresó en forma de frecuencias relativas (porcentajes) mientras que para las variables cuantitativas (aspectos no incluidos, índices de legibilidad, modificaciones y revisiones) se utilizó la media y la desviación estándar.
El análisis estadístico de los datos se realizó con el programa SPSS Statistics versión 15.0. El análisis de variancias de muestras independientes con su correspondiente test no paramétrico se empleó para la comparación de los resultados entre los servicios clínicos en cuanto a las modificaciones y revisiones del CEIC, los aspectos no incluidos en las hojas de información y los índices de legibilidad.
ResultadosSe analizaron un total de 50 HIP, de las cuales el 30% correspondían al Servicio de Hematología, 18% a Neurología y el 16% a Oncología.
De las 50 HIP analizadas, el 10% presentaron correctos los 20 apartados de la evaluación (fig. 1). Ninguna de las HIP presentó incorrectos/incompletos todos los apartados de la evaluación.
Cinco apartados estuvieron presentes en todas las HIP. Estos fueron: el ensayo supone una investigación, los objetivos del ensayo, participación voluntaria del sujeto y posibilidad de retirarse en cualquier momento sin ningún tipo de penalización o pérdida de beneficio, personal con acceso a datos del paciente y confidencialidad de los datos del paciente. Además, en todas las hojas de CI venía indicado el apartado «He leído y comprendo la HIP».
Los apartados que estuvieron menos presentes en las HIP fueron «las responsabilidades del sujeto» (presente en el 50% de las HIP) y la explicación de las posibles alternativas al EC (64%).
Todas las HIP requirieron aclaraciones por parte del CEIC con una media de 4,24 (DE=1,87) modificaciones por HIP, siendo necesarias 1,76 (DE=0,77) revisiones para su aprobación. Posteriormente a estas revisiones, se encontró una media de 2,24 (DE=2,27) aspectos no incluidos en la HIP según las GBPC. No se encontraron diferencias significativas entre los grupos de servicios clínicos para los resultados de revisiones realizadas por el CEIC, modificaciones solicitadas y aspectos no incluidos (tabla 2).
Resultados de las modificaciones solicitadas por el CEIC, revisiones realizadas y aspectos no incluidos
| Servicio | Modificaciones | Revisiones | Aspectos no incluidos |
| Grupo 1 | |||
| Alergia (n=1) | |||
| Neumología (n=3) | 3,8 (1,3) | 2,0 (1,2) | 1,2 (0,8) |
| Oftalmología (n=1) | |||
| Grupo 2 | |||
| UCI (n=2 | |||
| Endocrino (n=1) | 3,0 (0,8) | 2,3 (1,0) | 2,8 (3,2) |
| UEI (n=1) | |||
| Grupo 3 | |||
| Cardiología (n=3) | 3,0 (1,0) | 1,3 (0,6) | 2,3 (1,2) |
| Grupo 4 | |||
| Oncología (n=8) | 3,5 (2,0) | 1,7 (0,6) | 2,9 (2,6) |
| Grupo 5 | |||
| Hematología (n=15) | 4,9 (2,4) | 1,6 (0,6) | 2,6 (1,7) |
| UCC (n=1) | |||
| Grupo 6 | |||
| Neurología (n=7) | 4,9 (1,6) | 2,0 (1,4) | 3,4 (4,0) |
| Grupo 7 | |||
| Obstetricia (n=1) | 1 | 6 | 2 |
| Grupo 8 | |||
| Pediatría (n=1) | 4,3 (1,0) | 1,5 (0,6) | 1,0 (0,8) |
| Reumatología (n=3) | |||
| Grupo 9 | |||
| Nefrología (n=2) | 4,5 (0,7) | 1,5 (0,7) | 1,0 (1,4) |
| Estadístico | p=0,596 | p=0,341 | p=0,556 |
Estadístico: refleja el valor de p en la comparación entre grupos de servicios (test de Kruskal-Wallis). Resultados expresados en medias (DE).
UCC: Unidad de Coagulopatías Congénitas; UCI: Unidad de Cuidados Intensivos; UEI: Unidad de Enfermedades Infecciosas.
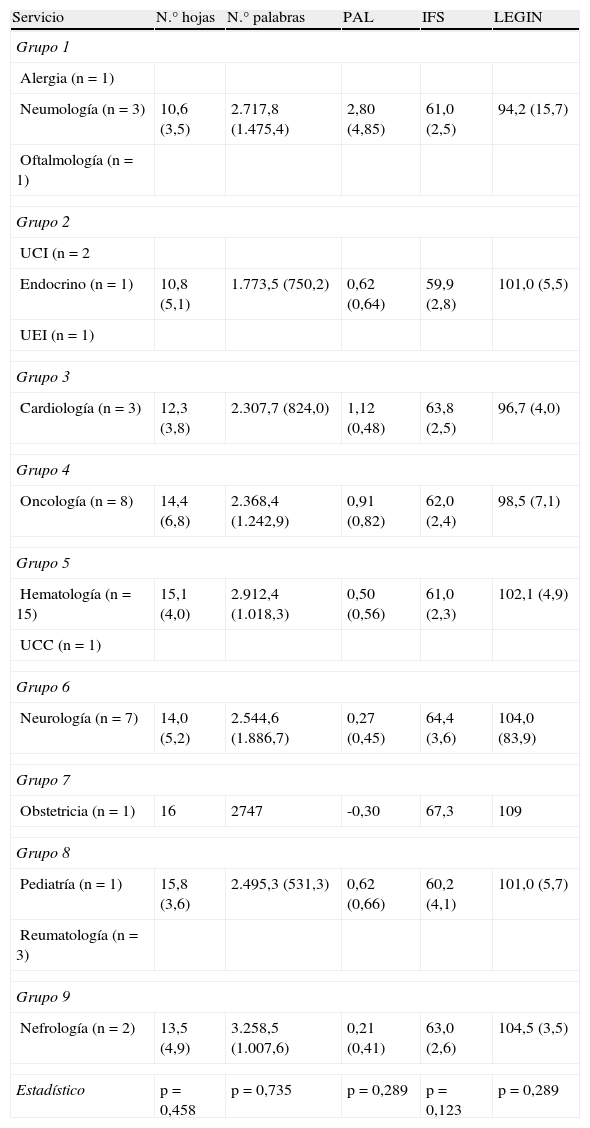
En cuanto a la legibilidad de las HIP y del CI estudiada, se obtuvo un número medio de palabras por hoja de 2.606,4 (DE=1.064,8) con una media de 13,9 (DE=4,8) páginas por HIP. Los EC del Servicio de la Unidad de Coagulopatías y de Nefrología fueron los que se asociaron a un mayor número de palabras, aunque no se encontraron diferencias significativas entre servicios (p=0,789; test de Kruskal-Wallis).
La media de los valores de los índices de legibilidad estudiados para las HIP y el CI agrupados por servicios se encuentran en la tabla 3. Las HIP obtuvieron buenos resultados en los índices de legibilidad, presentando una legibilidad aceptable en el 100% de los casos según la ecuación de García López y el índice de legibilidad de Szigriszt y en el 98% de los casos según el índice de legibilidad integrada (LEGIN). No se encontraron diferencias estadísticamente significativas entre los grupos de servicios para ninguno de los índices de legibilidad.
Resultados de la legibilidad de las hojas de información al paciente y consentimiento informado por grupos de servicios
| Servicio | N.° hojas | N.° palabras | PAL | IFS | LEGIN |
| Grupo 1 | |||||
| Alergia (n=1) | |||||
| Neumología (n=3) | 10,6 (3,5) | 2.717,8 (1.475,4) | 2,80 (4,85) | 61,0 (2,5) | 94,2 (15,7) |
| Oftalmología (n=1) | |||||
| Grupo 2 | |||||
| UCI (n=2 | |||||
| Endocrino (n=1) | 10,8 (5,1) | 1.773,5 (750,2) | 0,62 (0,64) | 59,9 (2,8) | 101,0 (5,5) |
| UEI (n=1) | |||||
| Grupo 3 | |||||
| Cardiología (n=3) | 12,3 (3,8) | 2.307,7 (824,0) | 1,12 (0,48) | 63,8 (2,5) | 96,7 (4,0) |
| Grupo 4 | |||||
| Oncología (n=8) | 14,4 (6,8) | 2.368,4 (1.242,9) | 0,91 (0,82) | 62,0 (2,4) | 98,5 (7,1) |
| Grupo 5 | |||||
| Hematología (n=15) | 15,1 (4,0) | 2.912,4 (1.018,3) | 0,50 (0,56) | 61,0 (2,3) | 102,1 (4,9) |
| UCC (n=1) | |||||
| Grupo 6 | |||||
| Neurología (n=7) | 14,0 (5,2) | 2.544,6 (1.886,7) | 0,27 (0,45) | 64,4 (3,6) | 104,0 (83,9) |
| Grupo 7 | |||||
| Obstetricia (n=1) | 16 | 2747 | -0,30 | 67,3 | 109 |
| Grupo 8 | |||||
| Pediatría (n=1) | 15,8 (3,6) | 2.495,3 (531,3) | 0,62 (0,66) | 60,2 (4,1) | 101,0 (5,7) |
| Reumatología (n=3) | |||||
| Grupo 9 | |||||
| Nefrología (n=2) | 13,5 (4,9) | 3.258,5 (1.007,6) | 0,21 (0,41) | 63,0 (2,6) | 104,5 (3,5) |
| Estadístico | p=0,458 | p=0,735 | p=0,289 | p=0,123 | p=0,289 |
Estadístico: refleja el valor de p en la comparación entre grupos de servicios (test de Kruskal-Wallis). Resultados expresados en medias (DE).
IFS: Índice de Flesch Szigrist; LEGIN: Índice de legibilidad integrada; PAL: resultados de índice de legibilidad de García López; UCC: Unidad de Coagulopatías Congénitas; UCI: Unidad de Cuidados Intensivos; UEI: Unidad de Enfermedades Infecciosas.
Este estudio se diseñó para conocer el grado de cumplimiento de la legislación europea de las HIP y del CI que recibían los pacientes que iniciaban EC en nuestro hospital.
Entre las limitaciones de nuestro estudio se encuentran el bajo número de HIP de ciertos servicios; de 15 servicios, 7 (46,6%) presentaban un único ensayo para analizar. Esto condujo a la agrupación de los servicios clínicos basándonos en las áreas de gestión clínica del hospital, lo que generó diferencias en el tamaño muestral de los grupos. El Servicio de Obstetricia al no poder agruparse con servicios clínicos afines y contener un único ensayo se ha excluido de las comparaciones realizadas.
Los resultados obtenidos muestran que los EC presentan, en general, un buen cumplimiento de las GBPC. El 75% presentaban más del 80% de los apartados recogidos en el documento de la Agencia Europea de Medicamentos. Sin embargo, ciertos apartados siguen estando poco presentes en las HIP:
- -
Es necesario que los pacientes faciliten los datos sobre su estado físico o sobre su salud, así como que colaboren en su obtención, especialmente cuando sean necesarios por razones de interés público o con motivo de la asistencia sanitaria. Esto cobra especial importancia en los EC, donde la información del paciente va a ser utilizada para evaluar la eficacia y seguridad de un medicamento.
- -
La explicación de posibles alternativas al ensayo puede modificar la decisión del sujeto de participar en un EC. Por tanto, la no mención de estas va en contra del derecho de autonomía del sujeto.
El conocimiento de los objetivos, riesgos y condiciones del ensayo, así como el derecho a retirarse sin ningún perjuicio, se incluían adecuadamente en más de un 90% de las hojas. Esta información junto con una redacción en términos claros y comprensibles son los requisitos de las HIP establecidos en el Real Decreto 223/2004.
El estudio muestra la importancia de la evaluación de la HIP y del CI por parte del CEIC para garantizar que la información que recibe el sujeto es completa y adecuada. Se requirieron modificaciones de las HIP y del CI a los promotores al considerar que no eran totalmente adecuadas. Este hecho permite que las HIP que finalmente lee el paciente que ingresa en un EC se adecúen en mayor medida a las GBPC. En este caso, las HIP presentaron una media de 2,24 aspectos no incluidos de un total de 20 aspectos recomendados según las GBPC tras su revisión por parte del CEIC.
La comprensión de una HIP es fundamental antes de iniciar un EC. El nivel de comprensión de esta información depende de varios aspectos: nivel de motivación del paciente, nivel sociocultural, nivel de conocimientos sanitarios, nivel de complejidad del texto tanto en estructura como en vocabulario empleado. Por ello, la dificultad de lectura de los documentos escritos que son entregados a un paciente que participa en un ensayo debe ser evaluada. Tanto la fórmula de Szigriszt como la ecuación de García López están adaptadas a textos en castellano, por lo que nos permiten analizar de forma adecuada la legibilidad de la información que se entrega a un paciente que inicia un ensayo clínico.
Los resultados obtenidos en el análisis de legibilidad coinciden con los mostrados en otros estudios8,9. Se demuestra que un número importante de las HIP y del CI presenta una legibilidad adecuada al nivel sociocultural de la mayoría de los pacientes.
Por tanto, el grado de cumplimiento de los diferentes aspectos que se han de reflejar en la HIP es alto. Sin embargo, se debe mejorar la información que recibe el sujeto sobre sus responsabilidades y detallar las posibles alternativas al ensayo clínico, pues es esencial que el sujeto comprenda y entienda todos los aspectos del ensayo para preservar sus derechos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.