Desarrollo de modelos que mejoren la accesibilidad de los pacientes oncológicos para la realización de las pruebas analíticas, flexibilizando la elección del centro de obtención de la muestra tanto en atención primaria como en especializada.
Material y métodosAnálisis del circuito de los pacientes oncológicos. Estudio de la accesibilidad del paciente a la realización de sus analíticas. Desarrollo del modelo de consulta de alta resolución (MCAR) y del modelo de accesibilidad analítica del paciente (MAAP).
ResultadosEl porcentaje de pacientes oncológicos que están en tratamiento ha sufrido un incremento bianual de un 8,76%. Se evidencia la utilización de ambos modelos por el paciente. El modelo MAAP sufrió un incremento progresivo de su utilización alcanzando hasta un 32% a los 2 años de su implantación. La causa principal de su elección ha sido en un 74% de los casos debido a una mayor accesibilidad. Un 8% de los pacientes han utilizado ambos modelos según sus necesidades.
ConclusionesLa implantación de circuitos asistenciales optimizados y preferentes en ambos modelos mejoran la accesibilidad y la flexibilidad para la realización de pruebas diagnósticas del laboratorio en los pacientes estudiados.
To develop models to improve accessibility of performing laboratory tests on chronic oncology patients, as well as a more flexible choice of sample collection in both primary and specialized care.
Material and methodsCircuit analysis of cancer patients. Patient survey to study access to laboratory tests. High Resolution Consultation Development Model (MCAR) and Patient Access Analytical Model (MAAP).
ResultsThe percentage of cancer patients on treatment has increased by 8.76% in the past two years. There was a 32% increased in the use of the MAAP model in the two years of its implementation, and has been the choice of 74% due to greater accessibility, with 8% of the patients having used both models to suit their needs.
ConclusionsThe implementation of optimized and preferred care systems has shown that both models improve accessibility and flexibility of the diagnostic testing laboratory in the patients studied.
En el momento actual, el cáncer es uno de los problemas de salud pública más relevante. En el mundo, cada año se diagnostican más de 160.000 casos nuevos con una prevalencia actual de casi medio millón de pacientes y una mortalidad de 7,8 millones de pacientes en el 2008 y con una previsión de 13,2 millones en el 20301.
El cáncer, como enfermedad crónica, presenta unas necesidades complejas que requieren una atención integral de los pacientes y familiares. Las estrategias para la prestación de los servicios asistenciales deben ir orientadas a la necesidad de organizar las unidades asistenciales con un enfoque integral y personalizado de los problemas de salud del paciente. La coordinación de dichas unidades es uno de los retos más importantes de la oncología en el momento actual2,3.
Dentro de los modelos desarrollados en este ámbito para la mejora de la calidad asistencial se prioriza la importancia de incluir la perspectiva del paciente bajo los conceptos de patient-centered care (asistencia centrada en el paciente) y patient partnership (el paciente en la sociedad)4–7.
A partir de los datos expuestos es fácil deducir que la asistencia integral del enfermo oncológico es actualmente uno de los elementos con mayor repercusión social y sobre el que hay que centrar nuestros esfuerzos. Para llegar al manejo integral se requiere una visión global multidisciplinar de las distintas áreas de la Medicina al servicio del paciente bajo la coordinación del Servicio de Oncología Médica8–10.
En este tipo de procesos adquieren una dimensión especial aspectos como el acceso a los servicios. En este sentido, el laboratorio clínico debe prestar una atención preferente y muy coordinada debido a que los resultados se necesitan a la mayor brevedad y son esenciales para la toma de decisiones médicas tanto en el diagnóstico y el seguimiento como en la elección de la terapeútica11–13.
En definitiva, la coordinación entre el Servicio de Oncología, el Servicio de Análisis Cínicos y Atención Primaria surge de la necesidad de mejorar la atención tanto del paciente como de sus familiares6–15.
El objetivo de este estudio es la búsqueda de estrategias que mejoren la accesibilidad a la toma de una muestra sanguínea para la realización de las pruebas analíticas en los pacientes oncológicos. Dentro de estas estrategias se plantea el interrogante de si la inclusión de los centros periféricos de extracción de atención primaria y especializada, además del hospital, para la toma de una muestra para las analíticas en los pacientes oncológicos serían modelos válidos para la realización de este tipo de pruebas.
Material y métodosSe trata de un estudio descriptivo longitudinal prospectivo. El periodo de estudio incluye desde el diseño del proceso de atención al paciente oncológico y el establecimiento de las estrategias de mejora hasta la implantación y el seguimiento de la atención al paciente oncológico (septiembre de 2008 a marzo de 2011).
La población estudiada fueron los pacientes procedentes del Servicio de Oncología que van a precisar la realización de pruebas analíticas previas al tratamiento oncológico específico en el Hospital de Día Oncológico. Se realizó un cálculo del tamaño de la muestra con una seguridad y una precisión del 95%, siendo Z alfa de 1,96 y Z beta de 1,645. El tipo de muestreo fue sistemático.
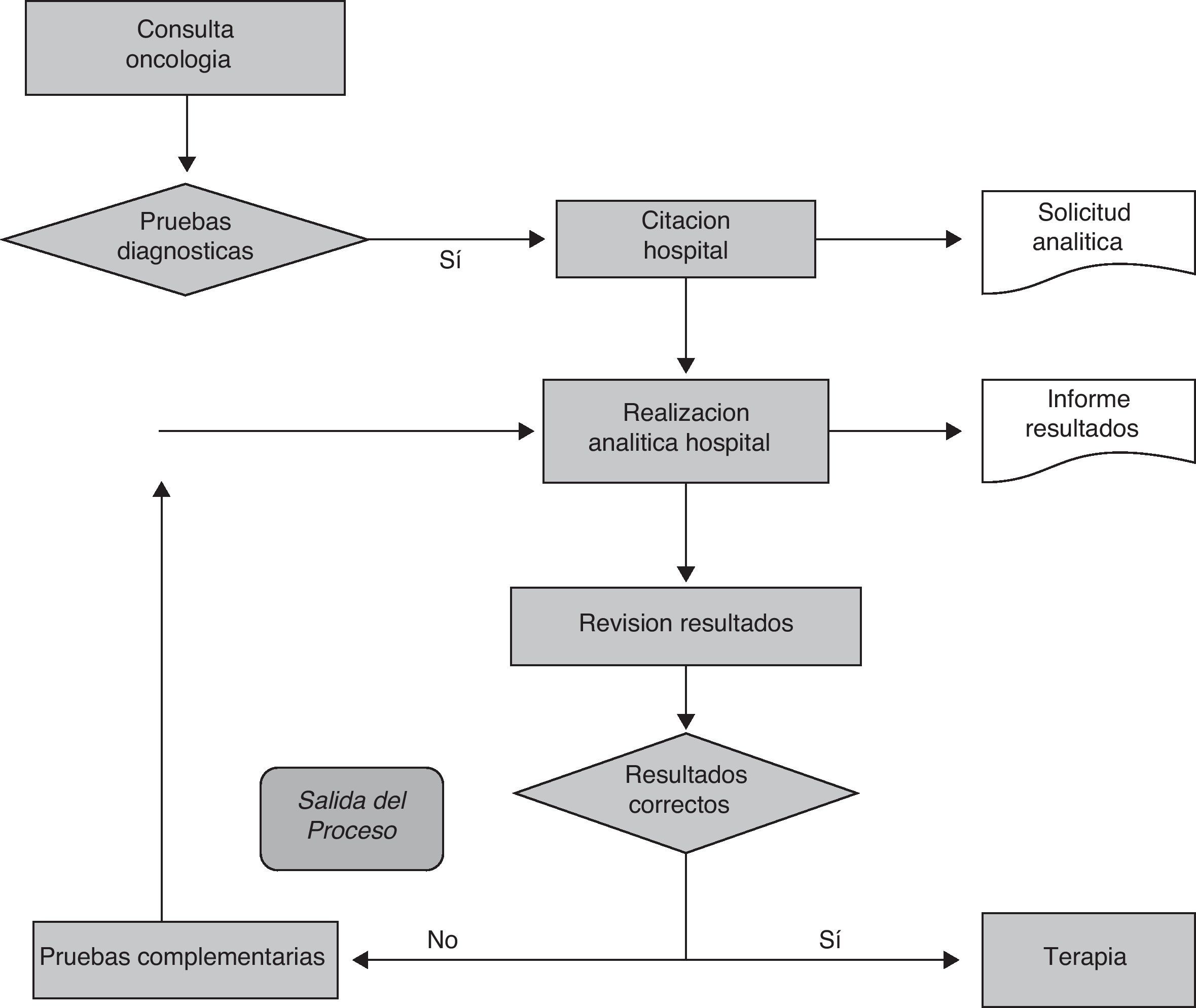
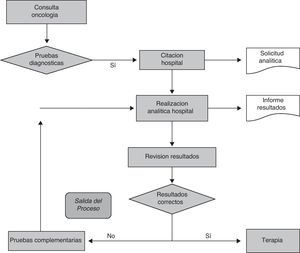
En primer lugar, estudiamos cómo se estaba llevando a cabo la realización de la analítica sanguínea. El procedimiento era el siguiente: los pacientes procedentes del Servicio de Oncología realizaban su analítica previa a la instauración del tratamiento únicamente en el hospital. Esto suponía que el paciente tenía que citarse previamente, venir otro día para realizarse la analítica y, posteriormente, volver un segundo día para la revisión de los resultados y/o administración de su protocolo terapéutico (fig. 1).
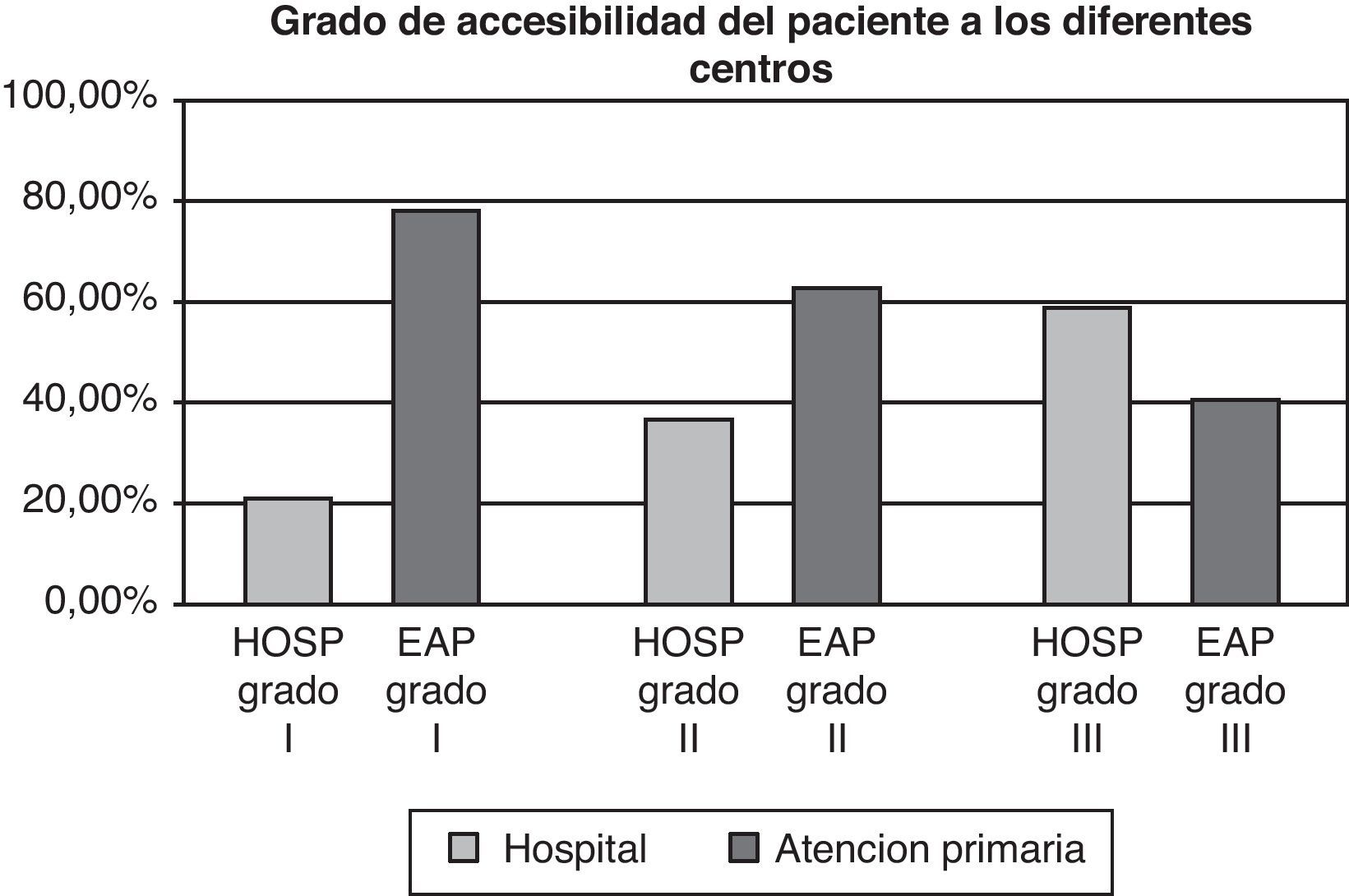
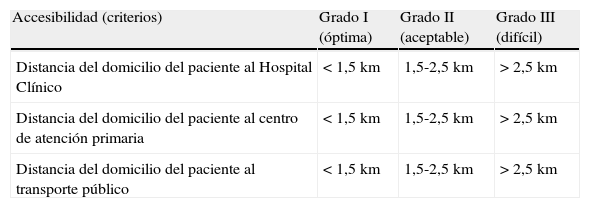
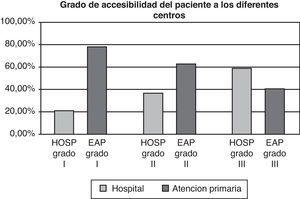
En segundo lugar, analizamos el grado de accesibilidad de los pacientes para la realización de sus analíticas. El concepto de accesibilidad se relaciona con la facilidad con la que los servicios sanitarios pueden ser obtenidos en función de las barreras organizativas (distancia, horario, etc.), económicas, culturales o emocionales. El área geográfica que tiene como referencia el hospital incluye en algunos casos grandes distancias desde el punto de origen (domicilio del paciente) al punto de destino (hospital) y en muchas ocasiones a este factor se añaden difíciles comunicaciones de transporte. Medimos las distancias máximas y mínimas desde el domicilio del paciente al hospital, a su centro de atención primaria o al medio de transporte público para acceder a los centros de obtención de la muestra. Una vez realizadas las medidas de distancia, dichas medidas se categorizaron en grados. Los datos se muestran en la tabla 1.
Accesibilidad geográfica a los centros de atención
| Accesibilidad (criterios) | Grado I (óptima) | Grado II (aceptable) | Grado III (difícil) |
| Distancia del domicilio del paciente al Hospital Clínico | <1,5km | 1,5-2,5km | >2,5km |
| Distancia del domicilio del paciente al centro de atención primaria | <1,5km | 1,5-2,5km | >2,5km |
| Distancia del domicilio del paciente al transporte público | <1,5km | 1,5-2,5km | >2,5km |
Accesibilidad geográfica categorizada en grados siguiendo los criterios de accesibilidad especificados.
Una vez analizados los 2 puntos anteriores se decidió crear un grupo multidisciplinar de profesionales de atención primaria y especializada con el objetivo de desarrollar un plan de mejora dentro del proceso asistencial del paciente oncológico basado en incrementar la accesibilidad que se le ofrece al paciente para la obtención de muestras sanguíneas posibilitando dicha obtención en todos los puntos periféricos de extracción existentes en nuestra área de referencia. Un factor relevante que se tuvo en cuenta en dicho plan es que, para este tipo de pacientes, se necesitan crear circuitos preferentes en todas las fases (fig. 1).
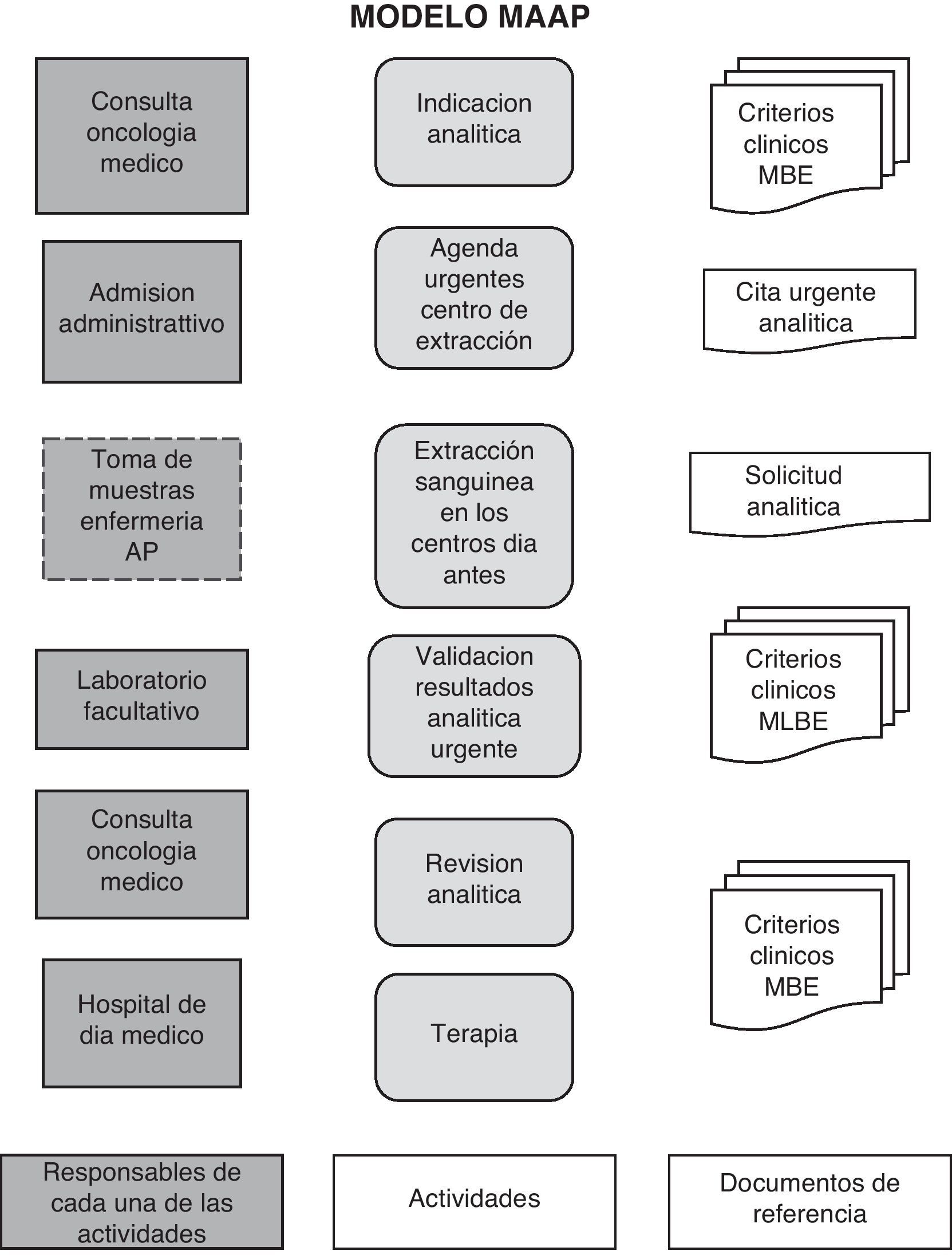
El grupo multidisciplinar diseñó 2 modelos de asistencia al paciente oncológico en relación con la obtención de muestras para las pruebas analíticas:
- •
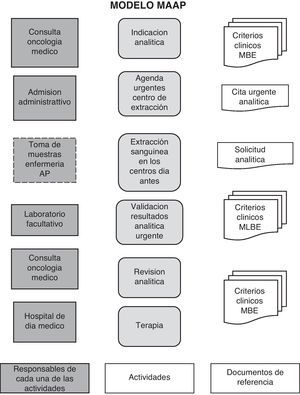
Modelo de consulta de alta resolución (MCAR): este modelo tiene el objetivo de incluir en el mismo acto asistencial la realización de las técnicas diagnósticas y la administración del tratamiento. Implica, prioritariamente, la reducción del número de visitas del paciente al hospital (fig. 2).
- •
Modelo de accesibilidad analítica del paciente (MAAP): es un modelo basado en mejorar la accesibilidad de los pacientes para la realización de las pruebas analíticas. El paciente, en este modelo MAPP, puede acudir a realizarse la extracción sanguínea en diferentes puntos geográficos (centros de atención primaria y especializada) 24h antes a la administración de la terapia. Implica una mayor accesibilidad a la realización de la toma de la muestra. Este es un aspecto importante ya que algunos autores reflejan que la lejanía del hospital y la dificultad del transporte es un factor de riesgo en el seguimiento14–17 (fig. 2).
Podríamos decir que, en definitiva, se diseñó un circuito coordinado de «atención integral al paciente oncológico» que ofrece al paciente la posibilidad de elegir dónde realizarse la analítica previa a su tratamiento según sus necesidades. En la figura 2 se describe la secuencia en que ocurren las actividades, sus interrelaciones y responsabilidades.
Finalmente, para poder analizar las causas de la elección de cada uno de los modelos, se realizó un cuestionario con preguntas sencillas que se entregó de forma aleatoria a los pacientes en el momento de la extracción analítica. Se les preguntaba cuál era la causa de elección del punto de extracción y las respuestas se agruparon en: 1. Siempre me he realizado la analítica en este centro y prefiero no cambiar. 2. Es el que más cerca me queda de mi domicilio. 3. El cuidador prefiere este sistema de hacer la extracción y la consulta en el mismo día. 4. Utilizo ambas opciones dependiendo de mis necesidades. 5. otras causas.
Indicadores de eficacia de los modelosLos datos para la medición de los indicadores fueron obtenidos a partir de la base de datos del sistema informático del laboratorio, de los datos de accesibilidad y de los cuestionarios realizados a los pacientes incluidos en el estudio. Los indicadores analizados fueron los siguientes:
- •
Porcentaje de pacientes que se atienden en el modelo MCAR (seguimiento mensual).
- •
Porcentaje de pacientes que se atienden en el modelo MAAP (seguimiento mensual).
- •
Porcentaje de las principales causas de elección de los modelos.
- •
Porcentaje de pacientes que, habiendo elegido uno de los modelos, cambian a otro modelo, así como las causas del cambio (seguimiento trimestral).
- •
Grado de accesibilidad a los puntos de obtención de la muestra.
Para el análisis estadístico de dichos indicadores se utilizó el estadístico t de Student.
Se utilizaron como variables el porcentaje de utilización de uno u otro modelo de asistencia, el grado de accesibilidad a los puntos de atención y las causas de elección del modelo.
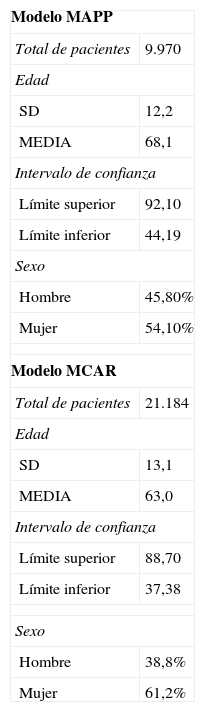
ResultadosHan sido incluidos en el estudio un total de 31.154 pacientes. En la tabla 2 se presentan los datos demográficos de los mismos agrupados según el modelo.
Características demográficas y total de pacientes incluidos en el estudio distribuidos según el modelo aplicado
| Modelo MAPP | |
| Total de pacientes | 9.970 |
| Edad | |
| SD | 12,2 |
| MEDIA | 68,1 |
| Intervalo de confianza | |
| Límite superior | 92,10 |
| Límite inferior | 44,19 |
| Sexo | |
| Hombre | 45,80% |
| Mujer | 54,10% |
| Modelo MCAR | |
| Total de pacientes | 21.184 |
| Edad | |
| SD | 13,1 |
| MEDIA | 63,0 |
| Intervalo de confianza | |
| Límite superior | 88,70 |
| Límite inferior | 37,38 |
| Sexo | |
| Hombre | 38,8% |
| Mujer | 61,2% |
MAPP: modelo de accesibilidad analítica del paciente; MCAR: modelo de consulta de alta resolución.
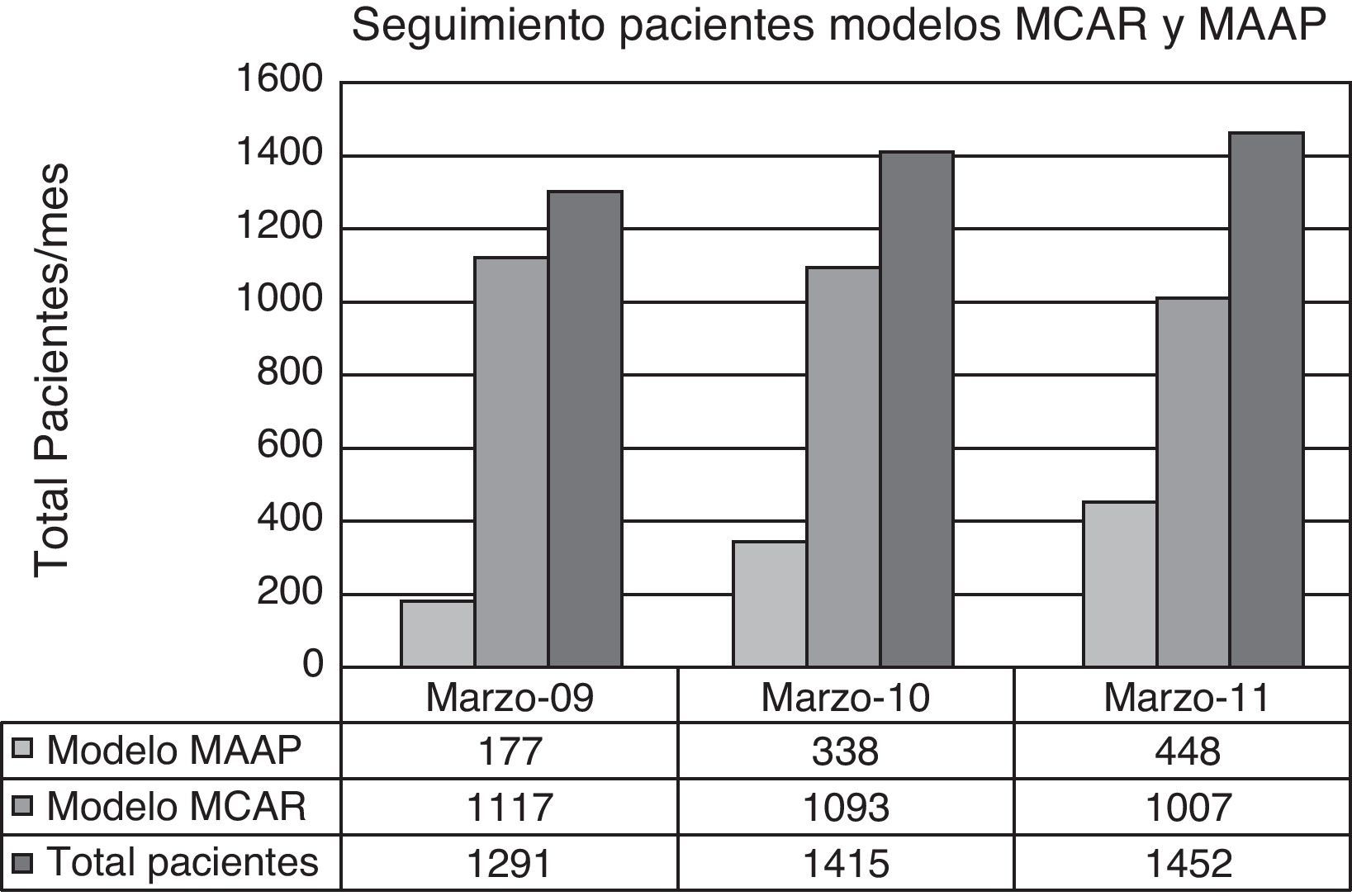
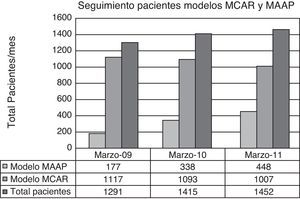
La media de pacientes procedentes del Servicio de Oncología a los que se les realizó una analítica previa a la administración de su terapia fue incrementándose progresivamente, pasando de una media de 1.291 pacientes al mes en el año 2009 a 1.452 pacientes al mes en el año 2011, lo que supone un incremento de un 8,7% bianual (fig. 3).
La media de analíticas por paciente fue de 8,3/año con una rango de 4 a 16.
Dado que la variable accesibilidad puede ser un factor importante a la hora de la elección de uno u otro modelo, analizamos el grado de accesibilidad geográfica. La media de distancia desde el domicilio del paciente al centro de extracción fue de 2,1km con un rango de 0,55 a 12,3km. En la figura 4 se observa como la accesibilidad de los grados i y ii es claramente mayor desde el domicilio del paciente a los centros periféricos que del domicilio del paciente al hospital.
El porcentaje de pacientes que acudieron a su centro de salud para realizarse la extracción analítica el día previo a acudir al hospital para la administración del ciclo (modelo MAAP) fue incrementándose continua y progresivamente, siendo a los 6 meses de la instauración del circuito de un 8%, a los 12 meses de un 14%, hasta alcanzar en el año 2011 un 32% (fig. 3).
Para analizar las causas de la elección de uno u otro modelo se realizaron mediante un muestreo aleatorio 237 cuestionarios con una tasa de respuesta del 72%. El porcentaje de repuestas agrupados por causas fueron las siguientes:
Elección del modelo MCAR: un 49% fue debido a que siempre se ha realizado la analítica en el hospital y no quiere cambiar. Un 28% fue debido a la cercanía a su domicilio (accesibilidad de grado i/ii), un 14% por necesidades del cuidador y un 8% por otras causas.
Elección del modelo MAAP: un 74% por la cercanía a su domicilio (accesibilidad de grado i y/o ii), un 21% conoce el centro de extracción y un 5% por otras causas.
Hemos de destacar que un 8% de los pacientes utilizaron ambos modelos MCAR y MAAP para realizarse la analítica según sus necesidades. Las principales razones fueron: un 64% por cambio de domicilio, un 31% por cambio de acompañante y un 5% por otras causas.
A la hora de elegir uno u otro modelo no se observaron diferencias significativas en relación con la edad o el sexo del paciente.
DiscusiónLa organización del proceso del tratamiento antineoplásico conlleva una secuencia compleja de actividades asistenciales. Para mejorar dicho proceso es esencial la identificación de todas las actividades dentro del mismo, así como el papel y la responsabilidad que asume cada profesional específico y cómo interactúan entre sí como un equipo interdisciplinar. De esta forma podremos identificar los puntos críticos y las acciones de mejora9–18.
Un avance importante es el desarrollo de los procesos asistenciales integrados y las unidades funcionales oncológicas que mejoran y resaltan aún más ese papel multidisciplinar. Es, en nuestra opinión, el paradigma de la atención integral multidisciplinar oncológica ya que permite mejorar la dinámica de los procesos transversales al integrar todos los elementos relacionados con los pacientes.
La organización multidisciplinar de los equipos asistenciales y la integración de todas las medidas diagnósticas y terapéuticas son elementos de gestión que facilitan la continuidad de la atención al enfermo oncológico. Crean, además, un entorno que facilita la proximidad y el contacto entre pacientes y profesionales y, por tanto, la satisfacción de las necesidades individuales de cada paciente9–20.
En relación con los tiempos de espera en la atención sanitaria, es un debate recurrente en el proceso asistencial oncológico21–23 la posibilidad de elegir entre los 2 modelos presentados ya que permite disminuir el número de visitas y los tiempos de espera innecesarios.
Por otra parte, dichos modelos mejoran las condiciones de acceso a las pruebas diagnósticas que, creemos, pueden constituir uno los factores más importantes en la evaluación de la calidad asistencial percibida. El grado de cercanía de los centros especializados del propio domicilio, el funcionamiento de los servicios de transporte y la continuidad asistencial por un mismo profesional se nombran por algunos autores como los criterios más relevantes para la fase de seguimiento, considerada de especial importancia por el carácter crónico de la enfermedad y el avance progresivo de los síntomas24–26.
Diferentes autores también han analizado cómo las desigualdades en el acceso a los centros de atención especializados en áreas rurales y urbanas son aspectos que repercuten de forma negativa en el proceso asistencial del cáncer, constatando un mayor retraso en el proceso de atención a causa de una cobertura insuficiente con centros especializados y una falta de facilitación de transporte24–28. Incluso algunos autores reflejan cómo la lejanía del hospital y la dificultad del transporte es un factor de riesgo en el seguimiento.
En el caso de nuestro estudio, la coordinación entre el Servicio de Oncología, el Servicio de Análisis Cínicos y el Área de Atención Primaria para la realización de una asistencia integral del paciente oncológico nos ha permitido una mejora en la atención al paciente implantando estos modelos que facilitan al paciente el acceso a la realización de las pruebas diagnósticas.
Si bien en un principio no se incluyeron para la libre elección de los modelos aquellos pacientes que tenían implantados catéteres venosos centrales, en el momento actual y tras observar los resultados obtenidos estamos pensando en incluir también a dichos pacientes. Creemos que los profesionales de Enfermería de Atención Primaria pueden constituir un pilar básico en el cuidado de este tipo de pacientes.
Ambos modelos (MCAR y MAAP) han demostrado ser perfectamente viables, adecuándose a la accesibilidad geográfica y a las necesidades del paciente y/o su cuidador. El modelo MCAR con el diseño de «consulta de alta resolución» permite a los pacientes resolver el proceso en un mismo acto asistencial y se adecua a los pacientes que ofrecen resistencia a los cambios y con una accesibilidad de grado i y ii y preferentemente es utilizado también en aquellos casos en los que son acompañados por el cuidador. El modelo MAAP, es decir, la posibilidad de realizarse la analítica el día antes en su centro de atención primaria, ha demostrado ser un modelo eficaz. Se consensuó como medida satisfactoria un incremento mayor o igual al 10% anual hasta alcanzar una derivación de al menos un 30% de los pacientes que utilizan el modelo MAAP, que era el nuevo modelo de accesibilidad de toma de muestras cumpliendo y superando las expectativas fijadas previamente, siendo utilizado por un 32% de los pacientes. El grado de accesibilidad ha sido el factor que más ha influenciado su elección.
Por otra parte, disponer de ambos modelos de una manera versátil permite al paciente elegir una u otra opción dependiendo de sus necesidades en cada momento de todo su proceso asistencial.
Si bien no podemos asegurar que exista un modelo ideal que sea aplicable a todos los ámbitos y niveles sanitarios y que se adapte al 100% a las necesidades del paciente, hay que pensar en modelos flexibles centrados en el paciente y que oferten diferentes posibilidades. Se trata de aportar y desarrollar nuevas ideas que mejoren y adecuen los modelos existentes.
Conflicto de interesesEste artículo no supone ningún conflicto de intereses.
A todo el personal sanitario y no sanitario de los centros de atención primaria. Sin su colaboración este estudio no hubiera podido llevarse a cabo.
A todo el personal del Servicio de Análisis Clínicos y de Oncología por su implicación diaria en la mejora de la asistencia sanitaria.