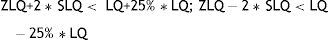Elaborar un esquema de validación de una técnica analítica siguiendo los requisitos de la ISO 17025.
Material y métodosTeniendo en cuenta la ISO 17025, los parámetros verificados fueron: selectividad, modelo de calibración y linealidad, precisión, exactitud, incertidumbre de medida e interferencias analíticas.
ResultadosEl procedimiento desarrollado fue aplicado satisfactoriamente para cuantificar cinc en suero por espectrofotometría de absorción atómica.
ConclusiónFinalmente, se ha demostrado que nuestro método cumple con los requisitos exigidos de selectividad, linealidad, exactitud y precisión, haciéndolo adecuado para el fin requerido.
The aim of this report is to propose a scheme for validation of an analytical technique according to ISO 17025.
Material and methodsAccording to ISO 17025, the fundamental parameters tested were: selectivity, calibration model, precision, accuracy, uncertainty of measurement, and analytical interference.
ResultsA protocol has been developed that has been applied successfully to quantify zinc in serum by atomic absorption spectrometry.
ConclusionIt is demonstrated that our method is selective, linear, accurate, and precise, making it suitable for use in routine diagnostics.
El laboratorio clínico resulta esencial en el diagnóstico del paciente. Ejerce un papel clave en la monitorización de un determinado tratamiento y en la evolución de una enfermedad. En este sentido es necesario asegurar que se cumple con las necesidades clínicas, garantizando la calidad de los resultados analíticos. Por ello, la acreditación del laboratorio juega un papel esencial. Esta puede llevarse a cabo por la norma International Standard Organization (ISO) 17025 (laboratorios de ensayo y calibración) o por la norma ISO 15189 (norma específica para el laboratorio clínico). Además, la acreditación en los laboratorios clínicos puede ser obligatoria, como ocurre en el caso de Francia o Corea, o voluntaria, como es el caso de España1. Con base en lo anterior, la acreditación de un laboratorio clínico de referencia que recibe muestras de otros laboratorios debería considerarse un objetivo prioritario.
Muchos de los requisitos técnicos de la norma ISO 17025 se encuentran incluidos en la ISO 15189. La esencia de ambas normas es la misma, aunque la forma de presentar los requerimientos en la norma 15189 es más fácilmente asumible para los profesionales del laboratorio clínico. La ISO 15189 es la norma de reconocimiento internacional para demostrar la competencia técnica de los laboratorios clínicos2–4.
El alcance de la acreditación será el conjunto de ensayos para los que el laboratorio ha demostrado su competencia técnica. El laboratorio deberá elegir el procedimiento más adecuado para la validación de las técnicas analíticas, dado que esta resulta ser una pieza clave para la acreditación.
El objetivo de este estudio fue desarrollar un procedimiento para la validación de la determinación de cinc en suero por espectrofotometría de absorción atómica por llama, cumpliendo los requisitos de la norma ISO 17025.
Material y métodoMétodo para la determinación de cinc (Zn) en suero por espectrofotometría de absorción atómica por llama. El equipo empleado fue el espectrofotómetro AAnalyst 300 Spectrometer (Perkin Elmer Inc., EE. UU.), con llama de aire/acetileno4,5.
Disoluciones de calibrado: a partir del patrón madre de Zn de 1.000mg/L (CAS N9300168, Zn Pure Grade Atomic Spectroscopy Calibration Standard, Perkin Elmer Inc.), se prepararon las disoluciones de calibrado 25, 50, 100, 200 y 400μg/L6.
Patrones de calibración, controles y muestras: se prepararon diluyendo 300μL del patrón, del control y de la muestra, respectivamente, con 2.000μL de agua desionizada (18MΩ·cm) y 20μL de Triton® X-100 al 10% (CAS 9002-93-1 Triton® X-100 BioXtra Sigma-Aldrich, EE. UU.). El blanco de calibración se preparó mezclando 100μL de Triton® X-100 al 10% con 1.000μL de agua desionizada.
Materiales de referencia: materiales procedentes de un programa de intercomparación de laboratorios organizado por el Institut National de Santé Publique du Québec, National Public Health Department Canada: PC SE 1218, PC SE 1306, PC SE 1301, PC SE 1111. Adicionalmente, se prepararon 2 muestras a partir del material de referencia para comprobar la fiabilidad en muestras de valores en el rango alto (adición sobre material de referencia certificado) y en el rango bajo (dilución del material de referencia certificado).
Procedimiento de la validación: los parámetros evaluados para la validación fueron: selectividad, linealidad de la calibración, sensibilidad, límite de detección (LOD) y límite de cuantificación (LOQ), exactitud y precisión, estudio de interferencias (hemólisis), validación/evaluación de la competencia de los analistas e incertidumbre7–9.
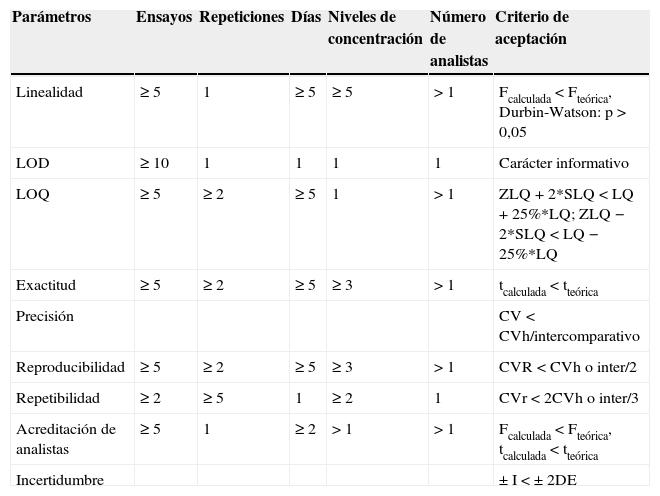
Se estableció una planificación de los ensayos a realizar y de los criterios de aceptación, con lo que se desarrolló el itinerario durante el proceso. Se aplicaron las estimaciones mediante las pruebas estadísticas especificadas en la tabla 1.
Planificación de las pruebas a realizar y sus respectivos ensayos
| Parámetros | Ensayos | Repeticiones | Días | Niveles de concentración | Número de analistas | Criterio de aceptación |
|---|---|---|---|---|---|---|
| Linealidad | ≥5 | 1 | ≥5 | ≥5 | >1 | Fcalculada<Fteórica, Durbin-Watson: p>0,05 |
| LOD | ≥10 | 1 | 1 | 1 | 1 | Carácter informativo |
| LOQ | ≥5 | ≥2 | ≥5 | 1 | >1 | ZLQ+2*SLQ<LQ+25%*LQ; ZLQ−2*SLQ<LQ−25%*LQ |
| Exactitud | ≥5 | ≥2 | ≥5 | ≥3 | >1 | tcalculada<tteórica |
| Precisión | CV<CVh/intercomparativo | |||||
| Reproducibilidad | ≥5 | ≥2 | ≥5 | ≥3 | >1 | CVR<CVh o inter/2 |
| Repetibilidad | ≥2 | ≥5 | 1 | ≥2 | 1 | CVr<2CVh o inter/3 |
| Acreditación de analistas | ≥5 | 1 | ≥2 | >1 | >1 | Fcalculada<Fteórica, tcalculada<tteórica |
| Incertidumbre | ±I<±2DE |
El calendario de pruebas planificadas fue desarrollado por el responsable del Área de Elementos Traza, basándose en la planificación propuesta en la norma NT 90-2105 y en procedimientos internos del laboratorio.
Los criterios de aceptación se eligieron teniendo en cuenta lo siguiente en orden de importancia: criterios normativos o legislativos, bibliografía o aplicaciones técnicas del equipo, y experiencia previa del laboratorio. En este sentido, la elección se basó en lo descrito en la literatura5,10–13 y en datos experimentales del ejercicio intercomparativo del que procede el material de referencia certificado proporcionado por el Institut National de Santé Publique du Québec.
La planificación de las pruebas a realizar y sus respectivos ensayos incluyó:
Selectividad: la longitud de onda (¿: 213,9nm) utilizada fue característica del elemento, en este caso del Zn, por lo que no existen interferencias de otros componentes de la muestra.
Linealidad: para evaluar la amplitud del rango lineal se ensayaron 10 niveles de concentración: 25, 50, 75, 100, 150, 200, 250, 300, 350, 400μg/dL. Los ensayos de calibración se realizaron a lo largo de 10 días. Se estimó la linealidad del intervalo por medio de 2 pruebas estadísticas: estadístico Durbin-Watson, que examinaba los residuos para determinar si había alguna correlación significativa basada en el orden en el que se habían producido los datos, y test F (Fisher), de contraste de varianzas con riesgo del 1%.
Sensibilidad: la sensibilidad se estimó del valor de la pendiente de la recta media de las 10 calibraciones independientes a realizar.
LOD y LOQ: se determinaron 30 blancos de calibración. Para estimar el LOD se multiplica la desviación estándar (DE) obtenida por 3,3 (LOD=3,3*DE); por lo tanto, se esperó que el LOQ se encontrara cercano a 10*DE.
En el LOQ se debía cumplir la siguiente regla5:
Donde:
ZLQ es el valor medio obtenido en los ensayos para la muestra empleada para verificar el LOQ.
SLQ es la desviación de la precisión intermedia calculada.
Exactitud: se expresó como el porcentaje de sesgo entre la media del valor obtenido y el valor verdadero o diana.
Cálculo de intervalos de aceptación del valor diana: dependiendo de la procedencia del suero a evaluar se realizó de forma diferente. En caso de intercomparativo será 2 veces la DE del intercomparativo. Si era un material preparado se calculó como 2 veces la DE de Horwitz. Si los intervalos t-Student calculados para el valor medio eran inferiores o iguales a los intervalos calculados para el valor diana se consideraba que se cumplía con los criterios de exactitud. Se comprobó que los límites calculados estaban dentro de los intervalos del valor diana.
Se realizó un test t-Student para evaluar que no había diferencias significativas entre los valores obtenidos y los valores de referencia. En todos los casos se obtuvo que t calculada<t teórica, por lo que no había diferencias significativas entre ambos valores.
Precisión: se expresó como el porcentaje del coeficiente de variación (CV) entre la DE y la media obtenida. El requerimiento es que el CV obtenido fuera inferior al CV intercomparativo, o en el caso de material de referencia preparado, que fuera inferior al CV de Horwitz (CVh).
CVh%=2 (1−0,5) log c; también se expresa como CVh%=0,02×c 0,8495
Donde:C=valor nominal del analito expresado en potencia de 10.
Reproducibilidad: fue la precisión bajo las condiciones de reproducibilidad; es decir, con el mismo método, pero variando las condiciones del análisis. Se efectuó durante 12 días diferentes, con distintos operadores. El criterio de aceptabilidad se basó en el CV del intercomparativo o Horwitz, según el origen de la muestra. En el caso de todos las muestras se cumplía que: %CVR<2/3 CVh/inter.
Repetibilidad: o precisión bajo condiciones de repetibilidad; es decir, sin variar las condiciones del análisis. Se efectuaron 20 medidas de 2 muestras control en un mismo día. El criterio de aceptabilidad se basó en el CV del intercomparativo o Horwitz, según el origen de la muestra. En el caso de todas las muestras se cumplía que: %CVr<CVh/inter/2.
Evaluación de los analistas: para evaluar la competencia técnica de los analistas se realizaron una serie de análisis con 2 controles. Se llevó a cabo un test F. Este demostró que no había diferencias estadísticamente significativas entre las varianzas de los analistas en cada uno de los niveles de concentración ensayados. A continuación, se realizó un test t-Student.
Estimación de la incertidumbre: en metrología, ‘measurement uncertainty se define habitualmente como «el parámetro que caracteriza la dispersión de valores que están siendo atribuidos a una cantidad medida»10,11.
Se realizó el análisis de incertidumbre utilizando la visión top-down. La aproximación top-down es la visión más realista de la incertidumbre, que no queda subestimada como suele suceder en el caso del modelo ISO GUM. Al contrario del modelo de la ISO GUM14,15, no se profundizó en el procedimiento analítico y no se trata a las fuentes del error de manera individual, sino que se planteó el sistema de análisis como si fuese una black box o caja negra. Si bien es cierto que se necesitan largas tandas de datos, en su mayoría estas podían provenir del trabajo ya realizado en la validación. Otra ventaja que presenta este método es que en los laboratorios de rutina se dispone de datos de controles a largo plazo, que pueden ser empleados para reevaluar la incertidumbre a lo largo del tiempo.
Estudio de interferencias: se realizó un estudio de la interferencia producida por la hemólisis de las muestras. En una primera fase se analizaron una serie de sueros no hemolizados de manera rutinaria. En una segunda fase se provocó mecánicamente una hemólisis moderada (nivel +) y se repitió el ensayo. En la última fase se hemolizó completamente la muestra (nivel ++). En el análisis estadístico se realizaron 2 test t-Student para ensayos pareados. El primero, suero normal vs. hemolizado (+) (moderadamente hemolizado), y el segundo, suero normal vs. hemolizado (++) (fuertemente hemolizado).
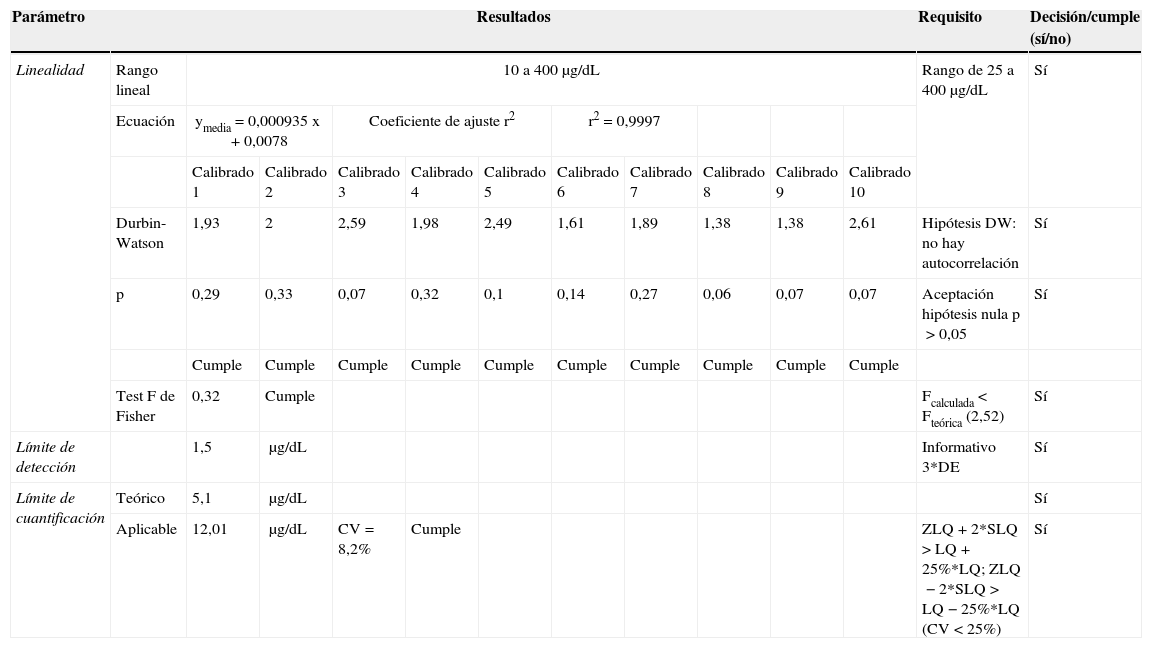
ResultadosLinealidadEstadístico Durbin-Watson: la probabilidad asociada al estadístico (valor de p) fue superior a 0,05 en todos los calibrados, es decir, superior al nivel de confianza elegido, α=0,05. No había indicio de autocorrelación serial en los residuos y, por lo tanto, no se pudo descartar estadísticamente la linealidad del modelo. Test F (Fisher): el valor F obtenido fue inferior a la F teórica, lo que confirmó la hipótesis de que no existían diferencias entre las varianzas de las poblaciones. Por tanto, el rango de trabajo elegido era lineal con riesgo 1%, p<0,001, y, por ello, el error del modelo era despreciable frente al error experimental.
El rango elegido era lineal y válido el modelo de ajuste matemático. Finalmente, para el método de rutina del laboratorio se pudo elegir una calibración de al menos 4 puntos más el blanco, dentro del intervalo lineal 25-400μg/dL.
Sensibilidad: la sensibilidad se obtuvo del valor de la pendiente de la recta media de las 10 calibraciones independientes realizadas (0,000935±0,000005).
Límite de detección y límite de cuantificaciónSe determinaron 30 blancos de calibración. Para estimar el LOD se multiplicó la DE (DE=0,51μg/dL) obtenida por 3,3 (LOD=1,53μg/dL); por lo tanto, era de esperar que el LOQ se encontrara cercano a 10*DE (LOQ = 5,1 μg/dL). A fin de poder verificar el LOQ, se hizo una dilución a un cuarto de un material de referencia de valor 48,05μg/dL para obtener un valor próximo al LOQ teórico (12,12>>5,1).
Considerando que se estaban validando 2 equipos iguales con diferente LOQ (en uno el LOQ era 5 y en el otro 10), se preparó un suero próximo a 10 para que los 2 equipos estuviesen acreditados en el mismo rango.
Los ensayos (5 ensayos, 2 repeticiones, ver tabla 2) confirmaron que el rango de la medida del LOQ se encontraba en el intervalo correspondiente al 25% del valor diana.
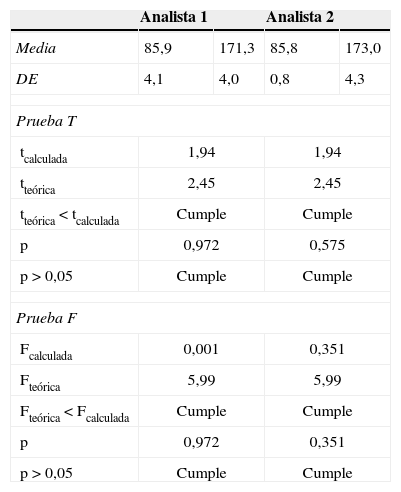
Validación/evaluación de los analistas
| Analista 1 | Analista 2 | |||
|---|---|---|---|---|
| Media | 85,9 | 171,3 | 85,8 | 173,0 |
| DE | 4,1 | 4,0 | 0,8 | 4,3 |
| Prueba T | ||||
| tcalculada | 1,94 | 1,94 | ||
| tteórica | 2,45 | 2,45 | ||
| tteórica<tcalculada | Cumple | Cumple | ||
| p | 0,972 | 0,575 | ||
| p>0,05 | Cumple | Cumple | ||
| Prueba F | ||||
| Fcalculada | 0,001 | 0,351 | ||
| Fteórica | 5,99 | 5,99 | ||
| Fteórica<Fcalculada | Cumple | Cumple | ||
| p | 0,972 | 0,351 | ||
| p>0,05 | Cumple | Cumple | ||
Se introdujo el valor 10μg/dL en el intervalo de calibración para poder cuantificar valores muy deficitarios en Zn, cercanos al LOQ.
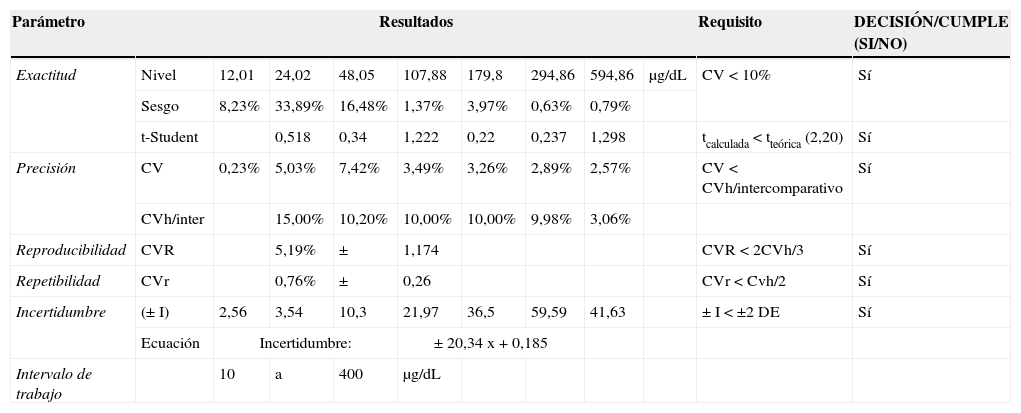
Exactitud y precisiónPara la evaluación simultánea de la exactitud y la precisión se analizaron 6 sueros (2 de ellos preparados por el laboratorio) excedentes de un ejercicio intercomparativo con concentraciones crecientes de Zn durante 10 días. Se realizó cada día una calibración independiente y en el proceso intervinieron distintos operadores. Se obtuvo para el rango normal de Zn en suero16 (66-110μg/dL) un exactitud menor al 10% y una precisión inferior al 5%.
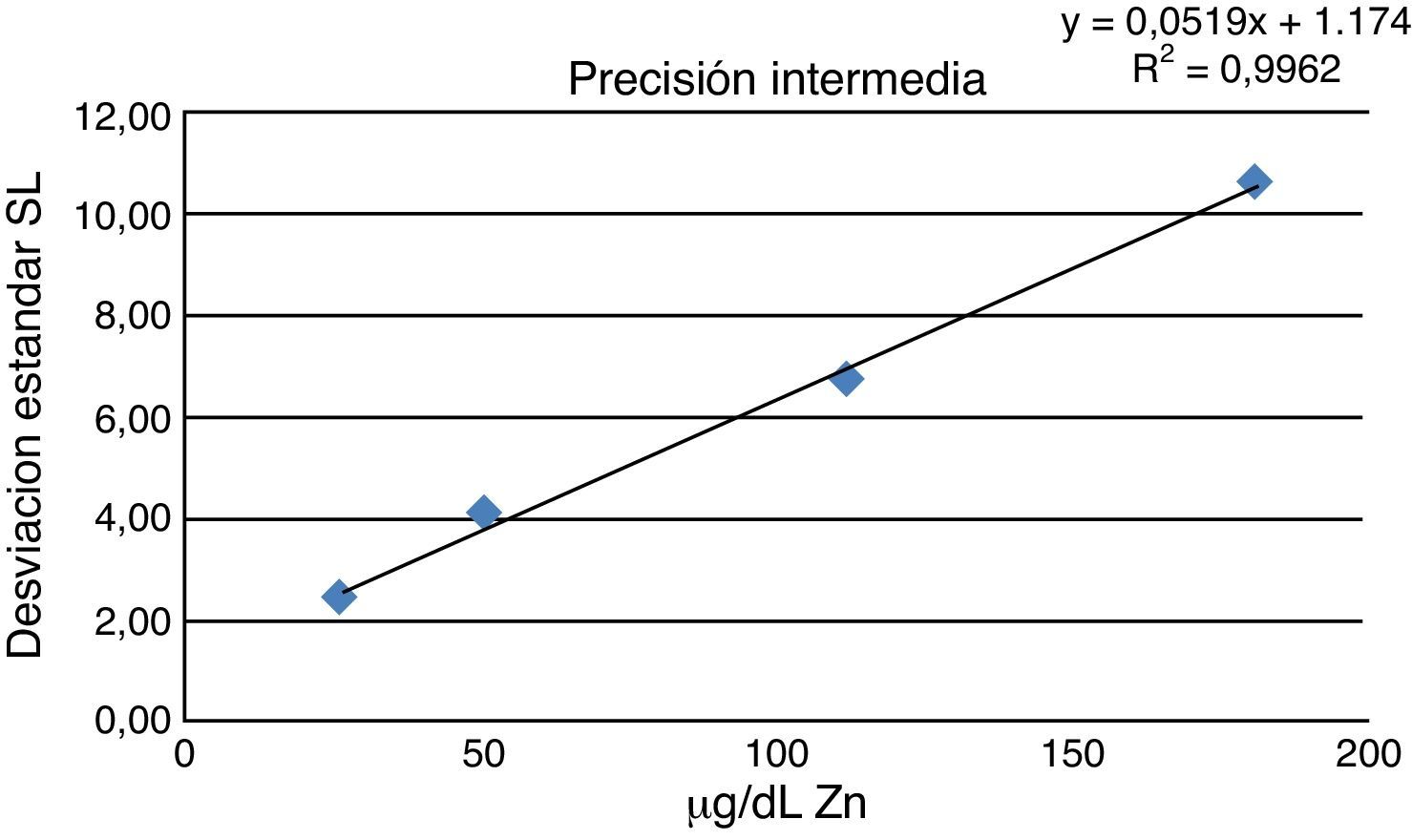
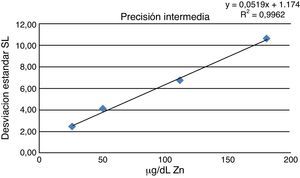
Reproducibilidad y repetibilidadSe determinó la precisión intermedia, representando la DE intermedia frente al valor medio encontrado en cada nivel de concentración (fig. 1), obteniéndose: (0,77% x+0,92) μg/dL, siendo «x» la concentración de Zn en μg/dL. La repetibilidad obtenida fue de: (0,76% x+0,26) μg/dL, siendo «x» la concentración de Zn en μg/dL.
Validación de los analistasLos resultados del test t-Student fueron los siguientes: tanalista1=1,94 (p=0,972) y tanalista2=1,94 (p=0,5275), siendo menor en ambos casos a tteórica=2,45. La prueba F fue de Fanalista1=0,001 (p=0,972) y Fanalista2=0,001 (p=0,331), siendo Fteórica=5,99.
Estadísticamente no existieron diferencias significativas entre las mediciones de ambos analistas (ver tabla 2).
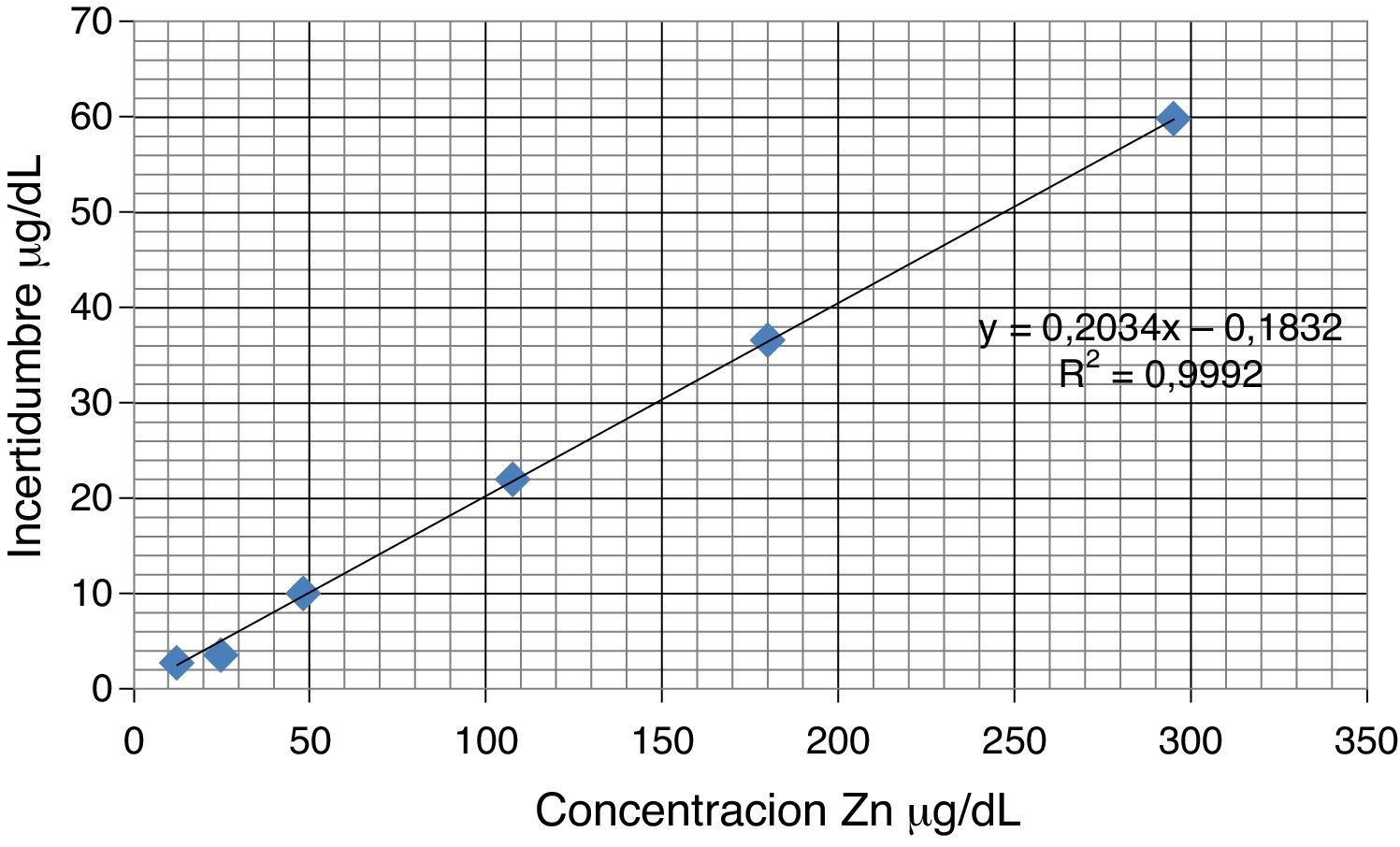
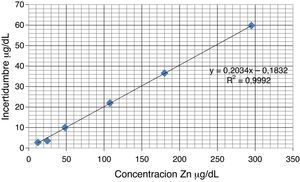
IncertidumbreSe representaron los niveles de concentración frente a los valores de incertidumbre asociada (fig. 2). A continuación se ajustó a un modelo lineal de recta de regresión, pudiendo expresar la incertidumbre como: (20,34% x−0,18) μg/dL, siendo «x» la concentración de Zn en μg/dL.
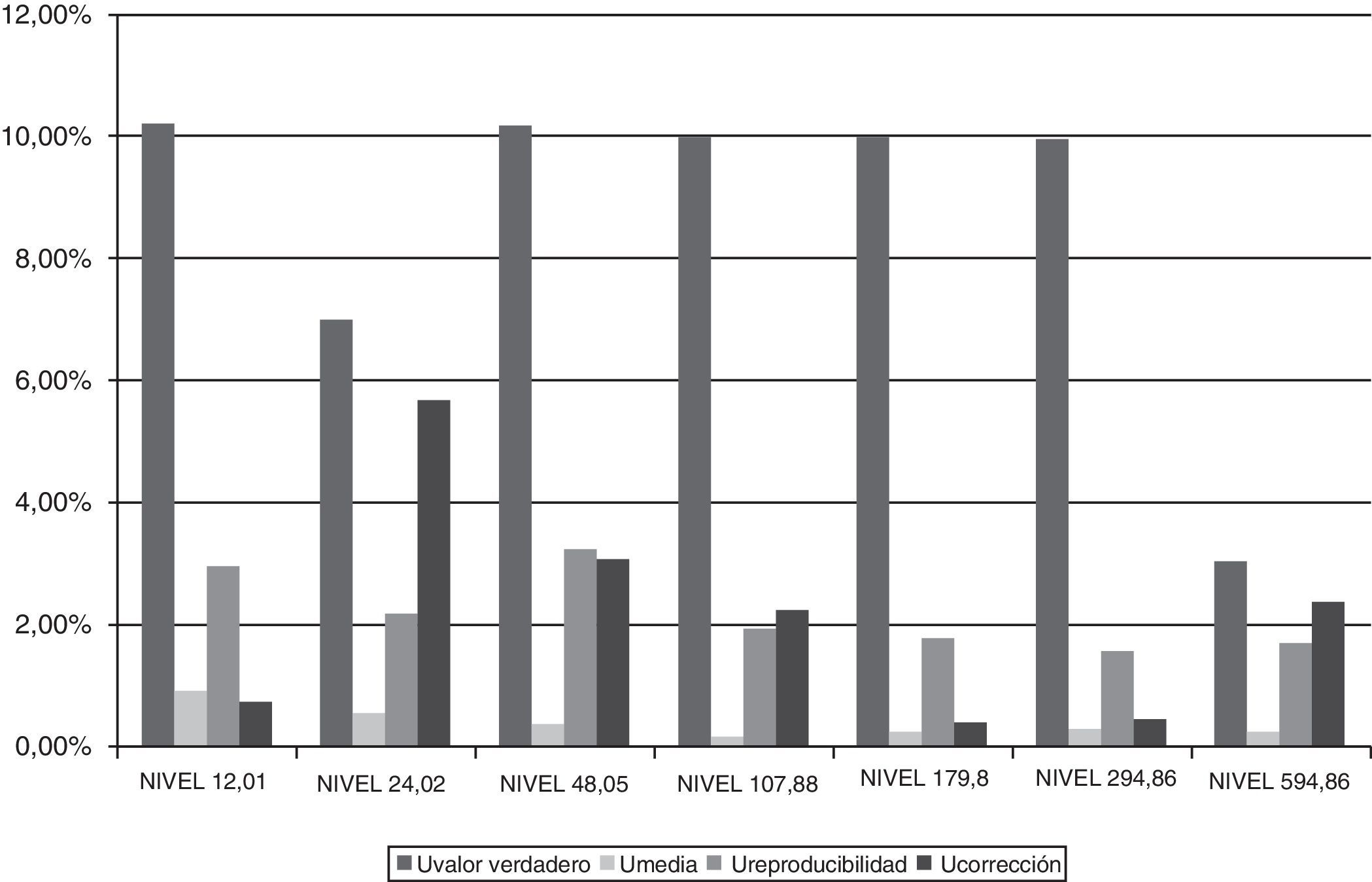
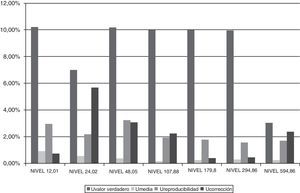
Se representó la incertidumbre obtenida descompuesta en sus factores y expresados en %U (fig. 3). Se observó que la componente mayoritaria de la incertidumbre corresponde a U del valor verdadero, que es la incertidumbre intrínseca al propio material de referencia utilizado.
Estudio de hemolizaciónCon los resultados obtenidos se observó que no había diferencia significativa entre el suero normal vs. hemolizado (+); t calculado es −1,47<t teórico 4,30 (p=0,28).
En el segundo caso, en la comparación suero normal vs. hemolizado (++) se obtuvo un resultado de t calculado: −4,76>t teórico 4,30 (p=0,04). Por ello, se estimó que había diferencias significativas entre el resultado del suero normal y el hemolizado (++) y, por ello, el grado de hemólisis deberá tenerse en cuenta en el procedimiento de determinación de Zn en suero en el laboratorio17.
DiscusiónLa valoración del estado nutricional y detección de síndromes de deficiencia de Zn requiere de la utilización de técnicas analíticas fiables y validadas. En nuestro caso se observó que todos los parámetros estudiados cumplían los criterios de aceptación especificados (tablas 3 y 4). Por ello, se pudo concluir que el método estaba validado. En este mismo sentido, junto con la validación se han de establecer criterios documentados de calidad analítica claramente establecidos tanto en la norma ISO 17025 como en la norma ISO 15189 a fin de lograr la acreditación2,3. Estos deben incluir, entre otros: uso de muestras control, mantenimiento preventivo de equipos, entrenamiento del personal y auditorías internas.
Resumen de los valores obtenidos en la validación
| Parámetro | Resultados | Requisito | Decisión/cumple (sí/no) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Linealidad | Rango lineal | 10 a 400μg/dL | Rango de 25 a 400μg/dL | Sí | |||||||||
| Ecuación | ymedia=0,000935 x+0,0078 | Coeficiente de ajuste r2 | r2=0,9997 | ||||||||||
| Calibrado 1 | Calibrado 2 | Calibrado 3 | Calibrado 4 | Calibrado 5 | Calibrado 6 | Calibrado 7 | Calibrado 8 | Calibrado 9 | Calibrado 10 | ||||
| Durbin-Watson | 1,93 | 2 | 2,59 | 1,98 | 2,49 | 1,61 | 1,89 | 1,38 | 1,38 | 2,61 | Hipótesis DW: no hay autocorrelación | Sí | |
| p | 0,29 | 0,33 | 0,07 | 0,32 | 0,1 | 0,14 | 0,27 | 0,06 | 0,07 | 0,07 | Aceptación hipótesis nula p>0,05 | Sí | |
| Cumple | Cumple | Cumple | Cumple | Cumple | Cumple | Cumple | Cumple | Cumple | Cumple | ||||
| Test F de Fisher | 0,32 | Cumple | Fcalculada<Fteórica (2,52) | Sí | |||||||||
| Límite de detección | 1,5 | μg/dL | Informativo 3*DE | Sí | |||||||||
| Límite de cuantificación | Teórico | 5,1 | μg/dL | Sí | |||||||||
| Aplicable | 12,01 | μg/dL | CV=8,2% | Cumple | ZLQ+2*SLQ>LQ+25%*LQ; ZLQ−2*SLQ>LQ−25%*LQ (CV<25%) | Sí | |||||||
Resumen de los valores obtenidos en la validación (continuación)
| Parámetro | Resultados | Requisito | DECISIÓN/CUMPLE (SI/NO) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Exactitud | Nivel | 12,01 | 24,02 | 48,05 | 107,88 | 179,8 | 294,86 | 594,86 | μg/dL | CV<10% | Sí |
| Sesgo | 8,23% | 33,89% | 16,48% | 1,37% | 3,97% | 0,63% | 0,79% | ||||
| t-Student | 0,518 | 0,34 | 1,222 | 0,22 | 0,237 | 1,298 | tcalculada<tteórica (2,20) | Sí | |||
| Precisión | CV | 0,23% | 5,03% | 7,42% | 3,49% | 3,26% | 2,89% | 2,57% | CV<CVh/intercomparativo | Sí | |
| CVh/inter | 15,00% | 10,20% | 10,00% | 10,00% | 9,98% | 3,06% | |||||
| Reproducibilidad | CVR | 5,19% | ± | 1,174 | CVR<2CVh/3 | Sí | |||||
| Repetibilidad | CVr | 0,76% | ± | 0,26 | CVr<Cvh/2 | Sí | |||||
| Incertidumbre | (±I) | 2,56 | 3,54 | 10,3 | 21,97 | 36,5 | 59,59 | 41,63 | ±I<±2DE | Sí | |
| Ecuación | Incertidumbre: | ±20,34 x+0,185 | |||||||||
| Intervalo de trabajo | 10 | a | 400 | μg/dL | |||||||
Con el fin de mejorar la calidad de los resultados analíticos cada método debe ser validado, requisito este obligatorio en caso de querer formar parte de los laboratorios acreditados en todo el mundo. Muchos de los requisitos técnicos de la norma ISO 17025 se encuentran incluidos en la norma ISO 15189, dado que la esencia de ambas normas es la misma. Pese a ello, la norma ISO 17025 obliga a determinar la incertidumbre, cosa que no ocurre en la norma ISO 15189. Aún así, la versión 2013 de la norma 15189 contempla, en el punto 5.5.1.4, que cada laboratorio debe determinar la incertidumbre de medida para cada procedimiento de medición en la fase analítica utilizada para obtener los valores cuantitativos medidos en las muestras de los pacientes. El estudio de la incertidumbre de la medida es importante tanto para el laboratorio como para el clínico que recibe el resultado, y favorece que se emita un informe de resultados más eficaz.
Por otro lado, aunque la norma ISO 17025 es válida para una acreditación, la tendencia en los laboratorios clínicos es hacia la implementación de la norma ISO 15189, norma específica para dichos laboratorios, dado que es más fácilmente asumible por los profesionales del laboratorio clínico.
La mejora continua y el equipo humano son los elementos clave para el mantenimiento de la garantía de calidad en un laboratorio clínico acreditado18. La acreditación de laboratorios clínicos aumenta la calidad de los resultados analíticos. Además, en la mayoría de los casos, esto es una motivación para el personal del laboratorio y redunda en beneficio de todos los interesados.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.