Las anomalías pancreáticas del desarrollo son un espectro de variaciones anatómicas, entre las que se destaca el páncreas divisum; su asociación con la pancreatitis aguda continúa siendo controversial.
Materiales y métodosEn primer término se realizó una investigación no experimental de corte transversal sobre 100 piezas duodenopancreáticas cadavéricas y en segunda instancia se analizó el reporte de caso de un paciente con colestasis extrahepática y pancreatitis aguda asociadas a la portación de páncreas divisum. El objetivo fue determinar la prevalencia del sistema descompresivo pancreático.
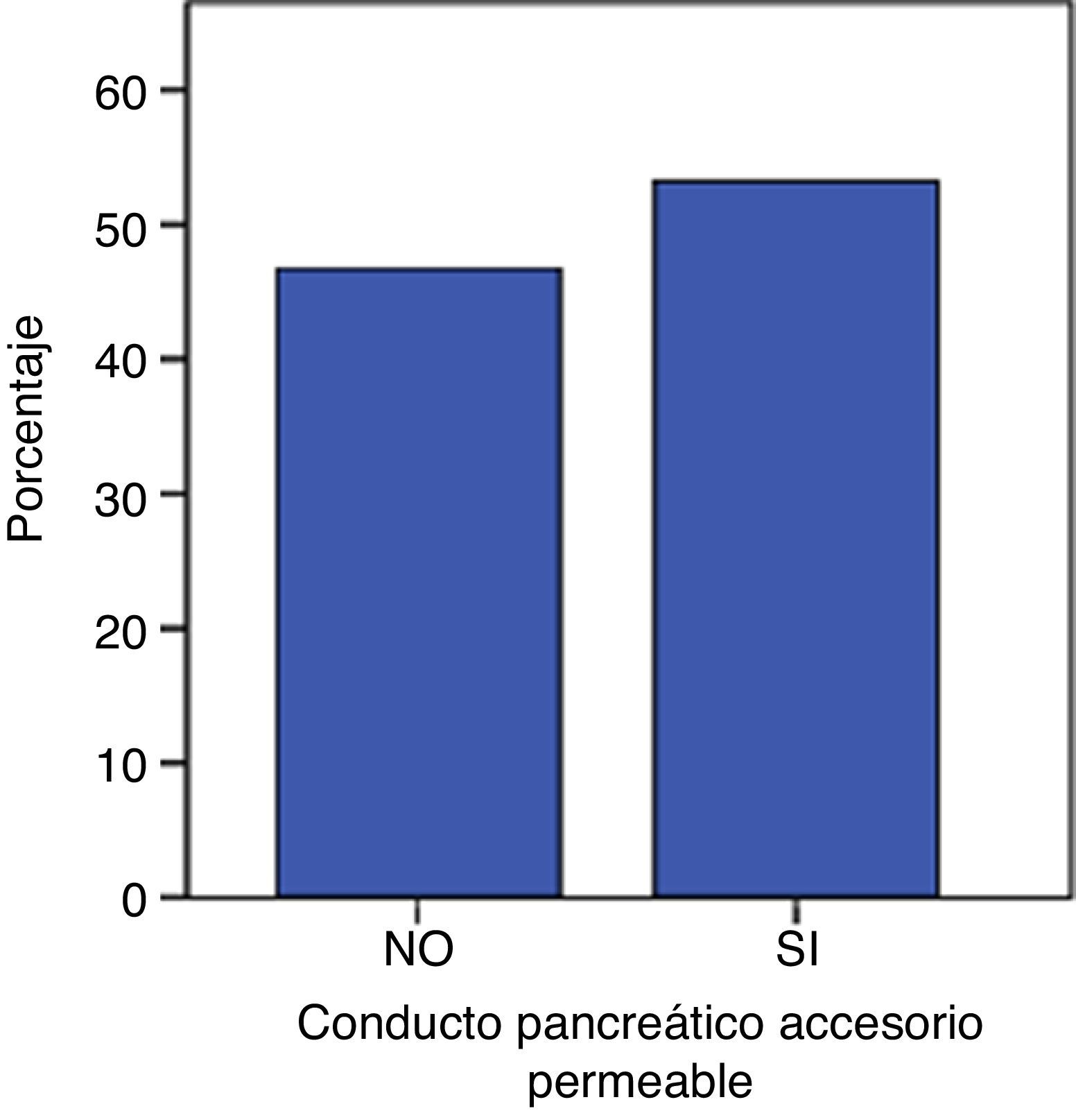
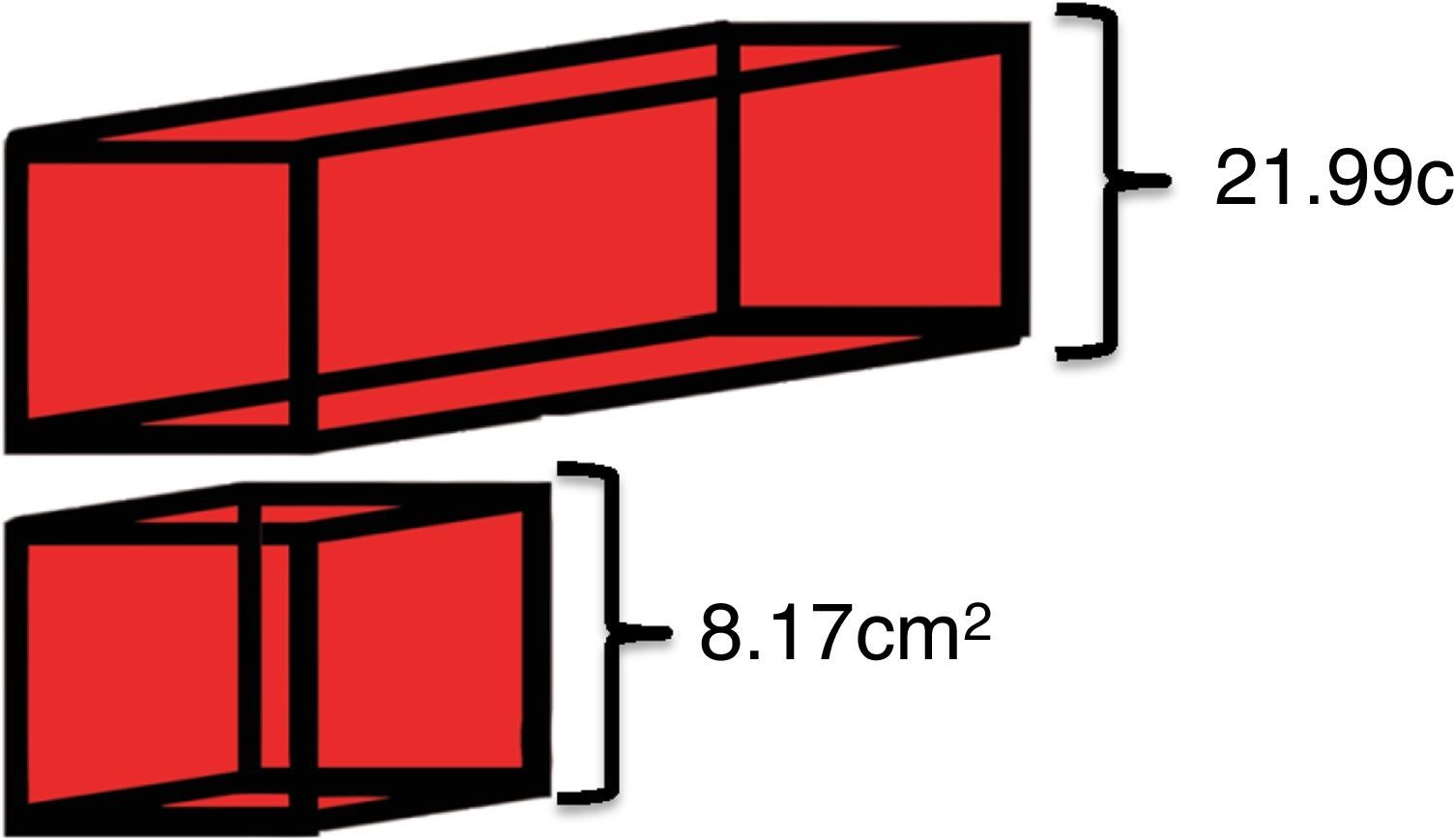
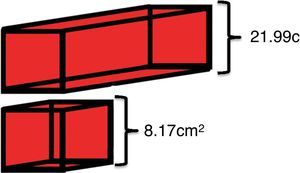
ResultadosExiste diferencia estadísticamente significativa entre las dimensiones del conducto pancreático accesorio y su relación con la permeabilidad. En cuanto a la volumetría pancreática, la sección correspondiente al tercio superior cefálico, cuello, cuerpo y cola del órgano registró una dimensión media de 21,99cm3, mientras que la sección de los dos tercios cefálicos restantes fue de 8,17cm3. Simultáneamente, el paciente reportado presentó cuadro clínico de pancreatitis con amilasa de 280UI/l y lipasa de 173UI/l asociado a colestasis. Al segundo día de internación se realizó colangiopancreatografía retrógrada endoscópica con papilotomía duodenal mayor y extracción de múltiples cálculos coledocianos, evidenciando un páncreas divisum completo.
DiscusiónEl caso expuesto exhibe que la pancreatitis, en presencia de páncreas divisum, tendría la denominación de una pancreatitis ventral subclínica.
ConclusiónEl páncreas divisum sería un predictor determinante de pancreatitis aguda al perder el mecanismo descompresivo protector pancreático.
Pancreatic developmental anomalies are a spectrum of anatomical variations, including the pancreas divisum, where its association with acute pancreatitis continues being controversial.
Materials and methodsFirstly, a non-experimental cross-sectional study was carried out on one hundred cadaveric duodenpancreatic pieces, and secondly was analyzed the case report of a patient with extrahepatic cholestasis and acute pancreatitis associated with pancreas divisum. The objective was to determinate the prevalence of the decompressive pancreatic system.
ResultsThere is a statistically significant difference between the dimensions of the accessory pancreatic duct and its relation with the permeability. In terms of pancreatic volumetry, the section corresponding to the upper third cephalic, neck, body and tail of the organ registers an average dimension of 21.99cm3, while the section of the last two thirds cephalic was 8.17cm3. Simultaneously, the patient reported presented a pancreatitis with amylase 280UI/l, lipase 173UI/l, associated with cholestasis. On the second day of hospitalization, endoscopic retrograde cholangiopancreatography was performed with a greater duodenal papillotomy and extraction of multiple common bile duct stones, evidencing a complete pancreas divisum.
DiscussionThe exposed case shows that pancreatitis, in presence of pancreas divisum, would have the denomination of a subclinical ventral pancreatitis.
ConclusionThe pancreas divisum would be a predictor of acute pancreatitis by losing the decompressive pancreatic protective mechanism.
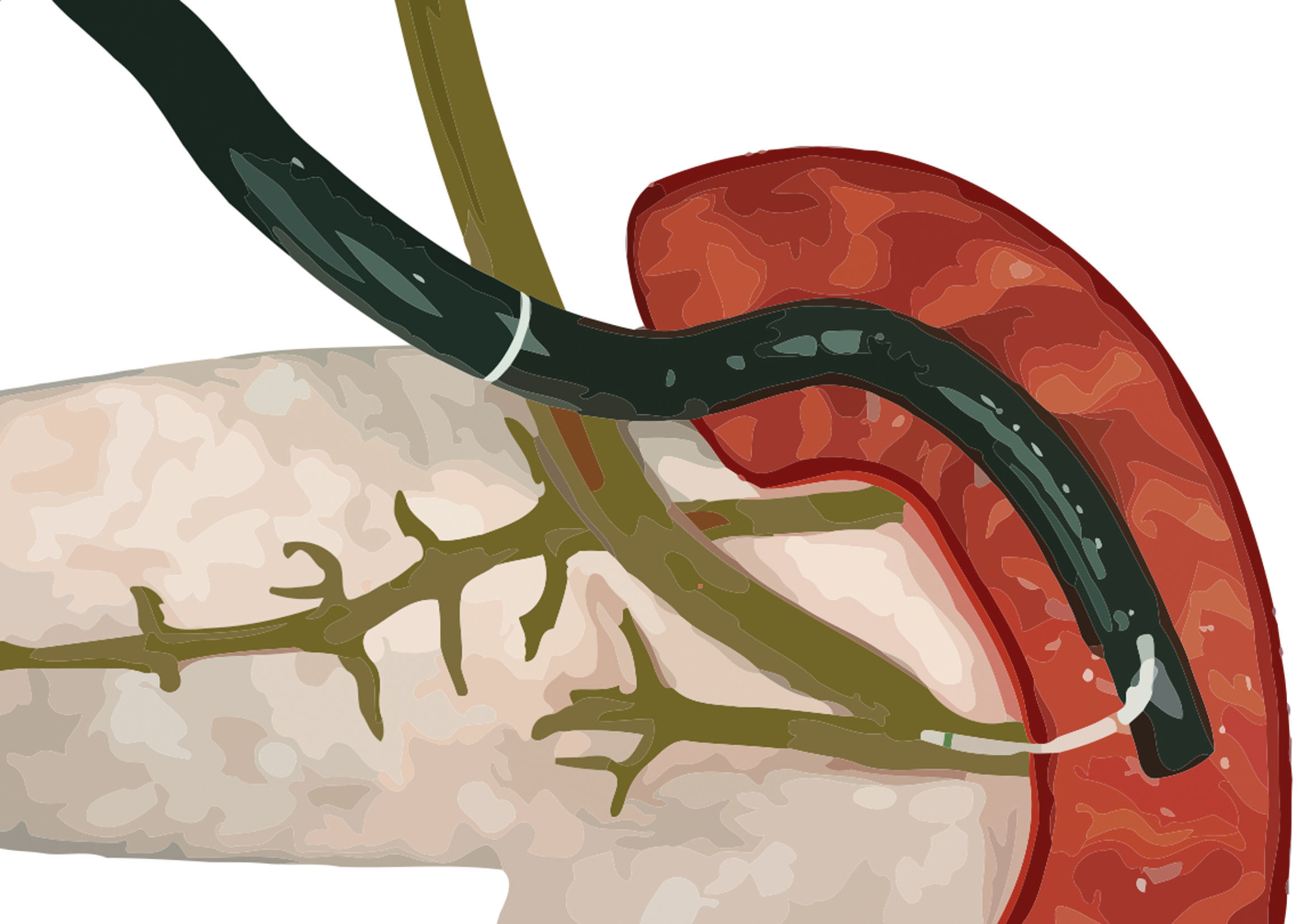
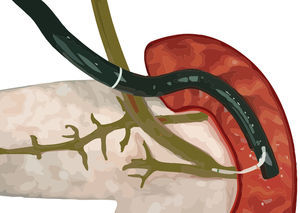
Las anomalías pancreáticas del desarrollo son un espectro de variaciones anatómicas, entre las que se destaca el páncreas divisum (PD) con una prevalencia del 5-10%1,2. Posee su origen embriológico en la falla de rotación y fusión de los esbozos pancreáticos ventral y dorsal durante la sexta y séptima semanas de gestación. Existen diversos tipos de PD de acuerdo con el grado de supresión ductal y comunicación entre ambos conductos pancreáticos; sin embargo, el paradigma médico centra el foco en el PD completo o clásico. En esta variante, el mayor volumen pancreático es drenado a través de la papila duodenal menor por el conducto pancreático accesorio (Santorini), mientras que la porción posteroinferior de la glándula, representada por el proceso uncinado, es drenado por el conducto pancreático principal (Wirsung) hacia el duodeno a través de la papila duodenal mayor, junto con la vía biliar común.
En este contexto anatómico las teorías etiopatogénicas vigentes de la pancreatitis biliar se tornan controversiales. Desde las primeras asociaciones entre pancreatitis y PD por Cotton3, Rösch et al.4 y Gregg5 hasta los últimos reportes bibliográficos de su implicancia clínica en la pancreatitis idiopática y autoinmune, la mayoría de los autores sostienen que no habría asociación directa entre ambas entidades. En algunos casos actuaría como un cofactor en presencia de mutaciones genéticas o como predisponente en caso de alteración del drenaje pancreático dorsal; en este último aspecto excluirían el origen biliar como etiología. De esta manera se plantea que aisladas otras etiologías la esfinterotomía de la papila duodenal menor sería la intervención terapéutica preceptiva.
No obstante, sostenemos la hipótesis de que el PD es un predictor determinante de pancreatitis debido a que se pierde el mecanismo descompresivo protector ductal pancreático y que el origen biliar continúa siendo la etiología prevalente, como sucede en la población carente de esta anomalía anatómica. Por lo tanto, el objetivo del estudio fue determinar la prevalencia del sistema descompresivo pancreático y analizar el reporte de caso de un paciente con PD sintomático resuelto por colangiopancreatografía retrógrada endoscópica (CPRE)
Materiales y métodoEn una primera fase se realizó un diseño de investigación no experimental de corte transversal sobre 100 piezas duodenopancreáticas cadavéricas (n=100), provenientes del Departamento de Anatomía de la Universidad de Buenos Aires, acorde con la declaración de STROBE de 2004. No se obtuvo el historial médico de los cadáveres.
En la segunda fase se analizó el reporte de caso de un paciente con cuadro clínico de colestasis extrahepática y pancreatitis aguda asociado a la portación de PD clásico por CPRE.
Fase I. Estudio morfológicoLas piezas duodenopancreáticas fueron disecadas con instrumental de microcirugía y magnificación óptica, exponiendo el sistema ductal pancreático principal y accesorio por su cara anterior. A su vez, se distinguieron ambas papilas duodenales a través de la apertura longitudinal de la porción descendente del duodeno. Se canalizó con catéter Angiocath® N.o 24 el conducto pancreático principal en su origen, próximo a la vía biliar común, efectuándose una inyección con contraste hidrosoluble y colorante (azul de metileno) en dirección pancreática. Se comprobó la repleción ductal y la permeabilidad del conducto pancreático accesorio según la presencia o ausencia de colorante por la papila duodenal menor. A su vez, se realizó una volumetría pancreática a partir de la medición de las dimensiones glandulares. Se midió por un lado el volumen pancreático de la sumatoria del tercio superior cefálico con el cuello, cuerpo y cola del órgano, y por otro el volumen de los dos tercios inferiores cefálicos que incluían el proceso uncinado. Las mediciones fueron efectuadas por el mismo operador con calibre manual-digital. Se registró fotográficamente los hallazgos. Se empleó recurso estadístico según la ley normal y pruebas no paramétricas (α=0,05) para el análisis de las variables estudiadas con el software SPSS.
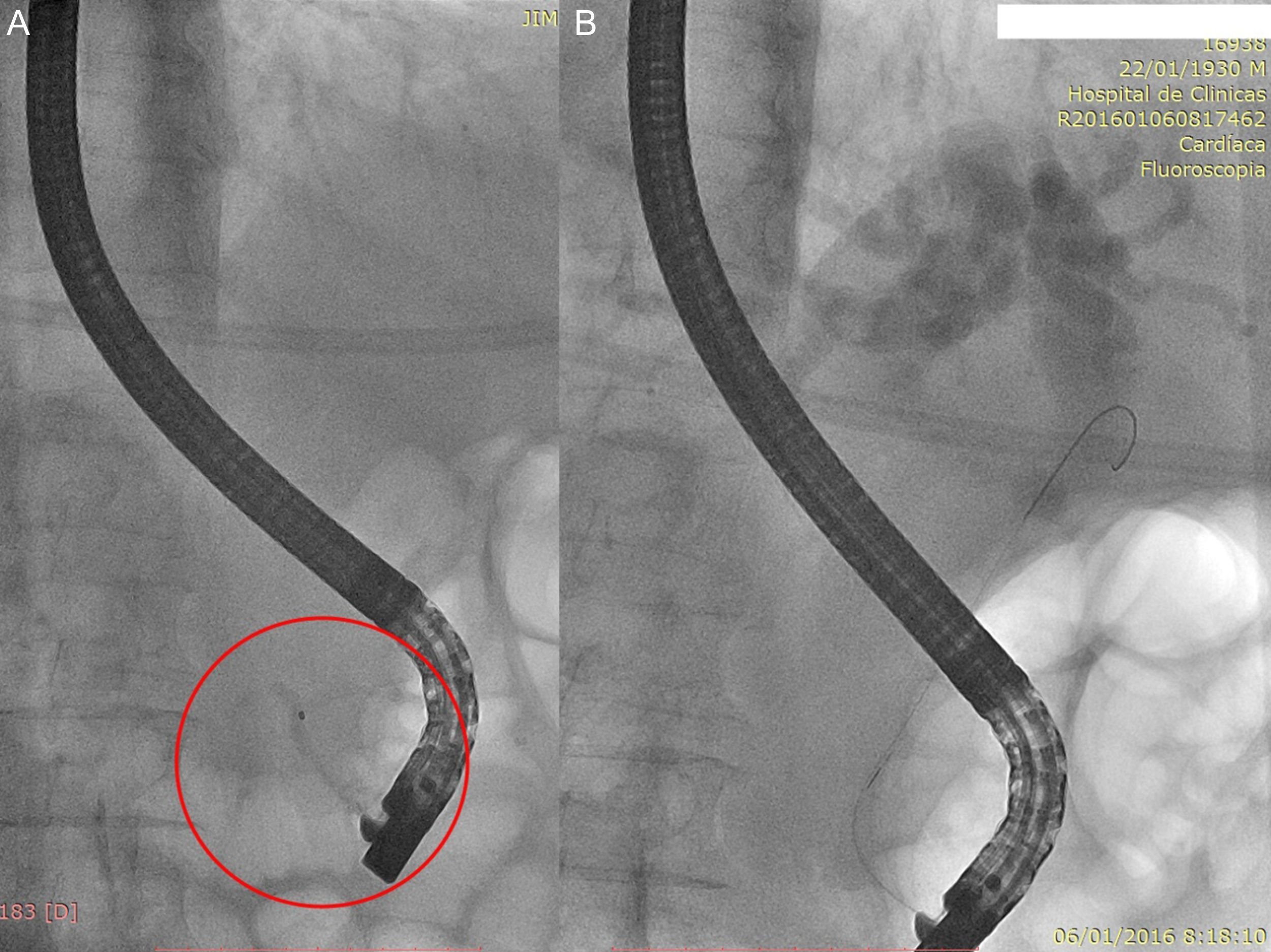
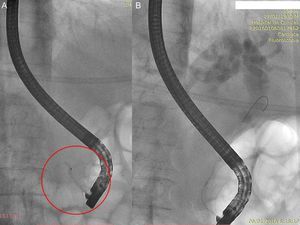
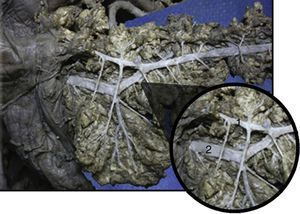
Fase II. Reporte de caso: historia clínicaPaciente masculino de 85 años, colecistectomizado en 1965, con epigastralgias leves (escala de categoría numérica de dolor [ECN] 3/10) de resolución espontánea. No presentó antecedentes de gastritis, consumo de antiinflamatorios no esteroides o corticoides ni trigliceridemia; sin historia de abuso de alcohol. Ingresó al servicio de urgencia del Hospital de Clínicas José de San Martín refiriendo dolor en hemiabdomen superior de un mes de evolución que aumentó de intensidad en la última semana (ECN 6/10), asociándose a coluria e hipocolia vinculadas a cefaleas, saciedad precoz, náuseas y vómitos sin registros febriles. No refirió pérdida de peso. Al examen físico presentaba ictericia de mucosas y dolor epigástrico sin defensa ni reacción peritoneal. Valores de laboratorio: leucocitos 7,8×103/μl; bilirrubina total 2,57mg/dl; bilirrubina directa 2,25mg/dl; fosfatasa alcalina 202UI/l; amilasa 280UI/l; lipasa 173UI/l. Los estudios complementarios revelaron a nivel ecográfico dilatación de la vía biliar extrahepática a predominio de colédoco distal (16mm), mientras que la tomografía informó dilatación de la vía biliar extrahepática y del Wirsung proximal. Al segundo día de internación se realizó CPRE con papilotomía duodenal mayor y extracción de múltiples cálculos coledocianos. Se evidenció durante el procedimiento la presencia de PD completo con conducto de Wirsung de 3,5cm, aproximadamente, con ramificaciones (figs. 1 y 2). Al cuarto día post-CPRE, presentó tolerancia digestiva por vía oral con abdomen indoloro y valores de laboratorio de bilirrubina total 0,91mg/dl; bilirrubina directa 0,73mg/dl; fosfatasa alcalina 137UI/l; amilasa 65UI/l; lipasa 102UI/l.
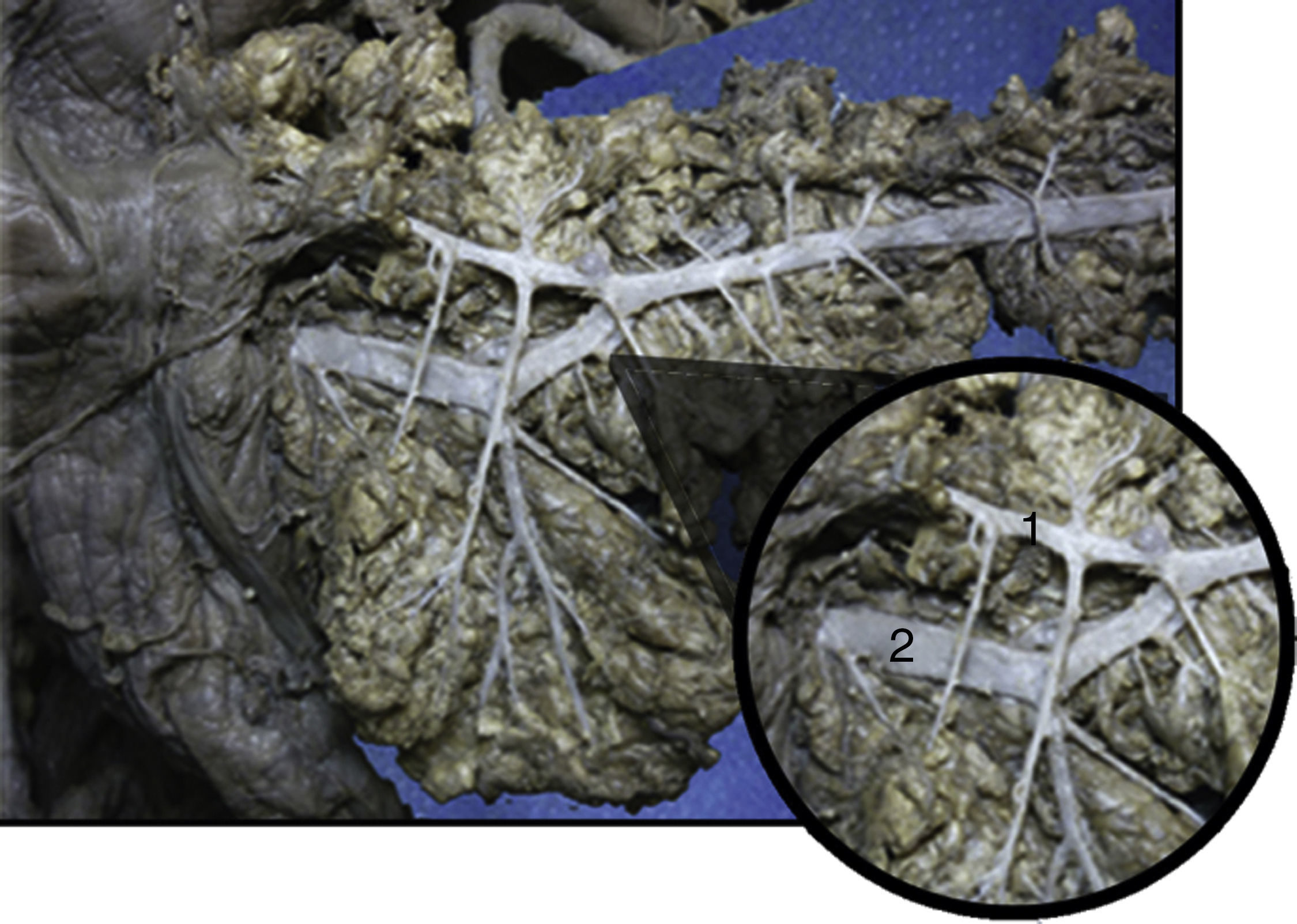
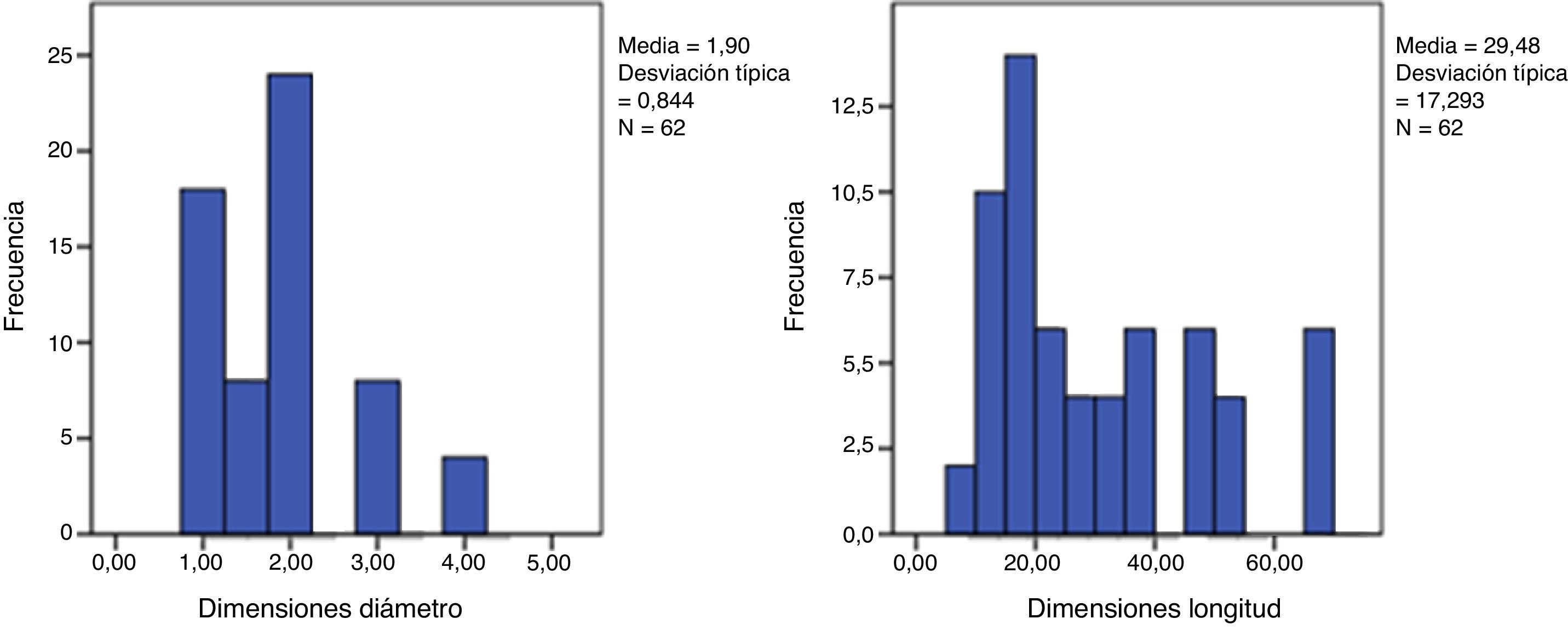
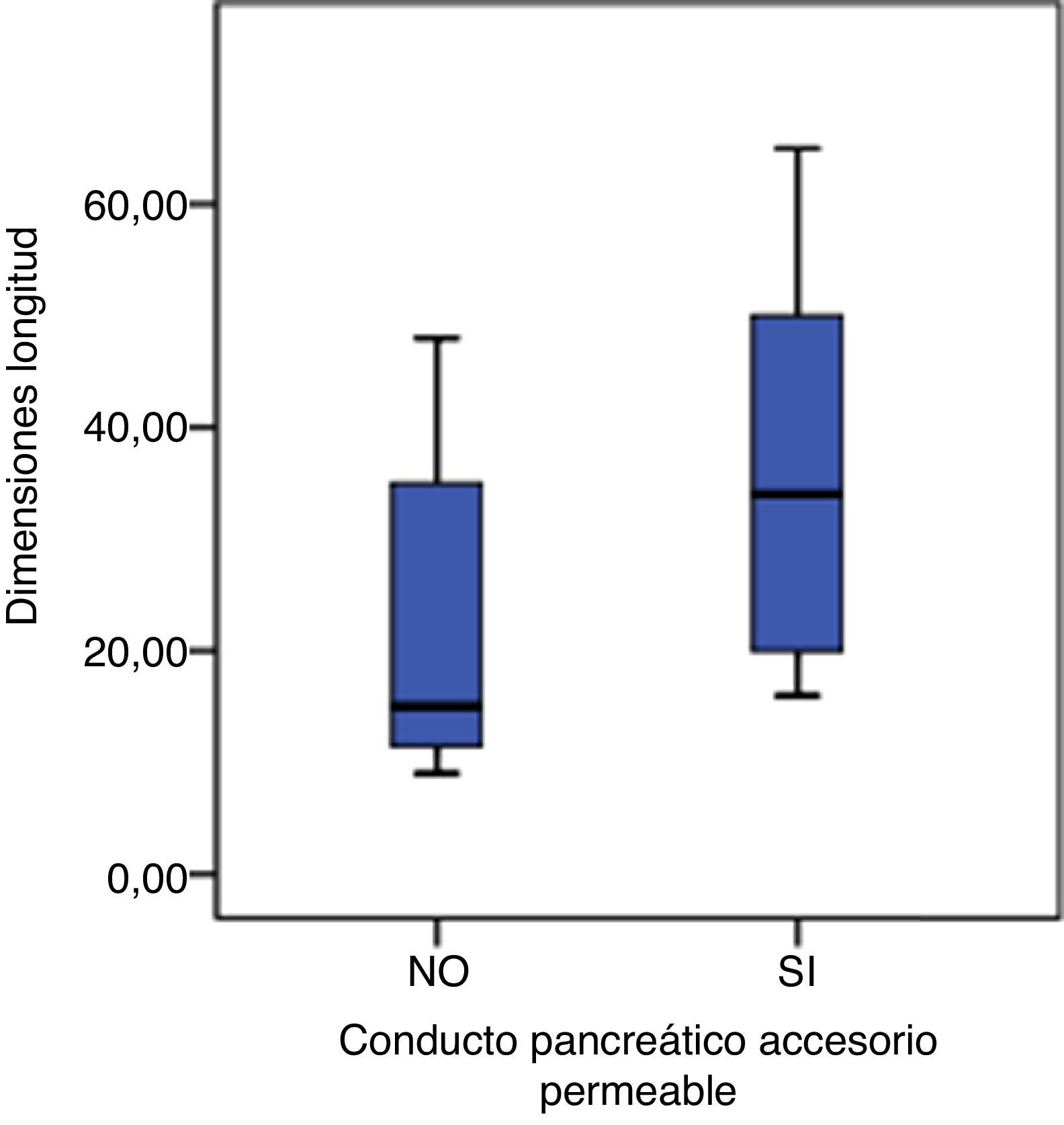
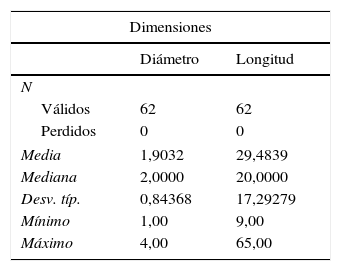
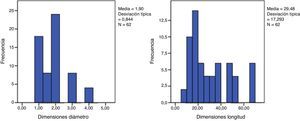
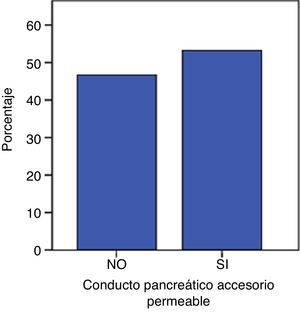
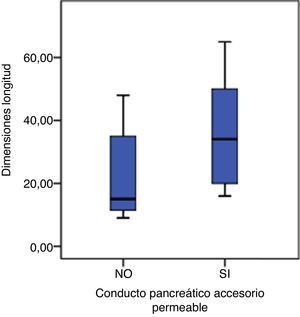
En las 100 piezas cadavéricas se encontró que el sistema ductal proveniente del esbozo pancreático ventral se encontraba comunicado con el sistema ductal dorsal, no registrándose la disposición de PD. Sin embargo, se observó diferentes grados de supresión ductal dorsal respecto a su continuidad hacia la papila duodenal menor. En el 62% de los casos documentados se halló el conducto pancreático accesorio con origen en la papila duodenal, con una longitud promedio, hasta su comunicación con la vertiente ventral, de 29,48mm y un diámetro de 1,9mm (tablas 1 y 2; figs. 3 y 4). El conducto de Santorini se encontró permeable en el 53,2% de los casos, evidenciándose por la positividad de la prueba hídrica con contraste y colorante (tabla 3; figs. 5 y 6).
Análisis de variables cuantitativas según resultados de la ley normal
| Análisis descriptivo | |
|---|---|
| Conducto pancreático accesorio permeable | Estadístico |
| Dimensiones diámetro | |
| No | |
| Mediana | 1,00 |
| Mínimo | 1,00 |
| Máximo | 2,00 |
| Amplitud intercuartil | 0,50 |
| Sí | |
| Mediana | 2,00 |
| Mínimo | 2,00 |
| Máximo | 4,00 |
| Amplitud intercuartil | 1,00 |
| Dimensiones longitud | |
| No | |
| Mediana | 15,00 |
| Mínimo | 9,00 |
| Máximo | 48,00 |
| Amplitud intercuartil | 23,50 |
| Sí | |
| Mediana | 34,00 |
| Mínimo | 16,00 |
| Máximo | 65,00 |
| Amplitud intercuartil | 30,00 |
Distribución de variables estadísticas según la ley normal: ninguna variable se distribuye según la normalidad
| Pruebas de normalidad | ||||||
|---|---|---|---|---|---|---|
| Conducto pancreático accesorio permeable | Kolmogorov-Smirnov | Shapiro-Wilk | ||||
| Estadístico | gl | Sig. | Estadístico | gl | Sig. | |
| Dimensiones diámetro | ||||||
| No | 0,379 | 29 | 0,000 | 0,692 | 29 | 0,000 |
| Sí | 0,388 | 33 | 0,000 | 0,679 | 33 | 0,000 |
| Dimensiones longitud | ||||||
| No | 0,271 | 29 | 0,000 | 0,793 | 29 | 0,000 |
| Sí | 0,174 | 33 | 0,012 | 0,876 | 33 | 0,001 |
El análisis de pruebas de comparación de grupos reveló que existe diferencia estadísticamente significativa entre las dimensiones del conducto pancreático accesorio y su relación con la permeabilidad (tabla 4).
Prueba no paramétrica de Mann-Whitney para valoración de la significación entre dimensiones y conducto pancreático permeable
| Rangos | |||
|---|---|---|---|
| Conducto pancreático accesorio permeable | N | Rango promedio | Suma de rangos |
| Dimensiones diámetro | |||
| No | 29 | 16,09 | 466,50 |
| Sí | 33 | 45,05 | 1.486,50 |
| Total | 62 | ||
| Dimensiones longitud | |||
| No | 29 | 21,12 | 612,50 |
| Sí | 33 | 40,62 | 1.340,50 |
| Total | 62 | ||
| Estadísticos de contraste (Santorini permeable) | |||
|---|---|---|---|
| U de Mann-Whitney | W de Wilcoxon | Z | Sig. asintót. (bilateral) |
| Diámetro | |||
| 31,500 | 466,500 | −6,599 | 0,000 |
| Longitud | |||
| 177,500 | 612,500 | −4,258 | 0,000 |
En cuanto a la volumetría pancreática, la sección correspondiente al tercio superior cefálico, cuello, cuerpo y cola del órgano registró una dimensión media de 21,99cm3 (20,15-22,55cm3), mientras que la sección de los dos tercios cefálicos restantes fue de 8,17cm3 (6,89-9,01cm3) (fig. 7).
DiscusiónEl PD fue documentado por primera vez en la literatura anatómica por el alemán Hyrtl en 1866 y representa la anomalía pancreática congénita más frecuente6. A su vez, Gregg5 llevó el concepto asociativo entre PD y pancreatitis al plano literario, quien junto con otros autores como Cotton3 y Carr-Locke7 sostenían este vínculo por el aumento de incidencia de PD en pancreatitis recurrente idiopática; por la obstrucción relativa o fisiológica de la papila duodenal menor con el consiguiente incremento de la presión endoluminal del conducto de Santorini evaluado por el ultrasound secretin test; por los cambios morfológicos en el conducto pancreático precedente, y por la mejoría sintomática luego de la papilotomía menor. Esto determinaba una asociación causal entre ambas entidades. Sumado a estas premisas, Bertin et al.1, Pezzilli8, y DiMagno y DiMagno9 agregan la necesidad de un cofactor para desencadenar el proceso inflamatorio, documentando la presencia de mutaciones en diferentes genes como el CFTR, regulador de la conductabilidad transmembrana de la fibrosis quística, el SPINK1 y el PRSS1 en paciente con PD y pancreatitis.
Uno de los puntos controversiales en esta asociación es la gran cantidad de publicaciones que valoran la prevalencia del PD en pacientes con pancreatitis, principalmente recurrente idiopática. Es así que argumentan que el 20-50% de los pacientes que cursan con esta enfermedad presentan esta alteración morfológica pancreática, así como también que el 72% de los portadores de PD presentan clínica de pancreatitis10. Takuma et al.11 complementan estos resultados describiendo que el 22,2% de los paciente portadores de PD terminan con cuadros de pancreatitis. Sin embargo, otros autores como Spicak et al.12 interpretan que el PD no juega un papel dominante en la pancreatitis, inclusive Stan-Luga et al.13 discriminan que el hallazgo de esta anomalía iría en contra del origen biliar por la independencia de ambos sistemas. Dejando de lado las argumentaciones que no validan la asociación de PD y pancreatitis, quienes la afirman ilustran que el origen del proceso se encuentra en el conducto pancreático accesorio.
El caso reportado en este artículo revela que el origen del proceso pancreático continúa siendo en la unión biliopancreática y que el fenómeno obedece a una pancreatitis ventral de origen biliar. Esto se debería a la pérdida del sistema ductal descompresivo, permeable en el 53,2%, que impediría la compensación de los incrementos de presión y flujo endoluminales14,15. Si bien existen casos reportados similares al descripto, ninguno justifica el mecanismo por el cual se produce como se efectúa en esta investigación16–18.
Por eso la interpretación del caso expuesto exhibe que la pancreatitis en presencia de PD tendría la denominación de una pancreatitis ventral producto de la falla en el manejo de presiones ductales donde el origen biliar, avalado por la resolución por papilotomía mayor en el caso precedente, sería la etiología a pesar de no contar con una prevalencia absoluta de esta enfermedad en paciente portadores de esta alteración. Por lo tanto, se puede plantear la hipótesis de que el PD sería un predictor determinante de la pancreatitis al perder el mecanismo descompresivo protector pancreático, el cual es más probable que se encuentre permeable a mayor dimensión ductal (p<0,05). A su vez, se considera que la manifestación sintomática es en su mayoría subclínica debido a que depende del volumen pancreático afectado, que en este caso representaría una dimensión 3 veces menor según nuestros hallazgos. Por lo que en verdad estaríamos en presencia de una enfermedad subdiagnosticada.
Es necesaria la realización de estudios prospectivos para confirmar la hipótesis asociativa planteada en el artículo precedente.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesNinguno.