La alopecia infantil es una afección poco frecuente en la consulta dermatológica pediátrica. Su etiología es variable según el grupo etario estudiado. El objetivo fue estudiar la causa de alopecia en niños en 2 hospitales pediátricos de referencia nacional en Chile.
Pacientes y métodoAnálisis descriptivo de registros clínicos del total de pacientes atendidos entre enero de 2007 y junio de 2010 en los Servicios de Dermatología de los Hospitales Roberto del Río y Luis Calvo Mackenna. Se incluyeron pacientes con diagnóstico clínico de alopecia.
ResultadosSe encontraron 345 registros clínicos, 179 varones (51,9%). La mediana de edad fue 72 meses. Los diagnósticos más prevalentes fueron alopecia areata (AA) (36,8%), tiña capitis (TC) (21%), nevo sebáceo (13,2%) y efluvio telógeno (8,7%). Según el grupo etario predominaron en recién nacidos: aplasia cutis y nevo sebáceo; en lactantes, preescolares y escolares: nevo sebáceo, AA y TC. En escolares se agregó tricotilomanía. En adolescentes nevo sebáceo, AA y efluvio telógeno. Se observó una correlación significativa entre AA con enfermedad autoinmune, enfermedad tiroidea, alteraciones ungueales, enfermedad psiquiátrica y síndrome de Down. En TC el agente etiológico más prevalente fue Microsporum Canis (86,6%). La tricotilomanía se correlacionó con enfermedad psiquiátrica significativamente.
ConclusionesLas principales causas de alopecia infantil fueron adquiridas y no cicatriciales. La etiología varía de acuerdo al grupo etario estudiado. Algunos tipos de alopecia infantil presentaron alta prevalencia de enfermedad psiquiátrica.
Childhood alopecia is a relative rare event in general paediatric dermatology practice. Hair loss in children may have multiple causes, and there are different types of alopecia according to age groups. The aim of the study was to describe the clinical and epidemiological profile of alopecia in children from two Chilean paediatric hospitals.
Patients and methodDescriptive analysis of clinical records of patients from the Dermatology Department of Roberto del Rio and Luis Calvo Mackenna Hospitals between January 2007 and June 2010. Patients with clinical diagnosis of alopecia were included.
ResultsA total of 345 clinical records were analysed, with 179 males (51.9%). The median age was 72 months. Overall, the most common diagnoses were: alopecia areata (AA), (36.8%), tinea capitis (TC), (21%), nevus sebaceous (13.2%), and tellogen effluvium (8.7%). According to age groups, in newborns, the most common causes were aplasia cutis and nevus sebaceous. In toddlers, pre-school and school children, the principal causes were nevus sebaceous, AA and TC. Trichotillomania was also significant in school children. In adolescents, nevus sebaceous, AA and tellogen effluvium were the most frequent diagnoses. AA was statistically associated with autoimmune disease, thyroid disease, nail disorder, psychiatric disease, and Down's syndrome. The most common aetiological agent in TC was M. canis (86.6%). Trichotillomania was also statistically associated to psychiatric disorders.
ConclusionsIn this study, the main causes of alopecia in children were acquired and non-scarring alopecia. In our results, the type of alopecia varies according to age group. Some types of childhood alopecia showed a close correlation to psychiatric disorders.
La alopecia puede provocar alteraciones considerables en la esfera psicológica y emocional de los pacientes afectados, provocando baja autoestima, sentimientos de vulnerabilidad y alteración de la imagen personal1–4.
La alopecia, de acuerdo a su modo de presentación, es posible clasificarla como congénita cuando se presenta desde el nacimiento, o adquirida si lo hace más tarde. Además, dependiendo de si existe o no un daño irreversible en el folículo piloso se define como cicatricial o no cicatricial5.
Los estudios de prevalencia de alopecia infantil muestran que la alopecia en niños se presenta en alrededor del 1% de la consulta de dermatología pediátrica, y aproximadamente el 90% de la alopecia infantil corresponde al tipo no cicatricial y adquirida, describiéndose como las causas más comunes la alopecia areata (AA), tiña capitis (TC) y tricotilomanía (TT)3,6. Las causas principales de alopecia pueden variar según edad, por ejemplo, un estudio realizado en EE. UU. encontró que en adolescentes predomina el efluvio telógeno (ET), alopecia androgenética y AA7. Otro estudio realizado en Nigeria muestra que la TC es la alopecia más frecuente en preescolares y escolares3. Si bien son múltiples los diagnósticos que pueden presentarse clínicamente como pérdida del pelo en niños, la mayoría de las investigaciones se han centrado en AA, siendo muy escasos los estudios de otras causas de alopecia infantil. En nuestro país no existen estudios de alopecia en niños. Esta investigación pretende realizar una caracterización de la alopecia infantil en la consulta dermatológica.
Pacientes y métodoDiseñoEstudio de tipo retrospectivo, de revisión de todas las fichas clínicas de pacientes cuyo diagnóstico consignado en el registro estadístico de atención diaria fue alopecia. Este estudio fue realizado en 2 hospitales pediátricos de referencia de la Región Metropolitana, el Hospital Roberto del Río y el Hospital Luis Calvo Mackenna.
PacientesSe define la población de estudio como el universo de los pacientes que consultaron en el servicio de dermatología de estos hospitales entre enero del año 2007 y junio del año 2010 con el diagnóstico consignado en la hoja de estadística de alopecia. Se incluyeron las fichas de los pacientes con diagnóstico de: alopecia, AA, alopecia cicatricial, alopecia por tracción, TT, ET, efluvio anágeno, síndrome de anágeno suelto, alopecia difusa, alopecia androgenética, aplasia cutis, alopecia triangular, TC, querion de Celso, tricodistrofia y nevo sebáceo de Jadassohn. Se consideraron criterios de exclusión: pacientes mayores de 15 años (edad límite de atención en estos hospitales), pacientes sin examen físico de alopecia de cuero cabelludo y pacientes con datos incompletos en la ficha clínica.
Se revisaron los registros clínicos identificándose variables de interés como: edad al diagnóstico, sexo, subtipo de alopecia, tiempo de evolución al diagnóstico, comorbilidades cutáneas y sistémicas, presencia de eritema, dolor, prurito y descamación, tratamiento efectuado y antecedentes familiares. Los diagnósticos incluidos como comorbilidad psiquiátrica fueron obtenidos de la evaluación psiquiátrica de los pacientes que estaba consignado como tal en la ficha clínica. Bajo el término comorbilidad autoinmune se incluyeron vitíligo, enfermedad celiaca, enfermedad tiroidea y mesenquimopatías.
Análisis estadísticoPara la descripción de la variable sexo se utilizaron medidas estadísticas de frecuencia (frecuencia absoluta y relativa) y para la variable edad se utilizó la mediana y estadísticas de frecuencia, las variables nominales causa de alopecia, sintomatología asociada y comorbilidad fueron descritas con medidas estadísticas de frecuencia (frecuencia absoluta y relativa). Para la correlación de las variables causa de alopecia (analizada como variable continua) y sexo se utiliza test exacto de Fisher. Para la correlación entre AA (dicotomizada en presencia/ausencia para efectos del análisis) con la variable comorbilidad se analizó a través de tablas de contingencia y odds ratio, aplicando test de Chi cuadrado utilizando el programa SPSS 11.5.
ResultadosSe revisaron un total de 470 registros, de los cuales se incluyeron 345 registros que reunían los criterios de inclusión, 179 varones (51,9%) y 166 mujeres (48,1%). La mediana de edad fue de 72 meses (0 a 180 meses), con una mediana de tiempo de evolución al diagnóstico de 3 meses (0 a 168 meses).
La mayor parte de los niños con alopecia presentó un patrón no cicatricial (97%) y adquirido (83%). En un 66,6% de los casos no existió presencia de eritema, dolor, prurito ni descamación. En el caso de los pacientes con alguna manifestación clínica se observó descamación en un 75,6% y eritema en el 34,7% de los síntomas, el prurito afectó a un 46,9% y dolor a un 7,8%.
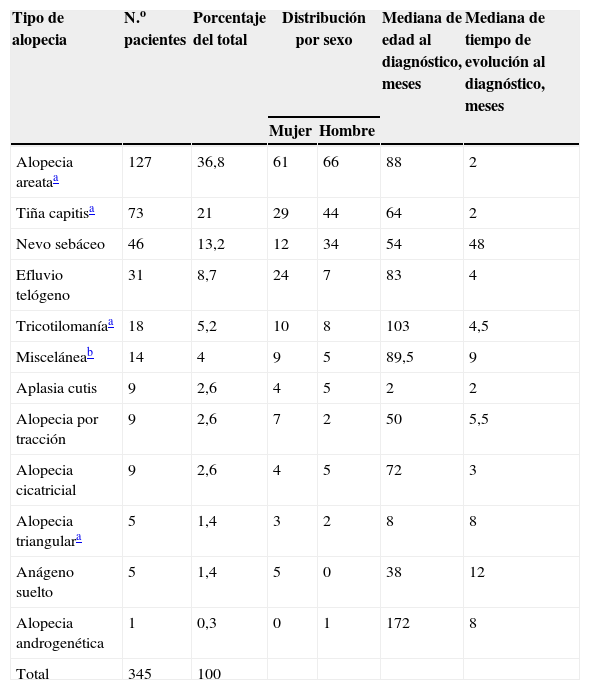
Se encontró una mayor prevalencia de AA, TC, nevo sebáceo y ET en el total de los casos que en conjunto reunieron el 80% de estos. Los diagnósticos clínicos por sexo y edad se muestran en la tabla 1. Se observaron más varones que mujeres con nevo sebáceo (p<0,002), por el contrario, se observaron más mujeres que varones con ET (p<0,011) y con síndrome de anágeno suelto (p<0,019). En el resto de las causas de alopecia no se observaron diferencias por sexo.
Prevalencia de Alopecias en Población Infantil, Distribuidos por Sexo y Edad
| Tipo de alopecia | N.o pacientes | Porcentaje del total | Distribución por sexo | Mediana de edad al diagnóstico, meses | Mediana de tiempo de evolución al diagnóstico, meses | |
|---|---|---|---|---|---|---|
| Mujer | Hombre | |||||
| Alopecia areataa | 127 | 36,8 | 61 | 66 | 88 | 2 |
| Tiña capitisa | 73 | 21 | 29 | 44 | 64 | 2 |
| Nevo sebáceo | 46 | 13,2 | 12 | 34 | 54 | 48 |
| Efluvio telógeno | 31 | 8,7 | 24 | 7 | 83 | 4 |
| Tricotilomaníaa | 18 | 5,2 | 10 | 8 | 103 | 4,5 |
| Misceláneab | 14 | 4 | 9 | 5 | 89,5 | 9 |
| Aplasia cutis | 9 | 2,6 | 4 | 5 | 2 | 2 |
| Alopecia por tracción | 9 | 2,6 | 7 | 2 | 50 | 5,5 |
| Alopecia cicatricial | 9 | 2,6 | 4 | 5 | 72 | 3 |
| Alopecia triangulara | 5 | 1,4 | 3 | 2 | 8 | 8 |
| Anágeno suelto | 5 | 1,4 | 5 | 0 | 38 | 12 |
| Alopecia androgenética | 1 | 0,3 | 0 | 1 | 172 | 8 |
| Total | 345 | 100 | ||||
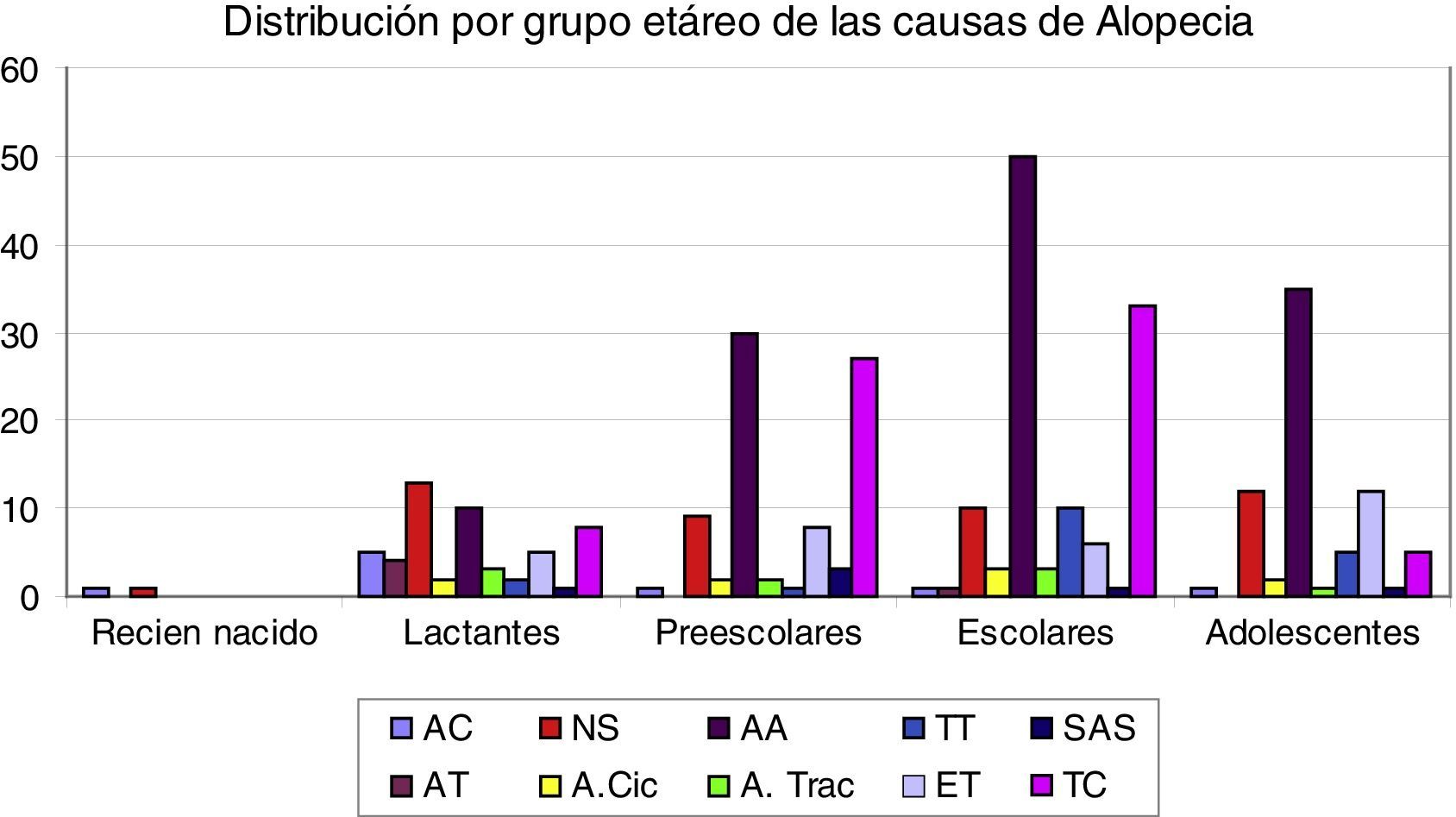
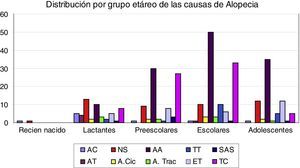
La distribución de las causas de consulta por alopecia por grupos etarios se muestra en la figura 1. En lactantes se observó una mayor presencia de nevo sebáceo (24%) seguido de AA (19%); en preescolares y escolares mayor presencia de AA (36% y 42%, respectivamente) seguida de TC (33% y 28%), y en adolescentes AA (47%) seguido de ET y nevo sebáceo (16%).
Distribución de las causas más frecuentes de alopecia, por grupo etario.AA: alopecia areata; AC: aplasia cutis; A. Cic: alopecia cicatricial; AGA: alopecia androgenética; AT: alopecia triangular; A. Trac: alopecia por tracción; ET: efluvio felógeno; NS: nevo sebáceo; SAS: síndrome anágeno suelto; TC: tiña capitis; TT: tricotilomanía.
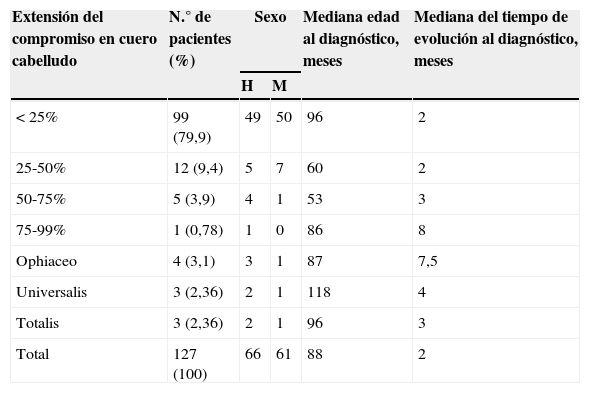
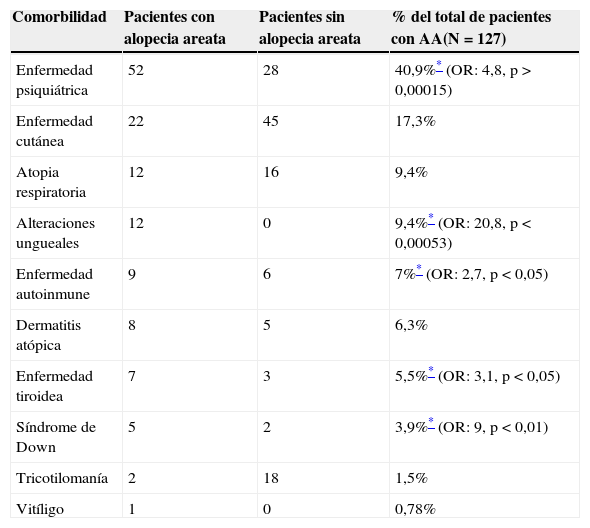
En AA el área comprometida del cuero cabelludo y el tiempo de evolución se presentan en la tabla 2. No se observaron diferencias significativas por sexo, existiendo predominio de alopecia menor al 50% del compromiso del cuero cabelludo. Como se observa en la tabla 3, dentro de las comorbilidades asociadas a AA que presentaron diferencias estadísticamente significativas respecto a los pacientes con otras causas de alopecia se encontraban: enfermedad autoinmune (OR: 2,7; IC: 1-7,8; p<0,05), enfermedad tiroidea (OR: 3,1; IC: 1-11; p<0,05), enfermedad psiquiátrica (OR: 4,8; IC: 2,8-8,1; p<0,00015), síndrome de Down (OR: 9; IC:1,04-77,9; p<0,01) y alteraciones ungueales (OR: 20,8; IC: 2,7-163,5; p<0,00053). La frecuencia de alteraciones ungueales fue la siguiente: pits en 6 casos, leuconiquia en 4 casos, estrías longitudinales en 3 casos, onicofagia en 2 casos, onicomadesis en un caso y onicolisis en un caso. En 5 pacientes existía más de una alteración ungueal. En relación con la comorbilidad psiquiátrica de pacientes con AA, se encontró que la presencia de déficit atencional/hiperactividad (12%), trastorno ansioso (10%) y del ánimo (7%) son los más prevalentes. No se observaron diferencias por sexo en cuanto a comorbilidad psiquiátrica. El 12,6% de los pacientes con AA tuvo un episodio previo, el cual se presentó con un tiempo promedio de 24 meses antes del último episodio. En el caso de los pacientes con AA severa, un 25% tuvo un episodio previo. Un 4,7% de los pacientes con AA refirió antecedentes familiares de AA.
Extensión de alopecia areata y distribución por sexo
| Extensión del compromiso en cuero cabelludo | N.° de pacientes (%) | Sexo | Mediana edad al diagnóstico, meses | Mediana del tiempo de evolución al diagnóstico, meses | |
|---|---|---|---|---|---|
| H | M | ||||
| <25% | 99 (79,9) | 49 | 50 | 96 | 2 |
| 25-50% | 12 (9,4) | 5 | 7 | 60 | 2 |
| 50-75% | 5 (3,9) | 4 | 1 | 53 | 3 |
| 75-99% | 1 (0,78) | 1 | 0 | 86 | 8 |
| Ophiaceo | 4 (3,1) | 3 | 1 | 87 | 7,5 |
| Universalis | 3 (2,36) | 2 | 1 | 118 | 4 |
| Totalis | 3 (2,36) | 2 | 1 | 96 | 3 |
| Total | 127 (100) | 66 | 61 | 88 | 2 |
Comorbilidades en pacientes con alopecia areata
| Comorbilidad | Pacientes con alopecia areata | Pacientes sin alopecia areata | % del total de pacientes con AA(N=127) |
|---|---|---|---|
| Enfermedad psiquiátrica | 52 | 28 | 40,9%* (OR: 4,8, p>0,00015) |
| Enfermedad cutánea | 22 | 45 | 17,3% |
| Atopia respiratoria | 12 | 16 | 9,4% |
| Alteraciones ungueales | 12 | 0 | 9,4%* (OR: 20,8, p<0,00053) |
| Enfermedad autoinmune | 9 | 6 | 7%* (OR: 2,7, p<0,05) |
| Dermatitis atópica | 8 | 5 | 6,3% |
| Enfermedad tiroidea | 7 | 3 | 5,5%* (OR: 3,1, p<0,05) |
| Síndrome de Down | 5 | 2 | 3,9%* (OR: 9, p<0,01) |
| Tricotilomanía | 2 | 18 | 1,5% |
| Vitíligo | 1 | 0 | 0,78% |
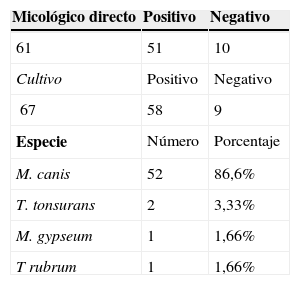
De los 73 pacientes encontrados un 98,7% tenía alguna manifestación en el momento del diagnóstico (descamación, prurito, eritema o dolor), el resto de los pacientes solo presentaba alopecia. Se solicitó estudio micológico directo a 61 pacientes y cultivo de hongos a 67 pacientes con TC, destacando que el 86,6% fue positivo para M. Canis (tabla 4).
Nevo sebáceoDe los 46 pacientes a quienes se les diagnosticó nevo sebáceo el 84,7% eran asintomáticos en el momento del diagnóstico; de estos pacientes un 54% fue intervenido quirúrgicamente, el resto solo se observó.
TricotilomaníaDe los 18 pacientes que se diagnosticaron con TT un 88,8% no presentó eritema, descamación, dolor ni prurito. El 50% de estos pacientes presentaba comorbilidad psiquiátrica asociada, en relación con pacientes sin TT (p<0,006). Dentro de estas comorbilidades se encontró trastorno ansioso en 7 niños (38,8%), trastorno de hiperactividad en 4 casos (22,2%), disfunción familiar, violencia intrafamiliar y oposicionista desafiante cada uno en un paciente.
Los 5 casos encontrados de síndrome de anágeno suelto eran de sexo femenino, asintomáticos. Todos los casos tenían tricograma que mostraba un 100% de cabellos en anágeno.
Se encontró solo un caso de alopecia androgenética, de sexo masculino, de 14 años de edad, con el antecedente familiar del padre con alopecia androgenética.
DiscusiónEl perfil de alopecia infantil encontrado en este estudio corresponde en su mayoría a alopecias adquiridas y no cicatriciales, concordante con lo descrito en niños en estudios internacionales3,8. Las principales causas encontradas fueron AA (36,8%), tiña capitis (21%), nevo sebáceo (13,2%) y ET (8,7%).
La AA en algunos estudios asiáticos muestra una mayor prevalencia en sexo femenino2,9,10 y en otros en el sexo masculino1,11; en nuestro estudio, sin embargo, no existió diferencias significativas por sexo. La mediana de edad de presentación fue 7 años, con el 68% de los casos entre los 5 y 15 años, similar a lo encontrado por Sharma et al.12, mayor a lo descrito en estudios más recientes que presentan edades cercanas a los 5 años8,12,13 y menor al estudio en China de Xiao, donde ocurre a los 10 años11.
En relación con la severidad de AA, el 87,4% de los pacientes presentó alopecia menor al 50% de la superficie del cuero cabelludo similar al estudio de Nanda et al.9, cifra mayor a la publicada por estudios de Nigeria e India con un 74,2% y 83,1% respectivamente3,12. Esta diferencia podría estar influenciada por el tiempo transcurrido desde la aparición de la lesión hasta la consulta dermatológica, que en este estudio fue de 2 meses en promedio. Por otro lado, el 12,6% correspondió a alopecia severa, y en este grupo existió un predominio en el sexo masculino, en un rango de 3,3:1, lo que concuerda con algunos estudios1,11, aunque otros trabajos no muestran esta tendencia2,12.
El antecedente familiar de AA se encontró en el 4,7%, coincidente con el estudio de Tan et al.2, pero inferior a lo mostrado en otros estudios donde oscila entre un 8% y un 24%10,13,14, llegando en el estudio de Kuwait al 51,6%9, lo que podría ser explicado por la alta consanguinidad de los padres en otros países.
La presencia de alguna enfermedad autoinmune afectó al 7% de los pacientes con AA, de los cuales la enfermedad tiroidea correspondió al 5,5%. Alteración de anticuerpos antitiroideos se presentó en un 11,1% de los pacientes a los que se les midió anticuerpos. En estudios internacionales se estiman cifras de 11,4% de alteraciones tiroideas y 25,7% de alteraciones en los anticuerpos antitiroideos15,16. Estas diferencias podrían deberse a la dificultad de estudiar mediante exámenes de laboratorio a nuestros pacientes, donde solo se estudió al 37,8% de estos con TSH y al 14,1% con anticuerpos.
La prevalencia de vitilígo fue rara (0,78%), similar al estudio de China11, muy por debajo de otros estudios en India1,12,15, mientras que hubo significativa prevalencia de síndrome de Down (3,9%), superior a lo reportado por Nanda et al., con un 1,4% de los casos9.
La presencia de atopia se describe entre el 10 y 50% de los pacientes con AA1,15,17, encontrando en nuestro trabajo un 15,7%, cifra que no fue estadísticamente significativa comparándola con el resto de los pacientes con alopecia no areata.
La AA totalis y universalis son las alopecias que frecuentemente se han asociado a enfermedad tiroidea y dermatitis atópica7, observándose en nuestro estudio la presencia de 33% para estas comorbilidades en la unión de estos subgrupos. Dentro de este grupo, los pacientes que tienen el peor pronóstico son los de inicio antes de la adolescencia, con antecedentes familiares de AA y presencia de comorbilidades antes descritas18. Alteraciones ungueales se evidenciaron en el 9,4% de los casos, valor similar al encontrado en el estudio de Singapur2, pero menor a lo descrito en otros estudios con cifras cercanas al 30%9,10,12. Al ser un estudio restrospectivo, puede ser que las manifestaciones ungueales sean subestimadas por no ser consignadas. En la literatura se describen como alteraciones más prevalentes los pits, traquioniquia, estrías longitudinales y leuconiquia punctata, siendo los 2 primeros cambios más específicos de AA en comparación con controles sanos19.
En nuestro estudio se encontró una importante asociación de prevalencia entre morbilidad psiquiátrica en AA (40,9% de los casos), tomando en consideración tanto los diagnósticos psiquiátricos como los estresores psicosociales (estos últimos pertenecientes al eje V del CIE-10, versión multiaxial para niños y adolescentes). Entre los estresores psicosociales destacaron la disfunción familiar (5,5%) y los problemas escolares (3,9%). Un estudio describe que pacientes con AA tienen mayor comorbilidad psiquiátrica, principalmente trastorno adaptativo, trastorno ansioso, trastorno del ánimo y agresividad20. En nuestra serie el déficit atencional con hiperactividad fue lo más prevalente (9,4%), seguido del trastorno ansioso (7,8%) y del trastorno del ánimo (5,5%).
En relación con los hallazgos en tiña capitis, no existieron diferencias por sexo, presentando una mediana de edad al diagnóstico de 5,3 años, similar a lo reportado en Paraguay y Nepal21,22. Casi todos los casos fueron sintomáticos, destacando la descamación y el prurito como manifestaciones asociadas. Microsporum canis fue encontrado en el 86,6% de los casos, especie más prevalente en Chile21 con casos aislados de Trichopyton tonsurans, M. gypseum y T. rubrum. En Estados Unidos se considera el T. rubrum como el primer agente etiológico seguido de M canis4. Es importante mencionar que nuestros resultados de prevalencia real de la TC podrían estar subestimada, ya que esta podría ser también tratada en centros de salud primaria.
Entre los casos de NS encontramos una diferencia estadísticamente significativa por sexo a favor de los varones, presentándose en un rango de 2,8:1, lo que difiere de otros estudios, sin hallazgos de tumores concomitantes23–25.
El ET fue la cuarta causa más común de alopecia en nuestro estudio, con un 8,9% del total, similar a lo descrito por Nnoruka et al.3. La edad de inicio de nuestros pacientes fue de 7 años, con mayor prevalencia femenina en un rango de 3,4:1, lo que concuerda con otros estudios7.
La TT en nuestro estudio no mostró diferencias por sexo, al igual que en el estudio de Tay26, aun cuando hay estudios que revelan mayor prevalencia en mujeres27,28. La edad media de presentación fue de 8 años, menor a lo descrito por Tay, donde fue de 11 años. La mediana de tiempo de evolución al diagnóstico fue de 4,5 meses, similar a lo encontrado por el estudio de Tay et al.26. En niños y adolescentes se asocia entre un 30% a 75% con comorbilidades del eje 1, tales como desórdenes ansiosos y del ánimo26,27; en nuestro estudio la comorbilidad psiquiátrica alcanzó un 50% de los casos.
Se encontró síndrome de anágeno suelto en el 1,4%, inferior a lo publicado por Cantatore-Francis et al.29. Su edad de presentación más común fue de 3,1 años y solamente se presentó en niñas, al igual que lo descrito en otros estudios28–30.
En conclusión, fue posible establecer las diferentes proporciones de diagnóstico de alopecia infantil de aquellos pacientes que consultan en centros de referencia de dermatología pediátrica, diferenciándolas por grupo etario. Se constató, además, asociación entre la presencia de comorbilidad psiquiátrica con AA y TT. Dentro de las limitaciones de nuestro estudio se encuentra que es un trabajo retrospectivo basado en revisión de fichas clínicas; que el grupo etario de adolescentes solo fue contemplado hasta los 15 años, pues en Chile los hospitales pediátricos atienden solamente a menores de 15 años; el origen étnico no fue un factor considerado en este estudio; por otro lado, los pacientes con alopecia infecciosa pueden ser también tratados en atención primaria, lo que lleva a una subestimación de este tipo de alopecia en los hospitales estudiados.
Conflicto de interesesEste trabajo cumple con los requisitos sobre consentimiento/asentimiento informado, comité de ética, financiación, estudios animales y sobre la ausencia de conflicto de intereses según corresponda.