Identificar si los biomarcadores cortisol salival y alfa-amilasa salival son adecuados para evaluar el grado de estrés de pacientes que presentan EP.
MétodoRevisión sistemática realizada de estudios publicados en diferentes bases de datos sobre el estrés y ambos biomarcadores. Se analizaron 17 estudios mayoritariamente analíticos: cuasiexperimentales y casos-controles. La población comprendía las edades de entre 20 y 80 años, aproximadamente, y el reparto entre sexos fue bastante equitativo.
ResultadosLos resultados obtenidos en cuanto a biomarcadores fueron distintos de los esperados, teóricamente se relaciona más al cortisol como biomarcador del estrés, pero en esta revisión bibliográfica se concluye que la alfa-amilasa salival es un biomarcador más fiable para la medición del estrés. Es un biomarcador menos estudiado pero un gran candidato para líneas futuras de investigación.
Además, se ha demostrado que el estrés favorece la neurodegeneración, siendo especialmente sensible el sistema dopaminérgico.
ConclusionesTanto la alfa-amilasa salival como el cortisol son biomarcadores válidos para la medición del estrés en pacientes con EP, siendo más fiable la alfa-amilasa salival. Es fundamental reducir los niveles de estrés en pacientes con EP tanto para reducir su incidencia y su sintomatología prodrómica y motora, como para poder reducir los tratamientos farmacológicos sustituyéndolos por terapias antiestrés.
To determine whether salivary alpha-amylase and salivary cortisol are adequate as biomarkers to evaluate the level of stress in patients suffering from Parkinson's disease.
MethodA systematic review was carried out on studies published in different databases on stress and both biomarkers. Seventeen analytical studies, including quasi-experimental and case-controls, were analysed. The population age was between 20 and 80 years, approximately, and the distribution between genders was fairly equitable.
ResultsThe results obtained in terms of biomarkers were different from those expected. Theoretically, cortisol is more associated with biomarker of stress, but in this literature review it is concluded that salivary alpha-amylase was a more reliable biomarker for stress measurement. This is a less studied biomarker, but a great candidate for future research.
In addition, stress has been shown to favour neurodegeneration, with the dopaminergic system being especially sensitive.
ConclusionsBoth salivary alpha-amylase and cortisol are valid biomarkers for stress measurement in patients with PD, with salivary alpha-amylase being more reliable. It is essential to reduce stress levels in patients with PD in order to reduce its incidence, as well as the prodromal and motor symptoms, and to reduce pharmacological treatments by replacing them with anti-stress therapies.
La enfermedad de Parkinson (EP) fue descrita en 1817 por el médico inglés James Parkinson (1755-1824) a la que llamó «parálisis agitante». La describió como un trastorno neurológico caracterizado por «movimientos temblorosos involuntarios» acompañados de una disminución de la potencia muscular, encorvación del tronco hacia delante y modificación en la marcha. Además, consideró la ausencia de lesiones en los órganos de los sentidos e intelecto. Parkinson basó su explicación en una alteración del funcionamiento de la médula espinal, a pesar de que pasó por alto una de las principales características de la enfermedad, la rigidez1.
Esta definición fue modificada por Jean-Martin Charcot, pero ambas definiciones son descriptivas y solo se basan en los síntomas motores. Durante mucho tiempo, siguió existiendo esta visión de la enfermedad como una enfermedad puramente motora, caracterizada por: bradicinesia, rigidez, temblor y alteración de los reflejos posturales. Con el paso del tiempo, se fueron descubriendo otro tipo de síntomas motores, tales como el enlentecimiento de la marcha, la micrografía o la hipomimia facial2.
Es una enfermedad neurodegenerativa que afecta a las neuronas dopaminérgicas que se encuentran en los ganglios basales de la sustancia negra del cerebro humano. Estas neuronas son las encargadas de transmitir la información del movimiento a todo el cuerpo humano utilizando como neurotransmisor la dopamina en el sistema nervioso central (SNC)3.
En España, se han realizado gran cantidad de estudios acerca de la prevalencia de la EP, tanto transversales como «puerta a puerta», obteniendo datos que oscilan entre los 150 y 1.500 por cada 105 habitantes, obteniendo una prevalencia media de 682,2 por cada 105 habitantes. Estos estudios muestran un aumento de la prevalencia a partir de los 70 años; solo se ha realizado un estudio en España (León) en pacientes menores de 60 años, el de Errea et al.4. Este estudio obtiene una prevalencia de 3,3 por cada 105 habitantes menores de 40 años y de 16,5 por cada 105 habitantes en menores de 50 años. Además, existe un estudio retrospectivo transversal multicéntrico que determina que el sexo más afectado, siendo menor de 40 años, es el masculino.
Cortisol. También denominada hormona esteroidea o glucocorticoide. Las glándulas suprarrenales se encuentran en la parte superior de ambos riñones y se encargan de la producción de hormonas. La zona fascicular de la corteza (parte externa) es la encargada de producir cortisol (aproximadamente, 10-20mg diarios) que es liberada como respuesta al estrés. Además, la hormona adenocorticotropa (ACTH) es la que regula su producción a nivel de la hipófisis.
Ante un factor estresor, el hipotálamo produce el factor liberador de corticotropina, que a su vez estimula a la hipófisis para que produzca ACTH, que estimula la secreción de cortisol por parte de la glándula suprarrenal5.
Tiene efectos sobre el metabolismo de los hidratos de carbono, lípidos y proteínas. Además, regula la función inmunitaria, circulatoria y renal, influye sobre el crecimiento, el metabolismo óseo y la actividad del SNC6.
Se estima que en situaciones de estrés puede aumentar hasta 10 veces su producción, aumentando principalmente la contractilidad cardíaca, el gasto cardíaco, la sensibilidad de los efectos constrictores de las catecolaminas y otras hormonas vasoconstrictoras, la capacidad de esfuerzo de los músculos esqueléticos y la capacidad de movilizar depósitos de energía7.
El estrés es capaz de producir desde lesiones leves y reversibles hasta muerte neuronal. El exceso de glucocorticoides provoca alteraciones especialmente en el hipocampo, zona encargada en gran parte del aprendizaje y la memoria. Se ha demostrado que el estrés puede producir en el cerebro: atrofia dendrítica, neurotoxicidad y exacerbación de otras lesiones con daño neuronal. Debido al gran número de sinapsis que existen en las neuronas dopaminérgicas y nigroestriadas, son más vulnerables al estrés, o cualquier otro tipo de elemento nocivo, ya sea un tóxico o una proteína anómala8.
El estrés psicosocial crónico provoca unas nuevas adaptaciones del comportamiento que se asocian a la neuroinflamación y deterioro de la plasticidad. Esta inflamación afecta al hipocampo deteriorando la neuroplasticidad, el comportamiento y la cognición9.
Así pues, el estrés crónico provoca muerte neuronal y cambios en el hipocampo, por tanto, los pacientes afectados por EP y estrés sufrirán una muerte neuronal dopaminérgica más acelerada y alteraciones a nivel del hipocampo, deteriorando así sus funciones principales mencionadas anteriormente.
Amilasa. La amilasa es una metaloenzima producida por las glándulas salivales que se encarga de hidrolizar el almidón para obtener dextrinas, maltosa, isomaltosa y glucosa. Su actividad comienza al inicio de la digestión en la cavidad oral. La producción de saliva es controlada tanto por el sistema nervioso simpático (SNS) como por el sistema nervioso parasimpático, pudiendo modificarse la cantidad producida por factores como el tabaco, el grado de hidratación, el alcohol, la ingesta de hidratos de carbono, la cafeína y el ejercicio físico10.
La alfa-amilasa salival es un marcador biológico del estrés (independientemente de cual sea su causa), ya que muestra la actividad del sistema simpático-adreno-medular. Las glándulas salivales tienen un elevado número de receptores betaadrenérgicos estimulados por la norepirefrina, de manera que la amilasa se regula por catecolaminas como la norepirefrina, aumentando su nivel cuando el paciente sufre estrés. Por tanto, existiría un aumento de norepirefrina en plasma11.
Ante la exposición a estrés psicológico existe un aumento de la producción de amilasa, que además está asociado a un incremento del ritmo cardíaco, lo que indica una activación del SNS, que se trata con la administración de bloqueadores betaadrenérgicos, reduciendo estos incrementos de amilasa introducida por estrés. Además, se ha demostrado este aumento de amilasa por estrés administrando estimulantes del SNS12.
El objetivo principal es investigar el fenómeno del estrés relacionado con el cortisol y la amilasa en pacientes que presentan EP.
El objetivo específico es describir los estudios más relevantes que investigan el tema del estrés relacionado con la EP, tanto como factor desencadenante como factor de empeoramiento de la sintomatología, relacionado además con el cortisol y con la alfa-amilasa salivales.
MétodoSe trata de una revisión sistemática sobre el estrés relacionado con la EP y la importancia de la medición de niveles de cortisol y amilasa como biomarcadores específicos.
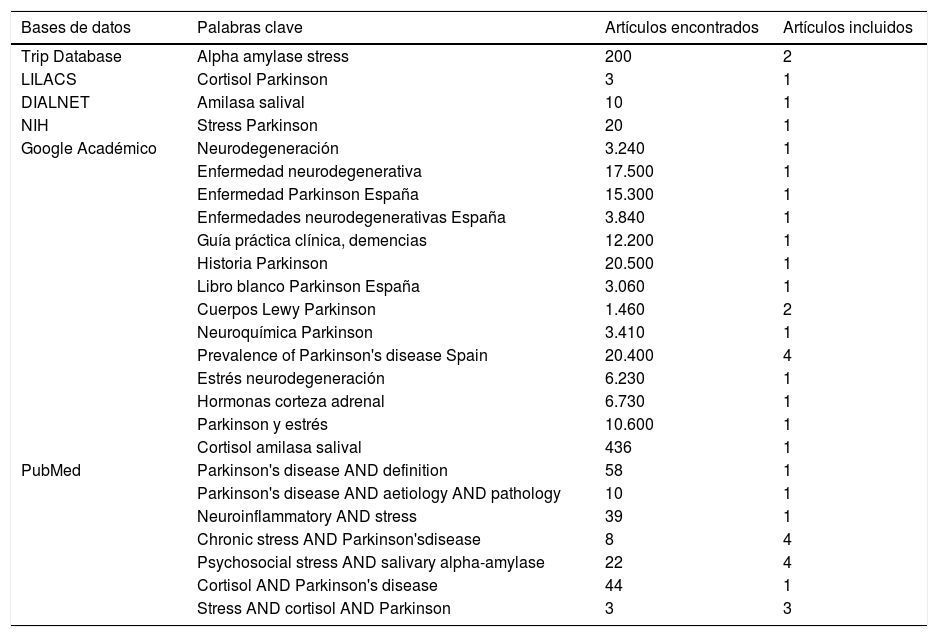
La búsqueda se efectuó entre julio del 2017 y abril del 2018. Se realizó una búsqueda de literatura científica en las bases de datos: PubMed, National Institutes of Health (NIH), Literatura Latinoamericana y del Caribe en Ciencias de la Salud (LILACS), Dialnet y Trip Database.
En la tabla 1 se recoge la estrategia de búsqueda y los términos utilizados en la misma: «stress», «chronic stress», «psychosocial stress», «Parkinson's disease», «salivary alpha-amylase», «cortisol», «enfermedad neurodegenerativa».
Resultados de la búsqueda bibliográfica
| Bases de datos | Palabras clave | Artículos encontrados | Artículos incluidos |
|---|---|---|---|
| Trip Database | Alpha amylase stress | 200 | 2 |
| LILACS | Cortisol Parkinson | 3 | 1 |
| DIALNET | Amilasa salival | 10 | 1 |
| NIH | Stress Parkinson | 20 | 1 |
| Google Académico | Neurodegeneración | 3.240 | 1 |
| Enfermedad neurodegenerativa | 17.500 | 1 | |
| Enfermedad Parkinson España | 15.300 | 1 | |
| Enfermedades neurodegenerativas España | 3.840 | 1 | |
| Guía práctica clínica, demencias | 12.200 | 1 | |
| Historia Parkinson | 20.500 | 1 | |
| Libro blanco Parkinson España | 3.060 | 1 | |
| Cuerpos Lewy Parkinson | 1.460 | 2 | |
| Neuroquímica Parkinson | 3.410 | 1 | |
| Prevalence of Parkinson's disease Spain | 20.400 | 4 | |
| Estrés neurodegeneración | 6.230 | 1 | |
| Hormonas corteza adrenal | 6.730 | 1 | |
| Parkinson y estrés | 10.600 | 1 | |
| Cortisol amilasa salival | 436 | 1 | |
| PubMed | Parkinson's disease AND definition | 58 | 1 |
| Parkinson's disease AND aetiology AND pathology | 10 | 1 | |
| Neuroinflammatory AND stress | 39 | 1 | |
| Chronic stress AND Parkinson'sdisease | 8 | 4 | |
| Psychosocial stress AND salivary alpha-amylase | 22 | 4 | |
| Cortisol AND Parkinson's disease | 44 | 1 | |
| Stress AND cortisol AND Parkinson | 3 | 3 |
Fuente: elaboración propia.
Estudios en castellano e inglés.
Estudios con el consentimiento informado de los pacientes. Estudios aprobados por un comité ético.
Estudios que incluyesen una o ambas hormonas, relacionadas o no con la EP, pero sí siempre con el estrés.
Estudios comprendidos entre los años 2006 y 2017, priorizando la búsqueda en los estudios más recientes (últimos 2-3 años) y aumentó el rango de búsqueda debido a la escasez de información.
Criterios de exclusiónEstudios sin texto completo. Estudios que no fueran originales, es decir, cartas al editor, estudio de caso único, etc.
Estudios que no tratasen el tema del estrés, a pesar de que tratasen cortisol y alfa-amilasa salival.
ResultadosEn cuanto al diseño de los estudios, de los 17 estudios internacionales analizados en la revisión, 14 han sido analíticos, de los cuales 7 son cuasiexperimentales, 6 casos-controles y uno de cohortes. Estos son estudios centrados en la medición de los biomarcadores estudiados en esta revisión bibliográfica relacionados con el estrés, con la EP o con otros factores/enfermedades que puedan ser agentes estresores. Los otros 3 han sido revisiones bibliográficas que tratan de explicar cómo los procesos neuroinflamatorios, por medio de sustancias proinflamatorias como las citocinas, pueden favorecer la neurodegeneración.
Tres de los estudios cuasiexperimentales fueron realizados con ratas de tipo «Winstar», «Albino» y «Long-Evans».
El número de sujetos varía considerablemente entre estudios, siendo el menor número de participantes de 23 y el mayor de 149, y, en el caso de los grupos de control (si lo hubiere), el menor número fue de 15 controles y el mayor de 355.
En cuanto al rango de edades, el menor fue de 23,2 ± 2,5 años y el mayor de 65,6 ± 15,5 años.
El reparto de sexos fue bastante equitativo, exceptuando un estudio cuasiexperimental que solo incluyó a hombres con la intención de evitar las posibles variaciones hormonales en mujeres por su ciclo menstrual, y un estudio en el cual el factor estresor es el lupus eritematoso sistémico y en el que, en su gran mayoría, los participantes fueron mujeres, ya que la enfermedad es mucho más prevalente en el sexo femenino.
Las variables medidas principalmente fueron el estrés, el cortisol y la alfa-amilasa salival, pudiendo incluir en alguno de ellos otros biomarcadores relacionados con el estrés u otros valores analíticos, pero que no son el objetivo de esta revisión sistemática.
En la tabla 2 podemos observar los principales estudios que se han contemplado en la presente revisión.
Clasificación de los estudios incluidos en esta revisión. Fuente: elaboración propia
| EstudioAutores (país), año | Tipo deestudioMuestra | Variables | Factor estresor | Conclusiones |
|---|---|---|---|---|
| Becerril et al.14 (México), 2012 | Revisión bibliográfica | EstrésCitocinas NeuroinflamaciónDopamina | – | El estrés provoca liberación de citocinas y otros factores inflamatorios, que intervienen en la neurodegeneración, provocando además alteraciones de tipo conductual. Las variaciones, tanto a nivel central como periférico, influyen en el metabolismo de la dopamina, reduciendo a nivel central su disponibilidad |
| Hemmerle et al.13 (EE. UU.),2012 | Revisión bibliográfica | EstrésDopamina Cortisol citocinas | – | El estrés contribuye al desarrollo de la EP y desempeña un papel importante en la sintomatología prodrómica y motoraEl estrés activa el eje HPA y SNA, causando atrofia neuronalEl estrés afecta a los niveles de dopamina en el SNCNiveles más elevados de cortisol en EP que en ausencia de EP ante una misma edadLa pérdida de neuronas dopaminérgicas en estadios avanzados de EP hace más vulnerable al SNC al estrésRelación entre la etiología de la EP y la inflamación, existencia de citocinas en cerebros post mortem de EP |
| Smith et al.17 (Canadá), 2008 | Analítico, longitudinal, experimental, cuasiexperimental71 ratas hembras Long-Evans | EstrésCorticosteronaTirosina hidroxilasaPost hoc | CorticosteronaEstrés restrictivo | El estrés crónico y los elevados niveles de corticosterona empeoran los síntomas motores y los eventos neurodegenerativos en el modelo de ratas de EPSensibilidad del sistema dopaminérgico al estrés |
| De Pablos et al.15 (España), 2014 | Analítico,longitudinal,experimental, cuasiexperimental(Ratas macho Albino y Wistar de 250-270 g) | EstrésMicroglía Citocinas Corticosterona | Nado forzadoDeprivación de agua/comidaContención a 4° insolación | Los mecanismos inflamatorios producidos por estrés crónico aumentan el número de células de microglía y citocinas colaborando en la muerte de neuronas dopaminérgicasEl estrés activa el eje HPA y eje simpático-adrenal-medularEn los animales tratados mediante factores estresantes hubo un incremento de corticosterona |
| Herrera et al.16 (España), 2015 | Revisiónbibliográfica | EstrésMicroglía CitocinasGlucocorticoides | Existencia de neuroinflamación que acompaña a la EP, en cerebros post mortem aparecen microglía y citocinasEl estrés activa el eje HPA y simpático-adrenal-medular. Los glucocorticoides promueven la neuroinflamación exacerbando así la pérdida de neuronas dopaminérgicas, afectan al desarrollo de la EP, a sus síntomas y a la respuesta del individuo a la medicaciónAlto riesgo de desarrollar una enfermedad mental tras un estrés emocional prolongadoNo solo se consideran factores estresantes acontecimientos traumáticos, sino situaciones del día a díaSe establece una relación directa entre altos niveles de cortisol y alteraciones de la marchaEl inicio tardío de la EP se ve influido por la mayor vulnerabilidad de las neuronas dopaminérgicas ante agresiones | |
| Rohleder et al.22 (España), 2006 | Analítico, longitudinal, experimental, cuasiexperimentalVarones sanos n = 26EM (Salivette®) = 23,2 ± 2,5EM (babeo pasivo) = 24,8 ± 4,1 | sAACortisol salivalFrecuencia cardíacaFlujo salival | Trier Social Stress Test | La cantidad de saliva no influye en la medición de la sAA como biomarcador del estrésAumentaron la frecuencia cardíaca, el cortisol salival y la sAA, y hubo un leve aumento del flujo de saliva tras el factor estresante |
| Sugama et al.20 (EE. UU.; Japón), 2016 | Analítico, longitudinal, experimental, cuasiexperimentalRatas Wistar macho de 280-320 g. E = 8 semanas | Tirosina hidroxilasaDopaminaNoradrenalinaReceptores de serotonina: 5-HT | Deprivación respiración | Es estrés crónico provoca neurodegeneración dopaminérgicas en el sistema nervioso parasimpático y en el locus coeruleus por el incremento del estrés oxidativo que provoca la activación de la microglíaReducción de la tirosina hidroxilasa (precursor de la DOPA, precursor de la dopamina) y del neurotransmisor dopaminérgico, acompañadas de respuesta inmunológicaEl efecto del estrés es directamente proporcional al tiempo de exposición |
| Skogar et al.21 (Suecia), 2011 | Analítico, longitudinal, observacional, casos-controlesn (EP) = 43M = 62,8%. V = 37,2%n (no EP) = 18M = 50%. V = 50%. E = 50-79 | Hoehn and Yahr scoreUnified Parkinson's Disease Rating ScaleCortisol salival | EP | Ritmo de cortisol normal, aumento del cortisol diurno y de su secreción durante el día en EP comparado con el grupo controlReacción excitatoria normal del cortisol y función del eje HPA normal |
| Maruyama et al.26 (Japón), 2012 | Analítico, longitudinal, experimental, cuasiexperimentaln = 149M = 38,2%. V = 61,8%. EM = 24,9 ± 3,7 | sAACortisol salival | Trier Social Stress TestElectroestimulación | La sAA sufre un aumento brusco tras los estímulos estresantes y vuelve rápidamente a los niveles basales. El cortisol salival sufre un aumento más retardado que vuelve a niveles basales a los 20 minNo hubo diferencias entre hombres y mujeres en cuanto a la sAA. En cuanto a niveles de cortisol, las mujeres presentaron un mayor incremento que los hombres. Además, los sujetos jóvenes tienen una mayor respuesta al estrés mediante la sAA |
| Petrakova et al.18 (Alemania; EE. UU.), 2015 | Analítico, longitudinal,experimental,cuasiexperimentalVoluntarios sanos n = 23M = 60,9%. V = 39,1%EM = 42 ± 8,8 | sAANoradrenalinaCortisol salivalFrecuencia cardíaca | Trier Social Stress Test | Los pacientes sanos tratados mediante el Trier Social Stress Test tuvieron un aumento de frecuencia cardíaca, activación del eje HPA, aumento del cortisol y SAA en saliva, pero no todos experimentaron un aumento de la noradrenalinaLa actividad de la amilasa incrementa en respuesta al estrés social |
| Tanaka et al.19 (Japón), 2013 | Analítico, longitudinal, observacional, casos-controlesn (trastorno bipolar: BP) = 25M = 44%. V = 56%E = 43,6 ± 12,7n (no BP) = 22M = 50%. V = 50%. EM = 36,8 ± 4,0 | sAACortisol salival | Trastorno bipolarEstimulación eléctrica en muñeca | Se observó un aumento de la sAA tras el factor estresante, aumentó más drásticamente en mujeres que en hombres. Los hombres muestran una tendencia al incremento, mientras las mujeres muestran un mayor aumentoEstudios anteriores ya demostraron esto, a pesar de que otros autores expresan que no hay diferencias entre sexosNo se han observado diferencias en los niveles de cortisol entre ambos grupos, explicado quizás por un estímulo eléctrico insuficienteEl estrés prolongado no suprime la actividad del SAM en pacientes con trastorno bipolar |
| Tanaka et al.27 (Japón), 2016 | Analítico, longitudinal, observacional, casos-controlesn (trastorno evasivo de la personalidad-AVPD) = 93M = 43%. V = 57%EM = 25,0 ± 3,6n (no AVPD) = 355M = 39,7%. V = 60,3%EM = 24,9 ± 3,9 | sAACortisol salivalFrecuencia cardíaca | Trastorno de la personalidad evasivoTrier Social Stress TestEstímulo eléctrico en muñeca | La sAA tras los estímulos estresores aumentó tanto en hombres como en mujeres de ambos grupos, mostrando así que no hay diferencia entre sexosEl cortisol salival disminuyó en mujeres con trastorno evasivo en comparación con las mujeres del grupo de control; no hubo diferencias entre los hombres con trastorno evasivo y los hombres del grupo de control |
| Törnhage et al.29 (Suecia), 2013 | Analítico, longitudinal, observacional, casos-controlesn (EP + masaje táctil) = 29M = 65,5%. V = 34,5%E = 50-79n (EP + música = grupos control) | Cortisol salival | Masaje táctilEP | El ritmo diurno de cortisol fue normal, no hubo diferencias significativas entre el grupo de control y el sometido al masaje táctil. El cortisol salival se redujo tras el masaje táctil y la música |
| Haglin et al.23 (Suecia), 2016 | Analítico, prospectivo, observacional, casos-controlesn (EP) = 75M = 45,3%. V = 54,7EM = 68,9n (no EP) = 24M = 50%. V = 50%EM = 68,2 | Mini-Nutritional Assessment scoreUPDRS FosfatoplasmáticoAlbúmina plasmáticaTransferrina plasmáticaCortisol plasmático | EP | Las condiciones postraumáticas incrementan el cortisol. La alteración del metabolismo de proteínas puede ir asociada a altos niveles de cortisol, induciendo una respuesta catabólica que puede manifestarse con pérdida de pesoLos niveles de fosfato son indirectamente proporcionales a los de cortisol, indicando así que los niveles bajos de fostato pueden afectar a las funciones motoras y cognitivas en la EPEl Mini-Nutritional Assessment score era menor en EP que en controlesLos niveles plasmáticos de fosfato van relacionados con los niveles de albúmina, transferrina y el Mini-Nutritional Assessment score |
| Ibrahimagic et al.24 (Bosnia-Herzegovina), 2016 | Analítico, transversal, experimental, cuasiexperimentaln (EP) = 30M = 50%, V = 50%EM (M) = 62,4 ± 10,7EM (V) = 65,6 ± 15,5 | Cortisol plasmáticoACTH plasmática | EP de nuevo diagnóstico | Incremento del cortisol plasmático en el 83,3% de los pacientes. No hubo diferencias entre hombres y mujeres |
| Jung et al.30 (Corea), 2015 | Analítico, prospectivo, observacional, casos-controlesn (SLP) = 100M = 93%. V = 7%EM = 46 ± 10,3n (no SLP) = 49M = 93,8%. V = 6,2%. EM = 41,6 ± 10,7 | sAACortisol salival | Lupus eritematoso sistémico | Hubo un incremento de la sAA en paciente con lupus respecto al grupo de controlNo hubo diferencias con respecto al cortisol, quizás por la cantidad de corticoides que toman al día para el lupus, interrumpiendo la respuesta ante un estímulo estresor |
| Valentin et al.25 (Alemania), 2015 | Analítico, transversal, observacional, cohortesn (médicos) = 14M = 29%. V = 71%EM = 36,8 ± 5n (paramédicos) = 27M = 11%. V = 89%EM = 30,9 ± 6,9 | sAACortisol salival | Escenarios estresantes médicos | La sAA aumentó sin seguir una secuencia en el tiempo. Mínimos cambios en cortisol, en algunos casos disminuyó y en otros aumentóLa edad y el género no influyeron. La sAA es un biomarcador más sensible |
Los principales factores estresores han sido la EP o la electroestimulación, pudiendo incluir otras enfermedades/situaciones como factores estresores. En el caso de los estudios cuasiexperimentales en los cuales se utilizaron ratas, los factores estresores suelen ser restrictivos a nivel de alimentación, hidratación, respiración y aumento del esfuerzo.
DiscusiónEn el presente estudio se han analizado diferentes estudios internacionales y nacionales que demuestran que sí existe una relación entre el estrés y la EP.
El estrés está relacionado con la EP a nivel tanto etiológico como sintomatológico (prodrómico y motor), es decir, el estrés y los glucocorticoides son capaces de provocar la activación de sustancias proinflamatorias que provocan inflamación a nivel del SNC, siendo especialmente sensible el sistema dopaminérgico, produciendo una neurodegeneración13-17. Además, también pueden producir descoordinación de miembros y alteración del comportamiento16.
Las variaciones de las sustancias proinflamatorias, como las citocinas o células de microglía, influyen significativamente en el metabolismo de los neurotransmisores como la dopamina13-16. Se sabe que este neurotransmisor es el principal implicado en la EP y, por tanto, es importante saber que las citocinas influyen en la síntesis, la recaptura y la secreción de la misma, además de reducir su disponibilidad a nivel central14. Cabe recalcar que la afectación a nivel dopaminérgico es directamente proporcional a la intensidad o la duración del factor estresor13.
El estrés puede afectar al control dopaminérgico de los movimientos motores, pudiendo los glucocorticoides afectar a la respuesta compensatoria del sistema motor dañado16. La pérdida de neuronas dopaminérgicas en estadios avanzados de la enfermedad hace al sistema más vulnerable todavía al estrés, además de reducir las respuestas hedónicas tras la exposición a estrés emocional13.
Estudios han demostrado la existencia de niveles elevados de citocinas y células de microglía en cerebros post mortem de pacientes con EP, pudiendo explicarse como un mecanismo de defensa inmunológico ante la muerte neuronal13,16.
El estrés activa el sistema eje hipotálamo-pituitaria-adrenal (HPA) y el sistema nervioso autónomo, además de causar atrofia neuronal13,16,18,19. El principal factor de riesgo de la EP es la edad, la cual puede ir asociada a niveles más altos de cortisol13. Con la edad, la respuesta del eje HPA ante el estrés es hiperactiva y menos eficiente a la hora de recuperar la homeostasia, dando lugar a largos períodos de exposición a glucocorticoides16.
Se ha demostrado que existe un alto riesgo de desarrollar una enfermedad mental tras un estrés emocional prolongado, a pesar de que no se ha demostrado una relación directa con la EP pero se sospecha que produce síntomas severos como discinesias, trastornos del sueño y bradifrenia. Además, un dato relevante es que hay un 50% de prevalencia de comorbilidad de EP y depresión13.
En los estudios cuasiexperimentales en los cuales se han utilizado ratas como modelo de EP se ha demostrado que la exposición a estrés crónico exacerba los déficits funcionales y acelera la pérdida de neuronas dopaminérgicas a nivel del locus coeruleus, acompañada de una activación de las células de microglía. Existe una reducción de la proteína tirosina hidroxilasa (precursora de la dopamina) y del neurotransmisor dopaminérgico. Además, existen evidencias de que esta neurodegeneración dopaminérgica va acompañada de neurodegeneración noradrenérgica14,17,20.
En cuanto a los estudios en los que se analizan los niveles de cortisol, existe gran variabilidad en los resultados. Se han hallado tanto aumentos20-26 y disminuciones25,27-29 como mantenimientos de los niveles de cortisol19,25,30.
En algunos de los casos en los que ha disminuido, se han dado motivos por los cuales puede ocurrir este descenso, tales como: una electroestimulación insuficiente en cuanto a fuerza o la influencia del tratamiento crónico con glucocorticoides19,23.
En un 50% de los casos ha habido un aumento del cortisol, en un 20% ha habido un descenso (con posible explicación), en un 20% no ha habido cambios significativos y en un 10% ha habido resultados variados.
En cuanto a las diferencias entre sexos, solo en un 20% de los estudios se ha demostrado que los resultados varían entre mujeres y hombres, siendo el sexo femenino el afectado por la variación26,27.
En cuanto a los estudios en los que se analizan los niveles de alfa-amilasa salival, todos concluyen la existencia de un aumento de los niveles de este biomarcador tras un estímulo estresor18,19,22,25-27,30. Además, se ha demostrado que, independientemente del flujo salival del paciente, se pueden obtener resultados totalmente fiables del biomarcador22.
Las diferencias entre sexos en cuanto a este biomarcador tampoco son relevantes, solo en un estudio se ha demostrado un aumento mayor en el sexo femenino19.
Las diferencias en edad tampoco son relevantes, excepto en un estudio que demuestra que la respuesta de la alfa-amilasa salival es mayor en personas jóvenes25.
Esta revisión sistemática ha presentado una limitación principal: el tema escogido está en proceso de investigación, por lo tanto, la cantidad de material bibliográfico existente es escaso y, en muchas ocasiones, restringido. A pesar de ello, se ha extraído la mayor cantidad de información posible y se ha sintetizado para poder contribuir a líneas de investigación futuras.
ConclusionesSe han descrito los estudios que evidencian el impacto del estrés en la EP, tanto a nivel desencadenante como a nivel de complicaciones sintomatológicas.
Se ha comprobado que los 2biomarcadores estudiados son adecuados para la medición del estrés en pacientes con EP, además de poner medirse a nivel salival, siendo una técnica menos invasiva para el paciente, provocándole, por tanto, menor estrés.
A pesar de la relación directa entre el sistema HPA y el cortisol como biomarcador del estrés, según esta revisión bibliográfica, los estudios demuestran que la alfa-amilasa salival es un biomarcador más sensible en cuanto a la detección del estrés.
Se ha evidenciado también la implicación del estrés en la neurodegeneración, mediante sustancias proinflamatorias que provocan inflamación a nivel central, siendo especialmente sensible el sistema dopaminérgico, fundamental en la EP.
Es un tema con escasez bibliográfica ya que está en proceso de investigación; la finalidad de esta revisión es determinar la validez de ambos biomarcadores para poder ser empleados en líneas futuras de investigación en pacientes con EP. Pudiendo así determinar cómo afecta realmente el estrés a los pacientes, tanto en sintomatología prodrómica, como motora y no motora durante la enfermedad, como en la etiología de la enfermedad. Esto podrá permitir abordar el tratamiento de la enfermedad, desde un punto de vista psicológico para disminuir el estrés (y, por tanto, la sintomatología), e intentar disminuir la cantidad de fármacos que ingieren, mejorando así la calidad de vida de los pacientes con EP.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.