Las reacciones locales en el punto de inyección (RLPI) constituyen uno de los efectos secundarios más comunes en pacientes con esclerosis múltiple (EM) tratados mediante inmunomoduladores por vía subcutánea. Algunos estudios demuestran que las RLPI son más frecuentes en mujeres que en hombres y también se han relacionado con la distribución de la grasa corporal.
ObjetivosDeterminar los factores antropométricos y hábitos dietéticos y de ejercicio físico implicados en la aparición RLPI en pacientes en tratamiento con inmunomoduladores por vía subcutánea y establecer la frecuencia de RLPI en nuestra población con cada tipo de fármaco.
MétodoEstudio observacional, transversal y descriptivo. Se seleccionaron 194 pacientes por muestreo sistemático no aleatorio. Las variable estudiadas fueron: edad, sexo, índice de masa corporal, índice cintura-cadera, fototipo de piel, tipo de dieta y nivel de actividad física.
ResultadosEl 76% de los pacientes entrevistados presentaban algún tipo de RLPI; entre las mujeres el 85,6% presenta algún tipo de RLPI y entre los hombres el 58% (p<0,001). Los pacientes que siguen una dieta favorable para la salud sufren menos RLPI (p=0,03). La duración del tratamiento en pacientes que presentan RLPI es 74,65 (DE: 55,14) meses, frente a los libres de RLPI que presentan una media de 71,04 (DE: 59,68) meses (p=0,71).
Conclusionesse encontraron una serie de factores protectores para la aparición de RLPI, como son el sexo masculino y seguir una dieta favorable; no se ha encontrado relación entre el resto de las variables estudiadas y la aparición de RLPI. Una mayor duración del tratamiento no implica necesariamente más RLPI.
Injection site reactions (ISRs) are one of the most common side effects in multiple sclerosis (MS) patients treated with subcutaneous disease modifying therapies (DMTs). Some studies show that ISRs are more common in women than in men, and are also related to the distribution of body fat.
ObjectivesTo determine anthropometric factors, and dietary and exercise habits associated with the appearance of ISRs in patients treated with subcutaneous DMTs, to establish what type of ISRs are more frequent in our population with each type of drug.
MethodAn observational, cross-sectional and descriptive study was conducted on 194 patients who were selected by non-random systematic sampling. The variables studied were age, sex, body mass index, waist-hip ratio, skin phototype, diet, and level of physical activity.
ResultsAbout three-quarters (76%) of patients (85.6% females and 58% males) had some kind of ISRs (P<.001). Patients following a reasonable diet for health suffered less ISRs (P=.03). The duration of treatment in patients with ISRs was 74.65 months (SD 55.14), compared to 71.04 months (SD 59.68) (P=.71) for those free of ISRs.
ConclusionsOur findings show that there are some protective factors for the onset of ISRs, such as being male and have a proper diet. No relationship was found between the other variables studied and the appearance of ISRs. A longer duration of treatment does not necessarily mean a higher frequency of ISRs.
La esclerosis múltiple (EM) es una enfermedad inflamatoria, desmielinizante y neurodegenerativa del sistema nervioso central (SNC)1. Actualmente la EM no tiene cura, e incluso la fase inicial de la enfermedad tiene un impacto importante, afectando al estado de ánimo, las capacidades profesionales y las relaciones sociales y familiares2. Sin embargo, existen varios medicamentos que pueden modificar positivamente su evolución y ser alternativa para el tratamiento sintomático3. Los brotes de la enfermedad habitualmente se tratan con choques o bolos de corticoides, y para el tratamiento a largo plazo existen varios tipos de medicamentos que tratan de reducir el número de brotes o hacer que estos sean más leves, y protegen contra el daño axonal y neuronal, con lo que se retrasa la evolución de la discapacidad4–6.
Actualmente están disponibles para el tratamiento de la EM en primera línea 3 tipos de interferón beta, 2 de ellos de administración subcutánea (sc) y otro de administración intramuscular (im) y, por otro lado, acetato de glatirámero, que es un polipéptido también indicado para el tratamiento de la EM remitente recidivante (EMRR). La principal diferencia entre ellos, además de la unidad de dosis, es la pauta posológica, que varía desde la administración diaria para acetato de glatirámero, en días alternos para interferón beta 1-b, 3 veces por semana en interferón beta 1-a sc, o semanal en el caso de interferón beta 1-a im7,8.
Los estudios comparativos entre ellos son limitados, pero hoy en día se acepta que todos proporcionan aproximadamente la misma tasa de reducción de brotes/año (aproximadamente un 30% de reducción de brotes). La decisión sobre la elección entre un tratamiento u otro se realiza según la situación clínica de cada paciente y también según sus preferencias, estilo de vida y otros factores sociosanitarios. A excepción de un pequeño número de pacientes con EM benigna, todos los pacientes con EMRR suelen ser tratados en primer lugar con algún tipo de interferón beta o con acetato de glatirámero9.
Si el paciente se encuentra estable o con mínimo incremento de discapacidad puede permanecer con el mismo tratamiento o una permutación entre ellos durante varios años. De este modo, desde la década de los 90, momento en que apareció el primer interferón para el tratamiento de la EMRR, podemos encontrar pacientes que, por presentar una evolución estable, han permanecido inyectándose algún inmunomodulador desde hace 15 años o más4.
Los efectos secundarios más comunes producidos por interferón beta que se encuentran descritos en la literatura médica son los siguientes: síndrome pseudogripal (hasta en el 90% de los pacientes); reacciones cutáneas locales en el punto de inyección (RLPI) (en el 76,7% de los pacientes) y alteraciones en la analítica10,11. Estos factores, junto a una eficacia moderada, pueden llevar a los pacientes a interrumpir el tratamiento12, por lo que las RLPI en numerosas ocasiones influyen en la adherencia al tratamiento y en la calidad de vida del paciente. Si bien la aparición de RLPI es bastante frecuente y motivo de consulta por parte de los pacientes, sobre todo de mujeres, porque son molestas, dolorosas y antiestéticas, estas, por sí mismas, no son un motivo clínico suficiente para interrumpir el tratamiento11,13,14.
Se considera habitual e incluso normal que aparezcan RLPI tras la inyección prolongada de estos tratamientos. Aunque la aparición de RLPI no es un fenómeno que indique la retirada del fármaco, en la mayoría de los casos los pacientes consultan sobre si lo que les pasa es normal, y en muchos casos les supone una alteración muy importante en la percepción de la imagen corporal, por lo que estarían dispuestos a cambiar de tratamiento por este motivo, aunque la enfermedad esté muy bien controlada. Las cuestiones relacionadas con la piel y la inyección han sido citadas como razones clave para la interrupción del tratamiento por parte del paciente, junto con la percepción de que el medicamento no está funcionando15. De esta forma, además del cansancio por inyectarse durante periodos tan prolongados, el paciente a menudo muestra su preocupación por las señales o marcas que le deja el tratamiento. Las RLPI pueden ser más o menos graves y están en relación directa con la falta de rotación de las zonas de inyección, la técnica de inyección, la duración del tratamiento y la asepsia2,16.
La valoración de estas RLPI en cuanto a gravedad es diversa, aunque las reacciones graves son raras17. Para su tratamiento no hay ninguna guía descrita, lo que suele ser motivo de discusión entre neurólogos y dermatólogos. Las RLPI más frecuentes por el uso de inmunomoduladores son hematomas, eritemas, manchas violáceas, hiperpigmentación, inflamación, induración, nódulos subcutáneos, celulitis infecciosa, lipoatrofia o lipodistrofia y úlceras cutáneas. La prevención y manejo de RLPI incluye la educación del paciente y revisiones periódicas por parte de enfermería y la palpación manual de los lugares de inyección3. Los geles con antiinflamatorios no esteroideos, corticoterapia local y endermología pueden ayudar a resolver estos efectos locales y continuar el tratamiento inmunomodulador13,18. Las enfermeras somos responsables y tenemos un papel primordial en el entrenamiento del paciente y en el manejo de las reacciones secundarias para favorecer la adherencia19.
Son más frecuente las RLPI en la administración subcutánea (más del 90%), que en la vía intramuscular (33%)10,13. En cuanto al tipo de lesión, casi la mitad de los pacientes tratados con acetato de glatirámero presentan lipoatrofia7, aunque también aparece en pacientes tratados con interferón beta-1b. Con el resto de interferones subcutáneos son más comunes el dolor, la inflamación y la induración16.
Samuel y Lowenstein afirman en su trabajo Reacciones locales recurrentes por interferón beta 1b, que la aparición de RLPI es más frecuente en mujeres que en hombres, y también se ha relacionado con la distribución de la grasa corporal14.
En este sentido podrían existir otros factores como, por ejemplo, las características antropométricas individuales y los hábitos higiénico-dietéticos que influirían en la aparición de RLPI por inmunomoduladores subcutáneos.
En la Estrategia mundial sobre el régimen alimentario, actividad física y salud, elaborada por la OMS, se describe que una dieta saludable y la actividad física suficiente y regular son los principales factores de promoción y mantenimiento de una buena salud durante toda la vida20.
Con respecto a la dieta las recomendaciones, tanto poblacionales como individuales, deben consistir en: reducir la ingesta calórica procedente de las grasas, cambiar las grasas saturadas por las insaturadas, aumentar el consumo de frutas, verduras, legumbres, cereales integrales y frutos secos y reducir la ingesta de azúcares libres, entre otras. Respecto a la actividad física algunas de las recomendaciones para adultos son: dedicar como mínimo 150min semanales a la práctica de actividad física aeróbica, de intensidad moderada, o 75min de actividad física aeróbica vigorosa cada semana, o una combinación equivalente de actividades moderadas y vigorosas.
Tras consultar con las especialidades de dermatología y alergia sobre posibles causas de aparición de RLPI nos aconsejaron incluir, además, el fototipo de Fiztpatrick21.
A partir de esta información nos planteamos la siguiente hipótesis: en la aparición de RLPI por inmunomoduladores en EM existen algunos factores predisponentes como pueden ser el sexo, un índice de masa corporal elevado, una distribución de la grasa corporal determinada, el fototipo de piel, el sedentarismo y una dieta poco saludable.
Objetivos- -
Determinar los factores antropométricos y los hábitos dietéticos que se relacionan con la aparición de reacciones locales en el punto de inyección en pacientes con EM en tratamiento con inmunomoduladores por vía subcutánea.
- -
Establecer qué tipo de RLPI son más frecuentes en nuestra población con cada tipo de inmunomodulador por vía subcutánea.
- -
Identificar factores que previenen la aparición de RLPI.
Estudio observacional, transversal y descriptivo que valora la relación entre la aparición de RLPI causadas por inmunomoduladores subcutáneos en EM con factores antropométricos, hábitos dietéticos y patrón de ejercicio físico.
Se reclutaron pacientes tratados con alguno de los siguientes medicamentos para EM:
- -
Interferón beta 1-b sc: Betaferon® y Extavia®.
- -
Interferón beta 1-a sc: Rebif 22® y Rebif 44®.
- -
Acetato de glatirámero sc: Copaxone®.
De forma previa al reclutamiento, el proyecto se entregó para su valoración por el Comité Ético y de Investigación Clínica del Hospital Virgen Macarena, y obtuvo un dictamen favorable. Los datos de los participantes se trataron de manera confidencial; las bases de datos fueron anonimizadas y custodiadas mediante claves de seguridad.
El estudio se desarrolló en la Unidad de EM del Hospital Virgen Macarena de Sevilla y se siguieron los siguientes criterios de inclusión/exclusión:
Criterios de inclusión- -
Pacientes mayores de 18 años con diagnóstico de EMRR en tratamiento con algún inmunomodulador por vía subcutánea, al menos un mes antes de la inclusión en nuestro estudio, con o sin RLPI.
- -
Pacientes que entregaran el consentimiento informado antes de la participación en el estudio.
- -
Pacientes en tratamiento con algún inmunomodulador vía intramuscular.
- -
Pacientes en tratamiento por vía subcutánea para otras enfermedades a medio o largo plazo (insulina, heparina, etc.), además del tratamiento inmunomodulador.
El reclutamiento se realizó por muestreo sistemático, no aleatorio, a medida que los pacientes acudieron a sus revisiones periódicas en la consulta de neurología y/o enfermería, tras la aceptación de participación en el estudio y firma del consentimiento informado, durante los meses programados para la recogida de datos. En el periodo de febrero a septiembre de 2013 se reclutó la muestra, obteniendo datos de pacientes en tratamiento desde 4 hasta 240 meses.
La información se recogió a través de una entrevista individualizada con cada paciente siguiendo un cuestionario elaborado por las enfermeras encargadas del proyecto (anexo 1). Este cuestionario consta de una serie de preguntas sobre hábitos dietéticos y patrón de ejercicio y unas medidas antropométricas determinadas que se tomaron en el momento de la visita. Solo se realizó una visita para este estudio.
La población se dividió en 2 grupos en función de si presentaban o no algún tipo de RLPI, ya fueran hematomas, eritemas, manchas violáceas, induraciones, nódulos subcutáneos, inflamación, lipodistrofia o úlceras cutáneas.
Variables estudiadas e instrumentos de medidaSe recogieron variables sociodemográficas y clínicas como: sexo, edad, duración del tratamiento, índice de masa corporal (IMC), distribución de la grasa corporal mediante el índice cintura-cadera (ICC), el grado de actividad física, fototipo de Fiztpatrick y el tipo de dieta.
- -
Para la obtención del IMC se recogieron el peso y la talla de los participantes y se utilizó la siguiente fórmula:
- -
IMC=peso (kg)/(altura en metros)2.
Se clasificó a la población por su IMC según la siguiente clasificación de la Organización Mundial de la Salud:
- -
Infrapeso: IMC<18,50.
- -
Normal: IMC: 18,50-24,99.
- -
Sobrepeso: IMC: 25,00-29,99.
- -
Obeso: IMC>30,00.
Para la obtención de la distribución de la grasa corporal se utilizó el ICC, que consiste en la relación que resulta de dividir el perímetro de la cintura de una persona entre el perímetro de su cadera.
Una relación entre cintura y cadera superior a 1,0 en varones y a 0,9 en mujeres está asociada a un aumento en la probabilidad de contraer diversas enfermedades (diabetes mellitus, enfermedades coronarias, tensión arterial, entre otras).
El índice se obtiene midiendo el perímetro de la cintura a la altura de la última costilla flotante, y el perímetro máximo de la cadera a nivel de los glúteos, siendo la interpretación la siguiente22:
ICC=0,71-0,84 normal para mujeres.
ICC=0,78-0,94 normal para hombres.
Valores mayores: síndrome androide (cuerpo de manzana).
Valores menores: síndrome ginecoide (cuerpo de pera).
- -
Nivel de actividad física/ejercicio: debido a que la vascularización de los tejidos es mejor en personas que hacen ejercicio físico regular, por la mejora en el aporte e intercambio de oxígeno y nutrientes, esto podría facilitar una más rápida mejoría de los microtraumatismos que producen las inyecciones. Se dividió la población estudiada en 3 grupos, en función de la frecuencia semanal en que practicaban ejercicio físico y teniendo en cuenta la posible alteración en la movilidad de los participantes:
- a)
Sedentario: no mantiene un patrón de ejercicio físico habitual o camina esporádicamente.
- b)
Activo moderado: camina o realiza una hora de ejercicio o fisioterapia de una a 3 veces por semana.
- c)
Muy activo: camina o realiza una hora de ejercicio o fisioterapia 4-7 veces por semana.
Tipo de alimentación/dieta: teniendo en cuenta algunas de las recomendaciones de la OMS20 sobre dieta saludable, se englobó a cada paciente en alguno de estos 2 grupos:
Los que mantienen una dieta favorable para la salud: ingieren al menos una ración de fruta o verdura al día y 1,5l de agua, con consumo ocasional o nulo de grasas saturadas y azúcares.
Los que no mantienen una dieta favorable para la salud: no ingieren al menos una ración de fruta ni verdura diariamente y beben menos de 1,5l de agua al día. Consumo habitual (más de 3 veces en semana) de grasas saturadas y azúcares.
Los pacientes se incluyeron en un grupo u otro si cumplían 2 o más requisitos de cada grupo.
Fototipo de piel: se englobó a los pacientes en unos de los siguientes fototipos de Fiztpatrick21:
Tipo I: pelirrojos o rubios con piel y ojos muy claros.
Tipo II: pelirrojo o rubio con piel u ojos claros.
Tipo III: rubio o castaño con piel u ojos oscuros.
Tipo IV: castaño con piel y ojos oscuros.
Tipo V: latinoamericanos, indios, indígenas.
Tipo VI: negros.
Tras la obtención de los datos se realizó el análisis estadístico de los mismos a través del software IBM SPSS Statistics for Windows, versión 20. Empleamos la prueba de la «t» de Student para comparar medias de las variables relacionadas y la correlación lineal de Pearson para evaluar la fuerza de asociación entre las variables. Los valores se consideraron como estadísticamente significativos si p<0,05.
ResultadosSe obtuvo una muestra de 194 pacientes, de la cual el 64,4% son mujeres, frente al 35,6% de hombres. La media de edad es 42,5 (DE: 10,8) años. Un 34,5% de ellos tratados con acetato de glatirámero, 28,3% con interferón beta 1-b y 37,1% con interferón beta 1-a.
El 76% de los pacientes presenta algún tipo de RLPI y el 24% no presenta ningún tipo de RLPI.
En cuanto al estudio de las variables:
- -
Edad: la media de los que presentan RLPI es 41,1 (DE: 11,16) y los que están libres de lesión 42,6 (DE: 10,72) (p=0,41). La edad no se considera un factor asociado a la aparición de RLPI.
- -
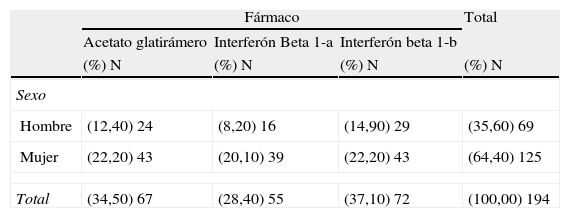
Sexo: la distribución de sexos en cada fármaco inmunomodulador es similar (tabla 1).
Tabla 1.Distribución de sexos por fármaco
Fármaco Total Acetato glatirámero Interferón Beta 1-a Interferón beta 1-b (%) N (%) N (%) N (%) N Sexo Hombre (12,40) 24 (8,20) 16 (14,90) 29 (35,60) 69 Mujer (22,20) 43 (20,10) 39 (22,20) 43 (64,40) 125 Total (34,50) 67 (28,40) 55 (37,10) 72 (100,00) 194 p=0,42.
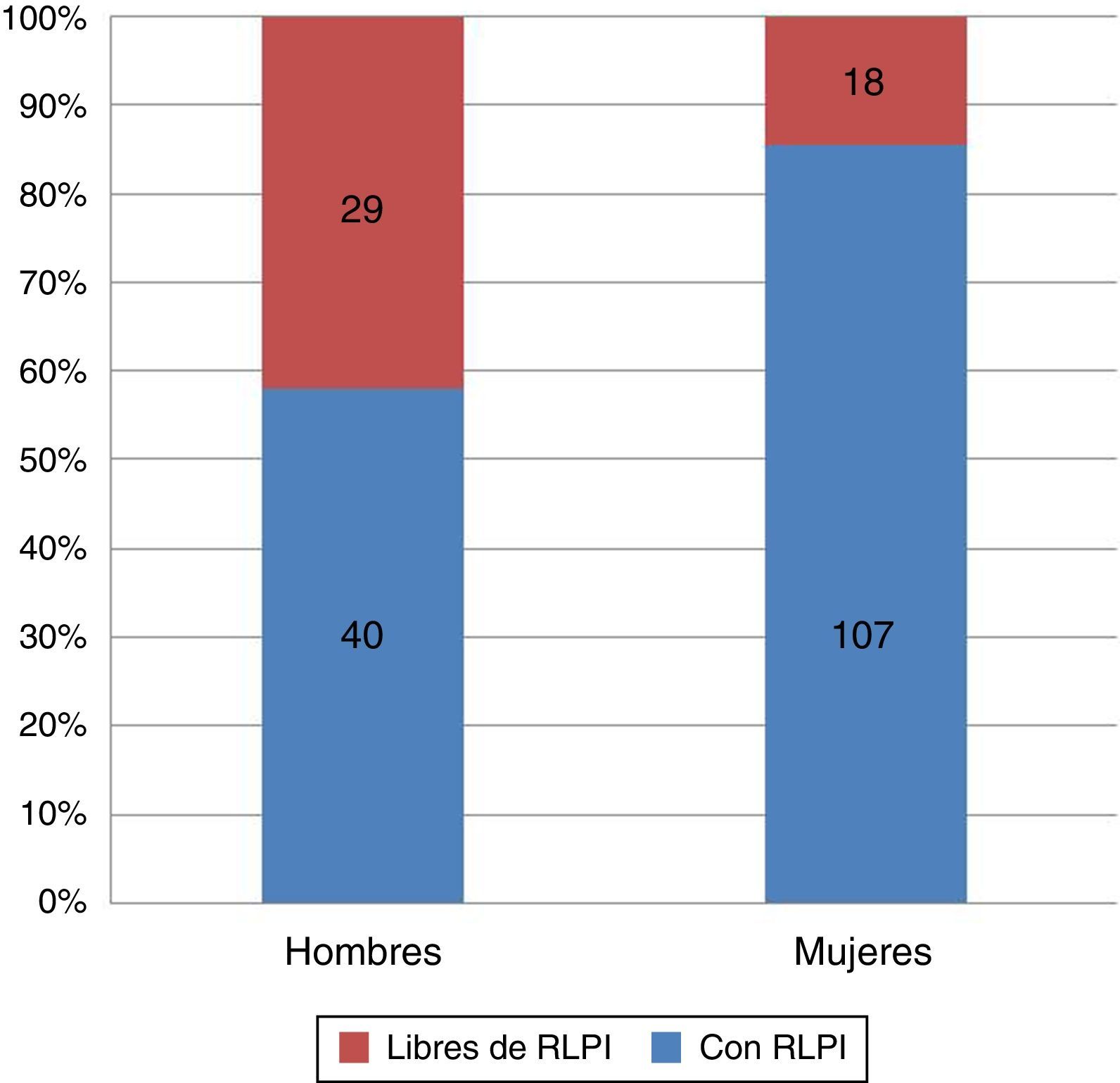
Dentro del grupo del total de los pacientes que presentan algún tipo de RLPI (147) el 72,8% son mujeres, frente al 27,2% de los hombres. Si analizamos por separado la población de mujeres y hombres obtenemos que en el total de las mujeres entrevistadas (125) el 85,6% presenta algún tipo de RLPI, y en el total de hombres entrevistados (69) el 58% presenta algún tipo de RLPI (p<0,001), por lo que los hombres tienen una incidencia de RLPI mucho menor que las mujeres (fig. 1).
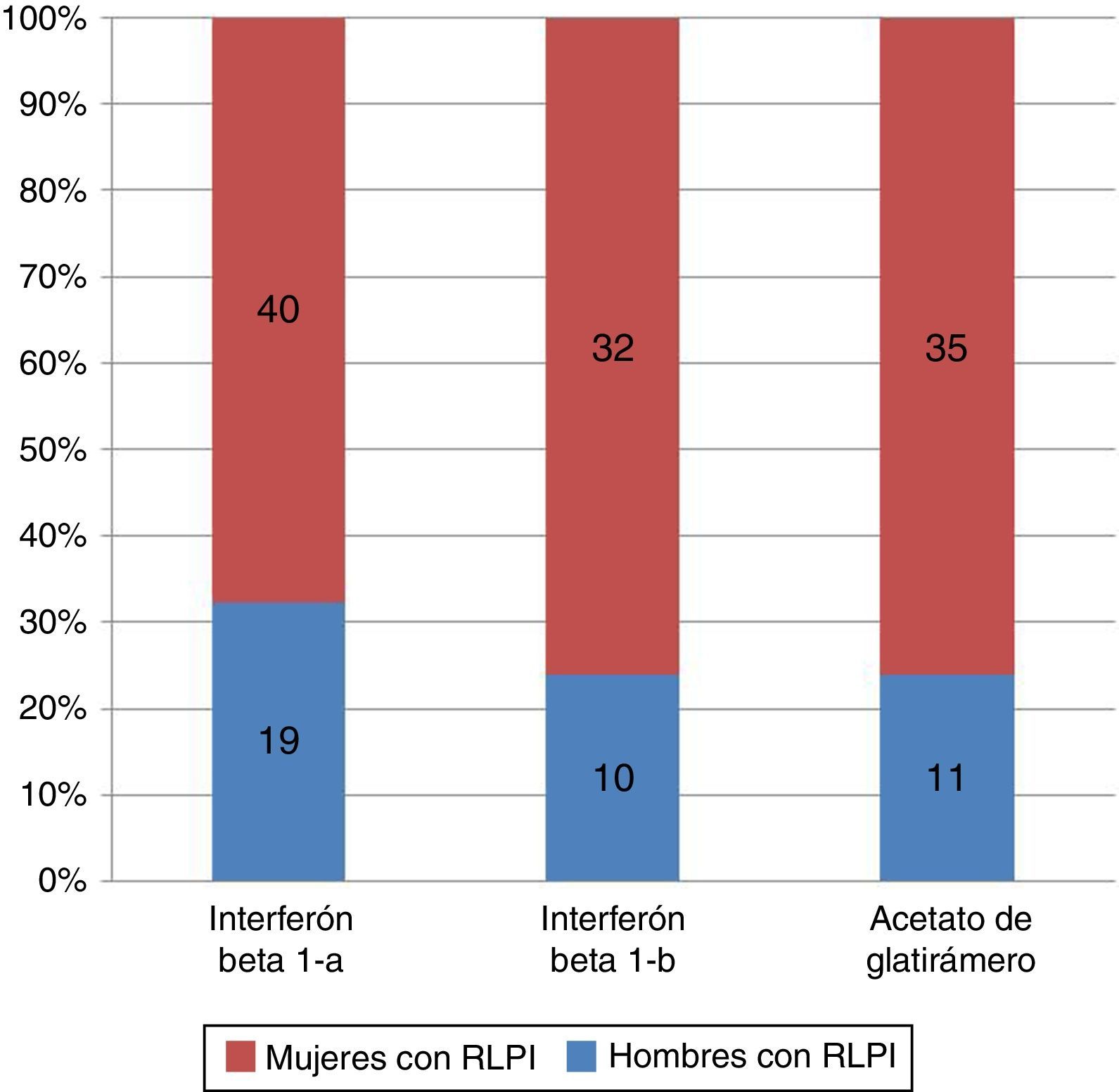
La frecuencia de aparición de RLPI por sexo y por tipo de fármaco inmunomodulador es similar en los 3 grupos (p=0,4) (fig. 2).
Meses de tratamiento: la media de duración del tratamiento es diferente en los 3 fármacos —acetato de glatirámero 56,8 meses (DE: 43,8), interferón beta 1-a 71, 6 meses (DE 51,2), interferón beta 1-b 97,2 meses (DE: 74,1)—, siendo el valor de p=0,001; sin embargo, dentro de cada fármaco no existen diferencias significativas en relación con los meses de tratamiento entre los que presentan RLPI y los que se encuentran libres de RLPI, siendo el valor de p en cada caso el siguiente: acetato de glatirámero (p=0,32), interferón beta 1-a (p=0,86) e interferón beta 1-b (p=0,43).
La media de meses de tratamiento entre los pacientes que presentan RLPI es de 74,65 (DE 55,14) meses, frente a los que están libres de RLPI que llevan una media de 71,04 (DE 59,68) meses (p=0,71).
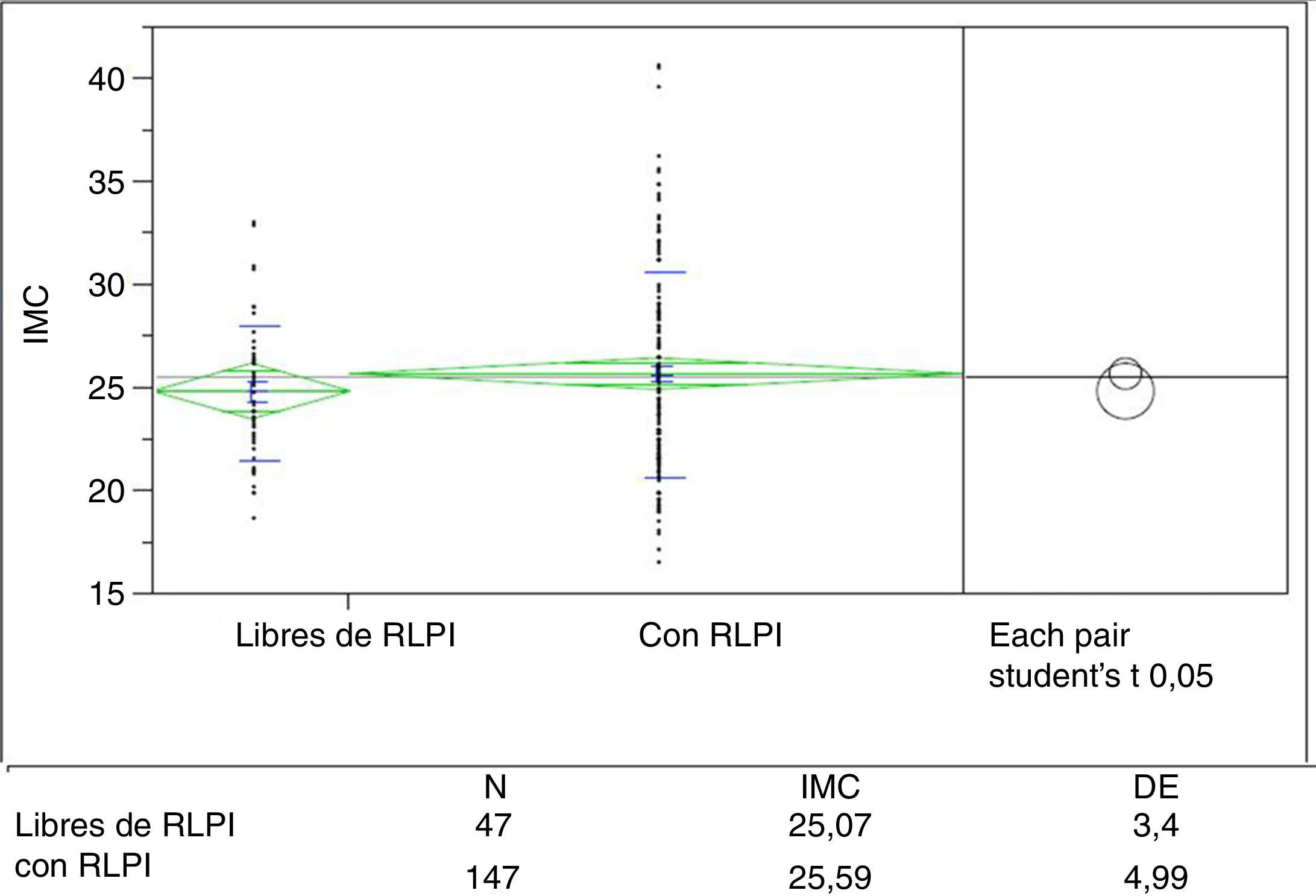
La media en el IMC en los que presentan RLPI es 25,5 (DE: 3,45) y en los que se encuentran libres de RLPI es 25,0 (DE: 4,99), (p=0,51). Se establecieron 2 grupos, separando a los pacientes con y sin presencia de RLPI por el IMC menor/mayor o igual a 25: no se encontraron diferencias estadísticamente significativas en los grupos (p=0,4); entre los que no presentan RLPI el 46,8% tiene un IMC≥25, y entre los que presentan algún tipo de RLPI el 47,6% tiene un IMC≥25. Asimismo, la obesidad, mostrada por un IMC≥30, no está relacionada con la mayor aparición de RLPI. En el grupo de pacientes sin RLPI el porcentaje de obesos que obtuvimos es 10,6%, y en el grupo de pacientes con RLPI el porcentaje de obesos es 17,6% (p=0,2). La elevación del IMC no está relacionada con la aparición de RLPI (p>0,05). En la figura 3 se muestra la distribución de sujetos por su IMC en 2 grupos, con RLPI y libres de RLPI (fig. 3).
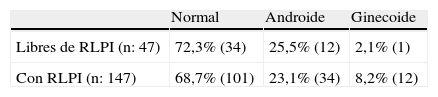
Distribución de la grasa corporal: la proporción de personas con síndrome androide, ginecoide y distribución de la grasa normal es similar en el grupo de pacientes con RLPI y los que se encuentran libres de RLPI, sin diferencias significativas entre los 2 grupos (p=0,35) (tabla 2).
Fototipo: la proporción de fototipos iiiy iv es similar en toda la muestra y no existen diferencias en el grupo de pacientes que presentan RLPI y los que se encuentran libres de RLPI (p=0,40).
Patrón de ejercicio: existe una proporción mayor de pacientes libres RLPI que realizan ejercicio moderado-activo (61,7%) frente a sedentarios (38,3%), así como una proporción mayor de pacientes que sí presentan RLPI y son sedentarios (52,4%), frente a los que presentan RLPI y realizan ejercicio moderado-activo (47,6%). Sin embargo, el valor de p=0,68, por lo que no existen diferencias estadísticamente significativas.
Tipo de dieta: entre los pacientes que se encuentran libres de RLPI el porcentaje de los que siguen una dieta favorable para la salud es mayor (80,9%) que entre el grupo de pacientes que presentan algún tipo de RLPI, en el que este porcentaje es menor (68,0%). El valor de p=0,035, lo que indica que el patrón de dieta, es decir, seguir una dieta favorable para la salud, está relacionado con la menor aparición de RLPI.
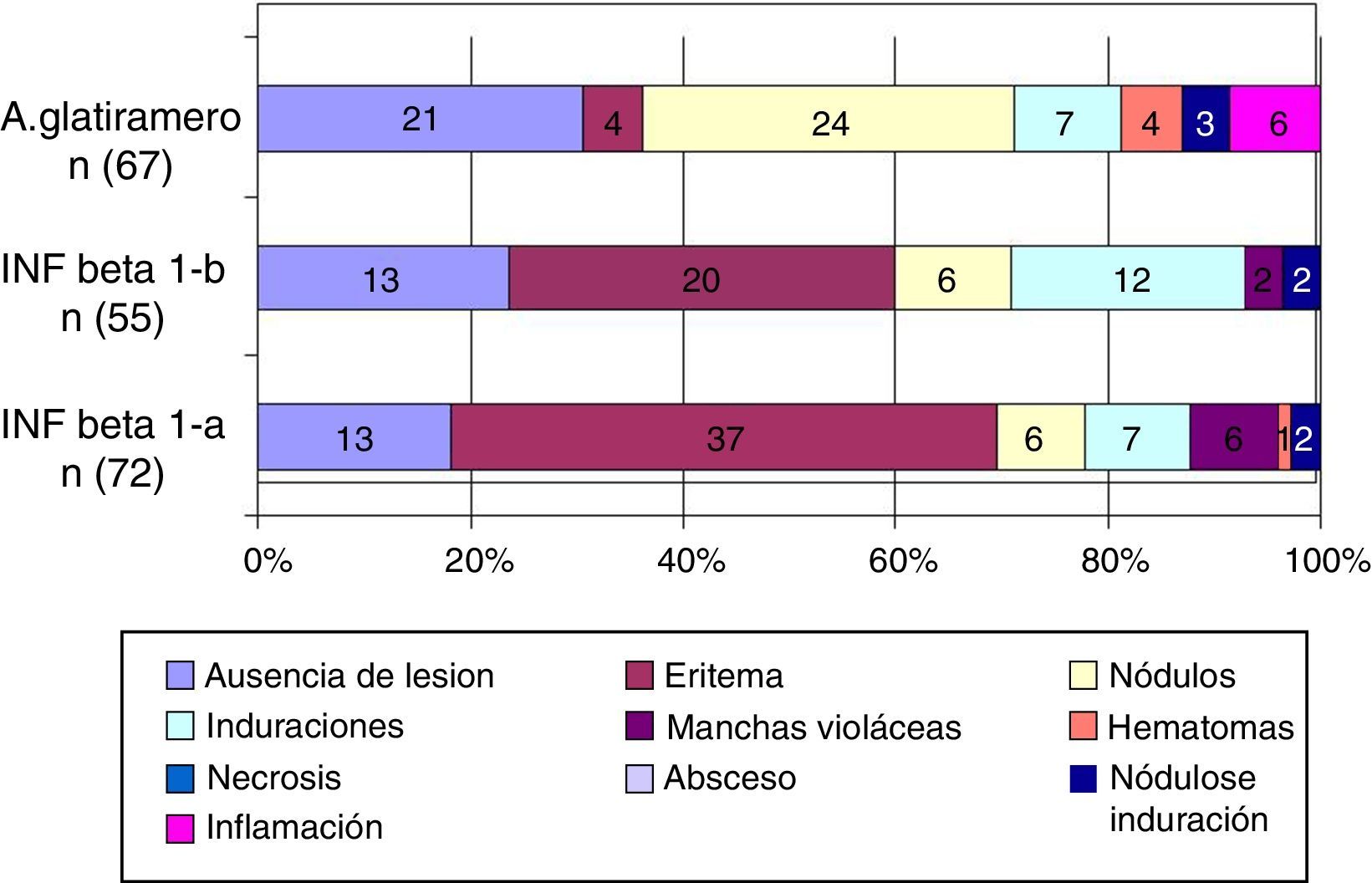
En cuanto a la aparición de cada tipo de RLPI, de mayor a menor frecuencia, presentan el siguiente orden: eritema, nódulos, induraciones, manchas violáceas, lipoatrofia, inflamación, hematomas, necrosis cutáneas y abscesos. Existen diferencias significativas en cuanto al tipo de RLPI por fármaco: interferón beta 1-a y beta 1-b producen más reacciones de tipo eritema e induración respecto a acetato de glatirámero (p<0,001); acetato de glatirámero produce más reacciones de tipo nódulos subcutáneos e induración respecto a interferón beta (p<0,001) (fig. 4).
DiscusiónSe han hallado variables determinantes para la aparición de RLPI, como son: personas del sexo femenino (con la mayor significación estadística en el estudio), al igual que se había concluido en estudios previos23–25. Y, por otro lado, seguir una dieta no favorable para la salud (rica en grasas y con bajo nivel de frutas, verduras y líquidos). En la literatura médica hasta hoy no tenemos constancia de la relación de la dieta con la aparición de RLPI, aunque sí está descrito que las bases moleculares de la fisiología humana muestran que existe una relación directa entre los alimentos y el proceso inflamatorio26, lo que induce a pensar que el consumo de determinados alimentos podría favorecer la aparición de RLPI. Basándonos en este dato, continuaremos nuestra investigación mediante un estudio más exhaustivo que relacione la alimentación con la aparición de RLPI.
Las otras variables estudiadas (edad, fototipo, IMC y distribución de la grasa corporal) han demostrado no tener relevancia en nuestro estudio.
En cuanto a la duración del tratamiento existen diferencias en los 3 grupos de tratamiento: la duración del tratamiento en pacientes con interferón beta 1-b es mayor (m. de 97,2 meses de media), puesto que es el primer fármaco inmunomodulador que se utilizó, respecto a acetato de glatirámero (m. de 56,8 meses de media), que es el más moderno. Sin embargo, como hemos visto, la duración del tratamiento no influye necesariamente en la aparición de un mayor número de RLPI, como viene impresionando entre las enfermeras hasta ahora. El grupo de pacientes que lleva más tiempo de tratamiento no es el que presenta RLPI con más frecuencia y la media de meses de tratamiento de los que presentan RLPI y los que están libres de RLPI es muy similar.
Al igual que en estudios previos25 ambos tipos de interferón beta han demostrado inducir RLPI con mayor frecuencia que acetato de glatirámero, y los tipos de RLPI varían respecto al fármaco inmunomodulador: las más frecuentes con interferón beta 1-a y beta 1-b son eritemas, induraciones y nódulos y con acetato de glatirámero nódulos, induraciones e inflamación7,16.
Una de las limitaciones para la realización del estudio que hemos encontrado trata acerca del estudio de la variable «dieta favorable» y patrón de ejercicio: quizás se ha utilizado un sistema de medición poco adecuado, ya que es limitado en cuanto a la clasificación favorable/no favorable para la salud.
Por otro lado, a medida que realizábamos el análisis de los datos advertimos la necesidad de desarrollar subestudios para el examen más profundo de cada variable, con el fin de obtener resultados más detallados acerca de cada variable en cuestión.
ConclusionesEn la aparición de RLPI por inmunomoduladores por vía subcutánea en el tratamiento de la EM existen factores relacionados como son el sexo femenino, llevar una dieta rica en grasa y baja en fruta, verdura y líquidos. La distribución de la grasa corporal, un IMC elevado, el ejercicio físico y el fototipo de piel no determinan mayor o menor riesgo de aparición de RLPI.
La duración prolongada del tratamiento no está relacionada necesariamente con la aparición de un mayor número de RLPI.
Interferón beta 1-a y beta 1-b ocasionan más RLPI tipo eritemas, induraciones y nódulos y acetato de glatirámero, por su parte, nódulos, induraciones e inflamación.
FinanciaciónProyecto galardonado con el premio especial de investigación SEDENE 2012, dotado con 1.900 euros.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al Dr. Polo, estadístico del Hospital Universitario Virgen Macarena.
Tipo de lesión más frecuente/numerosa:
Medidas antropométricas:
Peso: Altura: IMC:
Distribución de grasa corporal:
- -
Perímetro cintura (por debajo de las últimas costillas): n.° 1: n.° 2: n.° 3: media:
- -
Perímetro caderas (la zona de mayor perímetro): n.° 1: n.°2: n.° 3: media:
Índice cintura cadera: /=: androide/ginecoide/normal
ICC=0,71-0,84 normal para mujeres.
ICC=0,78-0,94 normal para hombres.
Valores mayores: síndrome androide
Valores menores: síndrome ginecoide
Ejercicio físico:
Sedentario: camina esporádicamente.
Medio: alguna actividad física en gimnasio/fisio/caminar 1h, 2 veces en semana.
Activo: alguna actividad física en gimnasio/fisio/caminar 1hora, 4-7 veces en semana.
Fototipo:
Tipo I: pelirrojos o rubios con piel y ojos muy claros.
Tipo II: pelirrojo o rubio con piel u ojos claros.
Tipo III: rubio o castaño con piel u ojos oscuros.
Tipo IV: castaño con piel y ojos oscuros.
Tipo V: latinoamericanos, indios, indígenas.
Tipo VI: negros
Alimentación:
Saludable (2 o más de las siguientes):
- -
Bebe más de 1,5l de líquido al día (no alcohol).
- -
Toma frutas y/o verduras todos los días.
- -
Consume grasas saturadas y dulces ocasionalmente (uno o 2 en semana).
Poco saludable (2 o más de las siguientes):
- -
Bebe menos de 1,5l de líquido al día.
- -
No toma fruta o verdura todos los días.
- -
Consume grasas saturadas y dulces habitualmente (más de 3 en semana).
Premio de Investigación en Enfermería Neurológica 2012.