La coexistencia de síndrome de Cushing y embarazo es rara. El diagnóstico es difícil, ya que la gestación produce síntomas y signos de hipercortisolismo. Su tratamiento idealmente es quirúrgico, pero conlleva un importante incremento de la morbimortalidad materna y fetal debido a complicaciones como hipertensión, preeclampsia, diabetes gestacional, aborto y parto pretérmino. Presentamos el caso de una primigestante de 32 semanas con síndrome de Cushing secundario a un adenoma suprarrenal funcional programada para cesárea.
The coexistence of Cushing syndrome and pregnancy is rare. Diagnosis is difficult because pregnancy can be accounted for signs and symptoms of hypercortisolism. Ideally, the treatment is surgical, though it implies a significant rise in morbidity and mortality for both the mother and the fetus. This is due to the increased number of complications such as hypertension, preeclampsia, gestational diabetes, abortion and preterm delivery. We present the case of a primiparous patient with a 32 week gestation and Cushing syndrome secondary to a functional adrenal adenoma who's been scheduled for a caesarean section.
La coexistencia de síndrome de Cushing y embarazo es rara. Se han descrito aproximadamente 140 casos en mujeres con edad gestacional promedio al diagnóstico de 18 semanas1,2. La mayoría presentaron adenoma adrenal con resección quirúrgica exitosa durante el embarazo. Pocos casos reportan la terminación de la gestación con persistencia del tumor y sus complicaciones asociadas. En este reporte se discute el manejo anestésico de una paciente con síndrome de Cushing secundario a un adenoma adrenal, programada para cesárea urgente y cuyas consideraciones para esta patología se aplican también en los casos electivos.
Caso clínicoPrimigestante de 33 años, con embarazo de 26 semanas, previamente sana, quien consulta por primera vez porque a partir de la semana 19 inicia edemas periféricos, astenia, adinamia, diaforesis, hirsutismo, hipertensión arterial y equimosis espontáneas en miembros inferiores. Al examen físico presenta presión arterial (PA) de 130/90mmHg, frecuencia cardiaca de 104/min, frecuencia respiratoria de 20/min, índice de masa corporal de 27kg/m2, fascies abotagada, hirsutismo, acné, MalampatiIII, distancia tiromentoniana de 6cm, buena extensión cervical, estrías abdominales, telangiectasias, edema gradoIII de miembros inferiores y taquicardia fetal (160-170/min). Sin masas cervicales ni picos febriles.
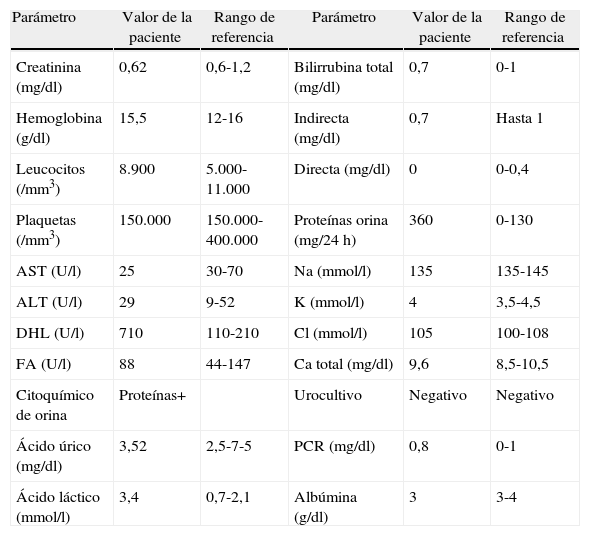
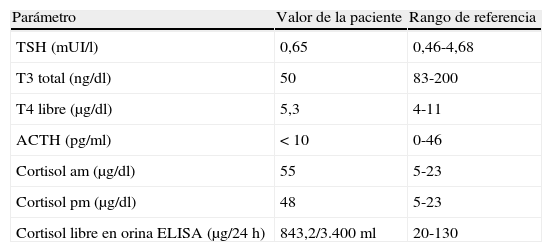
Se encuentra test de O'Sullivan positivo y prueba de tolerancia a la glucosa alterada. Proteinuria en orina de 24h de 360mg. Se realiza test de supresión con dexametasona 1mg vía oral, sin supresión de cortisol. Perfil reumatológico y gases arteriales normales. La ecografía de abdomen total mostró una lesión sólida en el polo superior del riñón izquierdo. La resonancia de abdomen, contrastada con gadolinio, muestra una masa adrenal izquierda de 5×5×4cm, con comportamiento de hipointensidad en secuencias T1 y caída en la intensidad de la señal en las secuencias de fuera de fase, más atrofia de la glándula adrenal derecha. La tabla 1 muestra el perfil bioquímico y la tabla 2 muestra el perfil hormonal de la paciente. Con estos resultados se establece el diagnóstico de síndrome de Cushing secundario a adenoma suprarrenal izquierdo funcional, asociado a diabetes mellitus gestacional y preeclampsia.
Perfil bioquímico de la paciente
| Parámetro | Valor de la paciente | Rango de referencia | Parámetro | Valor de la paciente | Rango de referencia |
| Creatinina (mg/dl) | 0,62 | 0,6-1,2 | Bilirrubina total (mg/dl) | 0,7 | 0-1 |
| Hemoglobina (g/dl) | 15,5 | 12-16 | Indirecta (mg/dl) | 0,7 | Hasta 1 |
| Leucocitos (/mm3) | 8.900 | 5.000-11.000 | Directa (mg/dl) | 0 | 0-0,4 |
| Plaquetas (/mm3) | 150.000 | 150.000-400.000 | Proteínas orina (mg/24 h) | 360 | 0-130 |
| AST (U/l) | 25 | 30-70 | Na (mmol/l) | 135 | 135-145 |
| ALT (U/l) | 29 | 9-52 | K (mmol/l) | 4 | 3,5-4,5 |
| DHL (U/l) | 710 | 110-210 | Cl (mmol/l) | 105 | 100-108 |
| FA (U/l) | 88 | 44-147 | Ca total (mg/dl) | 9,6 | 8,5-10,5 |
| Citoquímico de orina | Proteínas+ | Urocultivo | Negativo | Negativo | |
| Ácido úrico (mg/dl) | 3,52 | 2,5-7-5 | PCR (mg/dl) | 0,8 | 0-1 |
| Ácido láctico (mmol/l) | 3,4 | 0,7-2,1 | Albúmina (g/dl) | 3 | 3-4 |
Perfil hormonal de la paciente
| Parámetro | Valor de la paciente | Rango de referencia |
| TSH (mUI/l) | 0,65 | 0,46-4,68 |
| T3 total (ng/dl) | 50 | 83-200 |
| T4 libre (μg/dl) | 5,3 | 4-11 |
| ACTH (pg/ml) | < 10 | 0-46 |
| Cortisol am (μg/dl) | 55 | 5-23 |
| Cortisol pm (μg/dl) | 48 | 5-23 |
| Cortisol libre en orina ELISA (μg/24 h) | 843,2/3.400ml | 20-130 |
Se realiza ecocardiografía, que revela fracción de eyección del 66%, hipertensión pulmonar leve (presión sistólica de la arteria pulmonar, 27mmHg) y derrame pericárdico 350-400ml, sin repercusión hemodinámica.
La ecografía muestra placenta corporal anterior y feto único. Cervicometría normal. Perfil biofísico 8/8 y doppler fetal normal. Doppler de arterias uterinas con aumento de la resistencia de las arterias uterinas. No se encontraron paraclínicos para descartar feocromocitoma, probablemente porque la clínica no era sugestiva.
Se inicia maduración pulmonar, enoxaparina profiláctica, medias antiembólicas, alfametildopa y terapia insulínica por mal control metabólico con dieta. Durante su hospitalización y la realización de los diferentes estudios para obtener el diagnóstico, llega a la semana 32 de edad gestacional. Se interconsulta a cirugía general, quienes consideran que la paciente es candidata a adrenalectomía posparto, ya que los riesgos de una cirugía no obstétrica en el tercer trimestre pueden sobrepasar los beneficios. Fue evaluada por el grupo de anestesiología y se sugirió drenaje de derrame pericárdico guiado por vigilancia de la paciente, pero debido al deterioro clínico —como acidosis metabólica, hipertensión arterial no contralada y ruptura espontánea de membranas con líquido hemático— se sospecha abruptio y se programa para cesárea urgente. Tenía suspendida la enoxaparina 24h previo a cirugía, y se premedica con ranitidina 50mgi.v., metoclopramida 10mgi.v. e hidrocortisona 100mgi.v. Se reservan 3 unidades de glóbulos rojos y 5 unidades de plasma fresco congelado, unidad de cuidados intensivos neonatal y unidad de cuidados especiales para la madre. Presenta accesos venosos periféricos difíciles.
Al ingreso a quirófano la paciente se encuentra con PA de 170/90. Se coloca una línea arterial radial y se inician bolos de labetalol i.v. titulados hasta lograr presiones arteriales sistólicas <160mmHg (total, 140mg), más sulfato de magnesio (bolo 4gi.v., infusión 2g/h). Se inserta catéter venoso central subclavio derecho de alto flujo. Se realiza punción intratecal en espacio L3-L4 con aguja 25G punta de lápiz, inyección lenta de bupivacaína pesada 7.5mg, fentanilo 25μg y morfina 100μg, logrando nivel sensitivo en T4. Durante el intraoperatorio la paciente permanece estable hemodinámicamente. No requirió vasopresores ni transfusiones. Se realizó glucometría intraoperatoria, de 119mg/dl. El producto es un recién nacido prematuro, con un peso de 1.570g y con adecuada adaptación neonatal. Se trasladó a la unidad de cuidados especiales con una estancia de 5 días por el desarrollo posterior de sepsis urinaria por E. coli que requirió vasopresor e inotrópico, se descartó cardiomiopatía periparto y se realizó ventana pericárdica, con lo cual mejoró clínicamente. El líquido pericárdico mostró inflamación crónica, sin infección ni malignidad. Ingresó para resección del tumor por laparoscopia, sin complicaciones.
DiscusiónEl síndrome de Cushing es el conjunto de síntomas y signos secundarios a un exceso de glucocorticoides independiente de la etiología3-5. La principal causa es exógena, por el consumo de esteroides3,4. El síndrome se divide en:
- •
Dependiente de ACTH. Es la forma más común. En el 80% de los casos corresponde a tumores pitiuitarios, y el otro 20%, a focos de secreción ectópica de ACTH3,4.
- •
Independiente de ACTH. En el 20% de los casos se debe a adenomas adrenales3,4. La incidencia se calcula en 2,3 millones de casos anuales, con una proporción de 3:1 entre mujeres y hombres3. El diagnóstico de síndrome de Cushing durante el embarazo requiere un alto índice de sospecha clínica. El tamizaje también se dificulta, ya que los cambios en el embarazo producen signos de hipercortisolismo como ganancia de peso, amenorrea, fatiga, plétora, dolor de espalda y cambios en el estado de ánimo2,6.
Los adenomas adrenales causan el 40-50% de síndrome de Cushing durante el embarazo, comparado con el 15% en las no embarazadas2,7. Las complicaciones maternas son intolerancia a la glucosa, diabetes gestacional, hipertensión, preeclampsia, falla cardiaca, edema pulmonar, miopatía, osteoporosis, fracturas, alteración de la cicatrización, infección de herida quirúrgica, alteraciones psiquiátricas severas y muerte materna. Se han descrito 2 casos de síndrome de Cushing y desarrollo súbito y severo de HELLP temprano2,8. Las complicaciones fetales son aborto, parto pretérmino, restricción del crecimiento intrauterino, hipoadrenalismo y muerte perinatal6,9.
Las metas para un adecuado tratamiento son confirmar la presencia de exceso patológico de cortisol, determinar la fuente y removerla para prevenir las complicaciones6.
El diagnóstico es bioquímico, con aumento del cortisol libre en orina (valores durante el segundo o tercer trimestre de 3 veces el límite superior) y alteración del ritmo circadiano del cortisol (preservado en el embarazo)5,8-10. El aumento del cortisol diurno no es diagnóstico, ya que se encuentra también elevado en el embarazo7. La ACTH no está suprimida en las causas adrenales. Luego, se debe confirmar el sitio de secreción de cortisol con imágenes, preferentemente la resonancia magnética10.
El tratamiento de elección es quirúrgico durante el segundo trimestre, tanto para el adenoma adrenal como para el pituitario. Como segunda opción se da tratamiento médico con metirapone, un inhibidor de la síntesis de cortisol que ha sido bien tolerado pero que no se encuentra disponible en nuestro medio. El ketoconazol es teratogénico en ratas, presenta paso transplacentario, inhibe la producción de progesterona y hay poca experiencia en humanos6,10.
La paciente del caso clínico era asintomática antes del embarazo, y cuando se programó para cesárea continuaba con el tumor adrenal.
Una materna con síndrome de Cushing requiere de un manejo multidisciplinario con endocrinólogo, obstetra, anestesiólogo, neonatólogo, cirujano y nutricionista. En la evaluación preoperatoria se debe descartar tumoración mixta, como el feocromocitoma y coexistencia de preeclampsia, que empeora el pronóstico y modifica el manejo6. El manejo de la vía aérea puede ser difícil por la obesidad y el aumento del tejido graso en el cuello y en el área esternal (cuello de búfalo) que limita la extensión cervical11. La fragilidad de la piel y de los vasos sanguíneos hace difícil la venopunción11. Se deben descartar alteraciones electrolíticas, principalmente alcalosis hipokalémica, y optimizar el control metabólico con insulina. Estas pacientes hacen hiperglucemias persistentes por estimulación de gluconeogénesis y menor uso de la glucosa periférica.
Durante el transoperatorio hay que ser muy cuidadosos con la posición de estas pacientes por el alto riego de fracturas patológicas secundarias a osteoporosis12. Se debe tener estricta asepsia y antisepsia debido a su mayor susceptibilidad a la infección12. La técnica anestésica regional debe emplearse si no hay contraindicaciones para invadir el neuroeje.
En el postoperatorio debe vigilarse el riesgo de falla ventilatoria por la menor masa muscular respiratoria, la hipokalemia y obesidad asociadas11.
ConclusiónEl síndrome de Cushing durante el embarazo es una entidad rara y puede ser confundida con preeclampsia o diabetes gestacional. Una adecuada aproximación multidisciplinaria permite realizar un correcto diagnóstico y efectuar un plan anestésico para la paciente programada para cesárea o para cirugía no obstétrica y conseguir un mejor desenlace fetomaterno.
FinanciaciónNinguna.
Conflicto de interesesNinguno.