Determinar si el nivel de fibrinógeno al inicio de la hemorragia posparto se asocia con la severidad del sangrado y con mayor número de complicaciones; además, definir los puntos de corte que se relacionan con el desenlace.
Materiales y métodosAnálisis secundario de un estudio de cohortes realizado en 79 madres que ingresaron con diagnóstico de hemorragia posparto, definido como todo sangrado mayor de 1.000ml, a la Unidad de Cuidados Intensivos entre el 1 de febrero de 2012 al 31 de enero de 2013. Los niveles de fibrinógeno se realizaron al inicio de la hemorragia posparto. Se comparó el valor de fibrinógeno entre las pacientes que presentaron hemorragia obstétrica severa contra las hemorragias obstétricas leve-moderada, y de esta forma se correlaciona el valor del fibrinógeno con la severidad de la hemorragia y las complicaciones presentadas en las pacientes.
ResultadosEl 24,1% de las pacientes presentaron hemorragia posparto severa y se compararon contra el 75,9% de las pacientes clasificadas como leve y moderada. Se presentaron 12 complicaciones (15,2%), de las que 9 fueron injuria renal aguda, 2 coagulación intravascular diseminada y muerte en un paciente, todas en pacientes con hemorragia obstétrica severa. En cuanto al nivel inicial de fibrinógeno, el AUC-ROC para el valor de fibrinógeno y su relación con severidad fue de 0,71, con un punto de corte <200mg/dl para predecir severidad (valor predictivo positivo 100%).
ConclusiónEl nivel de fibrinógeno inicial en hemorragia obstétrica posparto es un predictor de severidad que ayuda a alertar el tratamiento en estas pacientes.
To determine if the level of fibrinogen at the onset of postpartum haemorrhage is associated with bleeding severity and a higher number of complications; to determine outcome-related cut-off points.
Materials and methodsSecondary analysis of a cohort study conducted with 79 mothers admitted to the Intensive Care Unit between February 1st, 2012 and January 31st, 2013, with a diagnosis of postpartum haemorrhage, defined as all cases of blood loss greater than 1000mL. Fibrinogen levels were measured at the onset of the postpartum haemorrhage. Fibrinogen values were compared between patients with severe obstetric bleeding and those with mild-to-moderate bleeding, in order to establish the correlation with severity of blood loss and complications.
ResultsOverall, 24.1% of the patients showed severe postpartum haemorrhage compared to 75.9% of the patients classified as having mild-to-moderate haemorrhage. There were 12 complications (15.2%), including 9 cases of acute renal injury, 2 cases of disseminated intravascular coagulation, and one death, all of them only in patients with severe obstetric haemorrhage. Regarding the initial fibrinogen value, the AUC-ROC for fibrinogen levels and their relationship with the severity was 0.71, with a cut-off point of <200mg/dL to predict severity (100% positive predictive value).
ConclusionThe initial fibrinogen level in obstetric postpartum haemorrhage is a predictor of severity that helps in alerting to the need for treatment in these patients.
A nivel mundial, tanto para los países desarrollados como para aquellos en vía de desarrollo, la hemorragia obstétrica continúa siendo una causa importante de mortalidad1. Entre esta, la hemorragia posparto (HPP) es la principal causa, en donde la atonía uterina ocupa el 70% y se mantiene como principal desencadenante de HPP masiva y complicación por coagulopatía2.
Dentro de la evaluación de la HPP contamos con variables clínicas, hemodinámicas y de laboratorio para clasificar la severidad del sangrado3 y valorar aquellas pacientes que se benefician de transfusiones masivas tempranas4, ingreso a Unidad de Cuidados Intensivos y aquellas en riesgo de presentar las complicaciones derivadas del shock hemorrágico severo. La causa más importante de mortalidad materna debida a la HPP secundaria a atonía uterina se debe a terapias transfusionales inadecuadas y reemplazos de volumen intravascular insuficiente5, así como inadecuado control de la hemorragia, en pacientes que se aprecian clínicamente «estables», lo cual hace de vital importancia el reconocimiento temprano de las pacientes que puedan progresar a disfunción orgánica y aumento del riesgo vital.
La actividad procoagulante aumenta el doble al final del embarazo; por lo cual, cuando ocurre HPP, el tiempo de trombina y el tiempo parcial de tromboplastina podrán resultar normal, enmascarando pacientes con evolución hacia coagulopatía de forma temprana. Cuando el valor del fibrinógeno cae a un valor <100mg/dl se ha relacionado con una pérdida de 1,4 volemias, lo que asocia el valor del fibrinógeno con la severidad de la HPP6.
El objetivo de este estudio fue determinar si el nivel de fibrinógeno al inicio de la HPP se asocia con la probabilidad de complicaciones maternas, y definir los puntos de corte que se relacionan con el desenlace.
Materiales y métodosAnálisis secundario de un estudio de cohortes7 en madres que se recogieron de forma prospectiva en una Unidad de Cuidado Intensivos obstétricos, que ingresaban con diagnóstico de HPP, entre el 1 de febrero de 2012 y el 31 de enero de 2013. Con base en los registros de esta cohorte de pacientes, se evaluó el valor de fibrinógeno al ingreso, correlacionando el resultado con la presencia o no de complicaciones secundarias a la hemorragia, al alta de la unidad. La HPP se definió como todo sangrado mayor de 1000ml secundario a parto vaginal o cesárea, estimado por el obstetra tratante al momento de la hemorragia.
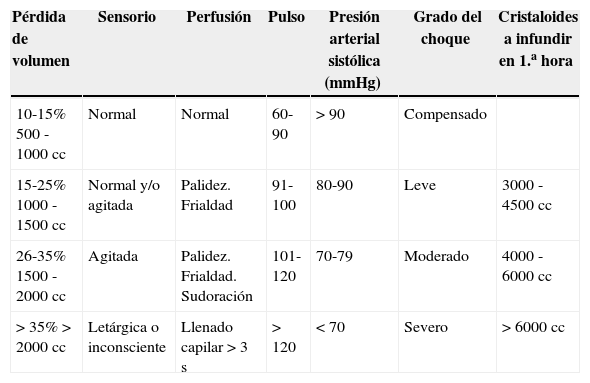
La severidad de la hemorragia se definió con base en el peor parámetro clínico de la clasificación del shock hemorrágico (tabla 1) o un sangrado inicial estimado mayor de 2000ml. Se excluyeron las madres que presentaban enfermedades asociadas como sepsis, enfermedad hepática previa, cetoacidosis y enfermedad cardiaca, ya que este estudio es un análisis secundario de un estudio donde se evaluó el ácido láctico como marcador pronóstico en hemorragia obstétrica, y las anteriores condiciones patológicas pueden elevar los valores de ácido láctico; igualmente, estas patologías se relacionan con alteración de los parámetros de coagulación que pueden alterar el valor del fibrinógeno, no relacionado con la severidad de la HPP, por lo cual también fueron excluidas.
Clasificación de severidad del shock
| Pérdida de volumen | Sensorio | Perfusión | Pulso | Presión arterial sistólica (mmHg) | Grado del choque | Cristaloides a infundir en 1.a hora |
|---|---|---|---|---|---|---|
| 10-15% 500 - 1000 cc | Normal | Normal | 60-90 | > 90 | Compensado | |
| 15-25% 1000 - 1500 cc | Normal y/o agitada | Palidez. Frialdad | 91-100 | 80-90 | Leve | 3000 - 4500 cc |
| 26-35% 1500 - 2000 cc | Agitada | Palidez. Frialdad. Sudoración | 101-120 | 70-79 | Moderado | 4000 - 6000 cc |
| > 35% > 2000 cc | Letárgica o inconsciente | Llenado capilar > 3 s | > 120 | < 70 | Severo | > 6000 cc |
Fuente: modificado Baskett3.
Se realizó medición del valor de fibrinógeno una vez, al inicio de la HPP, de acuerdo con el protocolo de la unidad para el manejo de estas pacientes, luego se comparó el valor inicial de fibrinógeno con el estándar de oro, que en este caso fue el seguimiento clínico de la paciente al alta, y la presencia o no de complicaciones definidas como injuria renal aguda8, coagulación intravascular diseminada9, muerte, necesidad de reintervención para histerectomía y síndrome de dificultad respiratoria del adulto10. El resultado final fue la presencia o no de complicaciones, no el grado de severidad de la hemorragia, la cual se clasificó de la forma clínica usual descrita anteriormente.
Para determinar la exactitud diagnóstica del fibrinógeno en relación con la presencia de complicaciones al alta de las pacientes de la unidad, se realizó curva ROC; el área bajo la curva fue estimada para evaluar la precisión del nivel de fibrinógeno para valorar la probabilidad de complicaciones en HPP, determinando el punto de corte de mayor sensibilidad y especificidad. Un valor de p<0,05 fue definido como significativo. Para el manejo estadístico se utilizó el programa SPSS versión 17.
Teniendo en cuenta que la información recolectada se realizó con base en registros y no se efectuó ninguna intervención o modificación de las variables de las pacientes, el presente estudio se considera una investigación sin riesgo11. En toda la realización del estudio se siguieron los principios éticos para investigación en seres humanos, promulgados por la Asociación Médica Mundial en la declaración de Helsinki12, y recibió la autorización del comité de investigación y ética de la institución para la recolección de datos y realización del estudio.
ResultadosSe recolectaron 79 pacientes con hemorragia obstétrica posparto en la cohorte inicial, con un promedio de edad de 24,6años; 19 pacientes (24,1%) presentaron HPP severa comparado con 60 pacientes (75,9%) que presentaron HPP moderada y leve. Todas las historias clínicas de las pacientes contenían el valor inicial de fibrinógeno, por lo cual ingresaron en el análisis.
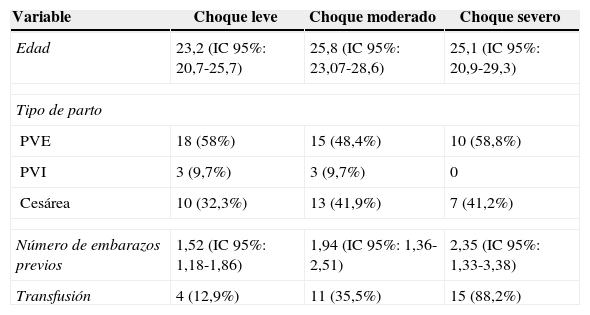
Las características demográficas se describen en la tabla 2. No se encontraron diferencias significativas entre la edad, el número de embarazos previos de las pacientes o la vía del parto, con respecto a la severidad de la hemorragia (tabla 2).
Características demográficas
| Variable | Choque leve | Choque moderado | Choque severo |
|---|---|---|---|
| Edad | 23,2 (IC 95%: 20,7-25,7) | 25,8 (IC 95%: 23,07-28,6) | 25,1 (IC 95%: 20,9-29,3) |
| Tipo de parto | |||
| PVE | 18 (58%) | 15 (48,4%) | 10 (58,8%) |
| PVI | 3 (9,7%) | 3 (9,7%) | 0 |
| Cesárea | 10 (32,3%) | 13 (41,9%) | 7 (41,2%) |
| Número de embarazos previos | 1,52 (IC 95%: 1,18-1,86) | 1,94 (IC 95%: 1,36-2,51) | 2,35 (IC 95%: 1,33-3,38) |
| Transfusión | 4 (12,9%) | 11 (35,5%) | 15 (88,2%) |
PVE: Parto Vértice Espontáneo; PVI: Parto Vértice Instrumentado.
Fuente: autores.
Dentro de las causas de la HPP, la mayoría fue por atonía uterina (62%), seguido por desgarro cervical o vaginal (13,9%), abruptio de placenta, rotura uterina, acretismo y retención de placenta (5,1% cada una), placenta previa (2,5%) e inversión uterina (1,3%) (fig. 1). No se encontró relación entre la causa de la hemorragia y la severidad de la misma.
La principal comorbilidad presentada por las pacientes fue el trastorno hipertensivo asociado al embarazo en 21 pacientes (26,6%), sin encontrar relación con la severidad de la hemorragia entre las pacientes con esta comorbilidad. Se presentaron 12 pacientes (15,2%) con complicaciones, de las cuales 9 (11,4%) fueron injuria renal aguda (todas AKINI), coagulación intravascular diseminada en 2 (2,5%) y muerte en una paciente (1,3%).
El tratamiento de la reanimación fue similar en todas las pacientes, de acuerdo a metas hemodinámicas y parámetros de perfusión. El uso de transfusión de hemoderivados quedó a criterio del médico a cargo de la unidad, con un total de 30 pacientes (38%) transfundidas, de las cuales 4 fueron clasificadas como leve (12,9%), 11 como moderada (35,5%) y 15 como severa (88,2%). Algunas pacientes requirieron procedimientos adicionales al manejo farmacológico para el control de la hemorragia (25,4%), entre los que encontramos colocación de balón de Bakri a 7 (8,9%), uso de sutura B-Lynch en 10 (12,7%) e histerectomía en 3 pacientes (3,8%).
Todas las pacientes con un nivel de fibrinógeno igual o menor a 200mg/dl presentaron hemorragia severa, 12 de las cuales presentaron complicaciones (12/19, 63%), correspondiente al 100% del total de pacientes que presentaron complicaciones. Sin embargo, el 20,5% de las pacientes con un nivel de fibrinógeno mayor a 200mg/dl también fueron clasificadas como severas, pero ninguna de estas presentó complicaciones secundarias a la hemorragia. El AUC-ROC para el nivel de fibrinógeno y su relación con complicaciones fue de 0,71, con un punto de corte ≤200mg/dl para predecir complicaciones (VPP 100%) y un punto de corte ≥515mg/dl para predecir ausencia de complicaciones secundarias a HPP (sensibilidad 71%, especificidad 65%) (fig. 2).
DiscusiónLa actividad procoagulante aumenta el doble al final del embarazo. Estas modificaciones responden a la necesidad de ofrecer una rápida y efectiva hemostasia en el momento del desprendimiento placentario para evitar la hemorragia exanguinante, donde los principales cambios observados son el aumento de la concentración plasmática de fibrinógeno, de factorviii y de factor de Von Willebrand13.
En la HPP severa que requiere de la infusión de grandes cantidades de volumen intravascular se presenta frecuentemente coagulopatía dilucional, observándose prolongación del PTT y del PT y caída del nivel de fibrinógeno y recuento plaquetario, la mayoría de estos cambios de manera tardía. Además de esto, se presenta un consumo adicional de los factores de coagulación para generar trombos en los sitios de lesión vascular; los niveles plasmáticos disminuirán por debajo del umbral hemostático, incluyendo el fibrinógeno14.
En nuestro estudio, cuando el valor del fibrinógeno inicial disminuye por debajo de 200mg/dl se correlaciona con la severidad de la HPP y la presencia de complicaciones, como lo describen Cortet et al.15, en donde el nivel del fibrinógeno fue un factor independiente para la severidad de la HPP, con un OR=1,90 (IC95%: 1,16-3,09) para un valor de fibrinógeno entre 200-300mg/dl y con una mejor correlación cuando el fibrinógeno estaba por debajo de 200mg/dl (OR=11,99; IC95%: 2,56-56,06).
En esa misma dirección, Charbit et al.16 demuestran en su trabajo que el valor de fibrinógeno <200mg/dl tiene un VPP 100% para HPP severa. Encontramos que este punto de corte en obstetricia, al igual que en los estudios nombrados anteriormente, es similar al punto de corte recomendado en la paciente no embarazada en reanimación de trauma, donde la asociación con severidad se aprecia en pacientes con valores de fibrinógeno por debajo de 150-200mg/dl17.
El uso del fibrinógeno como predictor de HPP severa es una herramienta referente en la identificación y clasificación de severidad en este grupo de pacientes, dada la dificultad que se presenta para el intensivista que no presencia el inicio de la HPP y muchas veces puede subestimar la severidad del sangrado y, con esto, llevar a reanimaciones subóptimas, pues las variables fisiológicas se alteran de forma tardía en este grupo etario, teniendo en cuenta que son pacientes por lo demás sanas y con buena reserva cardiopulmonar.
Adicionalmente, la presencia de un valor de fibrinógeno <200mg/dl al inicio de la HPP en la paciente con shock hipovolémico secundario a HPP severa va a facilitar realizar una terapia de resucitación intravascular adecuada con otros hemoderivados aparte de los glóbulos rojos, tal como plasma fresco congelado, crioprecipitados o concentrados de fibrinógeno, como lo recomienda actualmente el uso de protocolos de transfusión masiva18-20.
El estudio presenta algunas limitaciones, dentro de las que encontramos la valoración subjetiva de la hemorragia inicial por parte del obstetra tratante, hecho relevante desde el punto de vista de la clasificación inicial, pero recurrente en la gran mayoría de estudios de pacientes con hemorragia masiva sean o no obstétricas. Pese a lo anterior, esta subjetividad es lo que encontramos en la práctica cotidiana en la sala de partos y en las unidades de cuidado intensivo, lo que hace que nuestro estudio sea un reflejo del día a día de las maternas en nuestras unidades, y resalta la importancia de una medición objetiva que pueda orientar al médico acerca de la verdadera severidad de la hemorragia, como lo es en este caso el valor del fibrinógeno al momento de inicio de la HPP.
ConclusiónEl nivel de fibrinógeno al momento de inicio de la hemorragia puede ser usado para guiar el tratamiento y la reanimación en pacientes con HPP. Un punto de corte de fibrinógeno <200mg/dl debe alertar al médico sobre el alto riesgo de hemorragia severa y complicaciones, a pesar de la estabilidad en los parámetros fisiológicos y constantes vitales, y puede ser una indicación para terapia transfusional agresiva que incluya restitución de factores de coagulación, incluyendo el fibrinógeno. Para las pacientes con valores de fibrinógeno >200mg/dl se debe continuar usando variables clínicas y fisiológicas para la clasificación de severidad, y el uso de otros parámetros paraclínicos de perfusión tisular que permitan discriminar tempranamente las pacientes que se van a complicar de las que no.
FinanciamientoNinguna.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores reportan no tener conflicto de intereses.