El bloqueo supraclavicular habitualmente se realiza mediante abordaje lateral a medial, si bien puede realizarse de medial a lateral y su instauración puede evaluarse por el efecto simpático asociado al bloqueo sensitivo y motor.
ObjetivoDescribir el bloqueo supraclavicular ecoguiado por abordaje medial evaluando la instauración del bloqueo sensitivo, motor y simpático.
Materiales y métodosSe realizó el bloqueo supraclavicular ecoguiado en cadáver fresco con 20ml de volumen (con 2ml de yodo y 1ml de azul de metileno). Se realizó una tomografía computarizada y posteriormente cortes anatómicos sagitales. En la fase clínica se incluyeron 10pacientes a quienes se les realizó el bloqueo y posteriormente se evaluó la instauración del bloqueo con valoración sensitiva, motora y simpática (cambios en flujo arterial humeral, temperatura palmar y el índice de perfusión).
ResultadosEn el cadáver se evidenció una adecuada distribución del medio de contraste bañando la totalidad del plexo braquial, tanto en la reconstrucción tomográfica como en los cortes seccionales anatómicos. A los 5min del bloqueo se observó un cambio significativo de todos los parámetros de bloqueo simpático: temperatura (32,5±1,8 a 33,4±1,7°C; p=0,047), flujo arterial humeral (105±70 a 192±97ml/min; p=0,007) e índice de perfusión del pulgar (5±3 a 10±3%; p=0,002). El bloqueo fue efectivo en todos los pacientes y sin complicaciones.
ConclusionesEl abordaje supraclavicular propuesto logra una correcta distribución en el plexo braquial con elevada eficacia anestésica. Los cambios regionales secundarios al bloqueo simpático son precoces tras el bloqueo.
Supraclavicular block is usually performed using a lateral to medial approach, although a medial to lateral approach is also feasible. Block onset may be evaluated through the sympathetic effect associated with the sensitive and motor blockade.
ObjectiveTo describe the ultrasound-guided supraclavicular block using a medial approach, evaluating the sensitive, motor, and sympathetic block onset.
Materials and methodsAn ultrasound-guided supraclavicular block was performed in a fresh cadaver with 20mL volume (2mL of iodine and 1mL of methylene blue). A CT scan was performed and sagittal sections were obtained. The clinical phase included 10patients undergoing a medial approach block; the onset of the block was evaluated based on a motor, sensory and sympathetic assessment (measuring flow changes in the humeral artery, the palmar temperature, and the perfusion index).
ResultsAdequate distribution of the contrast medium was observed in the cadaver, with complete spread through the brachial plexus, both in terms of the CT-reconstruction as in the anatomical cross sections. A significant change in all the sympathetic block parameters was observed 5minutes after the bock: temperature (32.5±1.8°C to 33.4±1.7°C; P=.047), humeral arterial flow (105±70mL/min to 192±97mL/min; P=.007), and thumb perfusion index (5±3 to 10±3%; P=.002). The block was effective and uneventful in all patients.
ConclusionsThis supraclavicular approach achieves a homogeneous distribution throughout the brachial plexus, with high anesthetic efficacy. Regional changes secondary to the sympathetic block occur early after the block.
El acceso supraclavicular del plexo braquial (PB) es una opción para la realización de procedimientos quirúrgicos en la extremidad superior1-5. En sus inicios, el bloqueo supraclavicular (BSC) fue ampliamente extendido por Kulenkampff5 dada su elevada efectividad al estar todos los troncos del plexo íntimamente agrupados por encima de la primera costilla y por detrás del pulso de la arteria subclavia. Durante la era de la neuroestimulación se describieron múltiples abordajes supraclaviculares (SC) al PB, según el punto de entrada cutáneo y la dirección de la aguja5-8. La técnica perivascular descrita por Winnie empleaba el concepto de la vaina vasculonerviosa para explicar el comportamiento clínico y la eficacia del bloqueo mediante la inyección del anestésico en un solo punto, permitiendo una distribución entre los troncos y las divisiones del plexo6. Sin embargo, la elevada incidencia de complicaciones y efectos secundarios (punción arterial, disfonía secundaria al bloqueo del nervio laríngeo recurrente, parálisis hemidiafragmática por bloqueo del nervio frénico ipsilateral, síndrome de Horner, neumotórax por punción pleural accidental y neuropatía por lesión de nervio periférico) llevaron al desuso de la técnica9.
Con la introducción de la ecografía se retoman estos abordajes SC, ya que aumenta de forma manifiesta la seguridad al visualizar las estructuras anatómicas potencialmente vulnerables9-15. La visualización mediante el eje corto del plexo SC se logra utilizando una sonda lineal, y mediante un abordaje en plano se puede dirigir la aguja de lateral a medial (externo a interno) hasta acceder al tronco inferior corner pocket. No obstante, también se puede realizar mediante abordaje medial a lateral (interno a externo). Si bien este abordaje ha sido reportado, hay poca referencia en cuanto a la descripción de la técnica y a la disposición final de la aguja9,12,14.
Tradicionalmente la instauración de los bloqueos regionales se determina mediante parámetros clínicos que evalúan la respuesta del paciente ante un estímulo sensitivo (frío o punzada) y la capacidad de contracción muscular (motora)4,9-11. Al realizar el bloqueo de las fibras nerviosas simpáticas se produce vasodilatación y aumento del flujo sanguíneo en la extremidad bloqueada. Estas alteraciones hemodinámicas regionales se pueden medir de manera no invasiva mediante la temperatura cutánea, el índice de perfusión (IP) y el flujo arterial humeral (FAH)16-19. Estos cambios no han sido reportados en relación con el BSC.
El objetivo del presente estudio fue realizar una descripción anatómica del BSC ecoguiado por abordaje medial (BSCM) en cadáver, evaluando su evolución clínica mediante valoración sensitiva, motora y simpática regional en un grupo preliminar de pacientes.
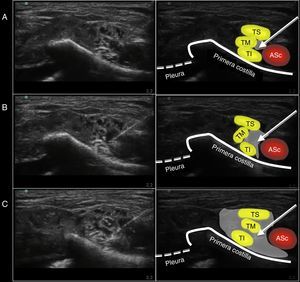
MetodologíaPrimera fase: anatómicaTras la aprobación del Comité Ético y Científico (CEIC) correspondiente, se realizó un BSCM ecoguiado a un cadáver empleando una sonda lineal de alta frecuencia (6-13MHz) y ecógrafo portátil (HFL 38X y M Turbo; Sonosite Inc., Bothell, Wa, EE.UU.). Se empleó una aguja de neuroestimulación de 50mm (Stimuplex D, Braun, Mengusen, Alemania). Con la sonda ecográfica inicialmente colocada paralela a la clavícula en la fosa supraclavicular (obteniendo un plano intermedio entre los tres ejes, el axial, sagital y el coronal) identificamos el PB a nivel SC con sus tres troncos (superior, medio e inferior); con la pleura protegida por la primera costilla y la arteria subclavia por encima de la costilla, se avanzó la aguja en plano de medial a lateral, pasando entre la arteria subclavia (medial) y el PB (lateral). El objetivo fue llegar a la zona próxima al tronco inferior del PB bajo visión directa de la punta de la aguja y, en este punto, lateral a la arteria subclavia y medial al PB, se administraron 20ml de solución (17ml NaCl 0,9%+2ml de contraste yodado +1ml azul de metileno) (fig. 1). Se obtuvo una tomografía computarizada (TC) de la zona SC para la posterior reconstrucción digital e identificación de la distribución del medio de contraste. Posteriormente la pieza anatómica fue congelada (a −20˚C durante 48h) y se le realizaron cortes seccionales sagitales (2-2,5cm), los cuales fueron fotografiados para la valoración de la distribución del contraste administrado en relación con el PB.
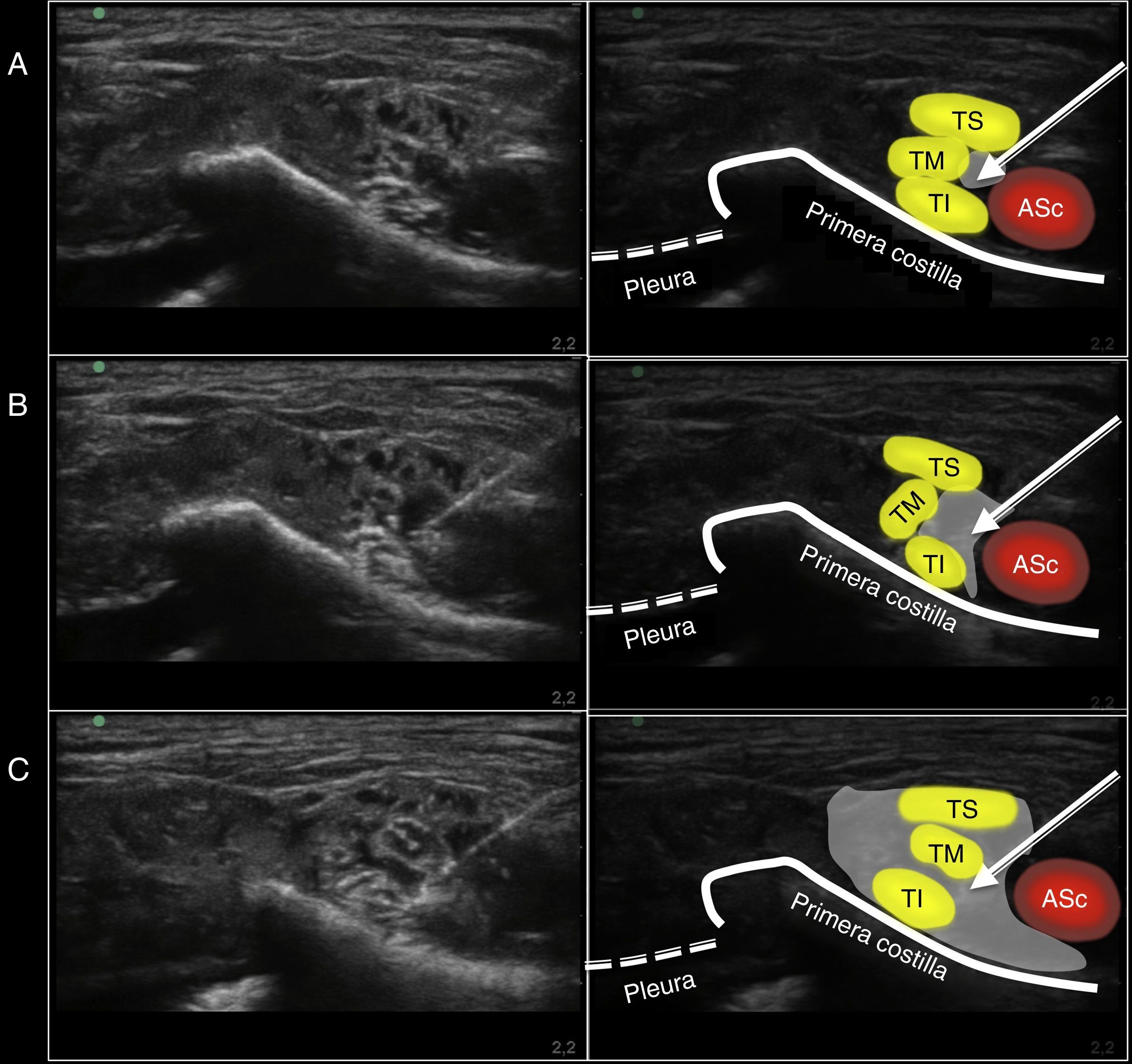
Imagen ecográfica obtenida durante la realización del bloqueo supraclavicular por abordaje medial sobre la pieza anatómica. A)Disposición de la aguja en su punto de inyección. B)Imagen ecográfica durante la inyección del volumen (10ml). C)Imagen ecográfica tras finalizar la inyección de los 20ml.
ASc: arteria subclavia; TI: tronco inferior; TM: tronco medio; TS: tronco superior.
La flecha indica la posición de la aguja de neuroestimulación. La sombra gris indica la distribución del volumen inyectado en el punto de inyección evaluado mediante ecografía.
Fuente: autores.
Se realizó un estudio observacional de una serie de casos previa aprobación por parte del CEIC correspondiente, y tras la aceptación y firma del consentimiento informado por parte del participante se procedió a la realización del BSCM a 10 pacientes adultos, ASAI-III, que requerían una intervención quirúrgica del miembro superior. Los criterios de exclusión fueron: pacientes portadores de enfermedad vascular periférica, alergia a anestésicos locales (AL), embarazo y coagulopatías.
El BSCM se realizó en la sala de bloqueos (temperatura ambiental constante de 24˚C). Los pacientes tuvieron monitoreo no invasivo constante, se les canalizó un acceso intravenoso en el miembro superior contralateral y de ser necesario recibieron 1-2mg de midazolam previo al bloqueo. Se colocó un oxímetro de pulso (Oxy-100 pulse oximeter, GIMA S.p.A., Italia) en el pulgar de la mano del mismo lado a bloquear y otro en el pulgar contralateral para la determinación en porcentaje del índice de pulsatibilidad (IP). Este IP es la relación existente entre el componente pulsátil y no pulsátil de la onda de oximetría de pulso16, además de un termómetro cutáneo palmar a nivel del metacarpo del tercer dedo en ambas manos (Phillips Medical Systems, Eindhoven, Países Bajos; fiabilidad de ±0,1°C) para el registro de la temperatura (°C). Se utilizó un ecógrafo SonoSite M Turbo y una sonda lineal HFL 38X/13-16MHz (Sonosite inc, Bothell, Wa, EE.UU.). Se midió el diámetro (mm) y el FAH (ml/min) 2cm proximales al pliegue del codo mediante doppler pulsado en la extremidad que se iba a bloquear y se determinaron los valores basales de diámetro y FAH además del IP y la temperatura. El paciente se colocó en decúbito supino con la cabeza girada hacia el lado contralateral a bloquear y la mano dirigida a la rodilla para lograr un descenso de la clavícula. Se realizó asepsia de la zona SC e infiltración cutánea en el punto de punción con 1ml de lidocaína al 2% y se procedió a realizar el bloqueo como se describe en la fase anatómica. En todos los casos se utilizó una aguja de neuroestimulación (0,71×50mm y 22G×2”, Stimuplex D, Braun Inc., Melsungen, Alemania) y como mecanismo de seguridad se asoció neuroestimulación (neuroestimulador Stimuplex HNS 12; Braun Inc., Melsungen, Alemania) para asegurar la administración del anestésico local sin estímulo motor a una intensidad igual o inferior a 0,3mA (con parámetros de estimulación de 2Hz y 100 microsegundos de duración). Se administraron 20ml de mepivacaína al 1,5% en todos los casos.
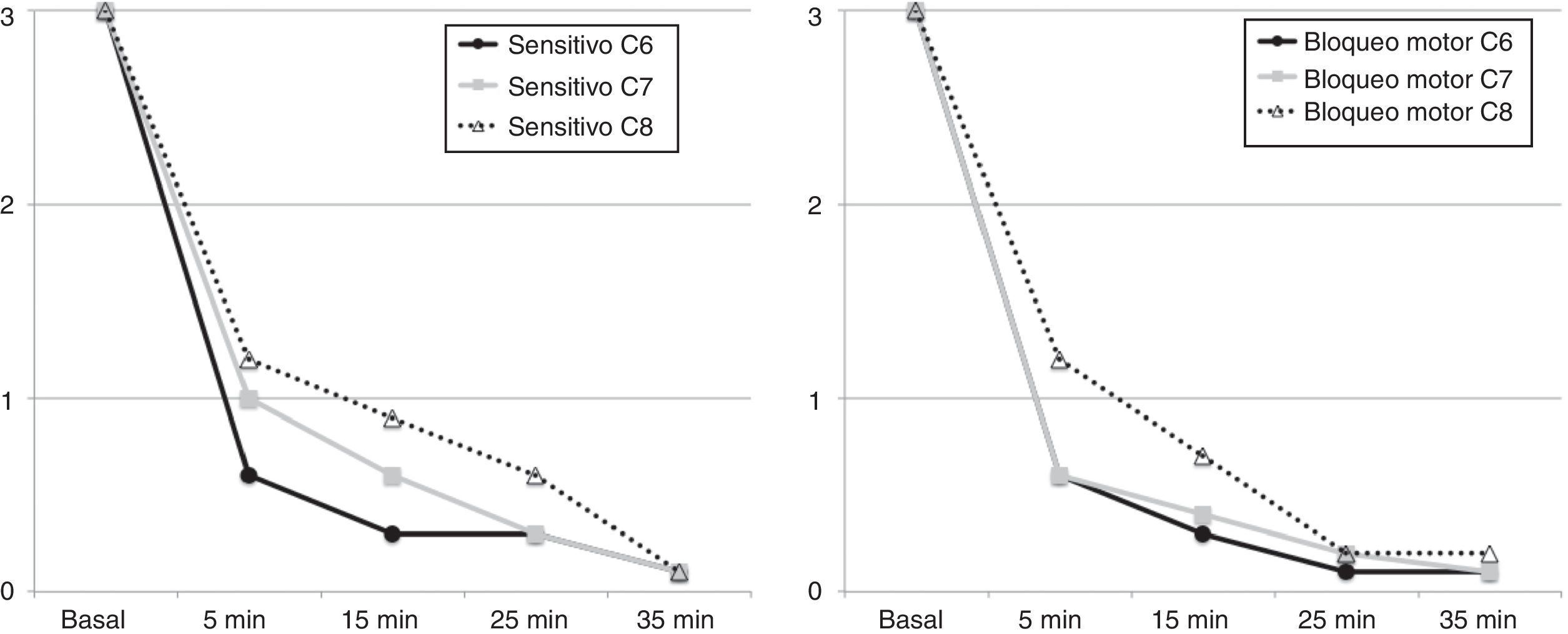
Se registró el tiempo inmediatamente después de inyectar el AL que se consideró el inicio del tiempo posbloqueo. Se registraron los valores de IP y temperatura a los 5 y a los 15min y se midió el diámetro humeral y flujo humeral a los 5min posbloqueo.
Se evaluó la función sensitiva ante una punzada a nivel de C6 (dorso de zona intermetacarpiana entre el primer y el segundo dedo), C7 (punta del tercer dedo), C8 (punta del quinto dedo), con una escala de 0 a 3 puntos (0: no sintió nada; 1: sintió pero sin dolor; 2: sintió con poco dolor; 3: el paciente tuvo una sensación normal). Se evaluó la función motora a nivel de C6 (flexión del antebrazo), C7 (extensión del antebrazo) y C8 (abducción de los dedos), con una escala de 0 a 3 puntos (0: no hubo fuerza, 1: fuerza disminuida y no venció la gravedad; 2: fuerza disminuida y venció la gravedad; 3: fuerza motora normal). Se registró a los 5, a los 15, a los 25 y a los 35min posbloqueo. Para efectos clínicos se consideró bloqueo quirúrgico cuando los valores de bloqueo sensitivo y motor en todos los territorios fue de 0 o de 1. En el postoperatorio se evaluó la presencia de disfunción neurológica posbloqueo a las 24h por contacto telefónico y a los 7 y 30días presencialmente.
El estudio se desarrolló con fines descriptivos de una serie amplia de casos. Simplemente se pretendió evaluar mediante este estudio observacional la viabilidad de la técnica propuesta. Para ello, y con estos fines, se consideró adecuada una muestra inicial de 10 pacientes. Los datos se analizaron mediante el paquete estadístico SPSS (IBM: Statistical Package for the Social Sciences) y se presentaron en forma de número de pacientes, mediana e intercuartiles, o medias y desviación típica, según los casos. Se realizaron estudios comparativos intragrupo (basal y posbloqueo) mediante tests no paramétricos de medidas repetidas (Wilcoxon, chi cuadrado). Se estimó significativo un valor de p<0,05.
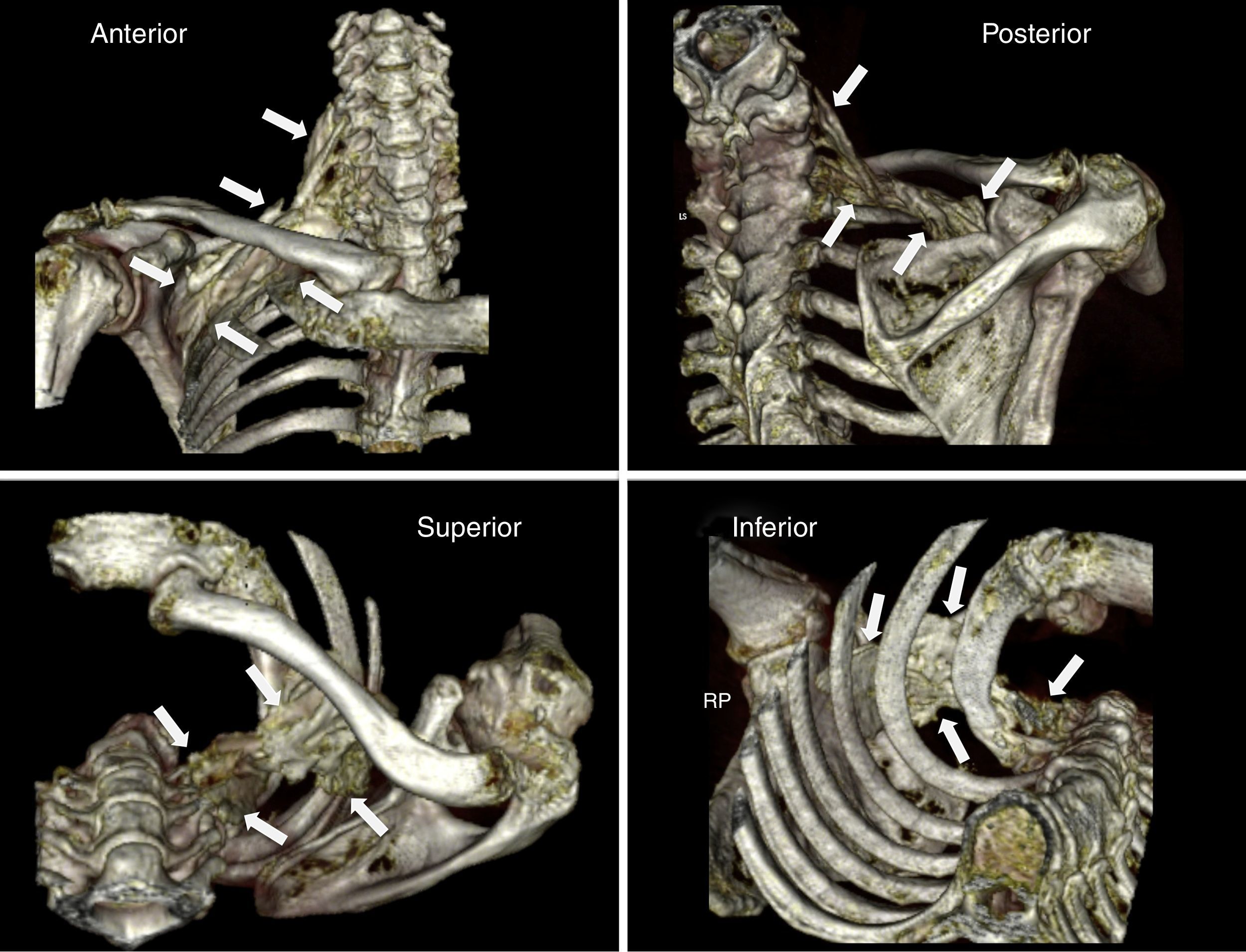
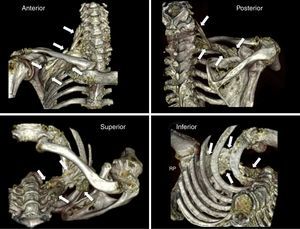
ResultadosPrimera fase: anatómicaEl procedimiento técnico se realizó sin incidencias ni complicaciones. La reconstrucción tridimensional de la TC mostró una distribución del medio de contraste desde la zona periclavicular en dirección craneal (hacia las raíces del plexo: C6, C7, C8 y T1) y caudal (a nivel infraclavicular hasta un punto próximo a la coracoides) (fig. 2).
Reconstrucción tridimensional (scanner) de la distribución del medio de contraste tras la realización del bloqueo supraclavicular por abordaje medial sobre la pieza anatómica. Las flechas blancas indican los límites de la difusión. Nótese la distribución craneocaudal que discurre desde la zona supraclavicular hasta la zona infraclavicular del plexo braquial, próximo a la coracoides.
Fuente: autores.
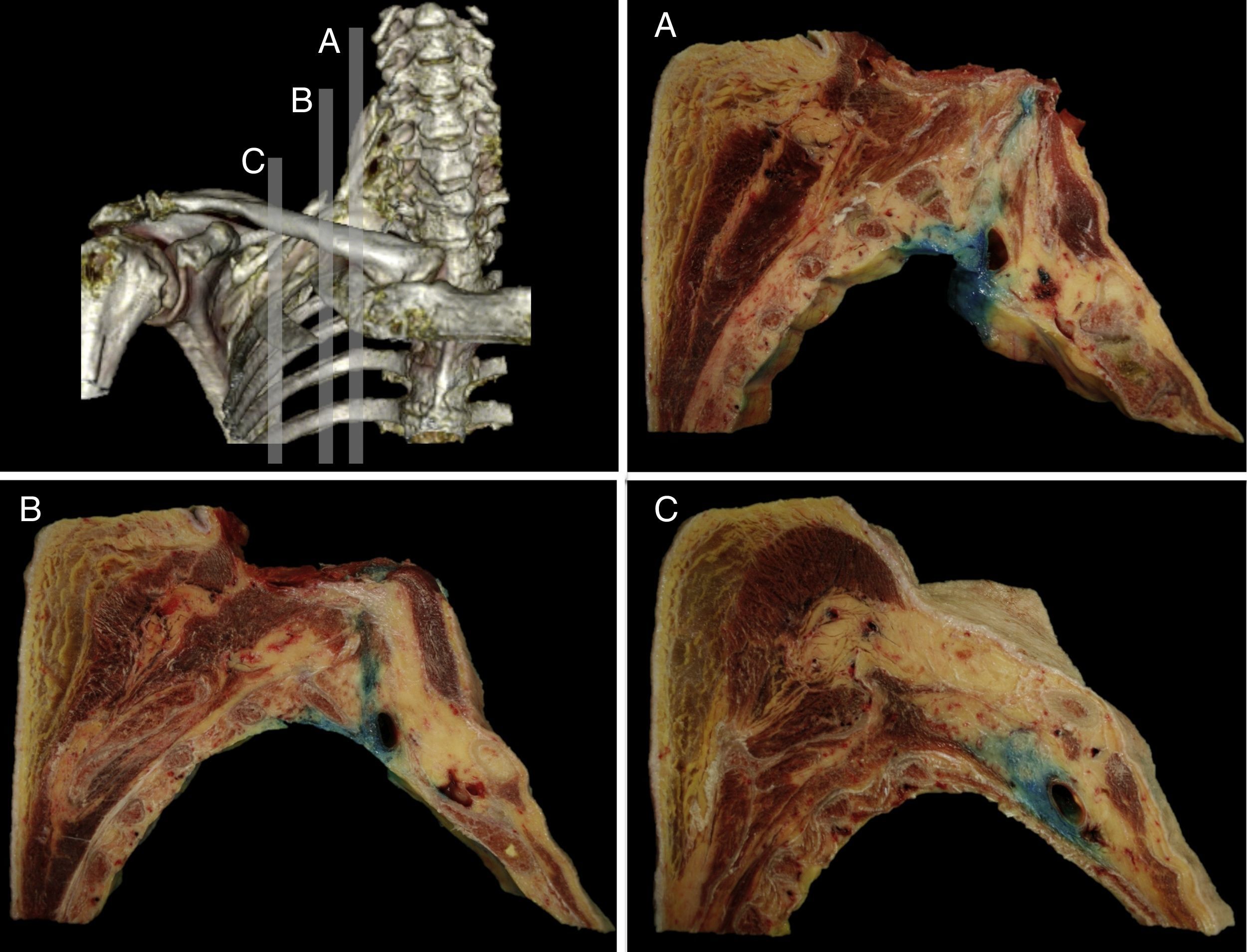
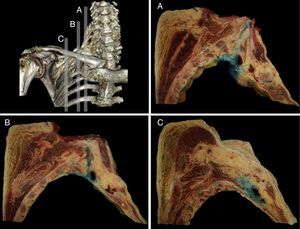
La distribución fue corroborada por los cortes seccionales sagitales realizados, donde se identificó el complejo neurovascular y las relaciones anatómicas del PB a nivel periclavicular. Se obtuvo una difusión del medio de tinción a nivel SC rodeando los troncos superior, medio e inferior (fig. 3), y en su eje longitudinal se distribuyó desde las raíces del PB (interescalénico) hasta los troncos secundarios (infraclavicular).
Secciones anatómicas sagitales obtenidas de la pieza anatómica donde se observa la difusión del azul de metileno desde la zona supraclavicular interescalénica (A), en el punto de punción (B) y en la zona infraclavicular medial a la coracoides (C). En todas ellas el azul de metileno se distribuye alrededor de los componentes vasculonerviosos del plexo braquial.
Fuente: autores.
Se incluyeron 10 pacientes, ASA I-III, para cirugía de miembro superior (4 casos de cirugía sobre hombro y húmero proximal, una cirugía sobre codo y 5 cirugías sobre mano). Siete de los pacientes fueron mujeres y 3 fueron hombres, con edad media de 56±5años, 68±10kg de peso, 163±11cm, con un IMC de 26±3.
La técnica se realizó sin complicaciones secundarias asociadas (punción vascular, neumotórax, parálisis hemidiafragmática) en los 10 pacientes, en un tiempo de 9±4min. La extremidad afectada fue la derecha en 4 pacientes y la izquierda en 6. Durante la manipulación con la aguja uno de los pacientes refirió parestesia que resolvió de manera inmediata al retirar del sitio la aguja. Se presentó respuesta motora a la neuroestimulación a una intensidad >0,3mA en 8 pacientes (80%). Ningún paciente presentó disfunción neurológica posbloqueo.
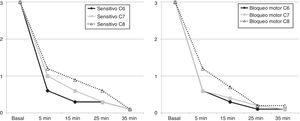
El bloqueo fue efectivo en todos los pacientes, presentando 7 pacientes (70%) un bloqueo sensitivo quirúrgico a los 5min, 8 a los 15min, 9 a los 25min y los 10 a los 35min en los territorios comprendidos entre C6 y C8. El bloqueo motor completo se obtuvo en 6 pacientes a los 5min, en 8 a los 15min, en 9 a los 25min y los 10 a los 35min (fig. 4).
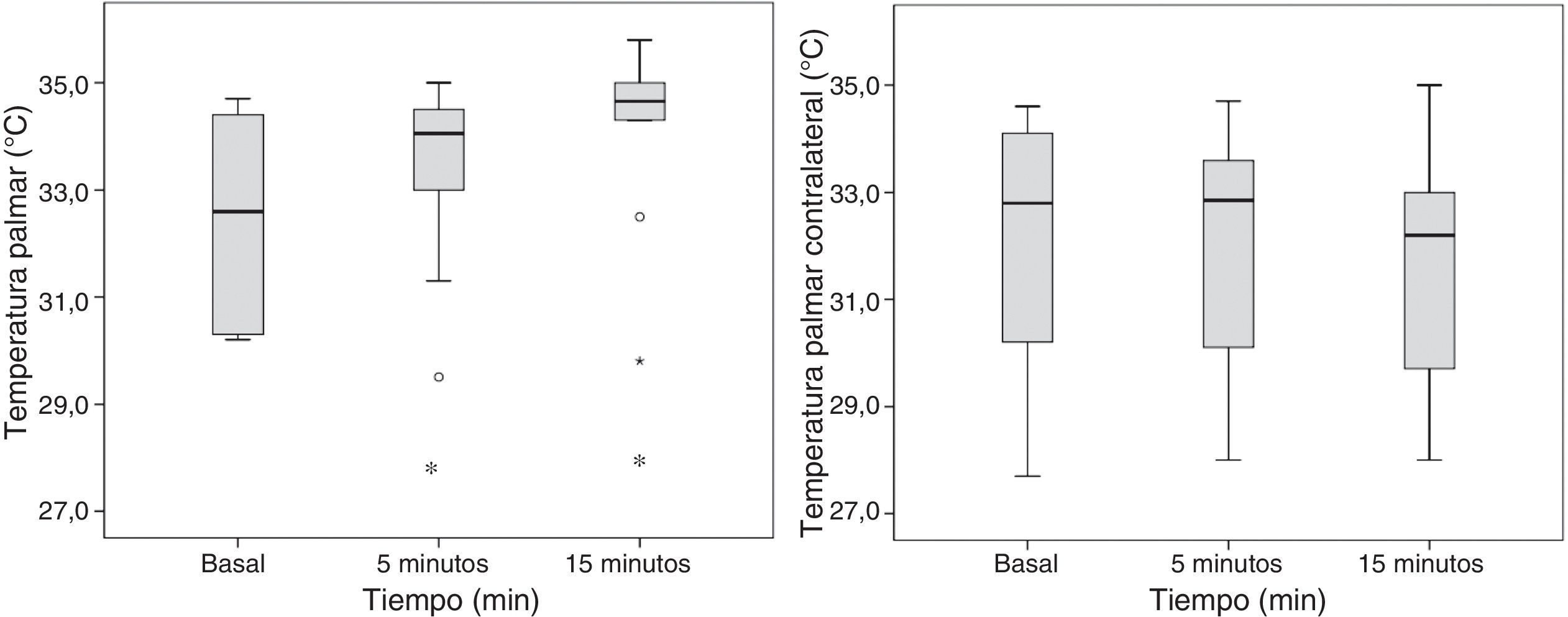
La temperatura palmar de la extremidad bloqueada se incrementó significativamente desde los 5min posbloqueo (32,5±1,8 a 33,4±1,7°C; p=0,047), sin alteración de la temperatura palmar contralateral (32,1±2,4 a 32,1±2,2°C; p=1) (fig. 5).
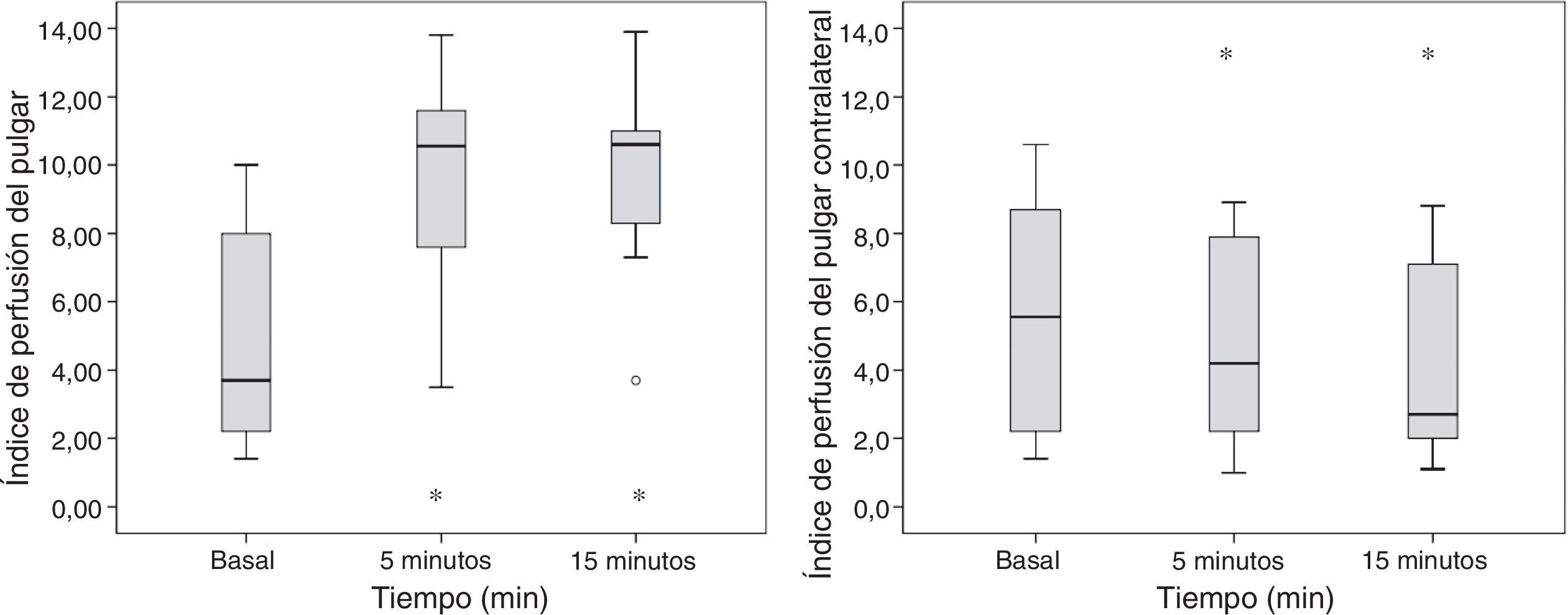
El diámetro de la arteria humeral no presentó cambios significativos posbloqueo (36±5 a 39±4mm; p=0,064), mientras que el FAH se incrementó significativamente a los 5min posbloqueo (105±70 a 192±97ml/min; p=0,007). El IP en el pulgar de la extremidad bloqueada incrementó significativamente de 5±3 a 10±3 (p=0,002) a los 5min posbloqueo y de 5±3 a 10±3 (p=0,002) a los 15min posbloqueo. Se observó una reducción significativa del IP en la extremidad contralateral a los 5min de finalizado el bloqueo de 6±4 a 5±3 (p=0,041) y a los 15min una reducción de 6±4 a 4±3 (p=0,009) (fig. 6).
DiscusiónEl bloqueo del plexo braquial supraclavicular presenta la ventaja de contar con una disposición anatómica agrupada del tronco superior (con sus divisiones anterior, posterior y supraescapular), tronco medio y tronco inferior14. La técnica propuesta combina dos de los conceptos clásicos de la anestesia regional: el de la vaina nerviosa y el de los abordajes perivasculares (para acceder a la vaina o paquete vasculonervioso), desarrollados por Winnie en los años sesenta-setenta1,7,20. Así, el abordaje ecoguiado descrito tiene como foco de atención a la arteria subclavia y propone a la misma como parte integrante del complejo vasculonervioso. La intensa relación entre los tres componentes nerviosos del PB (troncos superior, medio e inferior en su vaina nerviosa) con la cuarta estructura, la arteria subclavia, situada medialmente a estos, forma el paquete vasculonervioso. El objetivo es precisamente el centro de este paquete vasculonervioso (lateral a la arteria, medial al tronco medio, profundo al tronco superior y superficial al tronco inferior). Con la asociación de centralidad y contención fascial hace que una inyección única (en un solo punto) consiga una distribución amplia alrededor de las estructuras nerviosas del plexo y a lo largo de las mismas.
Si bien la dirección medial a lateral de la aguja en el abordaje propuesto permite alejar la aguja de la pleura, la técnica propuesta podría considerarse en un futuro como técnica que podría reducir la incidencia de la complicación más temida del BSC, el neumotórax. Sin embargo, dada la baja incidencia de esta complicación, difícilmente puede ser demostrado, más allá de la ventaja avalada por el sentido común. Otra ventaja posible sería favorecer la distribución del anestésico en dirección lateral y no medial; sin embargo, tampoco podemos demostrar que se pueda modificar la incidencia de parálisis hemidiafragmática, parálisis del nervio laríngeo recurrente y punción vascular con el empleo de este abordaje, con respecto del clásico de lateral a medial, si bien ha sido sugerido por otros autores7,14,15.
Los antecedentes a este abordaje ecoguiado que hemos definido se iniciaron con los abordajes anteroposteriores o en plomada, propuestos por Brown7, para evitar la complicación del neumotórax, hasta la descripción realizada por Pham-Dang, que evaluó las ventajas de esta dirección lateral de la aguja para la colocación de catéteres y su distribución más distal y homogénea del AL con el objetivo de obtener un bloqueo metamérico de las zonas más proximales de la extremidad (C5, C6 y C7) y de las zonas más distales de C8 y T1 que se afectan de manera más lenta12. La velocidad de instauración del bloqueo sensitivo durante la exploración de las áreas de C6 y C7 fue mayor en comparación con C8 tan solo a los 5min posbloqueo (ver fig. 5), al igual que la instauración del bloqueo motor, coincidiendo el patrón de instauración del bloqueo sensitivo y motor con los descritos en otros estudios, en donde la parte metamérica más distal se logra bloquear en un tiempo mayor11.
El bloqueo simpático asociado produce vasodilatación y aumento del flujo sanguíneo. Este efecto quedó patente en nuestro estudio con los cambios tempranos que se produjeron al medir el IP, la temperatura y la velocidad del FAH en la extremidad bloqueada. Todos ellos reflejan una disminución en el tono vasomotor17,21-23. La mayoría de los cambios hemodinámicos se presentaron a los 5min posbloqueo, probablemente debido a que el diámetro de la fibra nerviosa simpática es más pequeño en comparación al de una fibra motora o sensitiva22,23. El aumento en la velocidad del FAH se presenta por cambios a nivel de resistencias vasculares periféricas16,17. Sin embargo, no se puede afirmar que estos cambios asociados al bloqueo simpático sean predictores de la eficacia del bloqueo, entre otros motivos porque no hubo bloqueos fallidos en nuestro estudio. Tampoco podemos evaluar si alguno de los parámetros medidos (IP, temperatura o flujo) tiene más o menos poder predictivo de la instauración del bloqueo, ya que a los 5min, cuando se evaluaron, los tres parámetros presentaban cambios significativos y la muestra fue pequeña. A pesar de estas limitaciones, consideramos que, por la simplicidad de la medida y su aplicación no invasiva, el IP podría ser considerada una monitorización de futuro en este ámbito.
El hecho de realizar el BSC ecoguiado ya presupone una disminución de las complicaciones por la capacidad de visualizar las estructuras potencialmente lesionables y poder evaluar la distribución del anestésico local24. Así, en un reporte de 510 pacientes por Perlas et al.9 no se registró ningún caso de neumotórax al realizar un BSC con dirección de la aguja de medial a lateral o mediante el abordaje lateral a medial. En nuestro estudio no se presentó ningún caso de neumotórax, coincidiendo con lo que se reporta en la literatura. El único efecto indeseable que se presentó en un paciente fue un síndrome de Horner; desconocemos si se presentó algún caso de parálisis del hemidiafragma ipsilateral asintomática, ya que no se realizaron estudios específicos de la función diafragmática a ningún paciente24. La parestesia que se reportó en un paciente (10%) y que fue descrita como dolorosa pero transitoria se observó durante la introducción de la aguja de neuroestimulación; sin embargo, en ningún caso se reportó disfunción neurológica posbloqueo. Ni el objetivo ni las características del estudio observacional presentado permiten hacer consideraciones en cuanto a una mayor seguridad con respecto a otros abordajes SC, si bien las técnicas de Brown y Pham-Dang, similares a nuestra propuesta, fueron introducidas en base a una mayor seguridad.
ConclusiónEl BSCM ecoguiado propuesto con un volumen de 20ml consigue una adecuada difusión del AL en el espacio periclavicular, desde las raíces del PB (interescalénico) hasta los troncos secundarios (infraclavicular); por ello, la eficacia del bloqueo es muy elevada. Secundariamente, podemos afirmar que el aumento en el IP, la temperatura distal y la velocidad del FAH se observan precozmente tras el bloqueo. Al ser el IP una medida objetiva, fácil de cuantificar, que no genera molestias y que no precisa colaboración por parte del paciente, podría considerarse una monitorización con futuro para la evaluación clínica posterior al bloqueo. Estudios clínicos amplios deben vislumbrar en el futuro el papel de este abordaje SC ecoguiado frente a otras técnicas y otros abordajes del PB, así como determinar sus posibles ventajas en el entorno de la seguridad.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciamientoLos autores no recibieron patrocinio para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.