La farmacología de los lactantes es poco estudiada y difiere de la farmacología de otras poblaciones.
ObjetivoRevisar las características únicas de la fisiología de los neonatos e lactantes que afectan el manejo del fármaco y la farmacocinética de los anestésicos, incluyendo opioides, ketorolaco y acetaminofén.
Materiales y métodosEste artículo es una revisión narrativa de la literatura, desde el punto de vista de las autoras, y constituye un resumen de la información presentada en la reunión anual de la Sociedad Colombiana de Anestesiología y Reanimación en Cali, Colombia, en junio del 2015.
ConclusionesLa farmacología en neonatos y lactantes es única y debe ser considerada en esta población vulnerable. Las recomendaciones presentadas para la administración de esos analgésicos están basadas en sus propiedades farmacocinéticas únicas. También deben tenerse en cuenta las variaciones individuales y la respuesta clínica.
Pharmacology of infants is understudied and different from other populations.
ObjectiveTo review the unique features of neonatal and infant physiology that impact drug handling and the pharmacokinetics of analgesics, including opioids, ketorolac and acetaminophen.
Materials and MethodsThis article is a narrative review of the literature from the authors' point of view that constitutes a summary of the information presented at the annual Colombian Society for Anesthesia meeting in Cali, Colombia June 2015.
ConclusionsPharmacology in neonates and infants is unique and must be considered in this vulnerable population. Recommendations for administration of these analgesics are presented based on their unique pharmacokinetic properties. Individual patient variation and clinical response must also be taken into account.
El control perioperatorio del dolor y la selección de los agentes analgésicos es particularmente importante en lactantes y neonatos. Los datos emergentes indican que los eventos adversos, que incluyen la exposición a estímulos dolorosos en el periodo perinatal, pueden tener un impacto negativo en el bienestar emocional y de conducta a largo plazo1. Esto debe ser sopesado cuidadosamente con el perfil aumentado de eventos secundarios de medicamentos analgésicos en este grupo de edad.
Esta revisión narrativa de la literatura describe algunas de las características de la fisiología neonatal y del lactante que difieren de la fisiología adulta y su impacto en el manejo de los fármacos. Se presentan definiciones de los términos farmacocinéticos y una breve introducción a los modelos para el metabolismo de los fármacos. La morfina y el remifentanilo serán usados como ejemplos para comparar y contrastar farmacocinéticos en lactantes y la farmacodinámica particular de los efectos respiratorios en este grupo vulnerable. Se revisarán la cinética del acetaminofén y el ketorolaco (como ejemplos de analgésicos parenterales no esteroideos) en lactantes.
Este artículo es una recapitulación de la información presentada en la reunión anual de la Sociedad Colombiana de Anestesiología y Reanimación en Cali, Colombia, en junio del 2015. Es una selección de la literatura más que un examen exhaustivo de toda la literatura sobre estos fármacos o clases de drogas. Se usan referencias al trabajo propio de los autores por conveniencia y por conocimiento de los detalles del rendimiento del estudio, no se quiere indicar con ello que otros trabajos no son igualmente importantes.
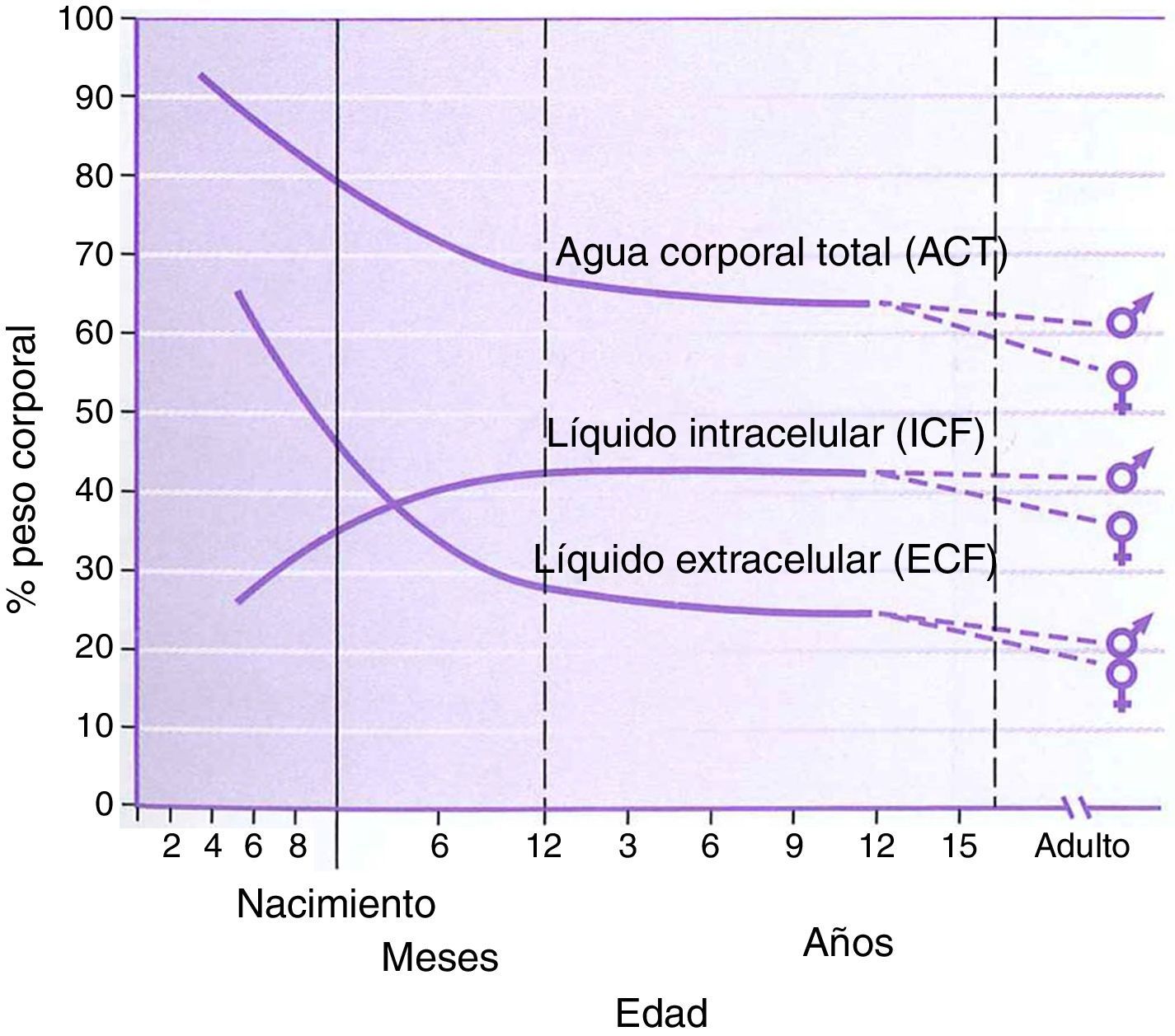
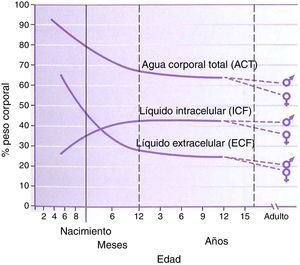
FisiologíaLa fisiología del neonato y del lactante difiere, en muchos aspectos, de la del adulto. Algunas de estas diferencias son factores importantes en el manejo del fármaco. El agua corporal total tiene un porcentaje más alto en el peso corporal de los niños, alcanzando valores adultos a la edad de 8 a 10 años (fig. 1). La función hepática y renal no está totalmente desarrollada en el momento del nacimiento, lo que afecta al manejo de muchos fármacos. La maduración de estas funciones sucede durante varios meses a lo largo del primer año de vida2. El desarrollo de fármacos en los últimos 10 a 20 años se ha concentrado en agentes cuyo metabolismo sea menos dependiente de una función renal o hepática normal, ya que estos órganos se ven comprometidos en el envejecimiento de la población adulta. Esto resulta beneficioso para los lactantes que también tienen una función inmadura. El remifentanilo es el ejemplo obvio de este proceso en acción.
Agua corporal total, líquido intracelular, líquido extracelular, porcentaje de peso corporal por edad en niños.
Fuente: Greenbaum et al.2. Reproducida con autorización.
Las enzimas hepáticas, incluyendo tanto el sistema P450 y las vías de glucuronidación, son inmaduras en el momento del nacimiento. La maduración ocurre durante los primeros meses de la vida posnatal a diferentes tasas para diferentes variantes de P450. Los fármacos metabolizados por glucuronidación (solubilidad aumentada para la excreción) tendrán un retiro tardío en los primeros meses de vida. La sulfatación se vuelve más importante como vía metabólica. También hay variantes heredadas por el sistema CYP (P450) que pueden afectar el manejo del fármaco. Un ejemplo de esto puede observarse en la codeína, donde la conversión a la morfina activa puede ocurrir más rápido, más despacio o no, dando como resultado un efecto impredecible3. Los informes de efecto excesivo en los metabolizadores ultrarrápidos se han asociado con calamidades respiratorias4,5.
El riñón es importante para eliminar los fármacos y sus metabolitos. En los lactantes, la tasa de filtración glomerular inicia aproximadamente en un 10% de los valores normales para adultos y los alcanza a los 12 meses de edad. La función tubular renal también madura durante los primeros 6 meses. Esta función disminuida puede resultar en la acumulación de metabolitos y es particularmente problemática con aquellos metabolitos que tienen efectos activos.
FarmacocinéticaLa farmacocinética se define como el estudio del manejo de los fármacos en los pacientes; está afectada por la absorción (importante para las vías de administración no intravenosa), la distribución, el metabolismo y la eliminación. Los términos farmacológicos son usados con frecuencia en estudios de manejo de fármacos. Estar familiarizado con estos términos puede resultar útil al revisar esta literatura6.
El aclaramiento (Cl) describe la eliminación del fármaco de un volumen de plasma por unidad de tiempo (ml/min o l/h). Este valor se reporta a menudo como un valor normalizado, por lo general en l/h/70kg o en publicaciones más antiguas como ml/min/kg. El aclaramiento refleja que la eficiencia con la que el paciente elimina el fármaco a través del metabolismo del mismo o la excreción del fármaco inalterado.
El volumen de distribución (Vd), otro término de volumen, describe el volumen aparente que sería necesario para dar cuenta de todos los fármacos si estuvieran presentes en la misma concentración medida en plasma o suero (L/70kg o ml/kg en trabajos más antiguos). Es importante reconocer que el volumen de distribución es más teórico que fisiológico. Su utilidad es mostrar qué tan amplia es la distribución de un fármaco en el cuerpo. Se observa un Vd pequeño en fármacos polares (dificultad en cruzar las membranas lipídicas, igual que los aminoglucósidos) o en aquellos unidos a proteínas plasmáticas como albúmina o alfa-1 glicoproteína ácida. Los fármacos con un Vd alto tienen una solubilidad lipídica alta o están unidos a proteínas tisulares. La concentración sanguínea puede reflejar mal la cantidad de estos fármacos presente en el cuerpo, como se observa con la digoxina.
La vida media de eliminación (t ½) es el tiempo requerido para cambiar la concentración sanguínea en un 50% y se reporta en minutos u horas. En 4 o 5 vidas medias se elimina entre un 94 y un 97% del fármaco, respectivamente. La vida media se ve afectada por el aclaramiento y el volumen de distribución. Los fármacos con un aclaramiento más alto y un volumen de distribución más pequeño tienen una duración de acción más corta y son más titulables, lo que es deseable en la práctica anestésica.
A medida que se han desarrollado nuevos anestésicos con estas características, ha empezado a usarse el término vida media sensible al contexto. Este término se refiere al tiempo requerido para cambiar la concentración del fármaco en un 50% (es decir, vida media) en el contexto de la duración de la administración. Se han descrito modelos farmacocinéticos a vida media sensible al contexto para anestésicos intravenosos7. Se han desarrollado nuevos agentes con vidas medias sensibles al contexto más cortas, e independientes de la duracion de la infusion del farmaco.
Las limitaciones en las muestras de sangres en pacientes pediátricos, que es particularmente significativa en lactantes, han motivado el desarrollo de esquemas de modelización matemática farmacocinéticos generados por ordenador que requieren datos escasos de concentración sanguínea en pacientes pediátricos. Existen modelos basados en la población que usan factores como la edad y el peso como covariables comunes e introducen elementos adicionales para mejorar el ajuste del modelo en gráficas de concentración vs. tiempo. Los modelos alométricos basados en el peso incorporan el peso usando valores exponenciales (0,75 para el aclaramiento, 1 para el volumen de distribución) con base en funciones de enzima. Estos modelos consideran factores apropiados para la edad como la creatinina y la bilirrubina para mejorar el ajuste. Ambos modelos han sido utilizados para estudiar el manejo de la morfina y el remifentanilo en lactantes8-10.
Existen factores genéticos que influencian el metabolismo de los fármacos y esto constituye un área activa de investigación. Aunque el efecto de las variantes genéticas es a veces difícil de extrapolar directamente en la práctica clínica, existen ejemplos de variantes metabólico-genéticas pertinentes a las poblaciones pediátricas11. La codeína, como profármaco, depende totalmente del metabolismo para su efecto analgésico. Su metabolito activo, la morfina, es producida por la O-desmetilación por la enzima citocromo P450 2D6 (CYP2D6), que es altamente polimórfica. Las diferencias en los alelos de CYP2D6 pueden dar lugar a diferencias significativas en el manejo de opiáceos porque el nivel de actividad de la enzima CYP2D6 se determina por la combinación de alelos que tiene cada paciente, que van desde los metabolizadores pobres hasta los ultrarrápidos. En la práctica clínica, los pacientes que metabolizan menos no lograrán ninguna analgesia con el uso de codeína, mientras que los pacientes metabolizadores ultrarrápidos tienen un mayor riesgo de depresión respiratoria. Se han presentado problemas similares con el tramadol, la hidrocodona y la oxicodona, lo que resultó en la publicación de pautas de dosificación considerando los genotipos CYP2D612.
La asociación de raza, origen étnico y la frecuencia del polimorfismo genético es una consideración adicional. Utilizando el ejemplo anterior, las frecuencias de los alelos CYP2D6 varían significativamente entre grupos raciales y étnicos. Los europeos caucásicos son más propensos a llevar alelos de función normal en comparación con los asiáticos y los afroamericanos13. Los africanos del este (etíopes), por otro lado, son más propensos a exhibir duplicaciones del gen CYP2D6 (que indica un metabolismo ultrarrápido), que los predispone a reacciones adversas graves14.
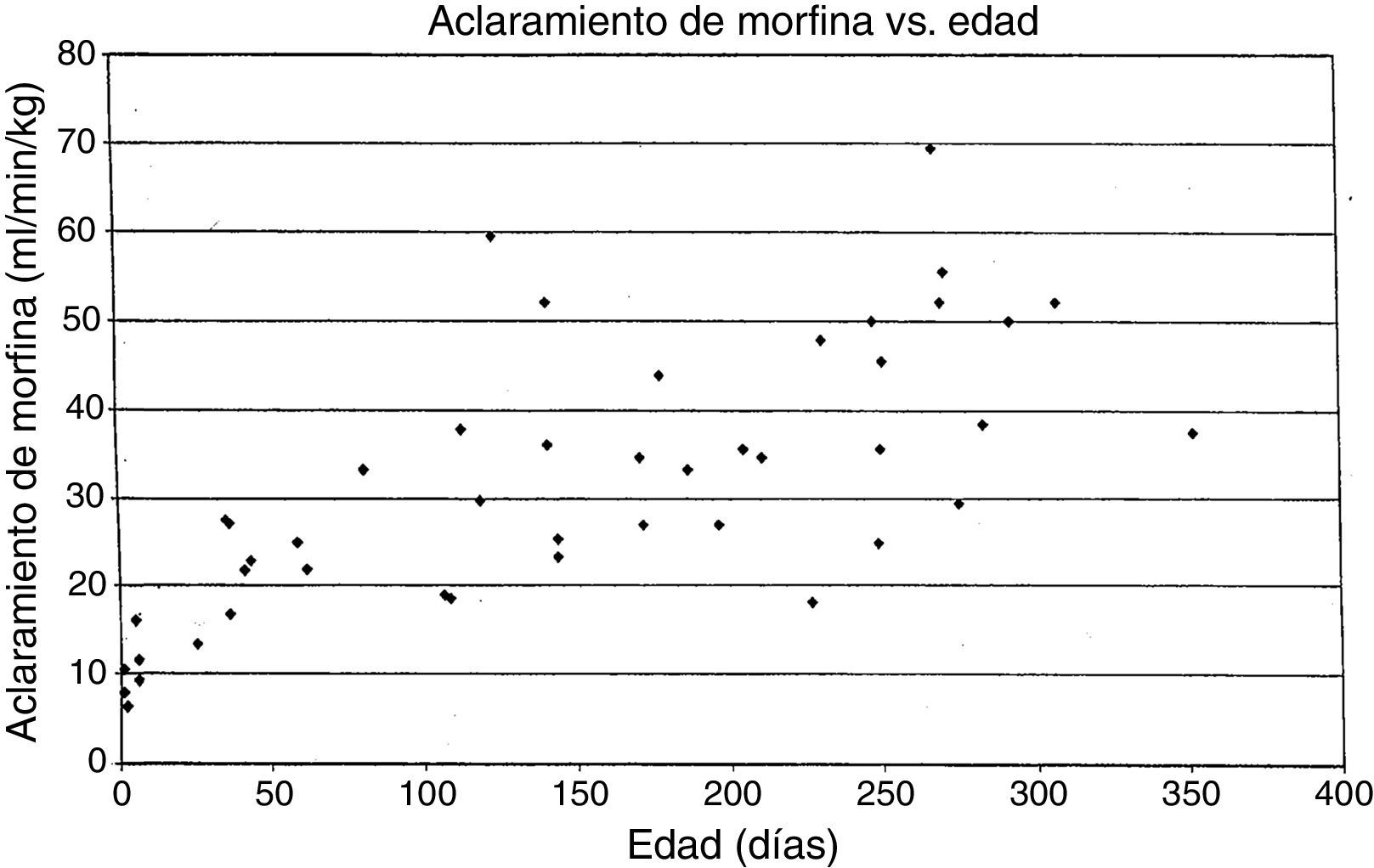
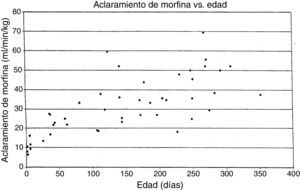
MorfinaVarios grupos han reportado estudios sobre la farmacocinética de la morfina. Nuestro enfoque será sobre el trabajo del autor (AL) que se conoce en detalle. En 1987, un pequeño estudio en 10 lactantes mostró que ellos tenían diferentes parámetros farmacocinéticos a los reportados en adultos, con un aclaramiento menor y un gran volumen de distribución, lo que dio como resultado una vida media de eliminación prolongada15. El aclaramiento parecía aumentar rápidamente en lactantes de 1 a 4 días de edad en comparación con lactantes mayores. Un estudio de una cohorte más grande de 49 lactantes y niños pequeños, todos recibiendo morfina por infusión después de una cirugía cardíaca, mostró el mismo patrón en el que los valores adultos de aclaramiento se alcanzaban a los 6 meses de edad16. En un estudio posterior de 26 niños que recibieron morfina por infusión intravenosa después de cirugías no cardíacas se encontró que el aclaramiento en lactantes no cardíacos era significativamente mayor que en los lactantes después de la cirugía cardíaca, con lactantes quirúrgicos no cardíacos que alcanzaban valores adultos de aclaramiento de morfina a los 1-3 meses de edad en vez de a los 6 meses17-20. En todos estos estudios el aclaramiento de morfina entre pacientes era alto, dando valores 2-3 veces diferentes para lactantes de la misma edad, un problema observado en la mayoría de los opiáceos «mayores»18-20 (fig. 2). Esta variabilidad hace que sea difícil predecir la duración tanto de los efectos deseados como los no deseados de la morfina en cualquier lactante individual.
Aclaramiento de morfina (ml/min−1/kg−1) frente a edad de lactantes que reciben morfina.
Fuente: Lynn et al.19. Reproducida con autorización.
La farmacodinámica se refiere a los efectos del fármaco sobre el paciente que pueden ser terapéuticos o no deseados (adversos). Para la mayoría de los clínicos, la farmacodinámica impulsa la administración del medicamento. La farmacodinámica se ve afectada por muchos factores. Para los opiáceos, estos incluyen diferencias en la morfología del receptor (OPRM variante del gen SNP 118 A/G), diferencias en las concentraciones en el sitio efecto (transportador ABCB 1/MDR 1) o efectos después de receptores de medicamentos y uniones como diferencias en el metabolismo de catecoles (472 G> A SNP) de la enzima COMT. Los estudios de estas diferencias genéticas en poblaciones diferentes han ido en aumento y deben seguir siendo un área activa de investigación.
Los efectos respiratorios de los opiáceos han sido uno de los factores que limitan su uso en lactantes. Son pocos los estudios que relacionan las concentraciones de fármacos con sus efectos. En 1993, se registraron concentraciones de morfina en estado estable en 30 lactantes que recibieron infusiones por vía intravenosa de morfina después de una cirugía cardíaca. Se encontró que una concentración plasmática de morfina < 20 ng/ml estaba asociada a hipercarbia en un 15% frente a un 67% en aquellos mayores de 20 ng/ml, independientemente de la edad. Esto indica que las infusiones de morfina establecidas para apuntar hacia una concentración plasmática de 20 ng/ml podrían minimizar el riesgo de depresión respiratoria en los lactantes21. Desafortunadamente, la variabilidad entre pacientes en la farmacocinética de la morfina hace que predecir la concentración de morfina sea más difícil (véase discusión arriba; fig. 2).
En el año 2000, un estudio de seguimiento en 83 lactantes demostró una analgesia superior con infusiones de morfina en comparación con la administración intermitente en bolo (puntuaciones de dolor altas en el 13% frente al 32%)19. No hubo diferencias en las lecturas continuas de oximetría < 90% aire ambiente o tiempo para la ingesta oral. Sin embargo, las pendientes de la curva de respuesta al CO2 mostraron evidencia de depresión ventilatoria en 4 de 57 (7%) lactantes del grupo de infusión. Un curso indicado para facilitar la extubación al final de la cirugía consiste en utilizar 0,05mg/kg de morfina como dosis de carga, luego infusión a 5-10 μg/kg/h en neonatos y 10-20 μg/kg/h en lactantes, ajustándose a las necesidades de cada individuo.
RemifentaniloLa farmacocinética impredecible y el potencial de depresión respiratoria no deseada de la morfina han llevado a la investigación de opioides con aclaramiento menos dependiente de la función hepática o renal. El remifentanilo es un ejemplo de dicho tipo de agente. El remifentanilo es una agonista mu, que se une a los mismos receptores opiáceos que la morfina o el fentanilo. Es metabolizado por esterasas tisulares, por lo que su farmacocinética no se ve afectada por cambios en la función hepática o renal. Estas esterasas tisulares, importantes por su uso en lactantes, son funcionales en el momento del nacimiento y, por tanto, no se observan en ellas cambios relacionados con la edad. El inicio es rápido y la duración corta, por lo que las infusiones por vía intravenosa son la vía de administración más común. La vida media sensible al contexto se reporta como 3-5 min, independientemente de la duración de la infusión22. Eck y Lynn hicieron un informe de caso temprano de 3 lactantes complejos manejados con remifentanilo como coadyuvante anestésico y reportaron extubación temprana (7-20 min después del fin de la infusión) en 2 de 323. Davis et al. realizaron un ensayo multicéntrico en 60 lactantes sometidos a piloromiotomía, comparando la infusión de óxido nitroso/remifentanilo a 0,55±0,2 μg/kg/min a óxido nitroso/halotano al 0,4%. Se utilizó un bloqueo de campo con bupivacaína para la analgesia posoperatoria en ambos grupos. Aunque no hubo diferencias en el tiempo para la extubación, ningún lactante en el grupo de remifentanilo presentó una anormalidad nueva en los neumogramas posoperatorios, mientras que 3 pacientes del grupo solo agente volátil lo hicieron24. Crawford et al. demostraron que el remifentanilo puede proporcionar excelentes condiciones para la intubación orotraqueal en lactantes sin el uso de relajantes musculares; 24 lactantes, pretratados con glicopirrolato 10 μg/kg, fueron asignados al azar a propofol/succinilcolina o propofol/remifentanilo 3 μg/kg y las condiciones de intubación fueron similares sin eventos adversos25. Un estudio posterior, que incluyó a 64 niños de 0-3 años de edad, estratificados en 3 grupos de edad (0-3 meses, 4-12 meses y 1-3 años)26, indicó que la dosis en bolo específica por edades del remifentanilo (ED50) para facilitar la intubación traqueal es ligeramente superior (3,7 μg/kg) en el grupo de lactantes de 4-12 meses de edad. En este estudio, todos los pacientes también fueron pretratados con glicopirrolato.
Se han reportado efectos no deseados incluyendo «rigidez de la pared torácica» y bradicardia, como se puede observar con otros derivados de fentanilo. Se reportan náuseas y vómitos en ∼ 30% en estudios de adultos. Más importante aún para el uso anestésico, la analgesia de remifentanilo desaparece luego de 15-30 min de detener las infusiones. Algunos autores han indicado que la taquifilaxia conduce posteriormente a mayores requerimientos de opiáceos; sin embargo, esto no ha sido reportado en lactantes.
El remifentanilo evita los retos de variabilidad farmacocinética que se observan con la morfina; sin embargo, es relativamente caro y la duración corta puede plantear un reto para la analgesia posoperatoria. Si el dolor postoperatorio puede ser abordado con técnicas regionales, el remifentanilo parece una opción viable para permitir la extubación temprana después de la cirugía infantil. El estudio de los factores étnicos, raciales y genéticos en el metabolismo de los opiáceos sigue siendo importante para ayudarnos a individualizar la atención a esta población vulnerable.
Dependiendo del paciente y del procedimiento, pueden considerarse otras categorías de analgésicos para complementar o reemplazar los opioides. La descripción de la farmacocinética/dinámica en lactantes del acetaminofén (centrándose en la vía intravenosa) y del ketorolaco (único fármaco antiinflamatorio no esteroideo [AINE] parenteral disponible en EE. UU.) se informará la siguiente sección. Estos agentes pueden ser particularmente beneficiosos en lactantes, ya que no funcionan a través de receptores opioides y no tienen efectos sobre la respiración o la consciencia.
KetorolacoEl ketorolaco trometamol está disponible de forma oral y parenteral. Como el único AINE por vía intravenosa ampliamente disponible en los EE. UU., se ha utilizado como un analgésico adjunto y ha demostrado disminuir los requerimientos de opioides en pacientes posoperatorios. Funciona inhibiendo el sistema de la ciclooxigenasa, que disminuye la síntesis de prostaglandinas y la cascada inflamatoria. No afecta a la consciencia o a la respiración, pero tiene efectos sobre la mucosa gástrica, la perfusión renal y la función plaquetaria. La disfunción basal renal o plaquetaria es una contraindicación relativa.
Un estudio prospectivo aleatorizado de 70 lactantes y niños no mostró diferencias en el drenaje del tubo torácico ni en las complicaciones hemorrágicas y ninguna diferencia en el cambio mediano de creatinina después de la cirugía cardaca congénita con o sin 48 h de tratamiento con ketorolaco en el posoperatorio27. Para explorar más a fondo la farmacocinética, la seguridad y los efectos respiratorios en lactantes, se realizó un estudio de centro único aleatorizado, ciego, con control de placebo en los lactantes de 6-18 meses admitidos después de la cirugía. La cinética se realizó para isómeros estereoespecíficos, ya que estudios en animales han indicado que el isómero S era un analgésico más potente28 y estudios en niños indicaron diferencias en el manejo de isómeros29,30. Treinta y siete niños fueron incluidos, 23 después de craniectomía. Todos recibieron morfina para el dolor irruptivo. Se encontró una marcada diferencia en el aclaramiento isomérico con el isómero S aclarado 4 veces más rápido que el R– (4,4±2,8ml/min/kg vs. 1,0±0,6, respectivamente). La eliminación t ½ fue de 64±24min (S) frente a 198±77min (R). Las concentraciones séricas del isómero S cayeron por debajo de los valores «terapéuticos» adultos (según lo reportado por Stanski et al.) antes de las 4 horas. El modelado de dosis de 0,5mg/kg o 1mg/kg mostró un aclaramiento completo del isómero S en 4 horas, pero una acumulación del isómero R con cada dosis. Como estudio de dosis única, no se observaron efectos adversos en la función renal (volumen de creatinina y orina), mucosa gástrica (examen de guayacol) o función plaquetaria (cantidad de drenaje en los lactantes de craniectomía). La oximetría continua no mostró episodios de desaturación en los grupos placebo o ketorolaco. Queda sin respuesta la posibilidad de que la toxicidad pueda estar relacionada con las concentraciones de isómero R que aumentan con la dosificación repetida31.
Falta información sobre la seguridad en neonatos o lactantes con mayor riesgo de disfunción renal (tras bypass cardíaco, enfermedad cardíaca compleja incluyendo fisiología del ventrículo único), excepto en el estudio de Gupta, detallado anteriormente. Se recomienda precaución en esta población de pacientes. En nuestra institución se administra ketorolaco a 0,5mg/kg cada 6-8 h durante un máximo de 72 h a lactantes mayores de 6 meses y una dosis única de 0,5mg/kg para lactantes de 1 a 6 meses. Aunque la revisión retrospectiva en el grupo de 1-6 meses de edad indica que la dosificación programada de ketorolaco puede ser bien tolerada, la farmacocinética y los datos prospectivos de seguridad para esta práctica son insuficientes. Si se utiliza la dosificación en serie en lactantes < 6 meses durante 48-72 h, se deben considerar la monitorización de la producción de orina, BUN/creatinina y el examen de guayacol de heces.
AcetaminofénEl acetaminofén (o paracetamol en la literatura europea o británica) es el analgésico/antipirético más utilizado en las formas oral o rectal. En 2002 se desarrolló propacetamol, un profármaco intravenoso, y en 2009 una forma activa intravenosa de acetaminofén estaba disponible en Europa. En los EE. UU., el paracetamol por vía intravenosa fue aprobado recientemente por la Food and Drug Administration, por lo que muchos de los informes sobre su uso provienen de sitios europeos o del Reino Unido. Una ventaja de este fármaco es su larga historia de uso en la forma oral, lo que implica que existe información disponible sobre seguridad en niños y lactantes. La toxicidad hepática por sobredosis de acetaminofén y la acumulación del metabolito N-acetil-p-benzoquinona imina (NAPQI) es muy poco frecuente en lactantes debido a que tienen una función enzimática P450 inmadura, específicamente CYP2E1, y hacen concentraciones mucho más bajas de este metabolito. La concentración analgésica ideal no ha sido estudiada por completo, pero Anderson et al. informaron que las concentraciones de paracetamol de 10mg/l dieron como resultado una analgesia en niños después de la amigdalectomía32. Esta concentración es comúnmente usada de forma terapéutica, pero se desconoce si esto aplica en todas las circunstancias.
En 2005, Anderson et al. reportaron un estudio farmacocinético poblacional de propacetamol por vía intravenosa en niños. Incluyó 846 concentraciones de acetaminofén de 7 estudios previos, con un total de 144 niños. La biodisponibilidad fue de 0,5, el aclaramiento fue de 16 l/h/70kg aumentando de 1,27 l/h/70kg en los prematuros (gestación de 27 semanas) al 84% de los valores de los adultos a la edad de un año. El volumen de distribución (periférico) disminuyó de 45 l/70kg en prematuros (27 semanas) a valores de adultos a los 6 meses de edad. Anderson et al. predijeron que la dosis de propacetamol 30mg/kg cada 6 h resultaría en pacientes pediátricos con concentraciones de acetaminofén de 10mg/l33.
Allegaert et al. (2004) reportaron la cinética de una dosis única de paracetamol por vía intravenosa en 30 neonatos que mostró un aclaramiento menor en lactantes con menos de 37 semanas de gestación (8,1 l/h/70kg) en comparación con los de 37-41 semanas de gestación (11,9 l/h/70kg), observando una marcada variabilidad entre pacientes. La vida media de eliminación se prolongó a 277 min en el grupo prematuro comparado con 172 min en el grupo neonatos a término, donde de nuevo se notó una gran variabilidad34. La farmacocinética de la población de paracetamol en los lactantes fue reportada por Allegaert et al. en 2011, incluyeron a 158 neonatos (58 prematuros) de 4 estudios, con 943 observaciones de acetaminofén. El aclaramiento en este grupo más grande de lactantes fue de 5 l/h/70kg, con un aclaramiento adulto de 16,2 l/h/70kg encontrado a la edad de un año. Su indicación fue el uso de una dosis de carga de 20mg/kg seguida de 10mg/kg cada 6h para apuntar hacia una concentración de 11mg/l de acetaminofén en lactantes de 32-44 semanas de gestación35.
El perfil de seguridad y la cinética del paracetamol por vía intravenosa fueron estudiados por Palmer et al. en 50 neonatos que recibieron dosis repetidas en el posoperatorio. El aclaramiento fue de 5,2 l/h/70kg, con un gran volumen de distribución de 76 l/70kg. La bilirrubina alta estaba correlacionada con un aclaramiento disminuido. Los niveles diarios de enzimas hepáticas se mantuvieron normales en 49 de los 50 lactantes, aumentando en uno después de 5 dosis y recuperándose cuando se detuvo el acetaminofén. Ella indica 15mg/kg/6h en lactantes a término, con reducción para la hiperbilirrubinemia36.
Ceelie et al. realizaron un ensayo controlado aleatorizado y ciego en 71 lactantes, con edades comprendidas entre las 37 semanas de gestación y el primer año de edad, tratados después de cirugía abdominal o torácica mayor. Los lactantes recibieron paracetamol por vía intravenosa 30mg/kg/día en 4 dosis o infusiones de morfina a 4-16 μg/kg/h después de un anestésico estandarizado con una dosis de morfina 30 min antes del final de la cirugía. Se hizo rescate de dolor con dosis de morfina en bolo en ambos grupos. Los puntajes de dolor y el número que necesitaba rescate fueron los mismos en ambos grupos. La morfina total fue menor en el grupo de acetaminofén (122 μg/kg durante 48h frente a 357 μg/kg/48h); se administró naxalona a 3 en el grupo de morfina, ninguno en el grupo del acetaminofén (p=NS)37.
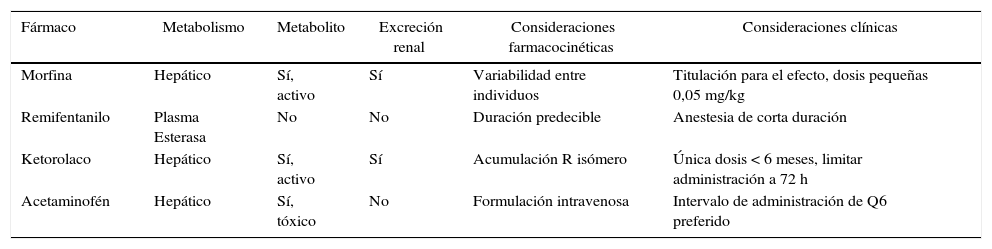
Puede encontrarse un resumen de las consideraciones farmacocinéticas revisadas aquí en la tabla 1. Existe información farmacocinética más detallada que está más allá del alcance de esta revisión y se puede encontrar en otro sitio6.
Consideraciones farmacocinéticas y clínicas de analgésicos comunes en lactantes
| Fármaco | Metabolismo | Metabolito | Excreción renal | Consideraciones farmacocinéticas | Consideraciones clínicas |
|---|---|---|---|---|---|
| Morfina | Hepático | Sí, activo | Sí | Variabilidad entre individuos | Titulación para el efecto, dosis pequeñas 0,05 mg/kg |
| Remifentanilo | Plasma Esterasa | No | No | Duración predecible | Anestesia de corta duración |
| Ketorolaco | Hepático | Sí, activo | Sí | Acumulación R isómero | Única dosis < 6 meses, limitar administración a 72 h |
| Acetaminofén | Hepático | Sí, tóxico | No | Formulación intravenosa | Intervalo de administración de Q6 preferido |
Fuente: autores.
La aplicación clínica de la farmacocinética y la farmacodinámica de los opiáceos (morfina o remifentanilo) o de los AINE (ketorolaco o acetaminofén por vía intravenosa) al cuidado de lactantes que requieren cirugía tiene espacio para mucho más estudio. Parece razonable considerar la terapia multimodal para minimizar los efectos secundarios indeseables de los opiáceos. La variabilidad del aclaramiento de los opiáceos más viejos como la morfina apoya el uso de dosis pequeñas (0,05mg/kg de morfina) y la titulación para el efecto. El remifentanilo evita el problema de la variabilidad, pero requiere de infusión para mantener el efecto y la analgesia desaparece rápidamente (< 30min) una vez que se suspende, lo que puede no ser apropiado para el lactante posoperatorio.
El ketorolaco, en un estudio de dosis única, no mostró efectos adversos en la función hepática, gastrointestinal o renal, pero plantea la preocupación de la acumulación del isómero R con dosis repetidas y su relación desconocida con la toxicidad.
El acetaminofén tiene información cinética intravenosa para los lactantes disponible para guiar la dosificación, por lo que puede ser parte de un régimen analgésico multimodal en la mayoría de los lactantes. También se deben considerar los adjuntos no farmacológicos que no hemos presentado en este foro, incluyendo el uso de técnicas de anestesia regional, glucosa oral, succión no nutritiva y arropamiento.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciamientoNinguno.
Conflicto de interesesLos autores declaran que no tienen conflictos de interés.