Se describe la técnica anestésica en 2 neonatos con diagnóstico prenatal de malformación adenomatoide quística sintomáticos, llevados a cirugía de resección pulmonar en el Hospital Universitario San Ignacio bajo anestesia general uno de los dos con ventilación unipulmonar y analgesia con catéter caudal guiada por ecografía y el otro con anestesia general y ventilación bipulmonar.
La malformación adenomatoide quística es una patología poco frecuente que mejora su desenlace con el diagnóstico y manejo temprano con una sobrevida mayor del 95%.
In this case report we describe the anesthetic management of two newborn patients with congenital cystic adenomatoid malformation of the lung. Both patients underwent lobe resection using general anesthesia. In the first patient we also use regional anesthesia trought an ultrasound guided epidural catheter and one lung ventilation. In the second patient we use general anesthesia and conventional ventilation.
Congenital cystic adenomatoid malformation is a rare condition, but it has an excelent prognosis with early diagnosis and surgical treatment.
La malformación adenomatoide quística es una lesión de presentación rara con incidencia de 1 en 10.000 a 1 en 35.000 embarazos1, es una lesión congénita que se genera con la proliferación de los bronquiolos terminales sin la formación normal de los alvéolos; no se presenta predilección por género, raza o lateralidad y el 100% se diagnostica con la ecografía de las 20 semanas. En neonatos, la clasificación de Adzick dependiendo del tamaño de los quistes es la más utilizada, siendo la tipo 1 o macroquística más prevalente (58%) que la tipo 2 o microquística2. El diagnóstico prequirúrgico debe realizarse con tomografía axial computarizada, con una sensibilidad del 100%3.
El objetivo del presente reporte es dar a conocer el manejo anestésico en el Hospital San Ignacio para 2 pacientes con una patología de presentación poco frecuente.
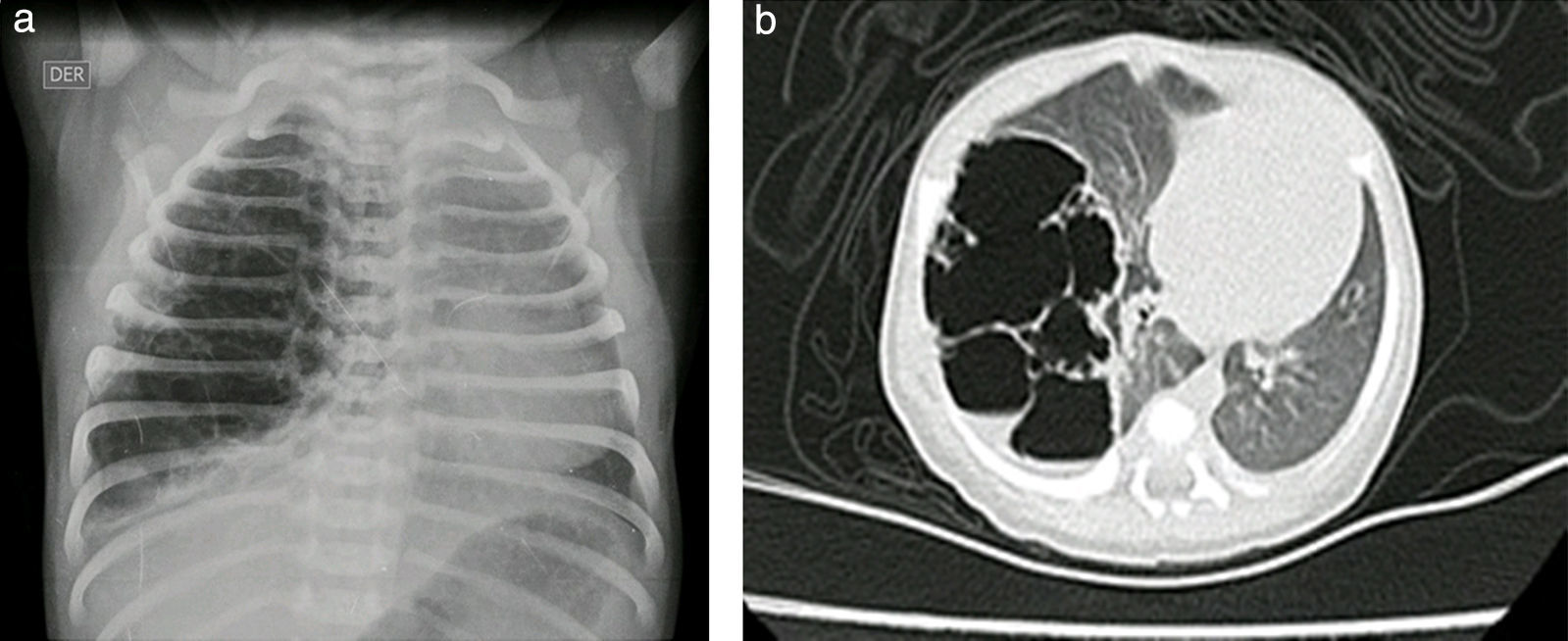
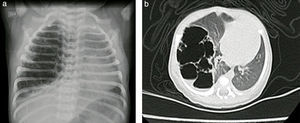
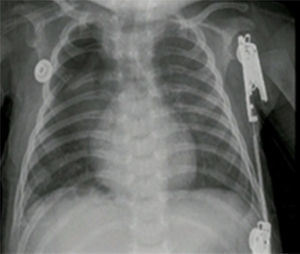
Reporte de casosCaso n.° 1Paciente masculino, de 43 semanas de edad posconcepcional, con diagnóstico prenatal de malformación adenomatoide quística derecha, al nacer con saturaciones de oxígeno entre el 75 y el 85%, requiriendo hospitalización en cuidados intensivos neonatales; peso de 3,2kg. Paraclínicos prequirúrgicos descritos en la tabla 1. Ecocardiograma con foramen oval permeable, buena función biventricular, hipertensión pulmonar leve PSAP 35mmHg. Previo al procedimiento quirúrgico, se solicitan radiografía de tórax y tomografía axial computarizada para caracterizar la lesión (fig. 1 a y b).
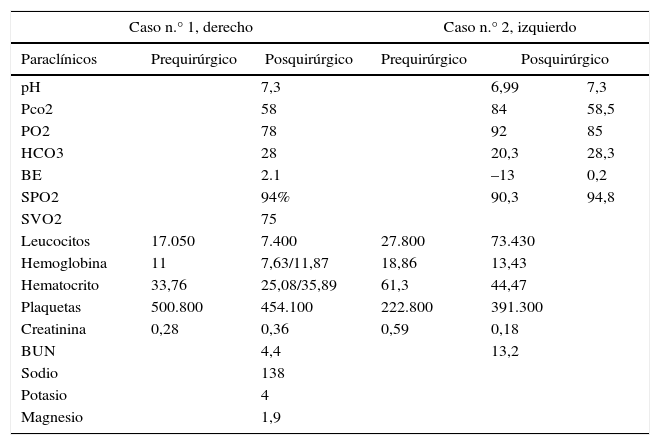
Paraclínicos pre y posquirúrgicos
| Caso n.° 1, derecho | Caso n.° 2, izquierdo | ||||
|---|---|---|---|---|---|
| Paraclínicos | Prequirúrgico | Posquirúrgico | Prequirúrgico | Posquirúrgico | |
| pH | 7,3 | 6,99 | 7,3 | ||
| Pco2 | 58 | 84 | 58,5 | ||
| PO2 | 78 | 92 | 85 | ||
| HCO3 | 28 | 20,3 | 28,3 | ||
| BE | 2.1 | –13 | 0,2 | ||
| SPO2 | 94% | 90,3 | 94,8 | ||
| SVO2 | 75 | ||||
| Leucocitos | 17.050 | 7.400 | 27.800 | 73.430 | |
| Hemoglobina | 11 | 7,63/11,87 | 18,86 | 13,43 | |
| Hematocrito | 33,76 | 25,08/35,89 | 61,3 | 44,47 | |
| Plaquetas | 500.800 | 454.100 | 222.800 | 391.300 | |
| Creatinina | 0,28 | 0,36 | 0,59 | 0,18 | |
| BUN | 4,4 | 13,2 | |||
| Sodio | 138 | ||||
| Potasio | 4 | ||||
| Magnesio | 1,9 | ||||
Fuente: autores.
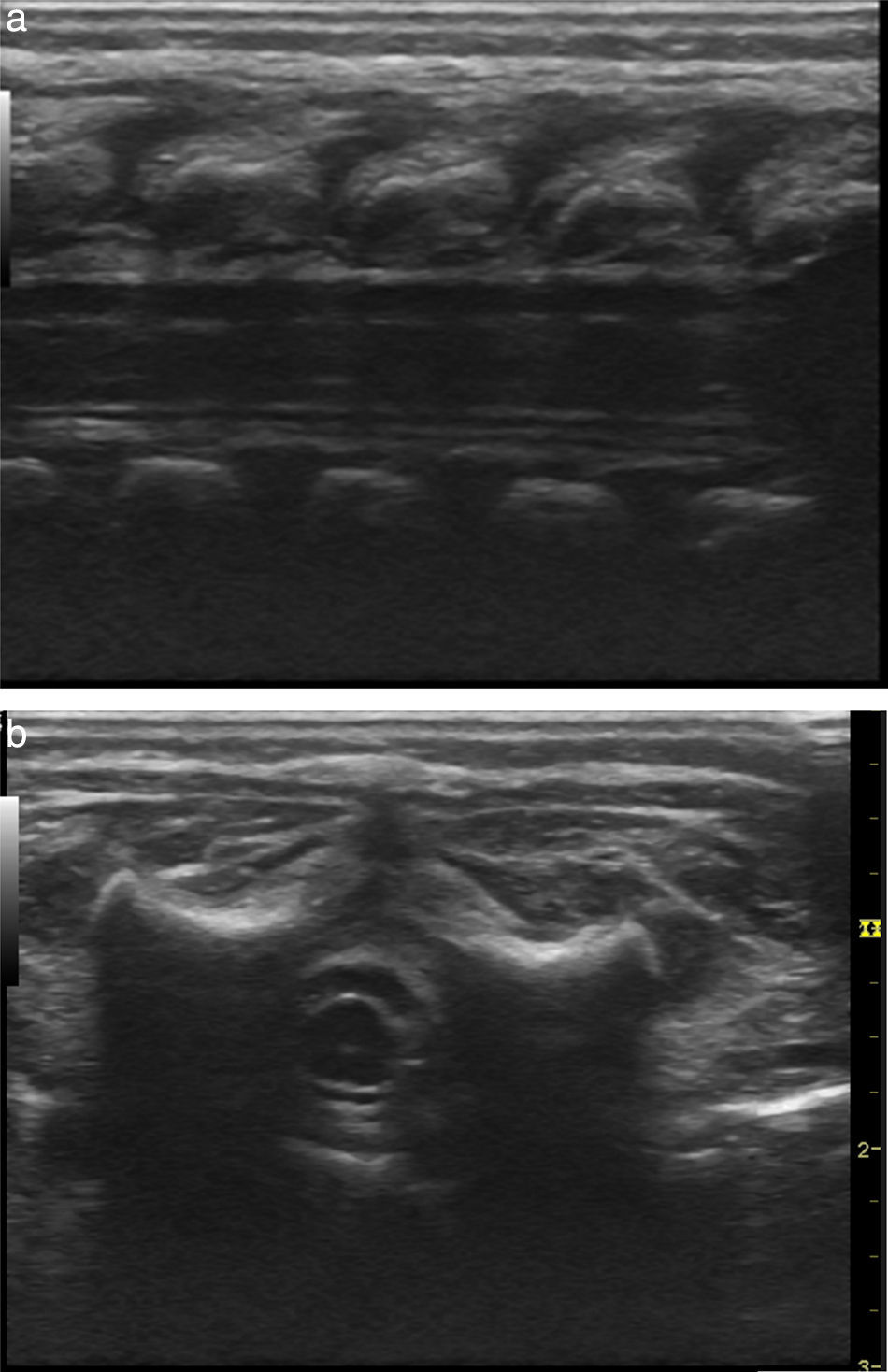
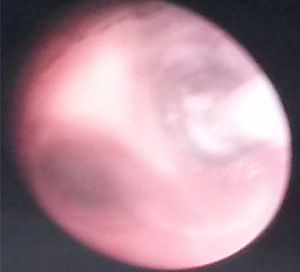
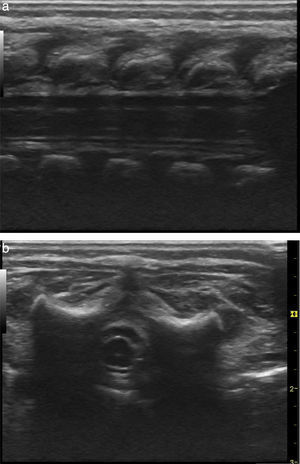
Se realiza monitorización básica, preoxigenación con máscara facial e inducción intravenosa con fentanilo 3 μg/kg, lidocaína 1mg/kg, propofol 1mg/kg, y manteniendo ventilación espontánea se efectúa broncoscopia rígida para colocación de catéter Fogarty número 3 Fr en el bronquio fuente derecho para ventilación unipulmonar (fig. 2); posteriormente, intubación orotraqueal con tubo 3,5 fijo a 9cm de la comisura labial, sin complicaciones, monitorización invasiva con línea arterial radial derecha y catéter venoso central yugular interno derecho. Para manejo analgésico, se procede a realizar una punción caudal con aguja Touhy n.° 20 pediátrica y se avanza el catéter peridural hasta nivel torácico de T6, espacio previamente marcado con ultrasonido y, bajo visión ecográfica con transductor de alta frecuencia, se inyecta a través del catéter bupivacaína 0,25% con volumen de 1,5 cc, observando distribución del anestésico local en el espacio peridural a ese nivel (fig. 3 a y b).
Se continúa manejo anestésico con sevorane a 2 Vol % y con paciente en decúbito lateral izquierdo con aislamiento pulmonar derecho se realiza resección de malformación pulmonar de lóbulo superior derecho de 10cm de diámetro. Durante el procedimiento, el paciente permanece estable hemodinámicamente con saturaciones entre 94 y 96%, sangrado total de 10 cc y control de gases arteriales en equilibrio ácido base (tabla 1), que permitió la extubación del paciente al final del procedimiento y el manejo postoperatorio de dolor con infusión por catéter caudal torácico durante las siguientes 48 h, lo que permite mantener adecuada mecánica respiratoria y recuperación postoperatoria temprana sin inestabilidad hemodinámica ni requerimiento de oxigenoterapia.
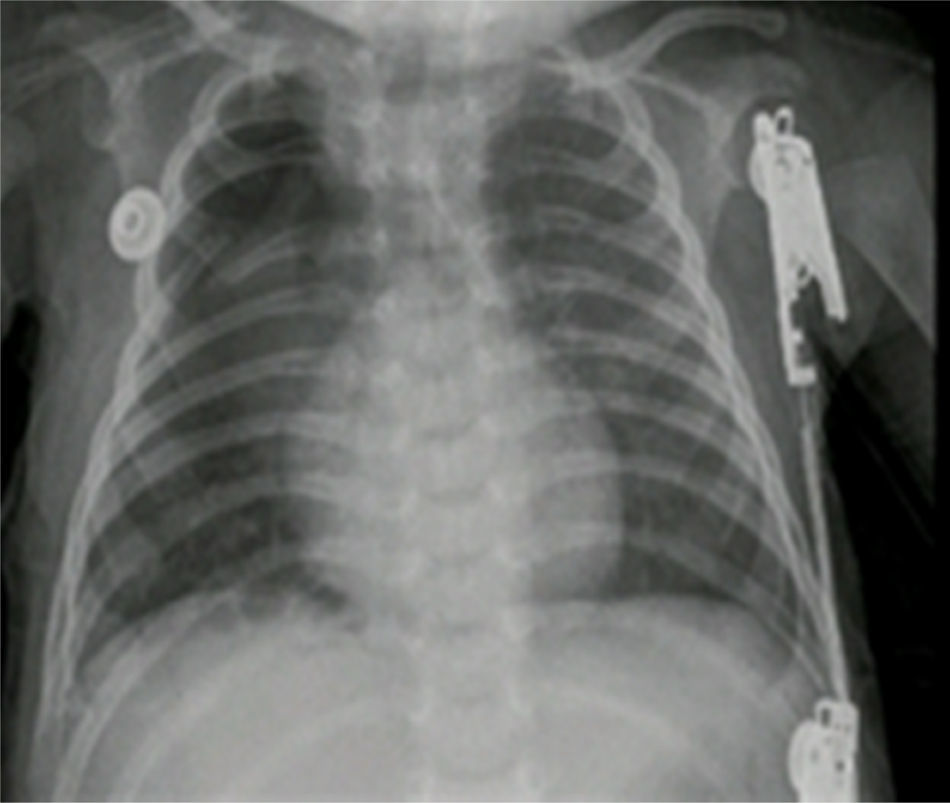
Reporte de patología: lóbulo superior derecho con malformación adenomatoide quística tipo ii; control radiográfico con adecuada expansión pulmonar (fig. 4).
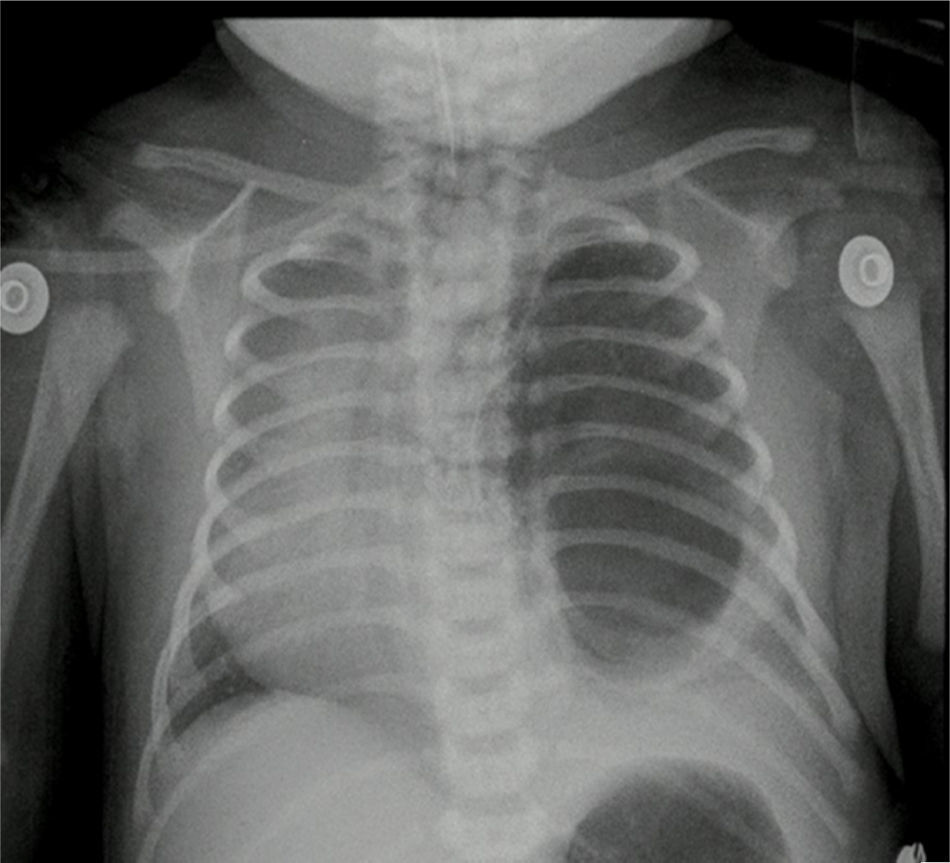
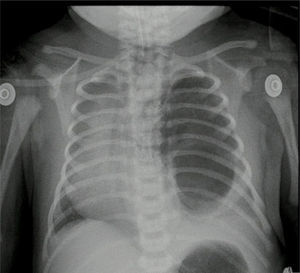
Caso n.° 2Recién nacido de sexo femenino de 38,5 semanas de edad posconcepcional, con diagnóstico antenatal de malformación adenomatoide quística tipo 1 del lado izquierdo; peso al nacer de 2.875 g. Ecocardiograma prequirúrgico con ductus permeable de 3,8mm, sin repercusión hemodinámica, foramen oval permeable, buena función biventricular. Paraclínicos prequirúrgicos descritos en la tabla 1. Previo al procedimiento quirúrgico, se realizan una radiografía de tórax y una tomografía axial computarizada (fig. 5).
Se realiza monitorización básica, previa oxigenación, inducción intravenosa con fentanilo 3 μg/kg, lidocaína 1mg/kg, propofol 3mg/kg y cisatracurio 0,1mg/kg; posterior intubación orotraqueal con tubo 3 sin neumotaponador fijo a 10cm de la comisura labial, quedando selectivo al pulmón derecho; verificación por auscultación pulmonar. Se canaliza la línea arterial radial izquierda; paciente con catéter epicutáneo en posición. Durante el intraoperatorio de lobectomía inferior y de la língula, paciente con dificultad para la ventilación, requiriendo ventilación manual para control de las presiones de vía aérea, con episodios de desaturación hasta el 84% durante la resección y la posición en decúbito lateral derecho; control de gases arteriales con acidosis respiratoria importante, con CO2 en 55, por lo que no fue posible la extubación. Sangrado intraoperatorio de 15ml.
Reporte de patología con lesión quística dependiente del lóbulo inferior del pulmón izquierdo y secuestro pulmonar intralobar. En el postoperatorio, control de radiografía de tórax con adecuada expansión torácica.
DiscusiónLa malformación adenomatoide descrita por primera vez en 1949 por Chi¿n Tang es una patología poco prevalente de etiología desconocida; es una lesión hamartomatosa que contiene tejido de diferentes orígenes pulmonares con formación anormal de los alvéolos, generando quistes de diversos tamaños que principalmente se presentan unilaterales (80-95%). Se desarrollan embriológicamente en el periodo seudoglandular y sacular a las 7-17 semanas de gestación; fisiopatológicamente, se cree que son secundarias a proliferación tisular anómala, obstrucción de la vía aérea y displasia y metaplasia de tejidos normales4.
Existen 2 clasificaciones: la de Stocker, que divide las malformaciones en 5 tipos sobre la base del componente histológico de la lesión, y la de Adzick, basada en el tamaño de los quistes encontrados en el pulmón. La ecografía prenatal diagnostica más del 80% de las lesiones, con lo cual, según el tamaño de la lesión con respecto al perímetro cefálico, se puede calcular el volumen de la lesión, lo que se correlaciona directamente con la sobrevida y el riesgo de complicaciones como desviación mediastinal marcada, hidropesía fetal, ascitis y falla cardiaca. En algunos casos se realiza cirugía antenatal, sin encontrar evidencia significativa que respalde este manejo5. El diagnóstico tardío en ocasiones se realiza por infecciones pulmonares a repetición, bronquiectasias, abscesos pulmonares, hemoptisis, pioneumotórax, asma resistente al manejo o por transformación maligna5.
El procedimiento quirúrgico debe realizarse previo a la aparición de los síntomas, tales como dificultad respiratoria, taquipnea, retracciones y cianosis; y de forma temprana, lo cual mejora el pronóstico, puede generar crecimiento compensatorio del pulmón, disminución en el riesgo de neumotórax espontáneo, de infección y de transformación maligna6,7, así como ayuda a salvar el parénquima adyacente sano y contrarresta la posible desviación mediastinal secundaria.
El riesgo de complicaciones quirúrgicas es del 6 al 9%, siendo principalmente secundario a fugas de aire, atelectasias, derrame pleural, neumotórax y fístulas broncopleurales. La mortalidad es prácticamente inexistente y posterior al procedimiento la extubación es facilitada por el manejo analgésico con regional/peridural8.
En algunas series se describe el manejo por videotoracoscopia, resultando en un incremento del tiempo quirúrgico con menor estancia hospitalaria, mejores desenlaces cosméticos y menor dolor en el postoperatorio9-11.
El reto anestésico en este tipo de pacientes es mantener la estabilidad hemodinámica y adecuadas saturaciones durante la ventilación del neonato en decúbito lateral con tórax abierto. En los casos anteriormente descritos, expusimos 2 técnicas anestésicas con resultados posoperatorios claramente diferentes. El uso de ventilación unipulmonar en el primer paciente redujo el sangrado, facilitó la resección de la malformación y mantuvo la relación ventilación/perfusión, disminuyendo el shunt en ese pulmón, logrando una adecuada saturación y manejo de CO2; a diferencia del segundo paciente, en el que el aislamiento con tubo orotraqueal selectivo con verificación clínica por auscultación no garantizó el aislamiento adecuado de la malformación, presentando mayor sangrado intraoperatorio, permanencia del shunt y dificultad en la ventilación por aumento de las presiones de la vía aérea, con aumento considerable del CO2, lo que hizo imposible la extubación al final del procedimiento. Por otro lado, la técnica anestésica combinada en el primer caso logró disminuir el consumo de anestésico inhalado con una dosis pequeña de anestésico local, sin producir cambios hemodinámicos y facilitando la extubación y el manejo analgésico posoperatorio a través de la infusión continua de anestésico local por el catéter peridural torácico.
Comité de éticaEl reporte de casos fue presentado en el comité de ética médica del Hospital Universitario San Ignacio y avalado para publicación.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciamientoNinguno.
Conflicto de interesesLos autores declaran no tener conflicto de interés.