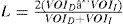Estudiar el comportamiento del uso de razones entre metabolitos y de la comparación de un volumen de interés con uno contralateral para determinar cuál de estas 2 técnicas es la más apropiada para obtener una relación del comportamiento metabólico de un espectro de resonancia magnética.
MétodosFueron reclutados 10 voluntarios sanos, en los que fueron analizados el lóbulo parietal, el lóbulo temporal y los ganglios basales.
ResultadosLa cuantificación directa del espectro mostró un mayor coeficiente de variación dentro de los análisis realizados, lo cual justifica usar técnicas con referentes endógenos. El estudio de un volumen contralateral mostró ser una técnica con dispersión e índice de lateralidad altos. El uso de la creatina (Cr) como metabolito de control presentó un coeficiente de variación menor que la primera técnica evaluada. Los resultados hallados (ganglios basales: N-acetil-aspartato/Cr: 3±6; colina/Cr: 2±4. Lóbulo temporal: N-acetil-aspartato/Cr: 5±5; colina/Cr: 8±12. Lóbulo parietal: N-acetil-aspartato/Cr: 2,0±0,6; colina/Cr: 0,9±0,5) muestran valores similares a los encontrados en la literatura, con variaciones regionales considerables.
ConclusionesLa técnica de cuantificación de la razón de los metabolitos con la Cr es la más adecuada para usar en el Instituto Nacional de Cancerología, por tener una dispersión menor y por arrojar valores cercanos a los reportados en la literatura en las diferentes regiones anatómicas estudiadas.
To study the performance in the use of metabolite ratios and the comparison of a contralateral volume of interest in order to determine which of these two techniques is most suitable for obtaining a ratio of the metabolite behaviour of a magnetic resonance spectrum.
MethodsThe parietal lobe, the temporal lobe, and basal ganglions were analysed in the 10 healthy volunteers included in the study.
ResultsThe direct quantification of the spectra showed a wide coefficient of variation within the analyses performed, which justified using techniques with endogenous references. The study of a contralateral volume showed to be a technique with a high dispersion and laterality index. The use of creatinine (Cr) as a control metabolite had a lower coefficient of variation than the first technique evaluated. The results obtained (basal ganglions: N-acetyl-aspartate/Cr: 3±6; choline/Cr: 2±4. Temporal lobe: N-acetyl-aspartate/Cr: 5±5; choline/Cr: 8±12. Parietal Lobe: N-acetyl-aspartate/Cr: 2.0±0.6; choline/Cr: 0.9±0.5) showed similar values to those obtained in the literature, with considerable anatomical region variations.
ConclusionsThe technique that measures the ratio of the metabolites with Cr is the most suitable for use in the Instituto Nacional de Cancerología (National Oncology Institute), due to having a lower dispersion and producing results near those repo rted in the literature in the different anatomical regions studied.
Si bien las técnicas de imágenes de resonancia magnética son usadas habitualmente en el diagnóstico de tumores primarios, secundarios y otras lesiones intracraneales, la espectroscopia por resonancia magnética (ERM) proporciona información por completo diferente, relacionada con la proliferación de las membranas celulares, el daño neuronal, el metabolismo energético y las transformaciones necróticas de tejidos cerebrales o tumorales. El uso de estas 2 técnicas en conjunto ha desempeñado un papel muy importante en el estudio no solo de los tumores, sino de traumas, epilepsias, esclerosis múltiple, demencia, etc.1–6.
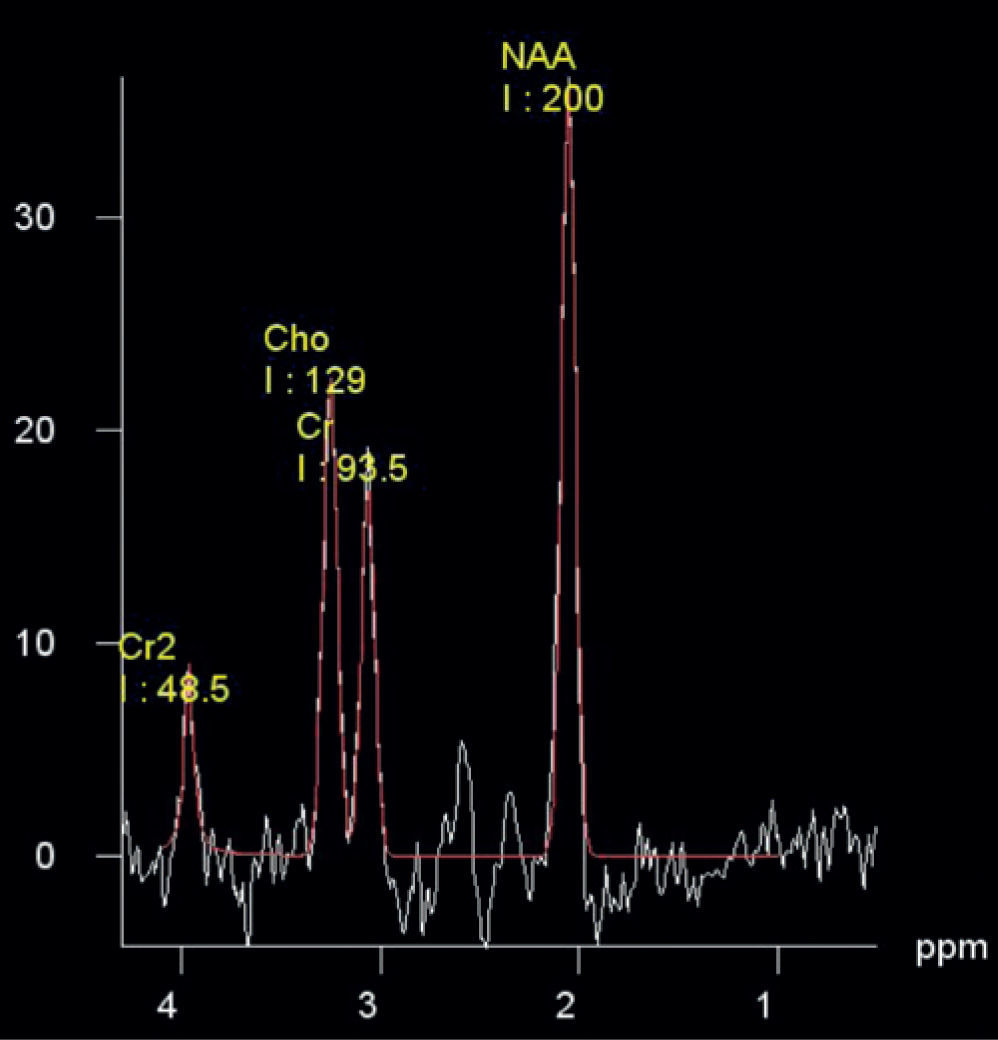
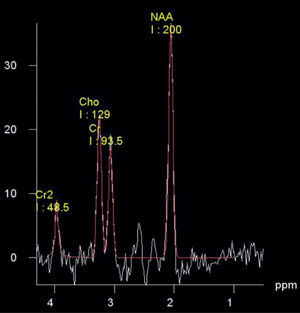
Cuantificación de espectrosA diferencia de las imágenes, el resultado de los estudios de ERM son gráficas que, a través de picos, presentan la concentración de diferentes metabolitos (fig. 1). Sin embargo, la forma del espectro se ve influenciada por las variaciones en los campos magnéticos usados para su adquisición; es decir, depende, principalmente, del equipo, de las antenas usadas y de la morfología de los pacientes, por lo que una simple inspección visual no permite la correcta interpretación de los espectros.
Se han desarrollado técnicas de cuantificación que buscan relacionar el área de los picos con la concentración del metabolito y expresarla en unidades de milimolaridad (mmol/L, o bien, en mM)7, mediante el uso de referencias internas (generalmente, el agua del parénquima no suprimida) o externas (que pueden ser agua o acetato de sodio contenidas en un tubo puesto cerca a la cabeza del paciente)8–10. Ambos métodos tienen limitaciones importantes relacionadas con los principios físicos y químicos de la adquisición; sin embargo, el problema más importante dentro de la práctica clínica radica en que dichas técnicas requieren un análisis matemático, en el que se incluyen los tiempos de relajación, la estimación de la cantidad de sustancia gris y blanca, el número de protones incluidos en la muestra (que se relaciona, a su vez, con el volumen y la localización del área por evaluar); tales cálculos resultan complicados si no se cuenta con personal experto que los realice11.
Por lo anterior, se estudian las técnicas de análisis más usadas en ERM, las cuales, aunque no permiten cuantificar la concentración metabólica, sí conducen a una evaluación más adecuada de los espectros que la inspección visual. Estas se basan en patrones endógenos, como el método de razones entre metabolitos y el uso de espectros de control como referencia. En el método de las razones entre metabolitos, las áreas halladas en cada uno de los picos del espectro son reportadas como la razón entre estas y el área de un pico de referencia, donde la creatina (Cr) es el metabolito más usado en los espectros de 1H. Esta técnica permite identificar anomalías metabólicas, al encontrar variaciones respecto a los valores de los espectros de tejido normal sano. Sin embargo, en la literatura se reporta que el sacrificio en exactitud y en precisión cuando se usa esta técnica excede los beneficios que ofrece12. Además de lo anterior, los niveles de Cr pueden modificarse cuando hay focos de esclerosis múltiple, VIH y demencia4, así como traumas, abscesos o neoplasmas, y todo ello hace que el control no sea válido3.
Por otro lado, el uso de espectros de control como referencia basa su análisis en la comparación del espectro hallado en el volumen de interés (VOI) con su correspondiente volumen contralateral (VC), ubicado en la misma región anatómica del otro hemisferio; así, el paciente es su propio control. Es decir, cuando se tiene un espectro de tejido sano como referencia, podrán identificarse alteraciones metabólicas en el VOI ubicado en la misma región anatómica del control VC; sin embargo, los resultados se hacen dependientes de las posibles variaciones del campo magnético entre estas 2 posiciones: el VOI y su VC1.
Al identificar las variables que pueden afectar estas 2 técnicas de análisis se pretende, entonces, evaluar su reproducibilidad, por medio de estudios en un grupo de voluntarios sanos; dichos estudios se llevan a cabo en las mismas condiciones que los realizados en la práctica clínica de la institución, con el fin de determinar los rangos clínicos que pueden llevar a la detección de anomalías metabólicas, y no a variaciones propias del experimento en los exámenes realizados en el servicio de imágenes diagnósticas del Instituto Nacional de Cancerología (INC).
MétodosEl estudio se realizó en un equipo de resonancia Siemens Essenza de 1.5T del INC. Fueron reclutados 10 voluntarios sanos en un estrecho rango de edad, con una media de 26±3 años, a quienes se les realizaron estudios de imágenes de resonancia magnética y de ERM cerebrales de 1H. Estos fueron incluidos en el estudio si, y solo si, eran considerados sanos, no tenían ningún tipo de dispositivo que pudiera verse afectado por los campos magnéticos o que degrade la calidad de la imagen (como aparatos de ortodoncia), y aceptaban su participación en el estudio con la firma de un consentimiento informado. El estudio fue aprobado por el Comité de Ética e Investigaciones del INC.
Para posicionar los VOI y para excluir patologías, se realizaron imágenes estructurales con el protocolo de cráneo del INC (tiempo de repetición/tiempo de eco): SE sagital (401ms/13ms); Flair Blade axial (8.500ms/13ms); T2 Blade axial (4.110ms/119ms); T2 Blade coronal (4.500ms/111ms); Eco planar imaging (EPI) (3.800ms/119ms) y Spin-Echo (SE) axial T1 (420ms/8,1ms); todas ellas, con un campo de visión de 230×230mm2. No fue necesario el uso de medio de contraste para los propósitos del estudio.
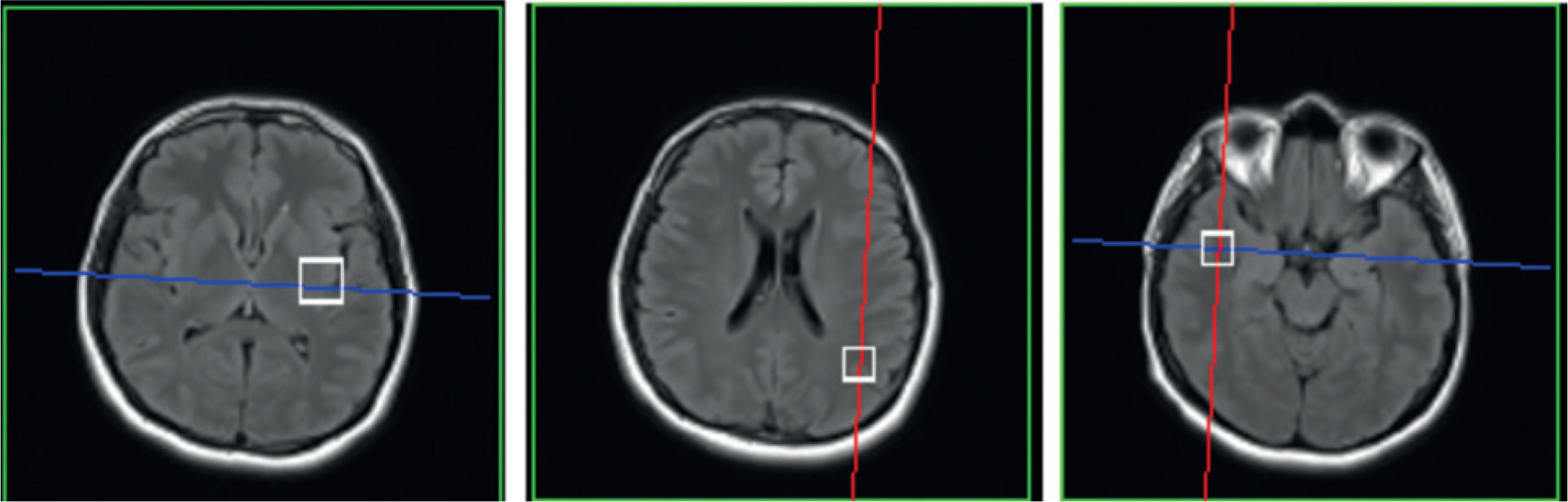
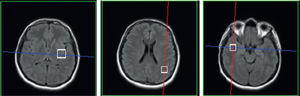
Se estudiaron las 3 regiones anatómicas de mayor relevancia clínica: una en los ganglios basales, otra en el lóbulo parietal y, finalmente, una en el lóbulo temporal; las 3 fueron tomadas en ambos hemisferios (fig. 2). El tamaño del VOI fue de 15×15×15mm3 en los lóbulos, y de 20×20×20mm3 en los ganglios basales.
Previamente a la obtención del espectro, se obtuvo una supresión débil de agua con la secuencia CHESS (chemical shift selective), con un ancho de banda de 35Hz. La secuencia usada para la selección del VOI fue la PRESS (point resolved spectroscopy), con 128 promedios, un tiempo de eco de 135ms y tiempo de repetición de 1.500ms. Antes de la medida, el equipo ajustó automáticamente el campo magnético con shimming de primer y segundo orden, sin realizar ningún otro ajuste por parte del usuario.
Procesamiento y análisisLos espectros fueron procesados con el software jMRUI13; este, a diferencia de los incluidos en los equipos comerciales, permite el análisis paso a paso de la señal, además es gratuito y abierto. Fueron incluidos en el estudio solo los espectros con un ancho de banda a mitad de altura del agua menor que 7Hz (5,80±1,20Hz), y dicha señal fue suprimida por la descomposición de valor único de Hankel-Lanczos. Se usó un filtro gaussiano de 5Hz como apodización, y la señal fue ajustada mediante el algoritmo AMARES10, con la cual se analizó como una superposición de 3 componentes: N-acetil-aspartato (NAA) a 2,02ppm, Cr a 3,02ppm y colina (Cho) a 3,22ppm. La relación señal-ruido fue de: 80±18 en los espectros de los ganglios basales; de 45±7, en los del lóbulo parietal, y de 34±7, en los del lóbulo temporal.
Con los datos obtenidos en cada una de las regiones, se evaluó la simetría de los espectros mediante el índice de lateralidad (IL)14:
donde: VOID es el VOI del lado derecho, y VOII, el del izquierdo.A su vez, en la práctica clínica vendrían siendo el VOI y el VC, dependiendo de su ubicación. Se analizaron también las razones entre metabolitos: NAA/Cr y Cho/Cr; y en ambos casos se determinó el coeficiente de variación (CV) como la razón entre la desviación estándar y el valor medio para comparar ambas técnicas. Los resultados se analizaron a través de los percentiles del 25, 50 y 75, y se utilizaron diagramas de cajón-bigotes para mostrar el comportamiento de las variables continuas.
ResultadosCalidad de los espectrosLos espectros con un ancho de banda a mitad de altura del agua menor que 7Hz fueron en todos los casos de muy buena calidad en cuanto a la interpretación clínica que puede extraerse de estos (fig. 1). En ningún caso, la relación señal-ruido ni el ancho de los picos se consideraron como una fuente de mala interpretación de los resultados, según criterio médico, lo que, a su vez, concuerda con los altos valores de las relaciones señal-ruido encontradas.
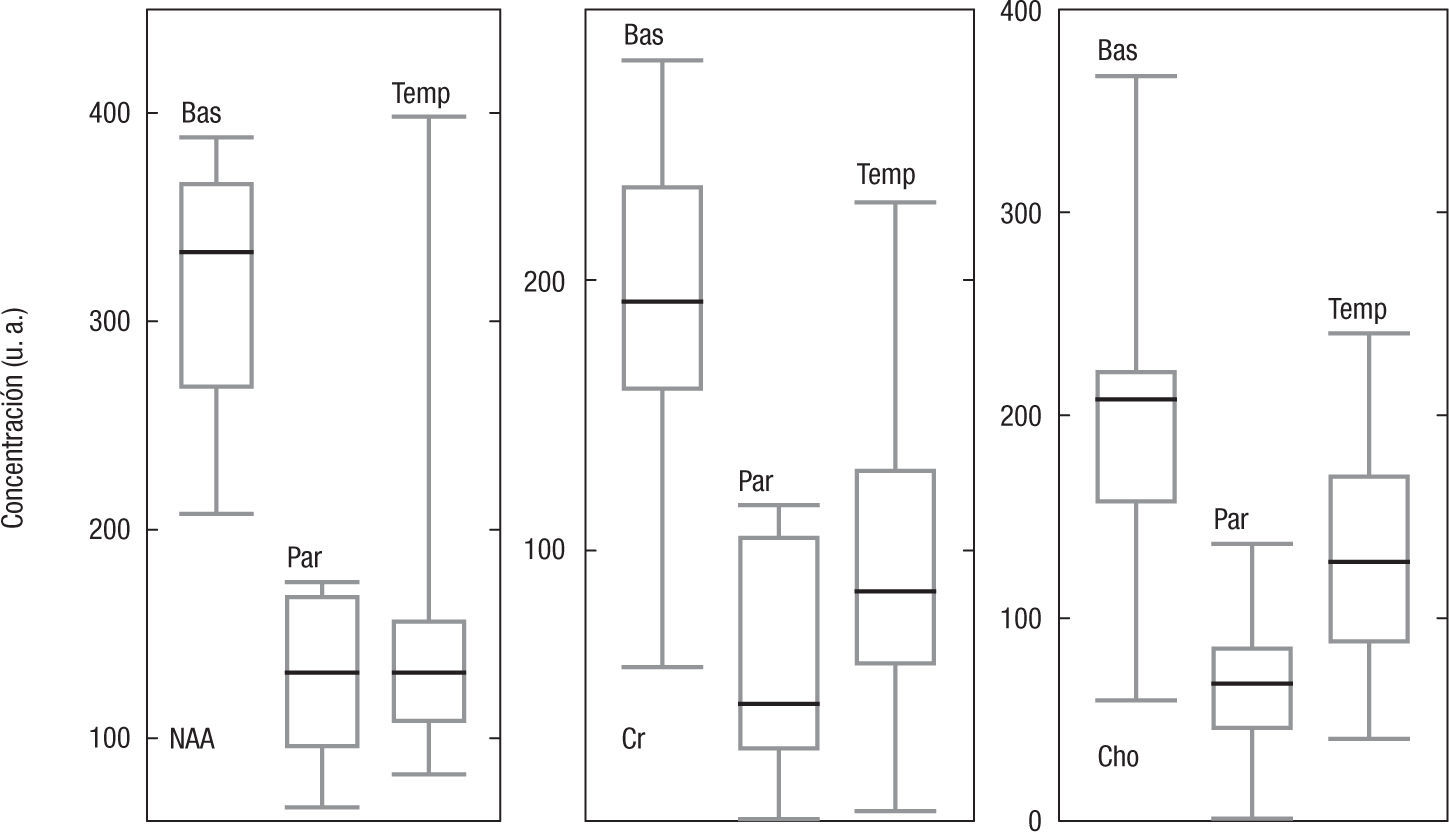
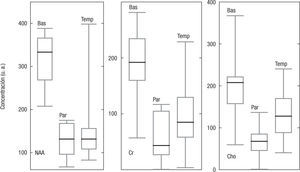
Cuantificación directa del área de los picosEl área de los picos estudiados (NAA, Cr y Cho) se determinó en cada una de las regiones anatómicas estudiadas; los resultados se muestran en la figura 3. Se observa en todos los casos que la mediana es inferior en el lóbulo parietal, y superior en los ganglios basales, y que existen variaciones significativas en los valores medios de todos los metabolitos en las diferentes regiones. La dispersión de estos fue similar en todos los casos. Analizando el CV, se halla en los ganglios basales: NAA=0,19; Cho=0,33; Cr=0,34; en el lóbulo parietal: NAA=0,33; Cho=0,45; Cr=0,66; y en el temporal NAA=0,21; Cho=0,44; Cr=0,75.
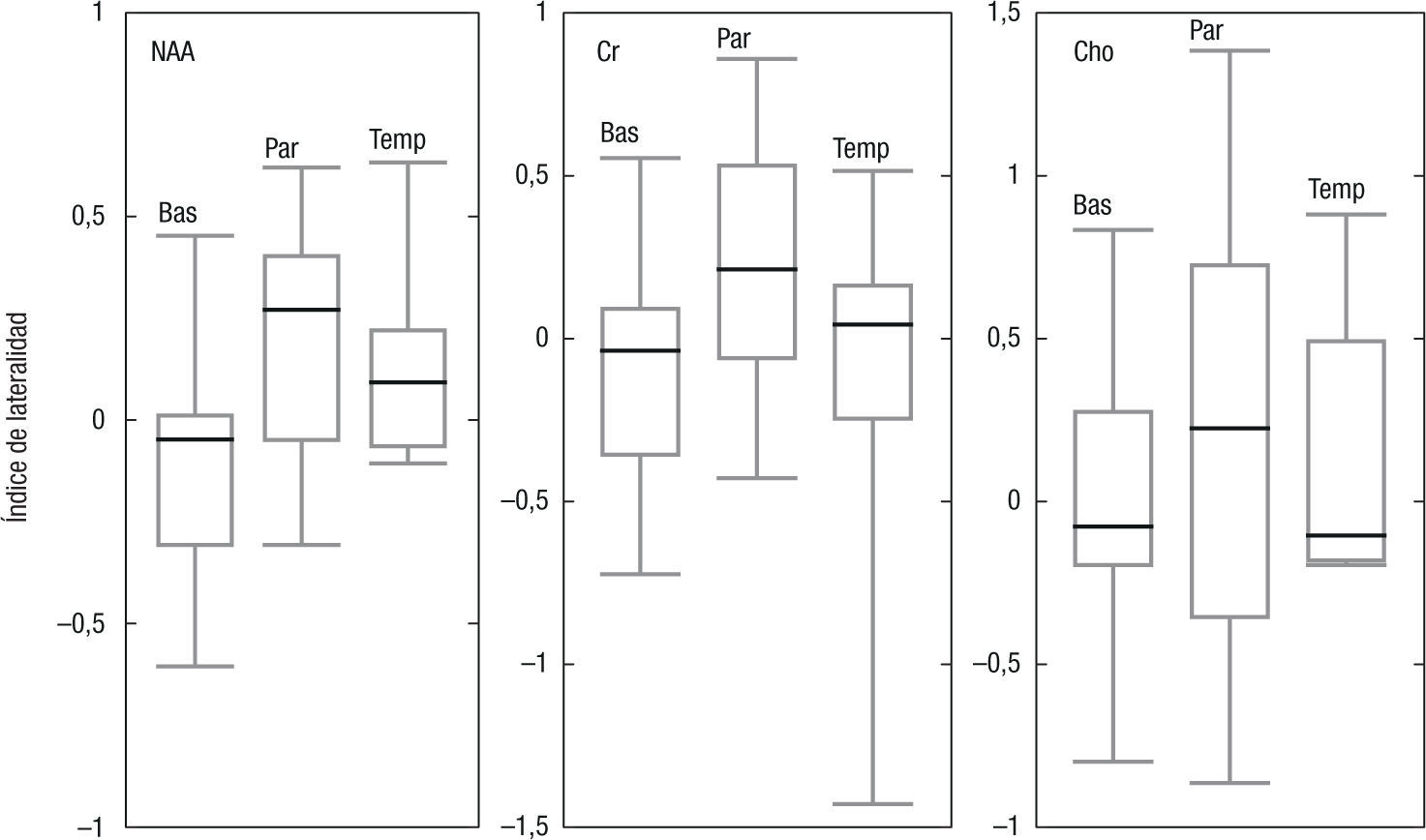
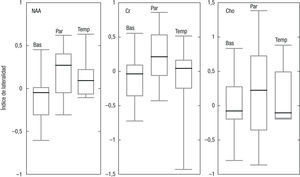
Índice de lateralidadLos resultados de los IL se muestran en la figura 4 para el NAA, la Cr y la Cho, en las regiones anatómicas estudiadas. Aunque la mediana en todos los casos es menor que 0,2, el tercer cuartil se incrementa en el lóbulo parietal hasta 0,7. Ni en el lóbulo temporal ni en los ganglios basales se excede de 0,4. El CV encontrado para el IL fue en los ganglios basales: NAA=0,05; Cho=0,07; Cr=0,01; en el lóbulo parietal: NAA=0,13; Cho=0,12; Cr=0,01; y en el temporal: NAA=0,08; Cho=0,09; Cr=0,05.
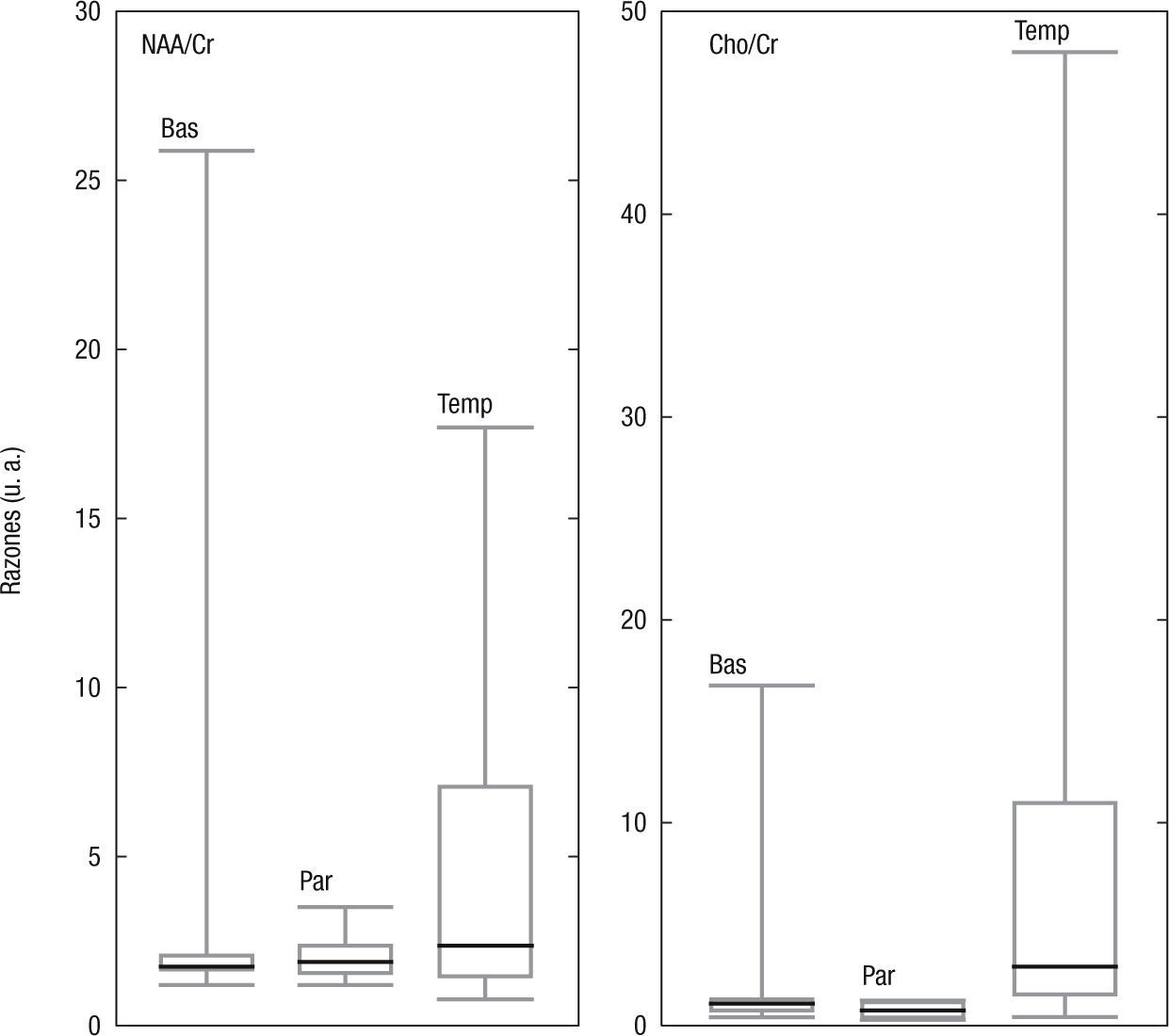
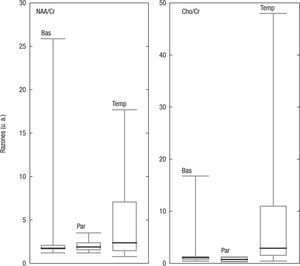
Razones entre metabolitosEn la figura 5 se esquematizan los resultados de las razones entre el NAA y la Cho con la Cr. En los ganglios basales y en el lóbulo parietal, el primer y el tercer cuartiles se encuentran muy cerca de su mediana, aunque los valores máximos en los ganglios basales estén muy distantes de ellos. Esto no se observa en el lóbulo temporal, donde el tercer cuartil resulta ser mucho mayor que el primer cuartil y el valor máximo está muy por encima de este. Lo anterior concuerda con las desviaciones estándares halladas en el estudio de las áreas de los picos en las mencionadas regiones anatómicas. Para esta técnica de análisis, el CV hallado fue en los ganglios basales: NAA/Cr=0,001; Cho/Cr=0,007; en el lóbulo parietal: NAA/Cr=0,003; Cho/Cr=0,003; y en el temporal: NAA/Cr=0,001, Cho/Cr=0,008.
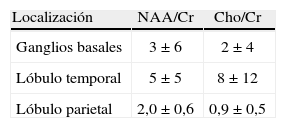
Los valores encontrados para los voluntarios normales de las razones de los metabolitos se muestran en la tabla 1.
DiscusiónCuantificación directaAnalizando los valores encontrados, se observa que las variaciones más pequeñas ocurren en el NAA y en la región anatómica correspondiente a los ganglios basales; esto se puede explicar fácilmente, debido a que el NAA es el pico más grande de todo el espectro en el tejido encefálico sano, y a que los ganglios basales presentan una buena uniformidad de campo, por su ubicación respecto al cráneo y al estar en el centro de la antena.
Aunque los valores medios de los lóbulos parietal y temporal están cerca entre ellos para los 3 metabolitos, en la Cho la diferencia es del 46%, y en la Cr, del 47%. Los CV encontrados son altos incluso para la Cr, que se considera la de menor variación, por su metabolismo (0,59±0,22), lo cual sustenta la idea principal de realizar análisis de espectros a través de referencias internas (endógenas o propias del espectro), y no con solo una inspección visual de este.
Índice de lateralidadSi se busca el análisis de anomalías del comportamiento de los metabolitos del espectro con este método, han de considerarse variaciones en el IL mayores que 0,5 en los ganglios basales y en el lóbulo temporal, mientras que en el lóbulo parietal es necesario considerar un límite de 0,8. Los valores encontrados son muy altos, y difieren de los reportados en la literatura11,12. Esto dificulta, a su vez, el estudio de patologías que involucren leves variaciones en las concentraciones metabólicas.
RazonesLos valores reportados en la literatura para las razones entre metabolitos, NAA/Cr=1,37±1,16Cho/Cr 0,81±1,53 en la sustancia blanca del lóbulo parietal, y NA A/Cr= =1,43±1,16Cho/Cr=0,82±1,30 en el tálamo14; NAA/Cr=1,51±0,10 y Cho/Cr=0,87±0,10, nuevamente del lóbulo parietal15, y NAA/Cr=4,8±2,3; Cho/Cr=7,7±3,7, del lóbulo occipital16, concuerdan con los valores hallados en las regiones anatómicas estudiadas. Sin embargo, las desviaciones estándares son significativamente mayores que el valor medio en los ganglios basales y el lóbulo temporal; este comportamiento se asemeja al descrito por Minatti et al.14. Debido a las importantes variaciones regionales, sería necesario determinar sus valores en cada región anatómica, y no solo en las estudiadas.
El hecho de que los coeficientes de variación de la técnica de razones entre metabolitos se encuentren en un orden de magnitud por debajo de la técnica del VOI contralateral respalda la idea de que las variaciones en los campos magnéticos en los 2 hemisferios son significativamente mayores que las variaciones propias de los ajustes de los metabolitos.
Si bien se reporta que el sacrificio en exactitud y precisión cuando se usa esta técnica excede los beneficios que ofrece12, en las condiciones actuales de adquisición de espectros se ve que presenta una variación más pequeña y concordante con los valores reportados en la literatura.
ConclusionesEl presente estudio pretendió evaluar la reproducibilidad de las técnicas de análisis de los espectros obtenidos con los protocolos actuales del servicio de imágenes diagnósticas del INC. Los espectros con un ancho de banda a mitad de altura del agua menor que 7Hz fueron considerados de muy buena calidad, según criterio médico. Se halló que las técnicas de análisis basadas en la inspección visual (áreas de los metabolitos) no presentan una buena reproducibilidad, incluso tratándose de tejido encefálico sano, por lo cual se justifica el uso de técnicas basadas en la concentración endógena de metabolitos.
Se encontró que las variaciones en los IL son muy grandes, lo cual lleva a que valores por encima de 0,5 en lesiones localizadas en los ganglios basales o en el lóbulo temporal sean necesarios para descartar diferencias propias del experimento y atribuirse, correctamente, a cambios metabólicos específicos de ese tejido. En el lóbulo parietal, las diferencias son del orden de 0,7 en el IL. Por lo tanto, las patologías con pequeñas variaciones podrían no ser detectadas con esta técnica de cuantificación.
Usando la razón entre los metabolitos, se observa que, si bien esta se ve afectada, nuevamente, por las desviaciones entre los sujetos, los valores hallados concuerdan con los reportados en la literatura, y muestran, además, que las amplias desviaciones estándares son propias según la localización anatómica. Sin embargo, se encuentran variaciones regionales importantes, por lo cual es necesario determinar sus valores en cada región anatómica.
Los CV de la técnica de coeficientes entre metabolitos se encuentran en un orden de magnitud por debajo de la usada de un volumen de control en el hemisferio opuesto; además, el comportamiento de la distribución presenta menor dispersión. Por ende, esta técnica debe ser la preferida frente a la comparación con un volumen contralateral.
FinanciaciónEl presente estudio fue financiado por la Convocatoria Inversión Nación 2012, del INC.
Al INC, por el apoyo metodológico prestado, y a Ricardo Sánchez, por su valiosa colaboración en el planteamiento del estudio, así como en el análisis estadístico de este.