Describir las características epidemiológicas, clínicas y de tratamiento de los pacientes con tumores de tejidos blandos, melanoma y carcinomas escamocelulares del Servicio de Seno y Tejidos Blandos del instituto nacional de Cancerologìa con amputaciones mayores de extremidades entre los años 1998 y 2008.
MétodosSe revisaron 80 historias clínicas de pacientes adultos en quienes se realizó amputación mayor de una extremidad entre enero de 1998 y diciembre de 2008, en el Servicio de Seno y Tejidos Blandos del instituto nacional de Cancerología.
ResultadosSe identificaron 24 pacientes con hemipelvectomía clásica, 22 con desarticulación de cadera, 19 con desarticulación interescapulotorácica, 8 con hemihemipelvectomía y 7 con desarticulación de hombro. los diagnósticos en orden de frecuencia fueron: sarcomas de tejidos blandos, 72,5%; carcinomas escamocelulares, 21,2%; melanoma, 6,2%. la intención de la cirugía fue curativa en 50% de los casos. En los pacientes en los cuales la intención de la cirugía fue paliativa, se presentó un mayor número de complicaciones, con significancia estadística solo para necrosis de los colgajos (22,5 vs. 5% p=0,02). la supervivencia en los pacientes con intención curativa luego del primer año de cirugía fue de 67,5 vs. 42,5% para cirugía paliativa (p=0,038).
ConclusionesEn pacientes con tumores proximales de las extremidades con imposibilidad de cirugías preservadoras, las amputaciones mayores continúan siendo una opción terapéutica válida, a pesar de su alto índice de complicaciones.
To describe the epidemiological, clinical and treatment characteristics of patients with soft tissue tumours, melanoma, and squamous cell carcinomas of the Breast and Soft Tissue Department of the Instituto Nacional de Cancerologìa, who had major limb amputations between the years 1998 and 2008.
Methodsa review was made of the clinical records of 80 patients in whom a major limb amputation was performed between January 1998 and December 2008 in the Breast and Soft Tissue Department of the Instituto Nacional de Cancerologìa.
ResultsOf the 80 patients studied, 24 had a classic hemipelvectomy, 22 with hip disarticulation, 19 with interscapular-thoracic disarticulation, 8 with hemi-hemipelvectomy, and 7 with shoulder disarticulation. The diagnoses, in order of frequency were: soft tissue sarcomas, 72.5%; squamous cell carcinomas, 21.2%; and melanoma, 6.2%. The intention of the surgery was curative in 50% of the cases. There was a greater number of complications in the patients where the intention of the surgery was palliative, with a significant significance only for necrosis of flaps (22.5% vs. 5% P=.02). The one-year survival in the patients with intention to cure surgery was 67.5% vs. 42.5% for palliative surgery (P=.038).
ConclusionsIn patients with tumours proximal to the limbs, where preservative surgery is impossible, major amputations continue to be a valid therapeutic option, despite its high rate of complications.
Los sarcomas de tejidos blandos y los tumores de la piel localizados en las extremidades son patologías poco comunes, pero que confieren una alta carga de la enfermedad, por presentarse en un alto porcentaje en personas activas laboralmente.
Por la baja incidencia de esta patología, su evidencia científica también es escasa y se limita, en gran medida, a series de casos. Según el anuario estadístico de 2009 del Instituto Nacional de Cancerología (INC), en Bogotá (Colombia), se presentaron 114 nuevos casos de sarcomas de tejidos blandos, 156 de carcinoma escamocelular y 112 de melanoma, lo que representa el 2,1, el 2,8 y el 2,0%, respectivamente, del total de nuevos casos oncológicos de esta institución1. El pilar en el tratamiento de este tipo de neoplasias es el manejo quirúrgico, asegurando, en la medida de lo posible, márgenes libres de tumor. La extensión de tales procedimientos puede ir desde una resección marginal hasta amputaciones proximales mayores, como la hemipelvectomía, las amputaciones interescapulotorácicas y las desarticulaciones.
Debido a la introducción de esquemas de tratamiento multidisciplinario que disminuyen el volumen tumoral para la preservación de la extremidad (quimioterapia, radioterapia o perfusión aislada de extremidad), el número de pacientes con indicación de amputación ha disminuido del 40 al 10%, aproximadamente2. Sin embargo, un número importante de pacientes en el INC consultan o son remitidos con tumores localmente avanzados, y en ellos muy a menudo la única opción es una amputación mayor, con intención curativa o paliativa. Estas cirugías son altamente complejas, y aunque la mortalidad ha disminuido de forma importante, continúan teniendo una alta tasa de complicaciones y secuelas funcionales importantes para los pacientes sometidos a ellas3,4.
El objetivo del presente estudio es describir las características epidemiológicas, clínicas y del tratamiento de los pacientes con tumores de tejidos blandos, melanoma y carcinomas escamocelulares del Servicio de Seno y Tejidos Blandos del INC llevados a amputaciones mayores de extremidades durante el período 1998–2008.
MétodosEl presente estudio es una serie de casos en la que se incluye a pacientes con diagnóstico de sarcomas de tejidos blandos y tumores de piel en las extremidades, sometidos a amputaciones mayores por el Servicio de Seno y Tejidos Blandos en el INC, en un período de 10 años, entre el 1 de enero de 1998 y el 31 de diciembre de 2008. Los tipos de procedimientos quirúrgicos incluidos fueron: desarticulación de hombro, desarticulación interescapulotorácica, desarticulación de cadera, hemipelvectomía clásica y hemihemipelvectomía.
Los casos se identificaron a partir de los libros de cirugía del servicio de seno y tumores de tejidos blandos y del registro de los informes del Servicio de Patología del INC. Se encontró a 96 pacientes; de estos, se excluyó a 16, porque fueron sometidos a amputaciones de menor radicalidad, como amputaciones infra- o supracondíleas. Al final, fueron identificados 80 pacientes, quienes fueron los sujetos de análisis.
Los datos demográficos, del procedimiento quirúrgico, patología, complicaciones y seguimiento se obtuvieron de la historia clínica, y fueron consignados en un formato predeterminado de recolección; después, fueron sometidos a revisión por el Grupo de monitoría del área de investigación del INC. Las discrepancias consignadas en la información se resolvieron con una tercera revisión de la historia clínica del paciente.
El análisis de las variables numéricas se realizó por medio de medidas de tendencia central y de dispersión. Las variables categóricas se presentan como proporciones y números absolutos. Las medidas de asociación utilizadas fueron las pruebas de χ2, o Fisher, según el caso.
La supervivencia fue analizada con el método de Kaplan-Meier, y las curvas de supervivencia, comparadas con la prueba de log-rank. Los datos fueron digitados en una base de datos creada en Microsoft Access®, y la información fue analizada en el programa Stata, versión 8.2. El estudio fue aprobado por el Comité de Ética del INC.
ResultadosDe los 80 pacientes incluidos en el estudio, el 57% (n=46) era de sexo masculino. La edad promedio en el momento del diagnóstico fue de 53 años, con un rango entre los 21 y los 86 años. El 67,5% de las amputaciones mayores (n=54) fueron realizadas en los miembros inferiores, por tumores localizados, en su mayoría, en muslo proximal, en un 32,5% de los casos (n=26), y en la pelvis, en un 18,7% (n=15). En cuanto a las amputaciones realizadas en las extremidades superiores, la principal localización que indicó la cirugía fue tumores ubicados en la axila, en un 15% (n=12) de los casos.
El 72,5% de las amputaciones mayores (n=58) se realizaron en pacientes con sarcomas de tejidos blandos; el 21,2% (n=17), en pacientes con carcinoma escamocelular, y el 6,2% (n=5), en pacientes con melanoma de extremidades. En los pacientes con sarcomas de tejidos blandos, el 68,8% (n=61) eran grado histológico III, y todos se hallaban en un plano profundo respecto a la aponeurosis muscular.
El tamaño tumoral promedio, en general, fue de 18,7cm, con un rango entre 4–77cm. El 34% de los pacientes (n=27) tenían tumores mayores de 20cm. Discriminando por el tipo de tumor, los sarcomas de tejidos blandos presentaron un tamaño tumoral promedio mayor, en comparación con los carcinomas escamocelulares y melanomas, de 19,5, 16,6 y 16,4cm, respectivamente.
La mayoría de los pacientes había recibido algún tipo de tratamiento previo a la amputación, en el 61,2% (n=49) de los casos. El tratamiento previo más común fue la resección local amplia, en el 42,8% de los casos (n=21); seguido de la quimioterapia, con el 40,8% (n=20); la radioterapia, con el 32,6% (n=16), y la amputación menor o distal, con el 24,4% (n=12). El esquema quimioterapéutico de mayor frecuencia fue ifosfamida-doxorrubicina. El 38,7% de los pacientes (n=31) debutaron con tumores con indicación inmediata de amputación mayor.
La intención de la cirugía fue curativa en el 50% (n=40) de los pacientes. En los 40 pacientes para quienes la intención de la cirugía fue paliativa, los principales motivos para su realización, en orden de frecuencia, incluyeron: dolor, en el 50% (n=40) de los casos; úlcera, con el 42,5% (n=34); sangrado, con el 17,5% (n=14), e infección, con el 2,5% (n=2). El 46,2% de los pacientes llevados a amputaciones mayores (n=37) cursaban con enfermedad metastásica; el sitio más común para ello fueron los ganglios linfáticos a distancia, en el 32,5% (n=26) de los casos, seguidos de los pulmones, con el 23,7% (n=19).
El procedimiento quirúrgico que se realizó más a menudo fue la hemipelvectomía clásica, en el 30% (n=24) de los pacientes de esta serie; seguida de la desarticulación de cadera, con el 27,5% (n=22); la desarticulación interescapulotorácica, en el 23,7% (n=19); la hemihemipelvectomía, en el 10% (n=8), y, la desarticulación de hombro, en el 8,7% (n=7) de los pacientes.
En 2 pacientes fue necesaria la utilización de malla. El primero fue llevado a una hemipelvectomía clásica por un carcinoma escamocelular del muslo proximal y la pelvis, en el cual la malla se utilizó para cubrir las asas intestinales, pues presentó compromiso del peritoneo parietal. El segundo fue un paciente llevado a desarticulación interescapulotorácica con resección de reja costal, quien requirió reconstrucción con malla e injerto de piel. En los 78 pacientes restantes, el defecto quirúrgico se cubrió mediante colgajos locales.
La principal complicación posquirúrgica fue el síndrome de miembro fantasma, en el 47,5% (n=38) de los casos; seguido de la infección del sitio operatorio, con el 28,7% (n=23), y la necrosis de los colgajos de cubrimiento, con el 13,7% (n=11). Solo el 13,7% (n=11) de los pacientes no presentaron ningún tipo de complicación secundaria al procedimiento quirúrgico.
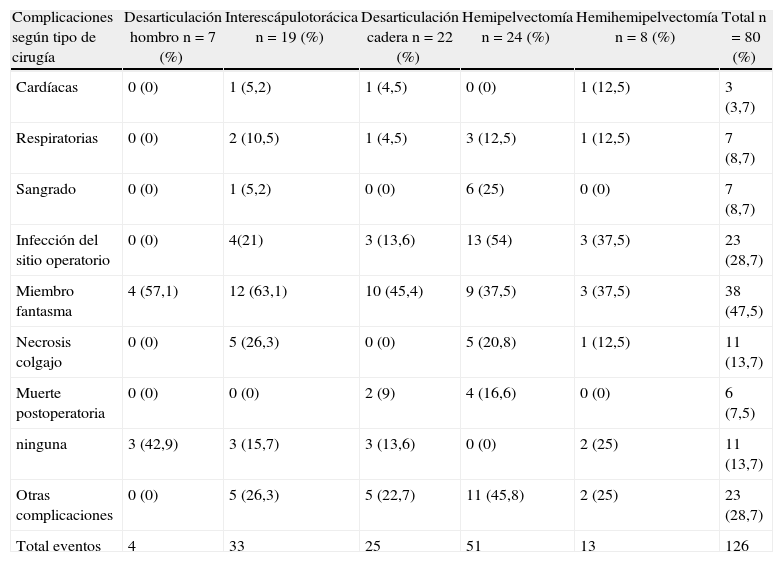
El tipo de procedimiento que se asoció con un mayor porcentaje de complicaciones, comparado con los otros procedimientos, fue la hemipelvectomía clásica; principalmente, para infección del sitio operatorio (54 frente a 17,5%; p=0,001) y el sangrado postoperatorio (25 frente a 1,81%; p=0,001). La desarticulación interescapulotorácica fue el procedimiento con mayor porcentaje de necrosis del colgajo de cubrimiento, con el 26,3% de los casos (tabla 1). El miembro fantasma se presentó en el 47,5% de los pacientes, con una tendencia mayor en las amputaciones realizadas en el miembro superior (p=0,081).
Tipo de procedimiento quirúrgico y complicaciones postoperatorias de los pacientes sometidos a amputaciones mayores en el Instituto Nacional de Cancerología (1998–2008)
| Complicaciones según tipo de cirugía | Desarticulación hombro n=7 (%) | Interescápulotorácica n=19 (%) | Desarticulación cadera n=22 (%) | Hemipelvectomía n=24 (%) | Hemihemipelvectomía n=8 (%) | Total n=80 (%) |
| Cardíacas | 0 (0) | 1 (5,2) | 1 (4,5) | 0 (0) | 1 (12,5) | 3 (3,7) |
| Respiratorias | 0 (0) | 2 (10,5) | 1 (4,5) | 3 (12,5) | 1 (12,5) | 7 (8,7) |
| Sangrado | 0 (0) | 1 (5,2) | 0 (0) | 6 (25) | 0 (0) | 7 (8,7) |
| Infección del sitio operatorio | 0 (0) | 4(21) | 3 (13,6) | 13 (54) | 3 (37,5) | 23 (28,7) |
| Miembro fantasma | 4 (57,1) | 12 (63,1) | 10 (45,4) | 9 (37,5) | 3 (37,5) | 38 (47,5) |
| Necrosis colgajo | 0 (0) | 5 (26,3) | 0 (0) | 5 (20,8) | 1 (12,5) | 11 (13,7) |
| Muerte postoperatoria | 0 (0) | 0 (0) | 2 (9) | 4 (16,6) | 0 (0) | 6 (7,5) |
| ninguna | 3 (42,9) | 3 (15,7) | 3 (13,6) | 0 (0) | 2 (25) | 11 (13,7) |
| Otras complicaciones | 0 (0) | 5 (26,3) | 5 (22,7) | 11 (45,8) | 2 (25) | 23 (28,7) |
| Total eventos | 4 | 33 | 25 | 51 | 13 | 126 |
Excluyendo a los pacientes que presentaron miembro fantasma y muerte postoperatoria como complicación, los pacientes con melanoma presentaron la tasa más alta de complicaciones, con el 60% (n=3); seguido de los pacientes con sarcomas, con el 53,4% (n=31), y los pacientes con carcinoma escamocelular, con el 52,9% (n=17).
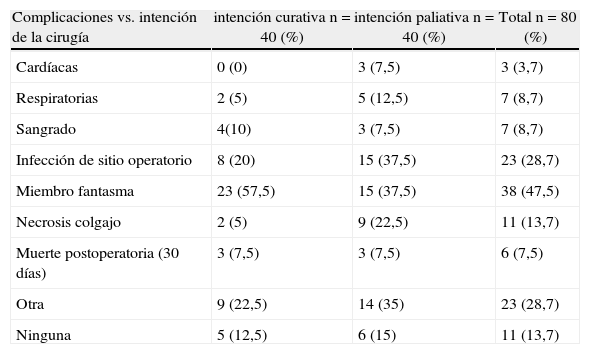
La mayor tasa de complicaciones posquirúrgicas, sin incluir el síndrome de miembro fantasma, se presentó en los pacientes cuya intención de la cirugía fue paliativa, en el 70% (n=28), frente a 37,5% (n=15) en los pacientes con intención curativa; alcanzó significancia estadística solo para necrosis de los colgajos (22,5 frente a 5%; p=0,02) (tabla 2).
Intención de la cirugía en relación con el tipo de complicación postoperatoria en los pacientes sometidos a amputaciones mayores en el Instituto Nacional de Cancerología (1998–2008)
| Complicaciones vs. intención de la cirugía | intención curativa n=40 (%) | intención paliativa n=40 (%) | Total n=80 (%) |
| Cardíacas | 0 (0) | 3 (7,5) | 3 (3,7) |
| Respiratorias | 2 (5) | 5 (12,5) | 7 (8,7) |
| Sangrado | 4(10) | 3 (7,5) | 7 (8,7) |
| Infección de sitio operatorio | 8 (20) | 15 (37,5) | 23 (28,7) |
| Miembro fantasma | 23 (57,5) | 15 (37,5) | 38 (47,5) |
| Necrosis colgajo | 2 (5) | 9 (22,5) | 11 (13,7) |
| Muerte postoperatoria (30 días) | 3 (7,5) | 3 (7,5) | 6 (7,5) |
| Otra | 9 (22,5) | 14 (35) | 23 (28,7) |
| Ninguna | 5 (12,5) | 6 (15) | 11 (13,7) |
La mortalidad postoperatoria, definida como la ocurrida dentro de los primeros 30 días posteriores a la cirugía, se presentó en el 7,5% (n=6) de los pacientes; 4 de ellos sometidos a hemipelvectomía y los 2 restantes, a desarticulación de cadera. No se presentó ninguna mortalidad postoperatoria en los pacientes a quienes se les realizó amputación mayor de miembros superiores.
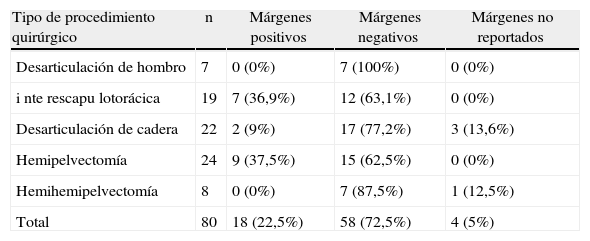
En el 72,5% (n=58) de los pacientes se lograron márgenes de resección negativos. Los tipos de cirugías que presentaron mayor porcentaje de márgenes positivos fueron la hemipelvectomía clásica y la desarticulación interescapulotorácica, con el 37,5% (n=9) y el 36,9% (n=7), respectivamente (tabla 3).
Tipo de procedimiento quirúrgico en relación con los márgenes de resección quirúrgicos en los pacientes sometidos a amputaciones mayores en el Instituto Nacional de Cancerología (1998–2008)
| Tipo de procedimiento quirúrgico | n | Márgenes positivos | Márgenes negativos | Márgenes no reportados |
| Desarticulación de hombro | 7 | 0 (0%) | 7 (100%) | 0 (0%) |
| i nte rescapu lotorácica | 19 | 7 (36,9%) | 12 (63,1%) | 0 (0%) |
| Desarticulación de cadera | 22 | 2 (9%) | 17 (77,2%) | 3 (13,6%) |
| Hemipelvectomía | 24 | 9 (37,5%) | 15 (62,5%) | 0 (0%) |
| Hemihemipelvectomía | 8 | 0 (0%) | 7 (87,5%) | 1 (12,5%) |
| Total | 80 | 18 (22,5%) | 58 (72,5%) | 4 (5%) |
El 26% (n=21) de los pacientes sometidos a amputaciones mayores recibieron radioterapia adyuvante, y el 18,7% (n=15), quimioterapia adyuvante. Por otra parte, 2 pacientes (2,5%) fueron llevados a metastasectomía pulmonar, como parte del control de su enfermedad.
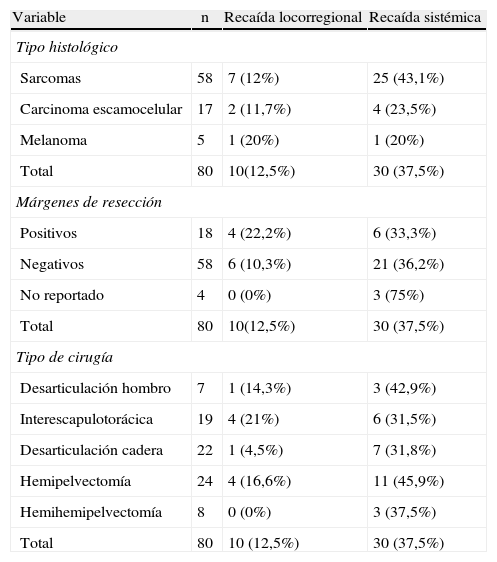
Se presentó recaída locorregional y sistémica en el 12,5% (n=10) y 37,5% (n=30) de los pacientes, respectivamente. Los pacientes con sarcomas presentaron el mayor porcentaje de recaída sistémica, con el 43,1% de los casos, comparado con el 23,5 y el 20% para carcinomas escamocelulares y los melanomas, respectivamente (p=0,0002). El 27,5% (n=22) de los pacientes de la serie presentaron metástasis; los pulmones fueron los órganos más afectados. El 40% (n=4) de los pacientes con recaída locorregional tenían márgenes de resección positivos (tabla 4).
Relación entre el tipo histológico, márgenes de resección y tipo de cirugía con la recaída locorregional y sistémica en los pacientes sometidos a amputaciones mayores en el Instituto Nacional de Cancerología (1998–2008)
| Variable | n | Recaída locorregional | Recaída sistémica |
| Tipo histológico | |||
| Sarcomas | 58 | 7 (12%) | 25 (43,1%) |
| Carcinoma escamocelular | 17 | 2 (11,7%) | 4 (23,5%) |
| Melanoma | 5 | 1 (20%) | 1 (20%) |
| Total | 80 | 10(12,5%) | 30 (37,5%) |
| Márgenes de resección | |||
| Positivos | 18 | 4 (22,2%) | 6 (33,3%) |
| Negativos | 58 | 6 (10,3%) | 21 (36,2%) |
| No reportado | 4 | 0 (0%) | 3 (75%) |
| Total | 80 | 10(12,5%) | 30 (37,5%) |
| Tipo de cirugía | |||
| Desarticulación hombro | 7 | 1 (14,3%) | 3 (42,9%) |
| Interescapulotorácica | 19 | 4 (21%) | 6 (31,5%) |
| Desarticulación cadera | 22 | 1 (4,5%) | 7 (31,8%) |
| Hemipelvectomía | 24 | 4 (16,6%) | 11 (45,9%) |
| Hemihemipelvectomía | 8 | 0 (0%) | 3 (37,5%) |
| Total | 80 | 10 (12,5%) | 30 (37,5%) |
Los procedimientos más radicales, como la hemipelvectomía y la desarticulación interescapulotorácica, presentaron el mayor porcentaje de recaída locorregional, con el 16,6% (n=4) y el 21% (n=4), respectivamente. El 45,9% (n=11) de los pacientes llevados a hemipelvectomía presentaron metástasis a distancia (tabla 4).
En relación con la rehabilitación de los pacientes amputados, el 5% (n=4) tuvo acceso a prótesis; el 11,2% (n=9), a silla de ruedas; el 12,5% (n=10), a cojín pélvico; el 20% (n=16), a terapia física, y el 22,5%(n=18), a muletas.
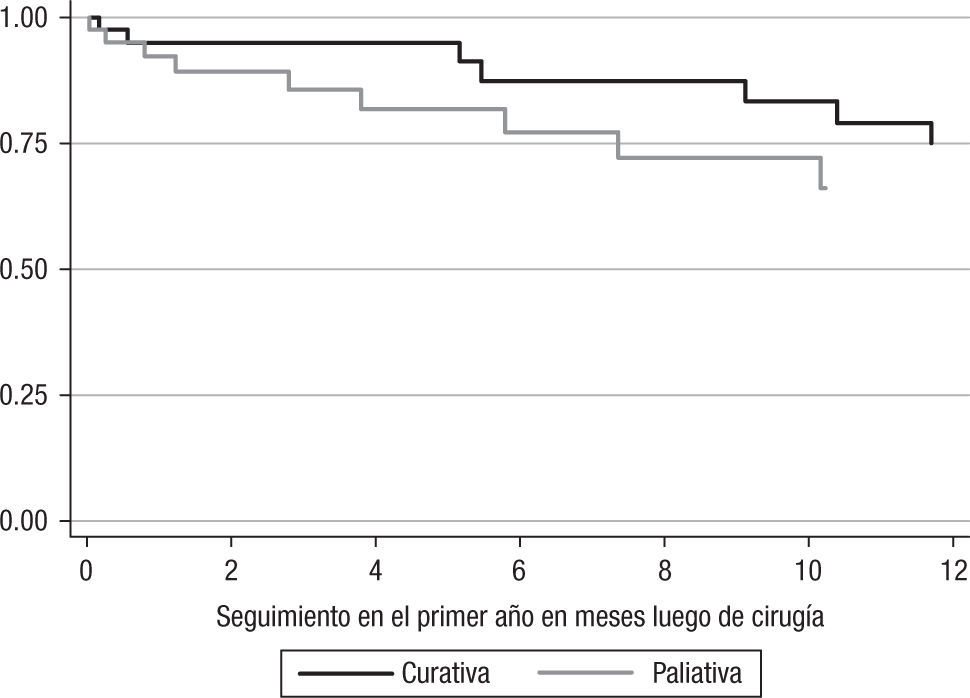
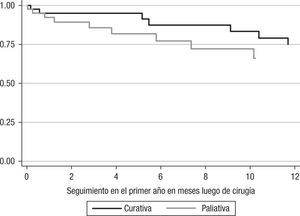
Para los 80 pacientes, la mediana del tiempo del seguimiento fue de 303 días, con un rango intercuartílico de 113 días a 1.182 días. La mediana del tiempo de seguimiento fue de 543 días (RI: 114–1.645 días) y 212 (RI: 113–792 días) para los pacientes con cirugía con intención curativa y paliativa, respectivamente. La supervivencia global de los pacientes llevados a cirugía con intención paliativa fue del 17,5% (n=7), y de los pacientes con intención curativa, del 50% (n=20).
La supervivencia en los pacientes con intención curativa luego del primer año de cirugía fue del 67,5% (n=27), y en el grupo de cirugía paliativa, del 42,5% (n=17); al comparar los 2 tipos de cirugía se encuentran diferencias significativas (p=0,038) (fig. 1).
DiscusiónLas amputaciones están, probablemente, entre los procedimientos quirúrgicos más antiguos de los cuales se tiene noticia. Algunas evidencias de estudios arqueológicos demuestran que fueron practicadas con éxito ya 4900 a. C.5 La primera amputación interescapulotorácica fue reportada por Ralph Cuming, en 1808, para tratar una herida por arma de fuego a la altura de la cintura escapular6. En 1891, Theodore Billroth realiza la primera hemipelvectomía en un paciente con sarcoma de tejidos blandos, pero el paciente murió por shock hipovolémico pocas horas después de la cirugía7.
Los adelantos en las técnicas quirúrgicas, en los tratamientos adyuvantes oncológicos y en el diagnóstico más temprano han disminuido la necesidad de realizar amputaciones para el tratamiento de sarcomas y tumores de piel entre el 5 y el 10% de los casos, en centros especializados en el manejo de este tipo de patologías2,8. Sin embargo, en ocasiones, para los pacientes con tumores proximales en las extremidades que son de gran tamaño o muestran compromiso neurovascular, la única opción de tratamiento es realizar algún tipo de amputación mayor, con las consecuencias funcionales que estas producen.
El INC, en Bogotá (Colombia), es un centro de cuarto nivel, donde se atiende a pacientes con cáncer remitidos de múltiples áreas geográficas del país; la mayoría, personas de bajos recursos económicos. Tales condiciones particulares condicionan que la población de pacientes oncológicos manejados en esta institución se presente, en su mayoría, con tumores en estadios avanzados. Esta serie de amputaciones mayores, de 80 casos oncológicos en 10 años, refleja, de forma indirecta, los estadios avanzados de los pacientes a quienes se trata en la institución si se les compara con las últimas series reportadas en la literatura sobre el mismo tema, y las cuales cuentan con 40 o 45 casos durante un período similar7,9,10.
El análisis descriptivo de la presente serie muestra una población heterogénea, con un rango de edad amplio en la presentación de tumores de tejidos blandos y piel, con un promedio de presentación a los 53 años y una tendencia de mayor presentación en el sexo masculino; algunas series muestran esta misma tendencia de género10.
En la serie del INC, los pacientes con sarcomas de tejidos blandos son quienes más a menudo se someten a este tipo de cirugías tan radicales (72%), lo que concuerda con otras series de la literatura que reportan porcentajes similares, entre el 55% en la serie de Parson10, hasta el 82% en la serie de Daigeler9.
Todos los pacientes con sarcomas en la presente serie fueron clasificados, por parte de patología, como grado III, y clínicamente eran profundos en relación con la fascia, lo cual puede sugerir un crecimiento rápido y agresivo de la lesión, que se refleja en el alto porcentaje de recidiva, tanto locorregional como a distancia.
Los sarcomas se pueden originar en cualquier lugar del cuerpo; sin embargo, hay una mayor tendencia en cuanto a su localización en los miembros inferiores, especialmente en la cara anterior del muslo11. Estas características clínicas de los pacientes con sarcomas podrían explicar la mayor proporción de amputaciones mayores en los miembros inferiores en la serie objeto de estudio (67%).
El principal subtipo histológico fue el histiocitoma fibroso maligno, o sarcoma pleomórfico indiferenciado de alto grado (26,2%), seguido del sarcoma sinovial (12,5%). Los carcinomas escamocelulares y los melanomas como indicación de amputación mayor de esta serie representaron el 21,2 y el 6,2% de los casos, respectivamente. En particular, los pacientes con melanoma se presentan con lesiones en su mayoría distales, dada la alta incidencia del melanoma acral lentiginoso en Colombia, y se pueden beneficiar de otro tipo de cirugías o procedimientos en estadios avanzados con intención paliativa, como la perfusión aislada de extremidad, la resección local amplia o la crioterapia, lo que explica la baja frecuencia de amputaciones mayores en esta patología.
Ni los tumores óseos ni los metastásicos fueron incluidos en esta serie; en la literatura se dispone de estudios que incluyen estos y otro tipo de tumores como indicación de amputación mayor12–15. El tamaño tumoral es uno de los criterios más importantes para definir el tipo de procedimiento quirúrgico. El tamaño tumoral promedio en esta serie fue de 18,7cm, y el 33,7% de los pacientes tenían tumores mayores de 20cm. En la serie de Clark, publicada en 20037, de pacientes con sarcomas de las partes blandas, solo el 45% de estos tenían tumores mayores de 10cm, en comparación con la presente serie, en la que el 82,7% de los pacientes con sarcomas presentaban tumores mayores de 10cm. Esto refleja el estadio avanzado de los casos objeto de estudio en este trabajo; posiblemente, debido a una consulta y una remisión tardías a centros especializados en el manejo de tal tipo de patologías.
Los pacientes sometidos a amputaciones mayores, en su mayoría, han recibido algún tipo de tratamiento previo. El 61,2% de los pacientes de la presente serie habían sido sometidos a algún tipo de tratamiento quirúrgico previo, por lo cual las recaídas tumorales son una causa frecuente de amputación mayor. En nuestro medio, un porcentaje importante de los pacientes son operados en otras instituciones no dedicadas al manejo de pacientes con sarcomas y tumores de piel. Varios reportes han enfatizado la importancia del manejo de estos pacientes en instituciones de referencia con un alto volumen de estas patologías, las cuales requieren un equipo multidisciplinario, lo que se traduce en un mejor pronóstico para los pacientes y mayor porcentaje de cirugías con salvamento de extremidad16–19.
En la presente serie, la mitad de los pacientes (n=40) fueron llevados a cirugía con intención paliativa; de ellos, el 92,5% (n=37) tenían metástasis a distancia, y el sitio más común de presentación fueron los ganglios linfáticos a distancia, seguidos de metástasis pulmonares. El principal síntoma que indicó la cirugía paliativa fue el dolor, el cual hacía presencia en todos los pacientes. Sin embargo, en quienes presentaban sarcomas de tejidos blandos y tumores de piel fueron habituales la ulceración y el sangrado, síntomas que también indican la cirugía con intención paliativa. Dichos síntomas se presentaron en esta serie en el 85 y el 35% de los casos, respectivamente.
En la serie de Daigeler, el 62% de los pacientes fueron llevados a amputación mayor con intención paliativa por enfermedad metastásica9, mientras que en la serie de Clark solo el 7,5% de los pacientes presentaban enfermedad metastásica a distancia, y se consideró que fueron llevados a cirugía paliativa7.
Una serie reciente publicada por Parson sobre amputaciones mayores propone una nueva clasificación referente a la intención de la cirugía10. Las clasifica como: intención curativa a la practicada a los pacientes con tumores proximales sin metástasis y sin síntomas debilitantes; intención curativa/ paliativa, a las de pacientes sin metástasis a distancia, pero con enfermedad locorregional, que causa síntomas como dolor intratable, pérdida de la función de la extremidad o tumores ulcerados con sangrado. Dichos pacientes son llevados a cirugía con la intención de paliar los síntomas descritos, pero ante la ausencia de metástasis a distancia, se tiene una oportunidad de curación. Por último están los pacientes con intención paliativa, los cuales se presentan con enfermedad metastásica y síntomas intratables, que son los que indican la cirugía. Tal clasificación, en concepto del grupo a cargo del presente trabajo, expresa de forma más clara la intención real de la cirugía entre este complejo grupo de pacientes, ya que muchos de ellos sin enfermedad metastásica son llevados a cirugía, principalmente con la intención de paliar síntomas intratables, pese a que también ante la ausencia de enfermedad sistémica tengan una oportunidad de curación en el contexto de una enfermedad locorregionalmente avanzada.
Las amputaciones mayores en muchos casos derivan en defectos de difícil cubrimiento; sin embargo, en la experiencia de este grupo investigador, en el 97,5% (n=78) de los casos el cubrimiento se logró mediante colgajos locales. Las hemipelvectomías y las desarticulaciones de cadera se cubrieron, la mayoría, con colgajos dermograsos posteriores, y en el caso de las hemihemipelvectomías, por medio de colgajos miocutáneos, con preservación de los músculos glúteos. Los tumores posteriores en ocasiones requieren cubrimientos con colgajos más complejos20,21.
Al igual que las amputaciones del miembro inferior, la desarticulación de hombro y la interescapulotorácica, en su gran mayoría, se pueden cubrir con colgajos locales. Sin embargo, en ocasiones, en pacientes que tienen tumores con compromiso de la reja costal, la resección incluye resección de pared torácica con reconstrucción de esta con malla de metilmetacrilato y cubrimientos con colgajos más complejos; incluso, colgajos libres22,23.
Históricamente, las amputaciones mayores han sido consideradas como cirugías con una alta morbilidad. A principios del siglo xx, la mortalidad de este tipo de procedimientos excedía el 50%24. A lo largo de las décadas siguientes, los avances en la anestesia y la técnica quirúrgica han derivado en una disminución importante de la mortalidad de tal tipo de procedimientos.
En la presente serie, la mortalidad operatoria, definida como la ocurrida dentro de los primeros 30 días del postoperatorio, fue del 7,5%, la cual es comparable con la reportada en la literatura para este tipo de procedimiento, y que oscila entre el 0 y el 10%4,7,12,13,25,26. Sin embargo, dichos procedimientos se siguen asociando con una alta morbilidad.
La incidencia de complicaciones con posterioridad a la hemipelvectomía varía entre el 50 y el 80%3,8,13. El porcentaje de complicaciones posteriores a desarticulaciones de los miembros superiores es menor12,15,27. En total, en este trabajo se presentaron complicaciones de la herida quirúrgica en el 42,5% de los casos, en comparación con el 35% de series más recientes10. El miembro fantasma como complicación se presentó en el 47,5% de los casos. Dicha frecuencia es menor que la reportada en otras series, donde un porcentaje mayor de los pacientes sufren tal tipo de dolor neuropático10. Esto podría explicarse por un subregistro de este síntoma, que, a su vez, podría atribuirse a una falta de consenso en su definición.
Obtener márgenes negativos constituye, en dicho tipo de cirugías, uno de los principales objetivos para el control local de la enfermedad. En esta serie, el 72,5% de los pacientes presentaron márgenes negativos microscópicos, según el reporte de patología. En la serie de Daigeler, el 65 y el 25%, respectivamente, de los pacientes con intención curativa y paliativa tuvieron márgenes negativos, para el 40% como total de márgenes negativos9.
Otras series muestran un porcentaje mucho mayor de márgenes negativos, hasta del 90%7,10. Teniendo en cuenta que el tamaño tumoral promedio de esta serie es mayor que el reportado en la mayoría de series en la literatura, el porcentaje de pacientes con márgenes positivos del 27,5% es aceptable. Sin embargo, llama la atención que los procedimientos más radicales, como la hemipelvectomía clásica y la desarticulación interescapulotorácica, presentaron el mayor porcentaje de márgenes comprometidos por tumor, en el 37,5 y el 36,9% de los casos, respectivamente. Como una posible explicación a este resultado, se comparó el tamaño tumoral promedio para dichos procedimientos con los otros tipos de amputación, sin hallarse diferencias que pudieran explicar este mayor porcentaje de márgenes positivos en los procedimientos más radicales. De igual forma, no se encontró diferencia en el tamaño tumoral promedio entre los pacientes con márgenes positivos y los pacientes con márgenes negativos.
El impacto del control local de la enfermedad sobre la supervivencia global ha estado sujeto a controversias. Algunos estudios muestran cómo el control local puede tener algún impacto en la supervivencia28–30. Otras series, sin embargo, han mostrado que el control local no tiene impacto en la supervivencia, y son las metástasis a distancia las que determinan el pronóstico y la supervivencia de los pacientes con tumores de tejidos blandos31–33.
Los datos de la presente serie muestran que el tipo más común de recaída en los pacientes sometidos a amputación mayor es la sistémica, con el 37,5%, frente a la recaída local, del 12,5%; los pacientes con sarcomas fueron quienes mostraron una mayor tendencia a la recaída de forma sistémica. Ello confirma que con este tipo de procedimientos se consigue un adecuado control locorregional de la enfermedad, pero no uno sistémico, y son las metástasis a distancia las que definen en mayor proporción el pronóstico de estos pacientes.
Se evidenció una tendencia importante respecto al mayor porcentaje de recaída locorregional en el grupo de pacientes con márgenes positivos, que fue del 22,2%, en comparación con los pacientes con márgenes negativos, del 10,3%. Por tanto, el control local de la enfermedad debe considerarse uno de los principales objetivos en los pacientes sometidos a dicho tipo de cirugías, y así evitar los efectos devastadores de las recaídas locales en la calidad de vida de estos enfermos34.
En esta serie, la supervivencia global de los pacientes llevados a cirugía con intención paliativa fue del 17,5% (n=7), y la de los pacientes con intención curativa, del 50% (n=20), a diferencia de reportes como el de Daigeler, quien mostró una supervivencia a 5 años del 12,7%9.
Desde el punto de vista de la rehabilitación, solo el 5% de los pacientes tuvieron acceso a una prótesis. Tan bajo porcentaje podría tener varias explicaciones: una sería la alta mortalidad de este tipo de pacientes durante los primeros años del postoperatorio en el contexto de enfermedades avanzadas y debilitantes, que imposibilitan la adecuada rehabilitación física, prerrequisito para acceder a una prótesis, dado el alto consumo de energía necesario para su manejo. También podría explicarse por el sistema de salud de Colombia, en el que no se contemplan las prótesis en el Plan Obligatorio de Salud. Sea cual sea la explicación, un adecuado plan de rehabilitación debe ser parte crucial en el tratamiento de los pacientes amputados.
Esta serie tiene las limitaciones inherentes a la mayoría de los estudios retrospectivos en cuanto al seguimiento de los pacientes, la extracción de la información de las historias clínicas y la falta de valoración de la calidad de vida. Solo algunas publicaciones han valorado de forma cuidadosa este aspecto, y el consenso es que los pacientes sometidos a amputaciones mayores, en su mayoría, presentan una mejoría en su calidad de vida, con aceptables niveles de actividad y reintegro a sus actividades cotidianas previas a la cirugía34–36.
En conclusión, las amputaciones mayores son procedimientos radicales de alta complejidad que deben ser realizadas en centros de referencia, por parte de equipos multidisciplinarios, como última opción en los pacientes con tumores proximales de las extremidades, de una morbilidad y una mortalidad aceptables. Pese a ello, las complicaciones siguen siendo comunes, pero susceptibles de manejo; principalmente, las derivadas de la herida y de los colgajos de cubrimiento.
Dada la radicalidad de la cirugía, asegurar —en lo posible—márgenes sin compromiso tumoral debe ser uno de los objetivos principales, aunque estos no tengan impacto en la progresión sistémica de la enfermedad, pero sí en la calidad de vida de los pacientes, al evitar recaídas locales en el área quirúrgica.
Si bien durante los primeros años posteriores a la cirugía, la mayor parte de los pacientes fallecen, en algunos casos se puede obtener una supervivencia libre de enfermedad mayor a 10 años. Deben realizarse estudios prospectivos con una valoración formal de la calidad de vida posterior a dichas cirugías, para poder establecer con claridad el beneficio de las amputaciones mayores en el contexto de la paliación de pacientes con enfermedades oncológicas avanzadas de las extremidades, con síntomas debilitantes e intratables en la mayoría de los casos.