Determinar la utilidad de la biopsia del ganglio centinela en cáncer de mama después neoadyuvancia.
MétodoEstudio de prueba diagnóstica.
ResultadosEl análisis se lleva a cabo en 67 pacientes intervenidas en el Instituto Nacional de Cancerología (INC) (Bogotá, Colombia), la obtención de una tasa de migración axilar de 85%. La tasa de identificación del ganglio centinela fue del 90%. La tasa de falsos negativos fue del 25%. El rendimiento de la prueba de diagnóstico muestra: una sensibilidad del 75%; una especificidad de 100%; un valor predictivo positivo de 100%; un valor predictivo negativo de 77,5% y un valor de precisión de 85,6%.
ConclusionesSegún los resultados de nuestra serie, esta técnica no se recomienda como procedimiento estándar aún en pacientes con axila clínicamente negativa corroborada con ecografía axilar. El alto porcentaje de falsos negativos (25%) encontrado puede deberse al número elevado de pacientes con estadios localmente avanzados en nuestra serie
To determine the usefulness of sentinel node biopsy in breast cancer after neoadjuvant treatment.
MethodsA study of a diagnostic test.
ResultsThe analysis was carried out on 67 Latin-American patients treated in the Instituto Nacional de Cancerología (Bogotá, Colombia), obtaining an axillary migration rate of 85%. The sentinel node identification rate was 90%. The false negative rate is 25%. The performance of the diagnostic test shows a sensitivity of 75%, specifity of 100%, positive predictive value of 100%, negative predictive value of 77.5%, and 85.6% accuracy.
ConclusionsThe results of our study show that this technique is not recommended as standard procedure, even in patients with clinically negative axilla confirmed by axillary ultrasound. The high percentage of false negatives may be due to the high number of patients with locally advanced disease in our series.
La técnica del ganglio centinela es un procedimiento usado en estadios tempranos de cáncer de mama el cual es seguro y poco mórbido comparándolo con el vaciamiento axilar1–5, que permite predecir el estado de compromiso ganglionar axilar de manera segura y precisa con falsos negativos de 8,4%6. Sin embargo, el uso de esta técnica no se encuentra suficientemente soportada en estadios localmente avanzados o posterior al uso de tratamientos neoadyuvantes.
Se ha demostrado que los ganglios axilares de pacientes con carcinoma mamario tienen regresión de su estadio tumoral hasta en un 40% posterior al uso de neoadyuvancia7, abriendo de esta manera la posibilidad del uso de la técnica de ganglio centinela en pacientes que reciben tratamientos neoadyuvantes. Dado que los ganglios axilares de estas pacientes a menudo se encuentran clínicamente negativos luego de la terapia, en teoría, estas pacientes serían candidatas para esta técnica evitando la morbilidad asociada al vaciamiento ganglionar como la formación de: seroma, infecciones, lesiones vasculares y nerviosas, dolor, linfedema, pérdida de la sensibilidad y limitación motora8.
Históricamente y bajo la evidencia existente, las pacientes con cáncer de mama localmente avanzado son sometidas a tratamiento neoadyuvante y posteriormente se ofrece manejo quirúrgico, bien sea mastectomía radical modificada o cuadrantectomía más vaciamiento axilar (VA), sin considerarse la biopsia del ganglio centinela para aquellas pacientes que tienen respuesta ganglionar al tratamiento neoadyuvante9.
Dado lo anteriormente mencionado se plantea como objetivo de este trabajo determinar la utilidad de la biopsia del ganglio centinela como prueba diagnóstica en cáncer de mama posterior a neoadyuvancia con hormonoterapia o quimioterapia, en un grupo de pacientes de la Clínica de Seno y Tejidos Blandos del INC.
Materiales y métodoSe calculó un tamaño de muestra de 367 pacientes, teniendo en cuenta como desenlace la sensibilidad del 95% y una especificidad de 100%, de acuerdo a reportes previos de literatura con un error alfa del 0,05 y una precisión del estudio del 0,02, por medio del paquete estadístico NCSS–PASS. Se tomó el tamaño de muestra para una proporción de base de 0,97 o mayor, como es el caso de la especificidad, el tamaño sería inferior a 261. Sin embargo, debido a bajo reclutamiento proyectado en el tiempo se decidió cerrar el estudio y se realizó análisis descriptivo y análisis exploratorio para evaluar la prueba diagnóstica.
La población contemplada fueron pacientes mujeres mayores de 18 años con cáncer de mama operable que consultaron al INC y recibieron neoadyuvancia. Entre los criterios de inclusión se definieron: diagnóstico histológico confirmado de cáncer de mama; recibir quimioterapia u hormonoterapia neoadyuvante; pacientes axila clínicamente negativa; haber completado mínimo 3-4 ciclos de quimioterapia o 3-4 meses de hormonoterapia neoadyuvante, además de aceptar y firmar voluntariamente el consentimiento informado para su participación en el estudio.
Entre los criterios de exclusión se tuvieron en cuenta: pacientes con cáncer de mama en estadio IV que habían recibido cualquier tipo de tratamiento quirúrgico axilar; antecedente de mamoplastia; pacientes con progresión de la enfermedad después de la neoadyuvancia; resultado ecografía axilar con ganglios sugestivos+ACAF positivo para carcinoma o haber recibido radioterapia neoadyuvante.
A todas las pacientes que cumplieron con los criterios de inclusión, se reclutaron, firmaron el consentimiento informado, y se realizaron ecografía axilar con un periodo máximo de quince días. En el caso de presentar alguna adenopatía sospechosa se les realizó ACAF y de ser positivo en la citología se excluían del estudio. Posteriormente fueron llevadas a cirugía, con una ventana de tiempo máximo de 35 días desde el momento de la ecografía axilar. Previamente se marcaron con tecnecio 99 para la identificación de ganglio centinela. Se realizó la disección de ganglio centinela identificándolo con gammasonda, en el mismo acto quirúrgico se completaba el vaciamiento axilar. El tejido aislado fue enviado al laboratorio para el estudio anatomopatológico con hematoxilina eosina e inmunohistoquímica al ganglio centinela y con hematoxilina-eosina a los ganglios del vaciamiento axilar.
Para el análisis estadístico se aplicaron: pruebas de estadística descriptiva, porcentajes para variables cualitativas, y promedios con desviación estándar para cuantitativas. Se realizó cálculo de la sensibilidad, del valor predictivo negativo y la tasa de falsos negativos por medio de una tabla de contingencia, siendo el estándar de oro el resultado del estudio histopatológico del vaciamiento axilar. No se realizó enmascaramiento para cirujanos ni patólogos.
La proporción de identificación fue definida como el número de pacientes, en las que se logró aislar el ganglio centinela para biopsia, dividida por el número total de pacientes en quienes se intentó aislar. Los resultados para cada ganglio centinela identificado satisfactoriamente fueron categorizados como verdadero positivo, verdadero negativo o falso negativo, tomando el desenlace de vaciamiento axilar como referencia estándar. Un ganglio centinela verdadero negativo (VN) fue definido como ganglio centinela negativo y un vaciamiento axilar negativo, un falso negativo (FN) como un ganglio centinela negativo con vaciamiento axilar positivo y un verdadero positivo (VP) como un ganglio centinela positivo con o sin vaciamiento axilar positivo. Basados en esta definición, se asumió que no hay casos de falsos positivos. Los parámetros operativos de la prueba fueron: sensibilidad, proporción de falsos negativo, valor predictivo negativo y precisión. Se utilizó STATA 10 para el análisis estadístico. El estudio fue aprobado por el comité de ética del INC.
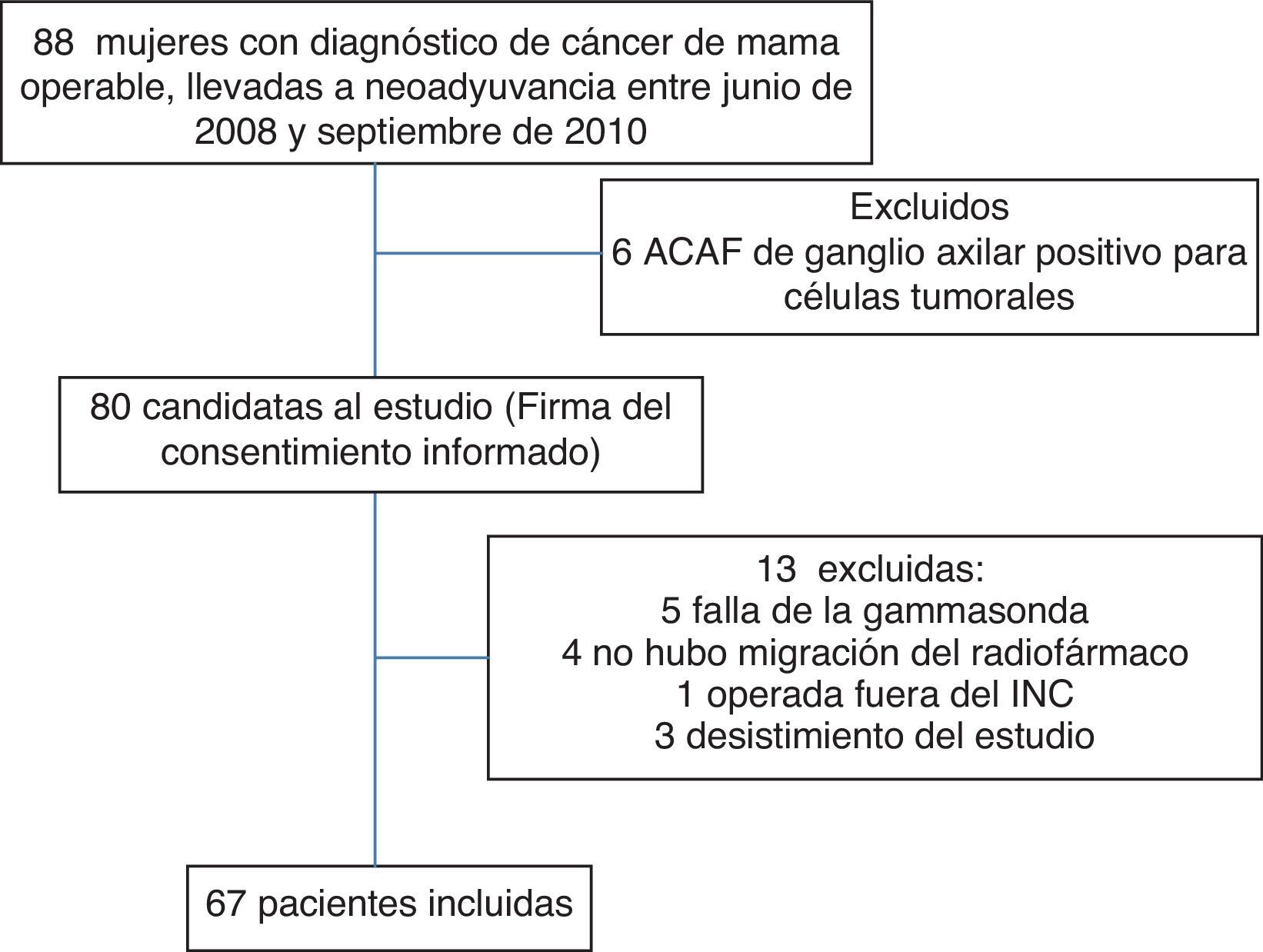
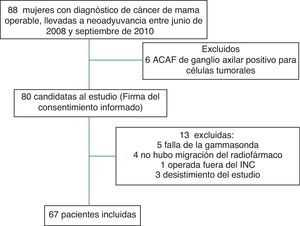
ResultadosSe reclutaron 88 pacientes entre junio de 2008 y septiembre de 2010, se excluyeron 8 pacientes de las cuales: 6 resultaron con ACAF+, una con adenopatías palpables axilares y otra con antecedentes de mamoplastia. De las 80 restantes se descontinuaron 13: 5 debido a falla de gammasonda; en 4 no se identifica ganglio centinela (no migración); 3 pacientes que desistieron del estudio antes del procedimiento quirúrgico y una paciente operada en otra institución (fig. 1).
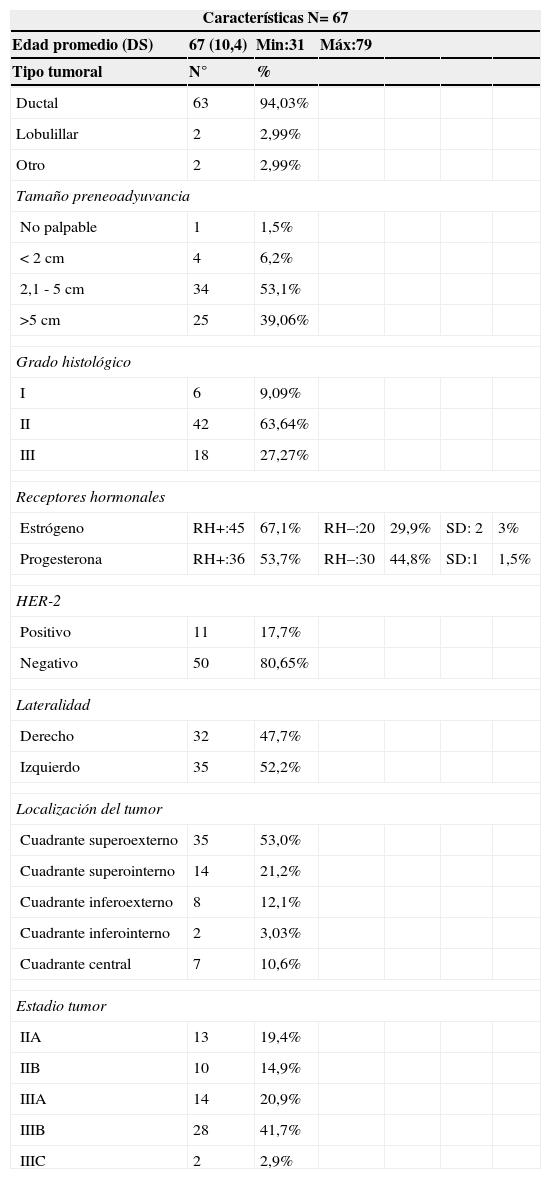
Las características demográficas de las 67 pacientes restantes se muestran en la tabla 1: la edad promedio fue de 53,3 años (DS 10,46); el 94,03% de los tumores fueron ductales; el 63,6% fueron de grado II histológico y el 27,2% de grado III; el 9% fueron tumores grado I; el 67,1% tenían receptores de estrógeno positivos y el 53,7% expresaron receptores de progestágeno. El 17,7% sobreexpresaron el receptor 2 del factor de crecimiento epidérmico humano (HER-2) detectado con inmunohistoquímica o Fish en caso de prueba indeterminada.
Características de las pacientes con identificación de ganglio centinela
| Características N= 67 | ||||||
|---|---|---|---|---|---|---|
| Edad promedio (DS) | 67 (10,4) | Min:31 | Máx:79 | |||
| Tipo tumoral | N° | % | ||||
| Ductal | 63 | 94,03% | ||||
| Lobulillar | 2 | 2,99% | ||||
| Otro | 2 | 2,99% | ||||
| Tamaño preneoadyuvancia | ||||||
| No palpable | 1 | 1,5% | ||||
| < 2cm | 4 | 6,2% | ||||
| 2,1 - 5cm | 34 | 53,1% | ||||
| >5cm | 25 | 39,06% | ||||
| Grado histológico | ||||||
| I | 6 | 9,09% | ||||
| II | 42 | 63,64% | ||||
| III | 18 | 27,27% | ||||
| Receptores hormonales | ||||||
| Estrógeno | RH+:45 | 67,1% | RH–:20 | 29,9% | SD: 2 | 3% |
| Progesterona | RH+:36 | 53,7% | RH–:30 | 44,8% | SD:1 | 1,5% |
| HER-2 | ||||||
| Positivo | 11 | 17,7% | ||||
| Negativo | 50 | 80,65% | ||||
| Lateralidad | ||||||
| Derecho | 32 | 47,7% | ||||
| Izquierdo | 35 | 52,2% | ||||
| Localización del tumor | ||||||
| Cuadrante superoexterno | 35 | 53,0% | ||||
| Cuadrante superointerno | 14 | 21,2% | ||||
| Cuadrante inferoexterno | 8 | 12,1% | ||||
| Cuadrante inferointerno | 2 | 3,03% | ||||
| Cuadrante central | 7 | 10,6% | ||||
| Estadio tumor | ||||||
| IIA | 13 | 19,4% | ||||
| IIB | 10 | 14,9% | ||||
| IIIA | 14 | 20,9% | ||||
| IIIB | 28 | 41,7% | ||||
| IIIC | 2 | 2,9% | ||||
La localización principal de los tumores es el cuadrante superior externo de la mama. El 80,6% de los tumores correspondían a tumores localmente avanzados, siendo el más frecuente el estadio IIIB con el 41,7%. El 19,4% pertenecían a estadios tempranos IIA.
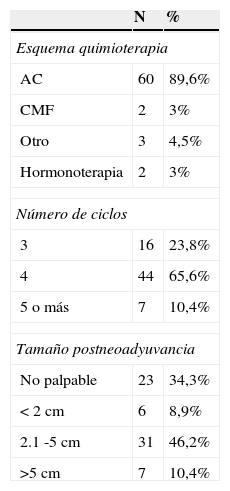
Como se muestra en la tabla 2 el esquema de quimioterapia más usado fue AC (adriamicina-ciclofosfamida), habiéndolo recibido el 89,6% de los pacientes. Dos pacientes (3%) recibieron CMF (ciclofosfamida-metotrexate-5fu). El 4,5% restante otro tipo de terapia. Dos pacientes (3%) recibieron hormonoterapia (letrozol y exemestano).
Todos los pacientes recibieron más de tres ciclos de quimioterapia: 23,8% recibieron 3 ciclos, el 65,6% recibieron 4 ciclos y el 10,4% recibieron 5 o más ciclos.
Antes de recibir tratamiento neoadyuvante, el 98,5% de los tumores que tenían las pacientes eran mayores de 2cm y únicamente el 1,56% tenía un tumor no palpable. Después del tratamiento el 34,3% de los tumores no eran palpables y el 55,3% de los tumores se encontraban entre 2 y 4,9cm.
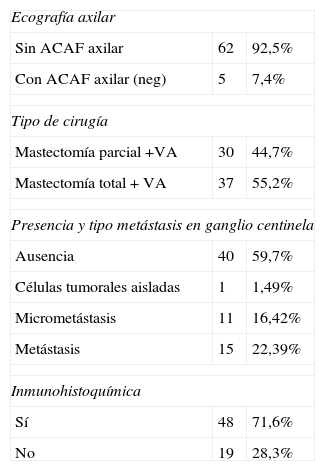
Al 44,7% de las pacientes se les ofreció como tratamiento quirúrgico mastectomía parcial y a las demás pacientes mastectomía total (tabla 3). Todas las pacientes fueron sometidas a VA.
Manejo quirúrgico y patológico
| Ecografía axilar | ||
| Sin ACAF axilar | 62 | 92,5% |
| Con ACAF axilar (neg) | 5 | 7,4% |
| Tipo de cirugía | ||
| Mastectomía parcial +VA | 30 | 44,7% |
| Mastectomía total+VA | 37 | 55,2% |
| Presencia y tipo metástasis en ganglio centinela | ||
| Ausencia | 40 | 59,7% |
| Células tumorales aisladas | 1 | 1,49% |
| Micrometástasis | 11 | 16,42% |
| Metástasis | 15 | 22,39% |
| Inmunohistoquímica | ||
| Sí | 48 | 71,6% |
| No | 19 | 28,3% |
Entre las 67 pacientes en las que existió migración, se identificó un ganglio centinela en el 74,6% de los pacientes y dos ganglios en el 16,4%.
En el estudio anatomopatológico de los ganglios centinelas identificados: el 59,7% tenía ausencia de células tumorales; el 40,3% tenía algún tipo de compromiso metastásico a los ganglios axilares; el 22,3% presentaba franco compromiso metastásico, el 16,4% presentaba micrometástasis y el 1,4% mostraba células tumorales aisladas. Hubo necesidad de realizar inmunohistoquímica en el 71,6% de los casos para la detección de metástasis.
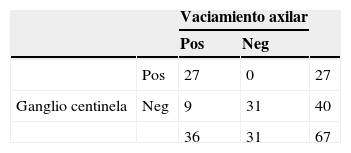
Los datos obtenidos (tabla 4) mostraron una proporción de identificación de 85% (67/78); una proporción de falsos negativos de 25% (IC 95% 10,8%-39,1%); una sensibilidad de 75% (IC 95% 57,8%-87,9%); un valor predictivo negativo de 77,5% y una precisión de 85,6%.
DiscusiónPosterior a la década del 90, cuando fue descrita, la técnica de ganglio centinela reemplazó el vaciamiento axilar linfático como la técnica de elección para la estadificación de la axila en estadios tempranos de cáncer de mama, con un excelente rendimiento diagnóstico en términos de sensibilidad y tasas de detección1–5,10–36, existe información acerca de la utilidad del ganglio centinela posterior al uso de neoadyuvancia y tumores localmente avanzados. Como se mencionó previamente, existe la posibilidad teórica de la aplicabilidad de esta técnica en este grupo de pacientes dado la citoreducción y eventual negativización patológica axilar.
De acuerdo a los resultados arrojados en este estudio, que muestran una tasa de falsos negativos de 25% (IC 95% 10,8%-39,1%), no se recomienda el uso de esta técnica, dado el alto riesgo de dejar tejido tumoral en la axila. Según la literatura la tasa de identificación del ganglio centinela posterior a neoadyuvancia oscila entre 72 y 100%, con sensibilidad variable entre 67% a 100%30. La tasa de falsos negativos varía según la técnica utilizada entre 5,6% y 35,5%30,33,34,37. En un estudio reciente, se encontró una tasa global de 14,2% de falsos negativos postneoadyuvancia en pacientes inicialmente N+ (cN1 o cN2)33.
La alta tasa de falsos negativos, puede ser explicada por el alto número de casos con tumores localmente avanzados y en los cuales, dado el volumen tumoral la esterilización axilar, puede ser incompleta. Al revisar los diversos estudios existentes en la literatura alrededor de este tema, se identifica que existe un alto número de pacientes con estadios tempranos32,33,38 en los que el fin de la neoadyuvancia es la reducción máxima de volumen para realizar cirugía conservadora y por lo que su tasa de falsos negativos pudiese ser menor a la reportada en nuestro estudio. Dos estudios recientes muestran que el rendimiento diagnóstico del ganglio centinela es menor en pacientes con axila positiva antes de iniciar la quimioterapia33,39.
Consideramos además, que los esquemas actuales de quimioterapia neoadyuvante, incluyen taxanos al concluir las antraciclinas, y esto podría lograr unas tasas de esterilización axilar mayores a las alcanzadas en nuestro estudio. En el NSABP B27, la adición de taxanos a los esquemas de antraciclinas aumentó la tasa de ganglios axilares negativos en un 16%40. Este aumento en la esterilización axilar podría disminuir, a su vez, la cifra de falsos negativos a los aceptados mundialmente en la realización de la técnica de ganglio centinela en estadios tempranos. Sin embargo, no existen estudios recientes que comparen el rendimiento del ganglio centinela postneoadyuvancia con respecto al esquema de quimioterapia utilizado.
Hasta el momento los factores que han demostrado disminuir la tasa de falsos negativos en el ganglio centinela postneoadyuvancia, son el número de ganglios resecados y la implementación de una técnica dual para la identificación del ganglio33,39.
Dentro de los casos de no identificación del centinela, cabe aclarar que existieron dos casos en donde hubo captación del radiotrazador, pero en la patología no se identificó tejido ganglionar. Esto se explica porque la quimioterapia puede generar un grado importante de respuesta sobre el tejido ganglionar reemplazándolo por tejido fibrótico.
Los casos en los que se informan células tumorales aisladas en el centinela deben ser analizados cuidadosamente. En el escenario de realización de ganglio centinela en estados tempranos el hallazgo de células tumorales aisladas no tiene una implicación clínica relevante y no conlleva a la realización de procedimientos posteriores, y este hallazgo en pacientes que han recibido neoadyuvancia puede corresponder a una esterilización incompleta de un ganglio afectado por lo que debe asumirse como un ganglio patológico y debe completarse el vaciamiento axilar.
ConclusionesLa técnica de ganglio centinela después de neoadyuvancia, según los resultados de esta serie, no se recomienda todavía como procedimiento estándar en pacientes con axila clínicamente negativa corroborada con ecografía axilar. El alto porcentaje de falsos negativos puede deberse al número elevado de pacientes con estadios localmente avanzados, que son frecuentes en la población colombiana. Este estudio usó 4 ciclos de AC por lo que se recomiendan estudios posteriores incluyendo esquemas con taxanos posteriores a AC. Asimismo, debido al número pequeño de la muestra no es posible realizar comparaciones con los estudios internacionales publicados a la fecha.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.