Existen múltiples factores pronóstico de la supervivencia en el cáncer de mama metastásico (CMM). Los dos factores mejor estudiados son la expresión de receptores hormonales (RH) y el estatus HER2, por lo que su determinación es obligada en toda paciente con diagnóstico de CMM. El 80% de los tumores expresan RH y el 20% son HER2-positivo. El objetivo de este estudio es determinar los factores pronóstico de la supervivencia global (SG) de pacientes con diagnóstico de CMM HER2-positivo atendidos entre 2009 y 2015 en el Instituto de Cancerología de Medellín (Colombia).
MétodosEstudio observacional retrospectivo. Se realizaron las curvas de supervivencia mediante el método de Kaplan-Meier comparadas con Log-Rank test y se analizaron los factores que influyeron en la supervivencia mediante la regresión de Cox.
ResultadosSe incluyeron 101 pacientes. La mediana de seguimiento fue 46,6 meses (rango 13-155 meses), la SG a cinco años fue 41% (IC95%: 31%-50%) y a diez años 13% (IC95%: 4%-30%). Tuvieron mayor SG pacientes con enfermedad en recaída, con estadios I y II, las mayores de 40 años, menopáusicas, con tumores con grado histológico bajo y co-expresión de receptores hormonales. Las pacientes que recayeron tuvieron mayor SG que las que hicieron metástasis de novo (HR: 0,47, IC95%: 0,27-0,81) ajustado por las otras variables.
ConclusionesLa supervivencia de estas pacientes fue semejante al de otros países, al igual que las líneas de tratamiento y la terapia recibida.
There are multiple risk factors associated with the prognosis of survival of metastatic breast cancer (MBC). The two major risk factors are the expression of hormonal receptors (HR) and HER 2 neu, and the reason why they are requested in every MBC patient. The large majority (80%) of breast tumours are HR positive, and 20% are HER 2 positive. The aim of this study was to determine the prognostic factors associated with the overall survival (OS) of patients diagnosed with HER 2 positive MBC seen between January 2009 and December 2015 in the Instituto de Cancerología (Medellín-Colombia).
MethodsA retrospective observational study was conducted, with survival analysis using the Kaplan-Meier method. The survival curves were compared using the Log-Rank Test, and factors associated with survival were analysed using the Cox regression.
Results101 patients were included in the study. The median survival time was 46.6 months (Range 13-155 months), the 5-year OS was 41% (95% CI; 31%-50%) and the 10-year OS 13% (95% CI; 4%-30%). Higher overall survival was found for patients with relapsed disease, those with stages I and II, patients older than 40 years, postmenopausal, tumours with low histological grade and with co-expression of hormonal receptors. The patients with relapse of disease had a higher OS than the de novo patients after being adjusted for the other factors (HR: 0.47, 95% CI; 0.27-0.1).
DiscussionThe overall survival time is similar to that of other countries, as well as the lines of treatment and therapy received.
En Colombia el cáncer de mama (CM) es el más frecuente de los tumores malignos entre las mujeres con una prevalencia en 2015 de 43.846 casos. Su incidencia ha ido en aumento en los últimos años, al pasar de 36 por 100.000 mujeres en 2012 a 39 por 100.000 en 2015, al igual que la mortalidad que fue de 11 y 12 por 100.000 mujeres, respectivamente1,2.
A diferencia de Colombia, en varios países desarrollados en los últimos años se ha observado un descenso en las tasas de mortalidad por CM y esto se atribuye: a la implementación de programas organizados de tamización; al uso de métodos radiológicos más sensibles que permiten un diagnóstico más temprano de la enfermedad metastásica; al uso de terapias de soporte (peg-filgrastim), y a los avances en el tratamiento con quimioterapia y hormonoterapia3,4.
El cáncer de mama metastásico (CMM) incluye dos tipos de pacientes: los pacientes a los que se les hizo diagnóstico de cáncer cuando ya tenían metástasis (de novo) y los pacientes que recayeron luego de haber tenido un estadio temprano (I a III). La incidencia del CMM de novo es de un 5% en el mundo, mientras que dentro del grupo de las pacientes que recaen el 6% tienen recaída local y el 30% desarrollan metástasis a distancia durante el curso de su enfermedad3,5,6.
No existe consenso si las pacientes con metástasis de novo tienen peor supervivencia que las que recaen. Dawood et al.7 encontraron que la supervivencia de estas pacientes depende del tiempo de la recaída: es similar a la de pacientes que recaen luego de 24 meses del diagnóstico, mejor que la de los que recaen menos de 24 meses del diagnóstico o que recibieron quimioterapia adyuvante y peor que la de los que recaen luego de cinco años. Zeichner et al.6 encontraron una mayor supervivencia en las pacientes de novo que la reportada por Dawood, atribuida quizás a que su población de estudio tenía características raciales y de seguridad social diferentes, aunque no afirman ni refutan que la supervivencia sea mejor que la de pacientes en recaída. Chia et al.8 no hallaron diferencias en la supervivencia entre las pacientes con cáncer de novo y las que recayeron dentro de los primeros cinco años de su diagnóstico inicial.
En la era post-trastuzumab, a partir de los años 90, la mediana de supervivencia global de pacientes con CMM HER2-positivo era de 3,5 años: el 14% de los pacientes sobrevivieron entre cinco años o más y entre el 2,2% a 7,6% de los pacientes sobrevivieron más de diez años9,10. Sin embargo, el CMM sigue siendo una enfermedad incurable. Actualmente existen otros medicamentos, como el lapatinib, el pertuzumab y el trastuzumab emtansina, que bloquean esta vía de señalización y que han mostrado mayor supervivencia libre de enfermedad (SLE) comparados con el uso de trastuzumab, tanto en pacientes con o sin enfermedad metastásica11–13.
La co-expresión de receptores hormonales y la enfermedad oligometastásica se han asociado con mayor SG en las pacientes con CMM HER2-positivo, mientras que el grado histológico alto, el estadio inicial III, una SLE menor a 2 años y tener compromiso hepático lohan sido con un menor tiempo de SG11,14,15.
El objetivo de este estudio fue describir las características de las pacientes con CMM HER2-positivo y los resultados del tratamiento, en términos de la SG y la SLE, que fueron atendidas en el Instituto de Cancerología (IDC) Las Américas de Medellín.
MétodosEstudio de seguimiento de una cohorte retrospectiva de pacientes con aplicación de análisis de supervivencia. Se revisaron todas las historias clínicas de pacientes con CM HER2-positivo incluidas en el Registro Institucional de Cáncer (SIPA) y las historias de las pacientes que recibieron quimioterapia entre enero de 2009 y diciembre de 2015 en el IDC.
Se incluyeron pacientes de sexo femenino, mayores de 18 años, sin antecedente personal de otro cáncer (excepto cáncer de piel) y cuya historia clínica tuviera al menos el 25% de los datos de interés del estudio disponibles, incluyendo el estado del HER2.
El estado del HER2 se tomó del informe del patólogo realizado por inmunohistoquímica (IHQ), el cual fue reportado como positivo cuando era (3+) o por hibridación in situ fluorescente (FISH) con resultado mayor o igual a dos16; los receptores hormonales se consideraron positivos cuando su valor fue mayor o igual a 1% por IHQ o según la escala de Allred17.
El sitio predominante de metástasis se definió así: compromiso de tejidos blandos o local (recaída al seno o la axila ipsilateral; brote o nódulos de permeación en el seno tratado o en la pared torácica; recaídas ganglionares axilares, supraclaviculares, infraclaviculares o cervicales), sistema nervioso (cerebro y cualquier otro órgano), visceral (hígado o pulmón y/o hueso sin cerebro) y hueso (hueso y/o tejidos blandos sin vísceras ni cerebro).
La SG y la SLE se evaluaron hasta el primero de junio de 2017 y hasta la fecha de la última valoración clínica en el IDC. La SG para las pacientes de novo y de recaída se determinó desde el momento del diagnóstico de la metástasis hasta la fecha de muerte por cualquier causa. La SLE para las pacientes de recaída se determinó desde la fecha del diagnóstico del cáncer hasta la fecha de la recaída local o primer sitio de metástasis. Se llamó por teléfono a quienes no registraban una visita de seguimiento luego de seis meses de su último control oncológico.
Se realizaron las curvas de supervivencia usando el método de Kaplan-Meier. Luego se compararon la SG y la SLE según los diferentes factores y se emplearon las pruebas Log-Rank test, Breslow y Tarone-Ware, teniendo en cuenta el momento en que se observara la diferencia entre los riesgos según los escenarios de las funciones de supervivencia (HR)18. Para la identificación de los factores se realizó un análisis multivariado con la regresión de Cox. Se realizó ajuste de la confusión con la variable menopausia.
El procesamiento y el análisis de los datos se realizó mediante el programa Stata12 y SPSS 21. Para la realización del estudio se obtuvo aprobación del Comité de Ética Independiente del IDC.
ResultadosSe revisaron 698 historias clínicas que estaban registradas como CM HER2-positivo, de las cuales: 13 eran HER2-negativo, en 24 no fue posible determinar el estado del HER2 (FISH desconocido) y 11 tenían antecedente de cáncer. De las 650 pacientes que eran HER2-positivo 503 no tenían o no desarrollaron metástasis entre 2009 y 2015, y de las 147 metastásicas no se incluyeron 25 porque no recibieron tratamientos en el IDC, 20 porque tenían diagnóstico de metástasis y fallecieron sin alcanzar a recibir tratamiento, y una tenía información incompleta.
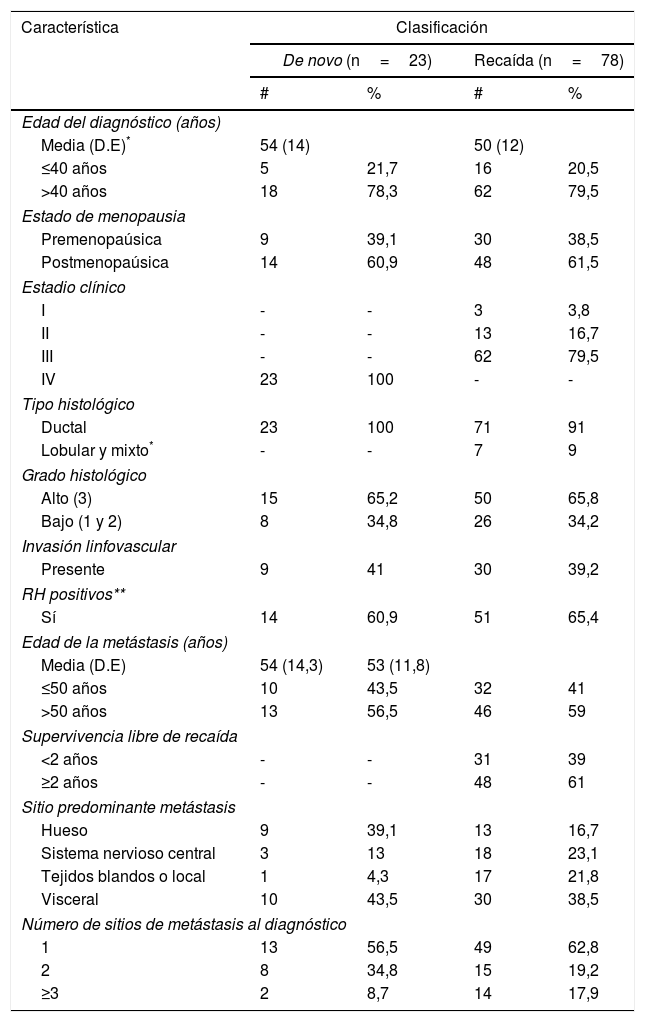
Se incluyeron 101 pacientes, 23 pacientes (22,8%) pertenecían al grupo de novo y 78 (77,2%) al de recaída. En la tabla 1 se presentan las características demográficas, clínicas y patológicas de la población estudiada.
Características clínicas y patológicas de las pacientes
| Característica | Clasificación | |||
|---|---|---|---|---|
| De novo (n=23) | Recaída (n=78) | |||
| # | % | # | % | |
| Edad del diagnóstico (años) | ||||
| Media (D.E)* | 54 (14) | 50 (12) | ||
| ≤40 años | 5 | 21,7 | 16 | 20,5 |
| >40 años | 18 | 78,3 | 62 | 79,5 |
| Estado de menopausia | ||||
| Premenopaúsica | 9 | 39,1 | 30 | 38,5 |
| Postmenopaúsica | 14 | 60,9 | 48 | 61,5 |
| Estadio clínico | ||||
| I | - | - | 3 | 3,8 |
| II | - | - | 13 | 16,7 |
| III | - | - | 62 | 79,5 |
| IV | 23 | 100 | - | - |
| Tipo histológico | ||||
| Ductal | 23 | 100 | 71 | 91 |
| Lobular y mixto* | - | - | 7 | 9 |
| Grado histológico | ||||
| Alto (3) | 15 | 65,2 | 50 | 65,8 |
| Bajo (1 y 2) | 8 | 34,8 | 26 | 34,2 |
| Invasión linfovascular | ||||
| Presente | 9 | 41 | 30 | 39,2 |
| RH positivos** | ||||
| Sí | 14 | 60,9 | 51 | 65,4 |
| Edad de la metástasis (años) | ||||
| Media (D.E) | 54 (14,3) | 53 (11,8) | ||
| ≤50 años | 10 | 43,5 | 32 | 41 |
| >50 años | 13 | 56,5 | 46 | 59 |
| Supervivencia libre de recaída | ||||
| <2 años | - | - | 31 | 39 |
| ≥2 años | - | - | 48 | 61 |
| Sitio predominante metástasis | ||||
| Hueso | 9 | 39,1 | 13 | 16,7 |
| Sistema nervioso central | 3 | 13 | 18 | 23,1 |
| Tejidos blandos o local | 1 | 4,3 | 17 | 21,8 |
| Visceral | 10 | 43,5 | 30 | 38,5 |
| Número de sitios de metástasis al diagnóstico | ||||
| 1 | 13 | 56,5 | 49 | 62,8 |
| 2 | 8 | 34,8 | 15 | 19,2 |
| ≥3 | 2 | 8,7 | 14 | 17,9 |
El sitio predominante de metástasis al diagnóstico fue el visceral, puesto que prácticamente duplicó el porcentaje de metástasis a hueso. Se definió como sitio predominante al órgano o sistemas donde el paciente desarrolla metástasis por primera vez (tabla 1). Con respecto al compromiso de SNC: 20,2 (20%) de las pacientes tuvieron compromiso al momento del diagnóstico y 41 (40,6%) pacientes desarrollaron metástasis a SNC a lo largo de su enfermedad, siendo más frecuente el desarrollo en pacientes que recayeron comparado con las pacientes de novo (43,5% vs. 39,7%).
La mayoría de las pacientes con cáncer de novo fueron llevadas a cirugía (73%), de las pacientes operadas 65% recibieron radioterapia también, hubo dos pacientes del grupo de novo que recibieron solamente radioterapia a seno para control sintomático.
De las 78 pacientes que presentaron recaída de su enfermedad, 35 (45%) recibieron hormonoterapia y 46 (59%) trastuzumab como neo o adyuvancia. Recibieron quimioterapia neo o adyuvante 72 (92,3%), de estas 68 (94%) de las pacientes recibieron antraciclinas y 53 (73%) taxanos.
En este estudio se encontró el uso de una variedad regímenes de quimioterapia para el manejo del CMM y todas las pacientes recibieron trastuzumab. Se registraron un total de 313 posibles combinaciones de tratamiento, donde: 57% incluyeron trastuzumab, 20% incluyeron lapatinib, 6,4% incluyeron pertuzumab y 6,4% incluyeron trastuzumab emtansina. La mediana de líneas de quimioterapia fue de dos (rango de 1 a 12 líneas): el 28% de los pacientes recibieron cuatro o más líneas de quimioterapia y el 10% de los pacientes recibieron seis o más líneas de quimioterapia.
En primera línea los regímenes de quimioterapia más utilizados fueron en orden descendente: trastuzumab combinado con taxanos (19%); lapatinib combinado con capecitabina (15%); antraciclinas (13%); trastuzumab combinado con vinorelbina (12%), y trastuzumab combinado con un inhibidor de aromatasa (8%). El resto (33%) recibieron diversos esquemas incluidos: transtuzumabemtansina y pertuzumab, entre otros.
SupervivenciaDe las 101 mujeres con CM observadas en el periodo de seguimiento 70 (69,3%) fallecieron, de las cuales: 17 pacientes (73,9%) eran del grupo de novo y 53 pacientes (67,9%) hacían parte del grupo de recaída (p=0,77). De este grupo, siete pacientes estaban vivas sin evidencia de enfermedad metastásica activa.
Las 53 (76%) pacientes fallecidas pertenecían en su mayoría al grupo de recaída, 41 (58,5%) tenían más de 50 años al momento del diagnóstico de su metástasis, 40 (57,1%) pertenecían al régimen contributivo, 56 (80%) vivían en el área metropolitana, 43 (61,4%) tenían cáncer de seno estadio III, 47 (67%) tumores con grado histológico alto y 44 (63%) se encontraban menopáusicas.
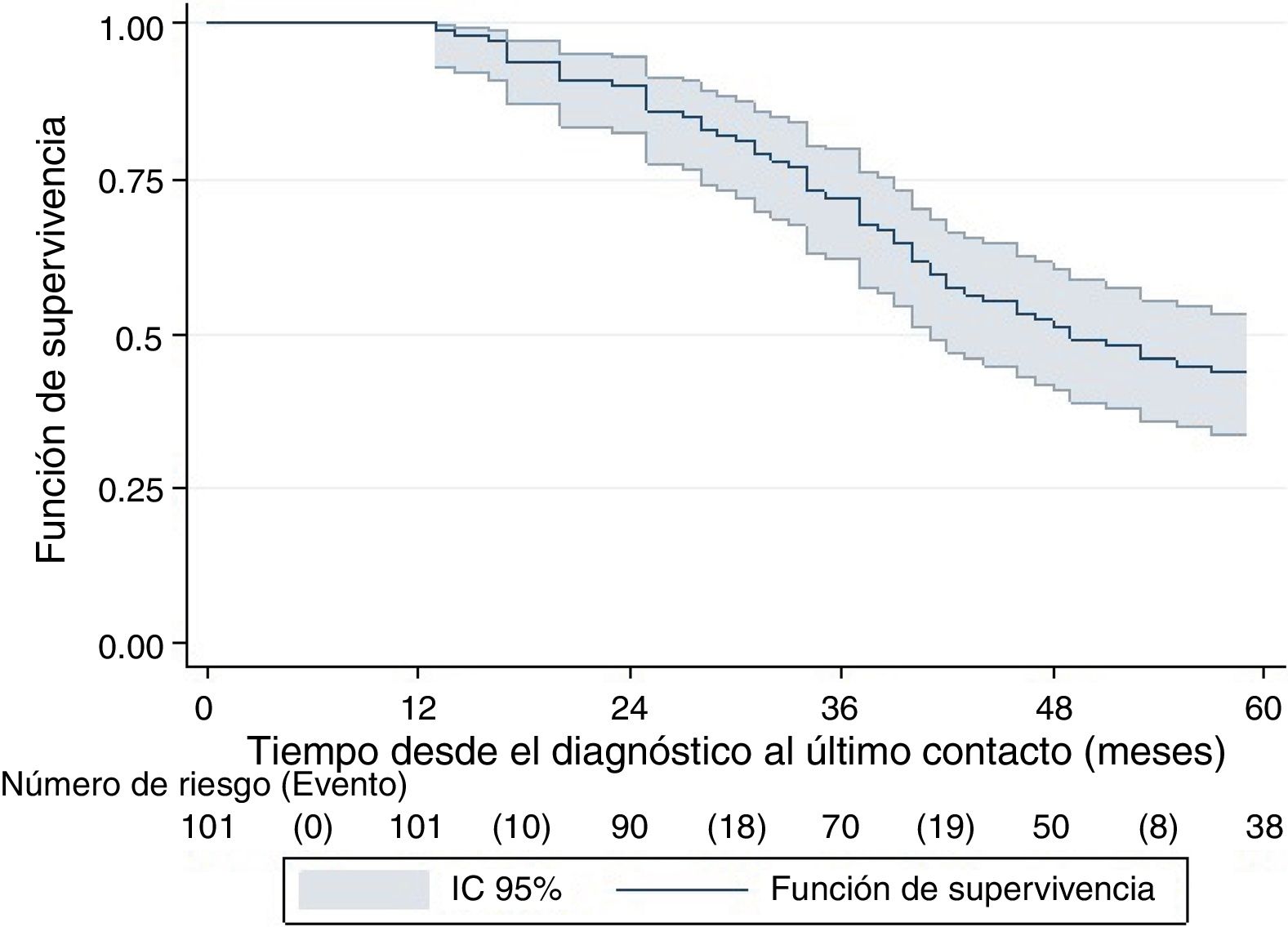
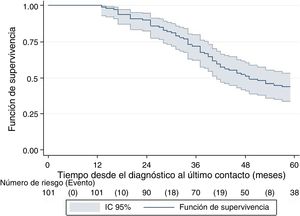
La mediana del tiempo de seguimiento fue 46,6 meses (RIQ: 33-71 meses), con una SG de 52% (IC95%: 41%-61%). La SG a 5 años fue de 41% (IC95%: 31%-50%) y a 10 años fue de 13% (IC95%: 4%-30%) (fig. 1).
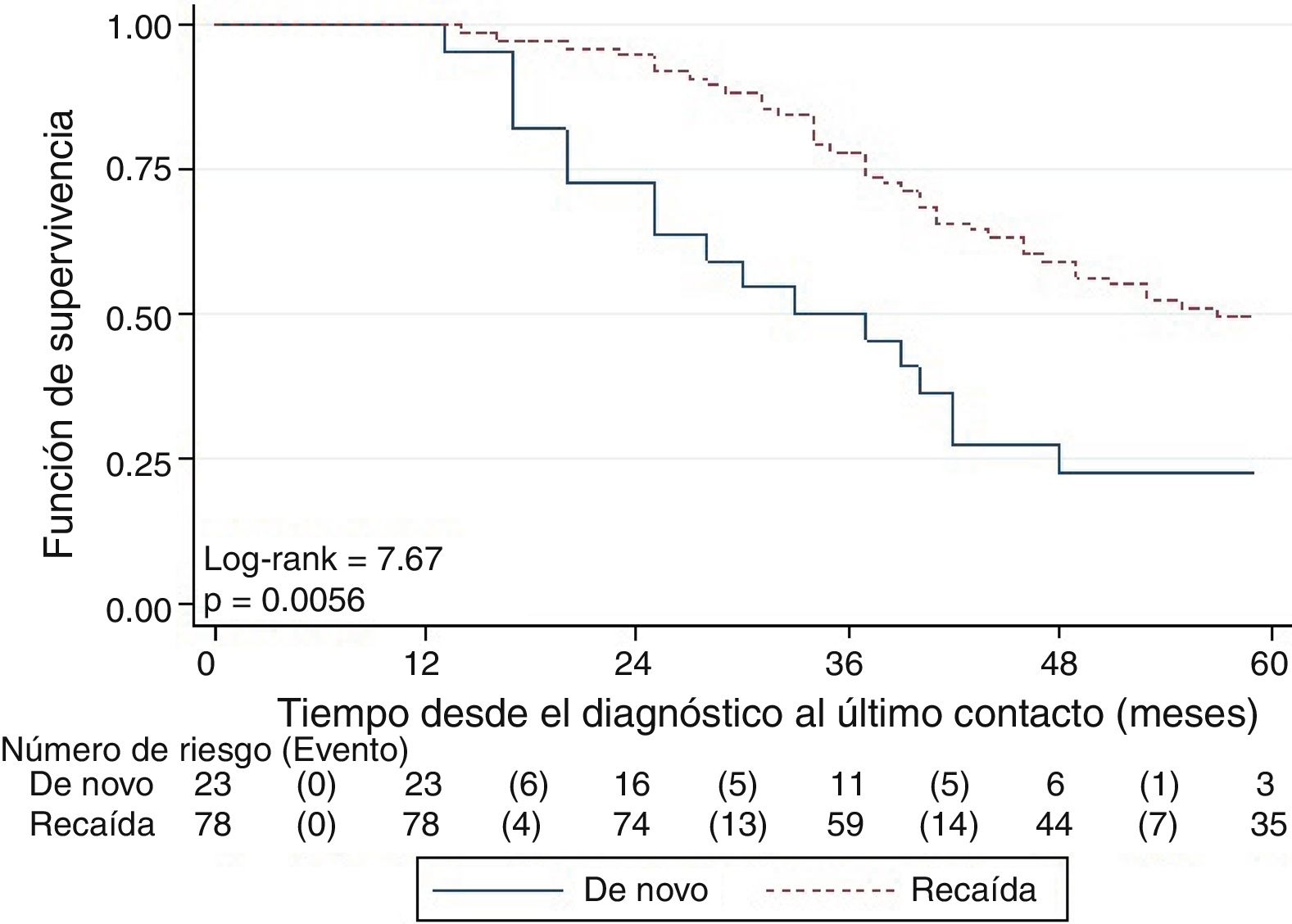
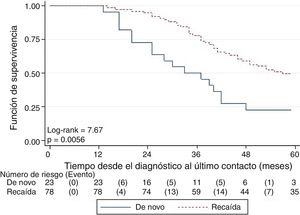
La SG fue significativamente mayor en las pacientes con enfermedad en recaída que en las de novo (fig. 2) y en las pacientes con estadios I y II en comparación con las de estadio III. Las pacientes mayores de 40 años, menopaúsicas, con tumores de grado histológico bajo y con co-expresión de receptores hormonales tuvieron mejor SG, aunque las diferencias no fueron estadísticamente significativas.
Al comparar la SLE según los diferentes factores estudiados, se encontró un mayor tiempo de supervivencia en las pacientes con grado histológico bajo, que recibieron trastuzumab neo y/o adyuvante y hormonoterapia; esta diferencia fue estadísticamente significativa. Se observó una tendencia a tener un mayor tiempo de supervivencia en las pacientes estadios I y II, no menopaúsicas y en aquellas, sin invasión linfovascular, diferencias no estadísticamente significativas.
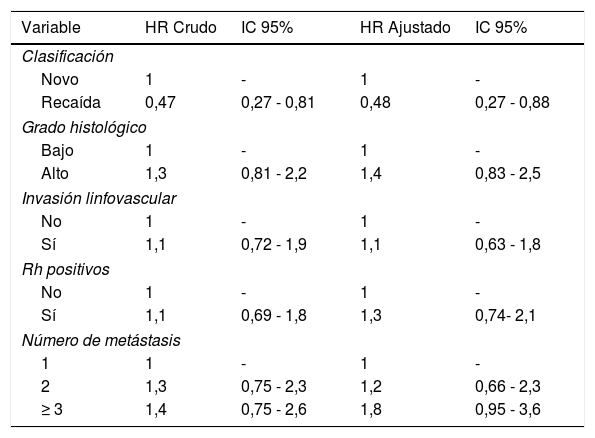
Se encontró que la clasificación en de novo y recaída es el único factor que tiene una asociación con la SG luego de ser ajustado por los otros factores (tabla 2), siendo mayor para las pacientes en recaída (HR: 0,47; IC95%: 0,27-0,81).
Factores asociados a la supervivencia global
| Variable | HR Crudo | IC 95% | HR Ajustado | IC 95% |
|---|---|---|---|---|
| Clasificación | ||||
| Novo | 1 | - | 1 | - |
| Recaída | 0,47 | 0,27 - 0,81 | 0,48 | 0,27 - 0,88 |
| Grado histológico | ||||
| Bajo | 1 | - | 1 | - |
| Alto | 1,3 | 0,81 - 2,2 | 1,4 | 0,83 - 2,5 |
| Invasión linfovascular | ||||
| No | 1 | - | 1 | - |
| Sí | 1,1 | 0,72 - 1,9 | 1,1 | 0,63 - 1,8 |
| Rh positivos | ||||
| No | 1 | - | 1 | - |
| Sí | 1,1 | 0,69 - 1,8 | 1,3 | 0,74- 2,1 |
| Número de metástasis | ||||
| 1 | 1 | - | 1 | - |
| 2 | 1,3 | 0,75 - 2,3 | 1,2 | 0,66 - 2,3 |
| ≥ 3 | 1,4 | 0,75 - 2,6 | 1,8 | 0,95 - 3,6 |
Este es el primer estudio en Colombia que reporta las características de las pacientes con CMM HER2-positivo, su mortalidad y las variables que se asocian con su supervivencia. A pesar de la importancia del tema en el país, sobre el cáncer de mama, solo es posible encontrar estudios descriptivos que reportan la incidencia de la patología.
Con respecto a la caracterización de las pacientes del presente estudio, la distribución en las categorías de novo vs. recaída, al igual que la edad del diagnóstico del CMM, fue similar a la reportada en los estudios de Estados Unidos, Italia y el Reino Unido14,19,20, siendo mayor el número de paciente de recaída y con una mediana de edad mayor o igual a 50 años. Sin embargo, esta distribución por edad, contrasta con lo reportado por Harano et al.21, en cuyo estudio la mayoría de las pacientes eran menores de 50 años (61%).
Por otro lado, se encontró un porcentaje importante de pacientes menores de 40 años (20%) que aunque no fue tan elevado como el reportado por Olson et al. (36%), es significativo, ya que podría reflejar el aumento en la incidencia del CM en las pacientes jóvenes y en tal caso, plantearía un reto de cómo hacer programas de tamización para pacientes de esta edad15.
Con respecto al estadio inicial del cáncer, en este estudio el 60% de las pacientes se hallaban en estadio III, porcentaje mayor al reportado por investigadores de Italia y Estados Unidos, donde se observa un mayor porcentaje de pacientes en estadios I y II11,19. Un factor que posiblemente haya influido para que esto ocurra es la falta oportuna de acceso a los servicios de salud que ocurre en nuestro país y que representa una barrera para la detección temprana.
Con referencia a los lugares de la enfermedad metastásica, en los datos analizados, se encontró un porcentaje de compromiso a SNC (20%) mayor al 7,2% reportado por Brufsky et al.22 y al 8% por Olson et al.15. Al respecto, es importante mencionar que identificar el porcentaje preciso de compromiso a SNC, es difícil, ya que la mayoría de los diagnósticos se hace solo en pacientes sintomáticas.
Las características patológicas de las pacientes abordadas en este estudio fueron similares a otras investigaciones en cuanto a la distribución de los tumores de acuerdo con: el grado histológico, el tipo histológico y la presencia de invasión linfovascular. Sin embargo, el porcentaje de co-expresión de receptores hormonales (64,4%) fue mayor al reportado por Yardley et al. (52,9%) y por Olson et al. (57%)15,20.
En cuanto al tiempo de recaía o SLE, las pacientes HER2 se ubican en un punto intermedio entre las triple negativas y las receptor hormonal positivas HER2-negativo. Las pacientes con tumores HER2 tienen un patrón en el cual suceden las recaídas entre dos y cinco años luego del diagnóstico, a diferencia de las de tumores triple negativo (recaída en menos de dos años) y las de receptores hormonales positivos HER2-negativo que recaen en un tiempo mayor a cinco años22,23.
Con relación a esto último, se ha encontrado que a pesar del avance en los tratamientos oncológicos neo y adyuvantes, un importante porcentaje de pacientes sufrirán recaída de su enfermedad. Sin embargo, desde la introducción del trastuzumab y de otros medicamentos como son el trastuzumab emtansina y el pertuzumab, se ha visto un aumento sustancial en la SG hasta el punto de que ya existen pacientes sin evidencia de cáncer activo, lo que para algunos podría ser llamada “curación” e indica que justifica seguir tratando a estas pacientes24.
En cuanto a otras formas de tratamiento, es de interés el hallazgo encontrado con relación a las cirugías, especialmente el alto porcentaje de las pacientes de este estudio con cáncer de novo, que fueron intervenidas quirúrgicamente para tratar su cáncer primario (73%). El dato difiere lo que da a conocer Lambertini et al., en Italia, en cuyo estudio es mayor el porcentaje de cirugías para otros subtipos moleculares diferentes al HER2, situación que posiblemente sea un reflejo de la alta tasa de respuestas que presenta el cáncer HER2-positivo a la quimioterapia19.
Al centrar la mirada en el desenlace de los casos investigados y la población que falleció se puede afirmar que los casos presentaban en su mayoría características que incrementan el riesgo de muerte: tumores con grado histológico alto y presencia de invasión linfovascular, compromiso visceral y de SNC y tres o más sitios de metástasis. A pesar de que dichos factores no resultaron significativos en análisis multivariado, son marcadores de mal pronóstico. Sería ideal la elaboración de un modelo predictivo en el que se pudieran incluir estas variables para así elaborar una especie de puntuación que permita decidir en cuáles pacientes usar una terapia sistémica más agresiva y que incluya un enfoque multidisciplinario con cirugía, radioterapia y quimioterapia.
Dentro de las pacientes que sobrevivieron, la mediana de SG de la cohorte estuvo en 46,6 meses (3,8 años) lo cual es semejante a lo reportado en la literatura por Olson et al.15. Se deja la discusión abierta para el lector, manifestando que predecir la supervivencia de pacientes metastásicos es algo complejo debido a la heterogeneidad biológica de esta enfermedad20.
El único factor con significación estadística en el modelo que se ha presentado fue el tener enfermedad en recaída comparado con ser metastásico de novo (HR: 0,47; IC95%: 0,27-0,81). Este factor había sido identificado en estudios llevados a cabo en Estados Unidos, Reino Unido e Italia sin llegar a un consenso entre las diversas cohortes, con respecto a cuál subgrupo de pacientes tiene un mayor tiempo de SG14,15,20.
Otros factores que influyeron en la SG son la SLE, la co-expresión de receptores hormonales, tener tres o más sitios de metástasis y el realizar cirugía en las pacientes de novo, los mismos que en este estudio mostraron una tendencia pero sin diferencias estadísticas, quizás debido posiblemente al limitado tamaño muestral.
La principal limitación con la que se contó es que en Colombia, como señalan Robledo et al.25 existe una altamovilidad interinstitucional por lo que la mayoría de las pacientes reciben parte de su terapia en un centro oncológico y luego en otro, lo que implica la falta de registros unificados y la carencia de sistemas centralizados de información.
En el presente estudio se corrobora que el tiempo de SG fue semejante al de otros países, al igual que las líneas de tratamiento y la terapia recibida. Lo anterior es una prueba empírica que permite justificar el seguir tratando a las pacientes en Colombia utilizando las guias de manejo internacionales.
Teniendo en cuenta el hallazgo de una mejor supervivencia de las pacientes con cáncer en recaída vs. las pacientes de novo, se considera de importancia que los actores gubernamentales y privados del Sistema de Salud insistan en las campañas de diagnóstico temprano del cáncer de mama.
Por tratarse de un estudio institucional los hallazgos obtenidos deben usarse con cautela si se quisieran extrapolar a otras instituciones del país. Adicionalmente, es importante considerar que la investigación refleja la práctica clínica en el momento en que se introdujeron en Colombia medicamentos como el pertuzumab y el trastuzumab emtansina, por lo que no fueron evaluados los factores pronósticos asociados a estos dos tipos de terapia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen de manera especial a Marcela Hernández quien apoyó con la elaboración de las gráficas de supervivencia y la corrección de figuras y tablas y a Patricia Montoya quien apoyó la recolección de datos, la elaboración de las tablas y la corrección de estilo y a Angela María Segura sin quien no hubiera sido posible culminar este proyecto.