Describimos la experiencia quirúrgica de diez pacientes sometidas a linfadenectomía paraaórtica extraperitoneal laparoscópica (LPEL) para clasificación en carcinoma de cérvix localmente avanzado (CCLA) y revisión de la literatura.
MétodosBúsqueda de literatura en MEDLINE y EMBASE usando palabras clave: ″Uterine Cervical Neoplasms; Neoplasm Staging; Lymph Nodes; Lymph Node Excision; Laparoscopy; extraperitoneal”. Describimos la técnica quirúrgica para LPEL y resultados obtenidos en 10 pacientes intervenidas.
ResultadosDiez pacientes con CCLA fueron sometidas a LPEL, rango de edad entre 29 y 65 años, sangrado operatorio entre 5 y 30 cc, recuento ganglionar entre 2 y 11 ganglios; no complicaciones intraoperatorias y estancia hospitalaria entre uno y tres días.
ConclusiónEs la primera experiencia reportada de LPEL para el CCLA en Colombia, siendo un procedimiento factible, seguro y útil para identificar compromiso paraaórtico adaptando el tratamiento.
A description is presented on the surgical experience of 10 patients who underwent laparoscopic extraperitoneal para-aortic lymphadenectomy (LEPL) in order to classify locally advanced cervical carcinoma (LACC), as well as a literature review.
MethodsA literature search was performed in MEDLINE and EMBASE using the following keywords:”Uterine Cervical Cancer; Cancer Staging; Lymph Nodes; Lymph Node Excision; Laparoscopy; extraperitoneal”. The surgical technique for LEPL is described, as well as the outcomes of the 10 patients who underwent surgery.
ResultsA total of 10 patients, with ages between 29 and 65 years and with LACC underwent LPEL. There were surgical blood losses between 5 to 30 cc, a lymph node count between 2 and 11, no surgical complications, and a hospital stay of between 1 and 3 days.
ConclusionThis is the first experience reported for LPEL for LACC in Colombia. It is a safe, feasible, and useful procedure to identify para-aortic involvement.
El cáncer de cuello uterino en América Latina se constituye en un problema de salud pública importante presentando una incidencia de 21,2 personas por cada 100.000 mujeres y una mortalidad de 8,7 personas por 100.000 mujeres según las estadísticas de GLOBOCAN 2012 para América Latina1,2. En Colombia se presentan alrededor de 4.462 nuevos casos al año lo que representa una incidencia anual de 18,7 personas por cada 100.000 mujeres y una mortalidad de 8 personas por cada 100.000 mujeres, siendo el segundo cáncer en frecuencia en la mujer colombiana1,3,4. Por otra parte, una alta proporción de pacientes (60-70%) son diagnosticadas con enfermedad localmente avanzada5 y este grupo presenta un compromiso ganglionar extrapélvico (paraaórtico), que va del 10% en estadios Ib2 al 40% en estadios IVa, lo que hace que fracase el tratamiento convencional con quimioradicación concomitante con campos de radioterapia limitados a la pelvis en un número significativo de estas pacientes6. Hasta el momento la Federación Internacional de Ginecología y Obstetricia (FIGO) ha mantenido la estadificación de esta neoplasia como una actividad meramente clínica5.
Los estudios imaginológicos utilizados para evaluar el compromiso metastásico a este nivel presentan bajas tasas de sensibilidad y de ellos, el 18-FDG PET/CT es el que mayor rendimiento diagnóstico provee pero a la vez es el menos asequible para la población general7; a pesar de su empleo, entre el 16% y el 32% de los pacientes con metástasis en los ganglios linfáticos paraaórticos se clasifican incorrectamente como ganglios negativos8.
Con el fin de no tratar de forma insuficiente este grupo de pacientes, se ha propuesto la técnica de clasificación ganglionar LPEL que permite direccionar mejor el tratamiento primario con quimioradioterapia concomitante definiendo con mayor precisión a los pacientes que requieren el uso de un campo ampliado de radiación que abarque la región paraaórtica, recomendado para las pacientes con resultados positivos8.
Motivados por esta situación, el grupo investigador ha querido implementar la clasificación quirúrgica en CCLA en el Instituto Nacional de Cancerología, en Bogotá (Colombia), y el objetivo de este artículo es describir la experiencia de las diez primeras pacientes sometidas a esta técnica y a la vez presentar una revisión de la literatura disponible.
Pacientes y métodosLos casos fueron definidos como mujeres con edad mayor a 18 años con diagnóstico confirmado histopatológicamente de CCLA, con adenomegalias pélvicas identificables en TAC con contraste sin compromiso ganglionar paraaórtico y que no hubieran recibido tratamientos previos para cáncer, con escala de funcionalidad Eastern Cooperative Oncology Group (ECOG) entre 0 y 1.
Se excluyeron: mujeres embarazadas; con presencia de hidronefrosis; falla renal; enfermedad recurrente o metastásica sistémica; antecedente de cirugía retroperitoneal pélvica, e índice de masa corporal mayor a 40. Las pacientes seleccionadas fueron clasificadas quirúrgicamente mediante LPEL en el Instituto Nacional de Cancerología, entre agosto y diciembre de 2016.
Búsqueda de literaturaSe llevó a cabo una búsqueda de la literatura en las bases de datos MEDLINE y EMBASE (19 de diciembre de 2016). Los términos para la construcción de la estrategia de búsqueda fueron elegidos del catálogo MeSH en MEDLINE y EMTREE en EMBASE. La estrategia de búsqueda utilizada en cada una de las bases de datos fue la siguiente: MEDLINE-OVID. (Lymph Nodes.mp. or Lymph Nodes/ OR Lymph Node Excision.mp. or Lymph Node Excision/) AND Uterine Cervical Neoplasms.mp. or Uterine Cervical Neoplasms/) AND (extraperitoneal.mp. EMBASE:’uterine cervix tumor’/exp AND (’lymph node excision’ OR’lymph node excision’/de) AND extraperitoneal. Además se utilizaron términos libres en la búsqueda.
Se excluyeron referencias publicadas antes de 1996 y escritos en idiomas diferentes al inglés o español.
La información fue seleccionada a partir de los títulos y los resúmenes por dos revisores de forma independiente; las diferencias fueron resueltas mediante consenso entre los dos revisores. Una vez finalizada la selección, los artículos fueron revisados en texto completo teniendo en cuenta los siguientes criterios: mujeres con diagnóstico CCLA y uso de LPEL para clasificación.
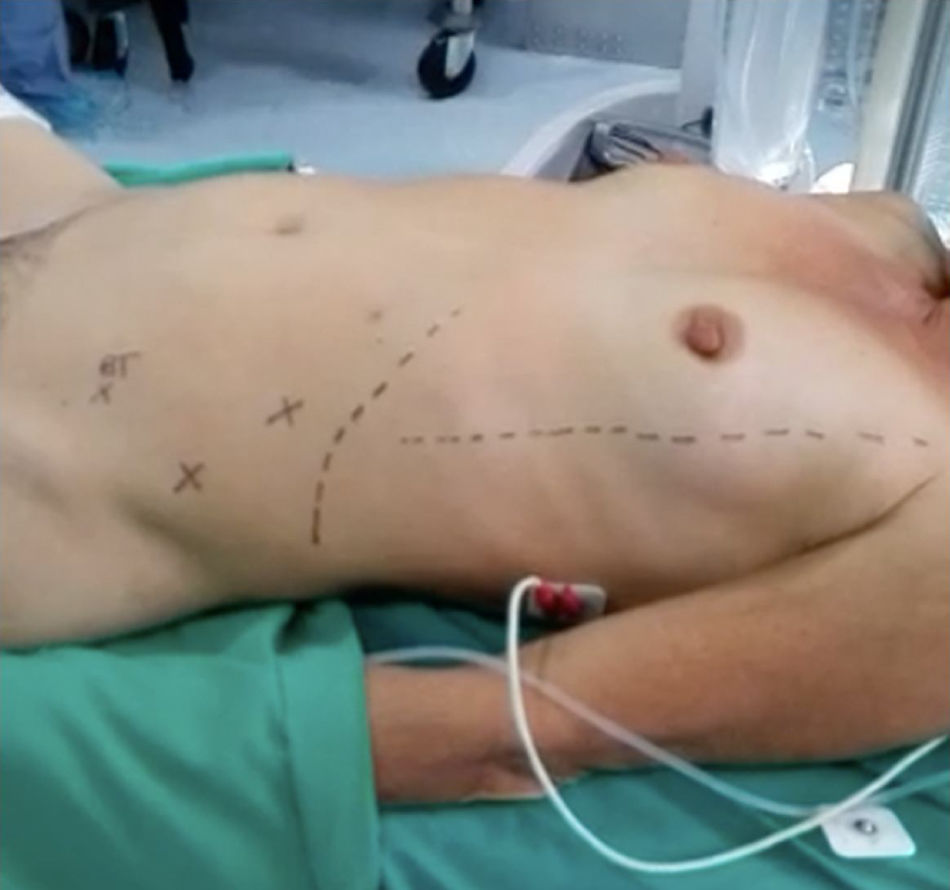
La técnica quirúrgica para LPEL que se utilizó en los casos en el Instituto Nacional de Cancerología da inicio desde que la paciente se encuentra posicionada en decúbito dorsal sobre la mesa quirúrgica, donde se coloca compresión neumática en miembros inferiores y administración de antibiótico profiláctico. Posterior a la inducción anestésica, el ginecólogo oncólogo encargado del procedimiento acomoda la paciente en posición de litotomía modificada con los brazos en aducción asegurados y se le coloca una sonda nasogástrica y se realiza una marcación abdominal con tinta indeleble (fig. 1); previa asepsia y antisepsia, se instala una sonda vesical de Foley y se colocan campos operatorios.
Se realiza un abordaje intraperitoneal con un trocar de 10mm umbilical para evaluar la cavidad pélvica y abdominal: si la cavidad abdominal se encuentra libre de enfermedad se procede a realizar una incisión en un área delimitada previamente a 2cm por encima de la espina ilíaca anterosuperior izquierda con línea medio clavicular izquierda y se realiza una disección de las estructuras de la pared abdominal hasta llegar al peritoneo parietal sin romperlo; el dedo índice izquierdo del cirujano se introduce en la incisión y libera el peritoneo de la superficie profunda de los músculos de la pared abdominal alcanzando el músculo psoas y más medialmente la arteria ilíaca común izquierda, creándose un espacio virtual entre el peritoneo y el músculo transverso del abdomen en el que se procede a colocar un trocar tipo Space Maker insuflado con aire el cual se utiliza como puerto visual; el peritoneo se desinfla mientras que el espacio extraperitoneal se insufla con CO2 hasta una presión máxima de 14mm de mercurio. A continuación se crean dos puertos adicionales para acomodar los instrumentos auxiliares: un trocar de 10mm más alto y posterior al primero (en la línea axilar media) a una distancia cefálica aproximada de 5cm del primero y a 3 o 4cm lateral al punto inicial; un trocar de 5mm en la línea axilar anterior aproximadamente a 3 o 4cm cefálico al segundo trocar de 10mm, por debajo del arco costal.
Antes de iniciar la disección se identifican: el músculo psoas izquierdo, el uréter izquierdo y la arteria ilíaca común izquierda. La disección se efectúa bilateralmente desde el nivel de la bifurcación de la aorta hasta el nivel de la vena renal izquierda; se envía el material extraído al servicio de patología debidamente rotulado para su procesamiento. Se revisa la hemostasia de los tejidos disecados y se procede a perforar el peritoneo a nivel de la gotera parietocólica izquierda con el fin de minimizar el riesgo de linfocele y bajo visión directa se extraen los trocares de los puertos utilizados.
En caso de observar un ganglio sospechoso, este se envía a patología para estudio por congelación y de confirmarse compromiso ganglionar metastásico se aborta el procedimiento.
Las incisiones de los trocares de 12mm y 10mm se cierran aproximando la fascia usando una sutura de 1-poliglactina (Vicryl) interrumpida y el sitio del puerto de 5mm y la piel de todos los puertos se cierran con prolene 3-0.
La paciente se traslada a recuperación de salas de cirugía sin sonda nasogástrica y con cateterización vesical; una vez recuperada del acto anestésico es conducida al servicio de hospitalización para su observación postquirúrgica hasta el momento del alta hospitalaria, manteniéndose con anticoagulación profiláctica en la hospitalización9–11.
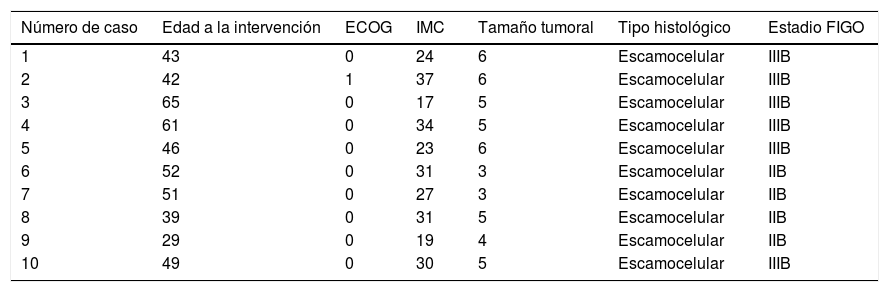
ResultadosCasosEntre agosto y diciembre de 2016 en el servicio de ginecología oncológica del Instituto Nacional de Cancerología fueron admitidas 36 pacientes con CCLA de las cuales se seleccionaron 10 con hallazgos imaginológicos en TAC de compromiso ganglionar pélvico sin compromiso paraaórtico y con ECOG <3 para clasificación quirúrgica con LPEL (tabla 1).
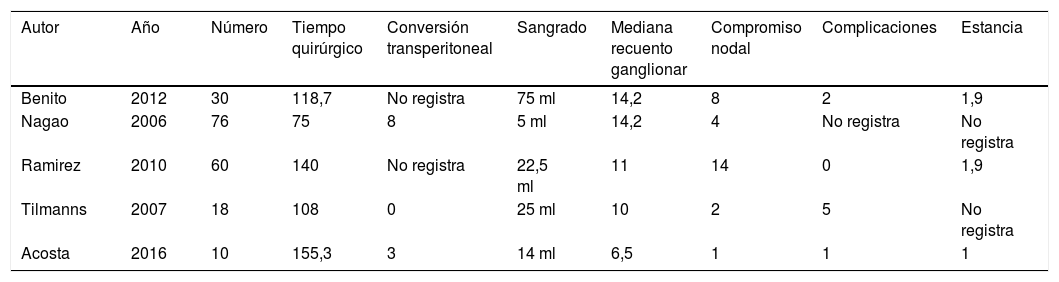
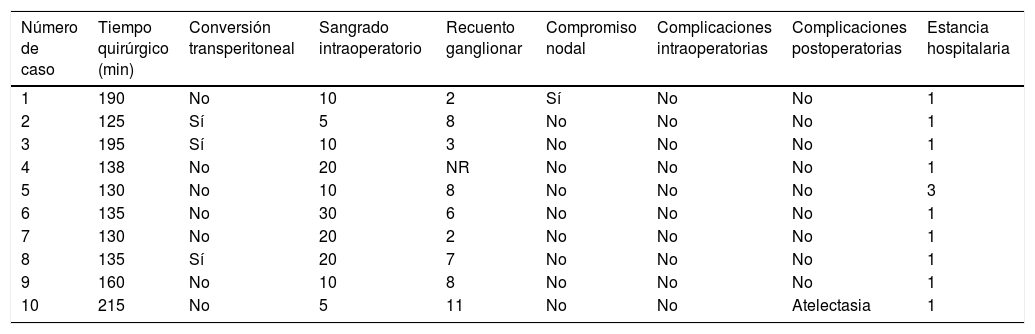
Los resultados en nuestras pacientes son equiparables a lo reportado en la literatura (tabla 2)7,9,12–18. La mediana de edad de los pacientes fue de 47,5 años (rango entre 29 y 65), el estadio FIGO entre IIB y IIIB y su estado funcional de acuerdo con el Eastern Cooperative Oncology Group (ECOG) estuvo entre 0 y 1. El índice de masa corporal (IMC) promedio de 27,3 (rango: 17-37). El tiempo quirúrgico promedio fue de 155,3 minutos (rango: 125 - 215). La mediana de recuento ganglionar 7 ganglios (rango 2-11). El compromiso nodal se identificó en una de las diez pacientes (10%). No hubo complicaciones intraoperatorias. El sangrado intraoperatorio promedio fue de 14 cc (rango 5-30cc) y el porcentaje de conversión a técnica laparoscópica transperitoneal fue de 30%. Solo se presentó una complicación postoperatoria correspondiente a atelectasia pulmonar y que requirió tres días de hospitalización. La mediana de la estancia hospitalaria fue de un día (rango: 1-3). Las características demográficas y clínicas de los casos son mostradas en la tablas 1 y 3.
Comparación con hallazgos en LPEL reportada en la literatura
| Autor | Año | Número | Tiempo quirúrgico | Conversión transperitoneal | Sangrado | Mediana recuento ganglionar | Compromiso nodal | Complicaciones | Estancia |
|---|---|---|---|---|---|---|---|---|---|
| Benito | 2012 | 30 | 118,7 | No registra | 75 ml | 14,2 | 8 | 2 | 1,9 |
| Nagao | 2006 | 76 | 75 | 8 | 5 ml | 14,2 | 4 | No registra | No registra |
| Ramirez | 2010 | 60 | 140 | No registra | 22,5 ml | 11 | 14 | 0 | 1,9 |
| Tilmanns | 2007 | 18 | 108 | 0 | 25 ml | 10 | 2 | 5 | No registra |
| Acosta | 2016 | 10 | 155,3 | 3 | 14 ml | 6,5 | 1 | 1 | 1 |
Características clínicas y clasificación de los pacientes
| Número de caso | Edad a la intervención | ECOG | IMC | Tamaño tumoral | Tipo histológico | Estadio FIGO |
|---|---|---|---|---|---|---|
| 1 | 43 | 0 | 24 | 6 | Escamocelular | IIIB |
| 2 | 42 | 1 | 37 | 6 | Escamocelular | IIIB |
| 3 | 65 | 0 | 17 | 5 | Escamocelular | IIIB |
| 4 | 61 | 0 | 34 | 5 | Escamocelular | IIIB |
| 5 | 46 | 0 | 23 | 6 | Escamocelular | IIIB |
| 6 | 52 | 0 | 31 | 3 | Escamocelular | IIB |
| 7 | 51 | 0 | 27 | 3 | Escamocelular | IIB |
| 8 | 39 | 0 | 31 | 5 | Escamocelular | IIB |
| 9 | 29 | 0 | 19 | 4 | Escamocelular | IIB |
| 10 | 49 | 0 | 30 | 5 | Escamocelular | IIIB |
Características operatorias de los pacientes
| Número de caso | Tiempo quirúrgico (min) | Conversión transperitoneal | Sangrado intraoperatorio | Recuento ganglionar | Compromiso nodal | Complicaciones intraoperatorias | Complicaciones postoperatorias | Estancia hospitalaria |
|---|---|---|---|---|---|---|---|---|
| 1 | 190 | No | 10 | 2 | Sí | No | No | 1 |
| 2 | 125 | Sí | 5 | 8 | No | No | No | 1 |
| 3 | 195 | Sí | 10 | 3 | No | No | No | 1 |
| 4 | 138 | No | 20 | NR | No | No | No | 1 |
| 5 | 130 | No | 10 | 8 | No | No | No | 3 |
| 6 | 135 | No | 30 | 6 | No | No | No | 1 |
| 7 | 130 | No | 20 | 2 | No | No | No | 1 |
| 8 | 135 | Sí | 20 | 7 | No | No | No | 1 |
| 9 | 160 | No | 10 | 8 | No | No | No | 1 |
| 10 | 215 | No | 5 | 11 | No | No | Atelectasia | 1 |
En el Instituto Nacional de Cancerología en el 2013 se presentaron un total de 711 nuevos casos de cáncer de cuello uterino de los que 540 pacientes se diagnosticaron en estadios localmente avanzados1,2.
El compromiso ganglionar en CCLA tiene un patrón de diseminación secuencial iniciando en la región pélvica y continuando en la región paraaórtica. En CCLA el riesgo de metástasis a ganglios linfáticos paraaórticos varía en un rango de 15% a 38% al momento del diagnóstico19,20. De acuerdo con la FIGO la estadificación de la enfermedad continúa haciéndose exclusivamente con la información clínica. Sin embargo, dado que el compromiso ganglionar paraaórtico impacta en el pronóstico oncológico12,20 y amerita un tratamiento diferente cada vez es más necesaria la realización de estudios complementarios que permitan mejorar la clasificación de las pacientes y escoger para ellas el mejor tratamiento disponible.
Los métodos imaginológicos habitualmente realizados en este grupo de pacientes corresponden a la tomografía axial computarizada (TC) y la resonancia magnética (RM); sin embargo, ninguno de los métodos de imágenes actualmente disponibles ha demostrado ser particularmente sensible en la detección del compromiso ganglionar linfático paraaórtico21. La sensibilidad de la TC y la RM en general está por debajo del 50% al 60%, siendo para estos métodos el tamaño ≥ a 10mm el único criterio para diagnóstico, lo que resulta en una difícil identificación de metástasis de menor tamaño22; la TC tiene una sensibilidad de solo 67% y aunque la RM puede tener un buen desempeño en la detección de la invasión parametrial, vesical y rectal de los tumores cervicales primarios, su desempeño es deficiente en la detección de metástasis ganglionares. Scheidler et al. informaron una sensibilidad general de la RM del 38% y las tasa de falsos negativos reportada para estos estudios oscila entre el 20% y el 30%12.
Actualmente, PET–CT con 18F-FDG es el mejor método de imagen para detectar ganglios linfáticos1,12. Sin embargo, la sensibilidad y la especificidad de este para detectar compromiso metastásico paraaórtico en pacientes con TC o RM negativa para este hallazgo son 36% y 96% respectivamente, mientras que los valores predictivo positivo y negativo de PET-CT para metástasis paraaórticas son de 71% y de 83%. En pacientes con PET-CT positivo para compromiso ganglionar pélvico la sensibilidad y la especificidad para detección de compromiso para-aórtico son de 45% y de 91% con un valor predictivo positivo de 71% y uno negativo del 78%9. Por lo tanto, aunque el PET tiene un rendimiento diagnóstico superior a la TC, 16% a 32% de las pacientes con metástasis en los ganglios linfáticos paraaórticos se clasificarán incorrectamente como ganglios negativos21.
Teniendo en cuenta las implicaciones de un tratamiento incompleto en la tasa de supervivencia de pacientes con ganglios linfáticos histológicamente positivos y en un intento de no tratar de forma insuficiente los pacientes con PET falsamente negativo, se planteó ampliar profilácticamente el campo de radiación para incluir estas cadenas ganglionares. Sin embargo, esta es una medida que no carece de morbilidad adicional puesto que el riesgo de toxicidad grado 3 o 4 con radioterapia de campo extendido se aproxima al 15%21.
Estudios recientes han demostrado que la estadificación quirúrgica de las pacientes con cáncer cervical localmente avanzado puede conducir a una modificación del tratamiento en el 18% a 44% de los pacientes9, pese a esto el enfoque quirúrgico ideal sigue siendo difícil de alcanzar y la estadificación abdominal abierta ha sido prácticamente abandonada como resultado de un alto costo y morbilidad. Actualmente se prefiere un abordaje mínimamente invasivo en los procedimientos de estadificación a fin de lograr una menor morbilidad a la observada por laparotomía, la linfadenectomía paraaórtica se puede realizar por técnica transperitoneal o extraperitoneal9,23,24, siendo esta última la más aceptada ya que es quirúrgica, anatómicamente más lógica, técnicamente más fácil y presenta tasas de complicaciones muy bajas (menos del 4%), con disminución de la posibilidad de adherencias postoperatorias lo que puede tanto reducir el riesgo de complicaciones relacionadas con la radiación como evitar la entrada a la cavidad peritoneal eliminando el riesgo de eventos adversos como: el íleo postoperatorio, las adherencias intraperitoneales y la obstrucción intestinal 15,25.
En cuanto a la técnica quirúrgica el procedimiento se divide en dos tipos con respecto al centro de la aorta: linfadenectomía paraaórtica derecha e izquierda. La derecha se realiza disecando los ganglios linfáticos del área precava y paracava hasta el nivel de origen de la vena ovárica derecha en la vena cava inferior (VCI) o en la vena renal derecha; la izquierda se realiza disecando los ganglios linfáticos en la aorta desde el nivel de bifurcación hasta la vena renal izquierda25.
La disección paraaórtica izquierda es la más importante ya que hasta el 72% de los ganglios involucrados en el cáncer de cérvix se encuentran de este lado de la aorta, empero la disección del lado derecho es mandatoria11. Dargent et al. informaron de su experiencia con linfadenectomía paraaórtica transperitoneal, bilateral extraperitoneal y laparoscópica extraperitoneal izquierda con tasas de éxito del 78%, 93% y 95%, respectivamente; con la laparoscópica extraperitoneal izquierda el número medio de ganglios aórticos resecados fue de 15 y el tiempo operatorio se acortó significativamente11,12.
En nuestra experiencia la LPEL se realiza de forma bilateral con vía de abordaje izquierda lo que la hace técnicamente más difícil. El nivel superior de la disección en pacientes con cáncer de cuello uterino sigue siendo un tema de debate, al ubicarse entre la arteria mesentérica inferior (AMI), la vena gonadal derecha y la vena renal izquierda, esto a razón de la teoría de la metástasis de omisión donde la enfermedad puede propagarse a través del tronco linfático cervical posterior a los ganglios linfáticos paraaórticos, como se ha propuesto en los estudios de Gil-Moreno y Michel et al.19,26,27.
La LPEL se asocia a tasas relativamente bajas de complicaciones intraoperatorias, que oscilan entre el 3% y el 4%, siendo la lesión vascular menor la más frecuente (1,6%), seguida de: las lesiones intestinales (1,2%), la conversión a laparotomía (0,4%) y el hematoma retroperitoneal (0,8%) 6,15. Las tasas de complicaciones postoperatorias publicadas oscilan entre 6% y 13%, siendo la más importante la formación de linfocele (6,3%), las disestesias (2,5%), y las hernias en puertos de trocar (0,4%)6,15,28.
En la serie de casos presentados el porcentaje de conversión a linfadenectomia trasnsperitoneal fue del 30%, cercano al 21% reportado por Ramírez et al. en los pacientes en los que se intentó linfadenectomía por vía extraperitoneal bilateral y al 14% de los pacientes en los que se intentó linfadenectomía por vía extraperitoneal izquierda12.
Para el Instituto Nacional de Cancerología es importante desarrollar este tipo de técnicas con el objeto de proporcionar así una mejor clasificación a nuestras pacientes y por lo tanto una mejor supervivencia global. Esta serie de casos corresponde únicamente al reporte de la implementación de una nueva técnica quirúrgica que por ahora no mide el impacto de este procedimiento en los desenlaces oncológicos de nuestras pacientes. Es importante desarrollar estudios aleatorizados controlados que comparen la clasificación quirúrgica de las pacientes con carcinoma de cuello uterino localmente avanzado con las técnicas imaginológicas usadas actualmente como el PET-CT y así medir el impacto sobre la supervivencia global y la calidad de vida.
En conclusión, la LPEL es una técnica factible que combina los beneficios de la cirugía mínimamente invasiva con el abordaje retroperitoneal, teniendo en cuenta que el diagnóstico histológico es el estándar de oro para determinar el compromiso ganglionar linfático y sabiendo las tasas de falsos negativos del 18-FDG PET/CT así como las dificultades en el acceso a esta tecnología en nuestra población; el enfoque quirúrgico proporciona un medio para diagnóstico de pacientes con metástasis subclínicas para la planificación individualizada del tratamiento con radioterapia con campo extendido en pacientes con CCLA.
Pese a que la técnica minimiza los riesgos conocidos del abordaje por laparotomía, que es factible y segura, existen muchas barreras a superar tanto en el campo quirúrgico, la curva de aprendizaje como la técnica dado que la literatura muestra únicamente ensayos clínicos controlados con pequeños tamaños de muestra8,9,17,20, por lo que se abre la posibilidad de la realización de estudios más grandes que evalúen el impacto que pueda tener la estadificación quirúrgica mediante esta técnica en la supervivencia de las pacientes con cáncer de cuello uterino localmente avanzado.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.