Determinar cuáles son los desenlaces clínicos empleados en los estudios faseIII de tratamiento de neoplasias hematoncológicas y qué proporción de ellos emplean supervivencia global como desenlace primario.
MétodoMediante una búsqueda en Pubmed, analizar todos los experimentos clínicos aleatorios publicados en los últimos 10años, de tratamientos de novo, en población adulta.
ResultadosLa búsqueda inicial arrojó 310 referencias, entre las que se seleccionaron 90 estudios clínicos. La enfermedad más estudiada fue mieloma múltiple, con 29 estudios, seguida de linfoma no Hodgkin, con 26. Las otras fueron: leucemia mieloide aguda (12), leucemia linfocítica crónica (10), leucemia mieloide crónica (8), síndromes mielodisplásicos (3) y linfoma de Hodgkin (2). En 20 estudios (22%) se empleó la supervivencia global como desenlace primario (en solo 3 de ellos alcanzó significación estadística), en 37 más (41%) se agrupó con otros desenlaces para conformar un desenlace compuesto. En 55 estudios (61%) la supervivencia global fue un desenlace secundario.
ConclusionesAunque la supervivencia global es el estándar de oro en terapia oncológica, los desenlaces agrupados u otros, como tiempo libre de enfermedad o indicadores paraclínicos de actividad de la enfermedad, son más empleados, quizá por ser buenos predictores y requerir muestras y seguimientos menores. Su capacidad para predecir supervivencia global (en algunos casos calidad de vida) debe ser validada. Solo en las formas más agresivas de cáncer se justifica usar de rutina la supervivencia global como el desenlace primario.
To describe the clinical outcomes used in phaseIII studies in Hematology-Oncology malignancies, and to determine what proportion use overall survival as the primary outcome.
MethodsUsing a systematic literature search in PubMed, an analysis was made of phaseIII randomized clinical trials with de novo treatments of hematology-oncological neoplasias in adult populations published in the last 10years.
ResultsThe initial search yielded 310 references, 90 of which were finally selected. The overall survival rate was used in 20 studies (22%) as the primary outcome (in 3 of them it reached statistical significance). Grouped intermediate outcomes were used in 37 others (41%). As a secondary outcome the overall survival rate was used in 55 studies (61%). Among the intermediate outcomes used were, response rates, disease-free or relapse-free survival rates, and progression-free survival rate. Multiple myeloma was the most studied disease, with 29 studies (32%), followed by non-Hodgkin lymphoma (28%).
ConclusionsAlthough overall survival rate is the gold standard in cancer therapy, it is not the most often used outcome. Intermediate outcomes, such as disease-free survival or biomarkers are often good predictors, and require smaller samples and less follow-up time. Nevertheless, their predictive capacity for overall survival rate (or, in some cases, quality of life) should also be assessed. The use of the overall survival rate as the routine primary outcome is only justified in the most aggressive forms of cancer.
El estudio de los desenlaces de las intervenciones en salud se ha convertido en un tema de gran interés1. De hecho, toda una nueva disciplina denominada «investigación de resultados» (outcomes research) ha surgido alrededor de la necesidad de describir, interpretar y predecir el impacto de las intervenciones en salud, en unidades que sean clínicamente significativas, que sean comparables de una intervención a otra, y que sean relevantes para los tomadores de decisiones (desde pacientes hasta pagadores de servicios)2. Se pueden distinguir desenlaces biomédicos, clínicamente evaluables, y no-biomédicos, como son los desenlaces económicos y los relacionados con las percepciones de los pacientes3.
Adicionalmente existen desenlaces finales —también llamados fuertes—, como la reducción en mortalidad o supervivencia libre de enfermedad, y los desenlaces intermedios y clínicos. Los marcadores biológicos y la reducción macroscópica de tumores son, respectivamente, algunos ejemplos. Los desenlaces clínicos se definen como aquellos indicadores utilizados en investigación clínica enfocados en el paciente (funcionalidad, sentimientos y modo de supervivencia)4.
El desarrollo de la investigación en desenlaces en oncología se ha dispuesto en un modelo con 3 enfoques: macronivel, el cual analiza a nivel poblacional aspectos relacionados con la calidad de vida asociada a estados de salud y carga económica; mesonivel, que incluye desde estudios que miden eficacia y efectividad de las intervenciones en cáncer hasta evaluaciones económicas, y micronivel, donde se enfatiza en la interacción médico-paciente durante la toma de decisiones y el uso de herramientas para definir perfiles de riesgo5.
Muchos de los estudios a largo plazo en oncología buscan modificar la mortalidad general (o su inverso, la supervivencia global) de los pacientes tratados3. Hay, sin embargo, numerosas razones prácticas para que los estudios clínicos busquen otros desenlaces «intermedios», que pueden ser signos clínicos o paraclínicos (por ejemplo, mediante imágenes diagnósticas, resultados de patología o pruebas inmunológicas)6. Entre las razones para usar desenlaces intermedios está el hecho de que el tamaño de la muestra y el tiempo de seguimiento necesarios para demostrar cambios estadísticamente significativos sobre la mortalidad general son mucho mayores que si se plantean desenlaces intermedios7. Además, en muchos de los estudios clínicos, por razones éticas, los pacientes asignados al «grupo control» también terminan recibiendo la intervención de interés una vez se demuestra su superioridad terapéutica. Ello lleva a que las diferencias de supervivencia global desaparezcan o se reduzcan, y a que se incentive la búsqueda de predictores de mortalidad antes de que el desenlace sea inevitable8. A pesar de estas ventajas, los desenlaces intermedios reflejan un beneficio indirecto de las terapias utilizadas en los estudios clínicos, mientras que los desenlaces fuertes o clínicamente importantes son una medida directa9. Para la validación de un desenlace intermedio en la práctica clínica, debe existir evidencia de que este predice el efecto de la intervención terapéutica sobre desenlaces fuertes o clínicamente importantes, y que este efecto debe ser mediado directamente por el desenlace intermedio10.
La supervivencia global, definida como el tiempo desde el momento de la aleatorización hasta la muerte por cualquier causa, sigue siendo el desenlace fuerte estándar de oro en investigación clínica en oncología11. Una de las desventajas de este desenlace, además de las ya mencionadas anteriormente, es la imposibilidad de evaluar discriminadamente el efecto de terapias de segunda línea. Con el desarrollo de nuevas tecnologías los desenlaces intermedios aprobados por la FDA en oncología para sustituir la supervivencia global se posicionan como indicadores de efectividad en los protocolos de aprobación de las agencias encargadas del control de medicamentos.
El propósito de este trabajo fue revisar cuáles son los desenlaces primarios y secundarios empleados en los estudios clínicos en hematoncología, y en cuántos de ellos se empleó la supervivencia global como el desenlace principal.
Materiales y métodosSe realizó una revisión bibliográfica a través del motor de búsqueda Pubmed de la US National Library of Medicine (MEDLINE) con los siguientes términos MESH, utilizando entre ellos el conector booleano «OR»: «Neoplasms, Plasma Cell»[Mesh], «Leukemia»[Mesh] y «Lymphoma»[Mesh]. La búsqueda se limitó con los siguientes filtros: experimentos clínicos faseIII, que buscaran determinar la efectividad de uno o más medicamentos oncológicos, publicados en los últimos 10años y en población mayor de 18años.
Dos investigadores independientes realizaron la selección por título y resumen de los artículos teniendo en cuenta los siguientes criterios de inclusión:
- -
Experimentos clínicos aleatorizados.
- -
Neoplasias hematopoyéticas: linfoma, leucemia, mieloma múltiple o síndrome mielodisplásico.
- -
Población mayor de 18años.
- -
Patologías de novo, sin tratamiento previo.
- -
Experimentos que evaluaran terapias, ya sea de inducción o de mantenimiento.
Adicionalmente se excluyeron los estudios de análisis secundarios de estudios clínicos, en los cuales se analizaban patologías secundarias o los que se concentraban exclusivamente en efectos adversos. En casos de divergencia se realizó una evaluación conjunta por parte de todos los investigadores.
Para la recolección de datos se tuvieron en cuenta las variables: edad, sexo, tipo de cáncer, intervenciones evaluadas, tiempo de seguimiento, desenlaces primarios, desenlaces secundarios, año de publicación y revista. Para la descripción de los resultados se utilizaron tablas de frecuencias, proporciones y porcentajes. La información se recogió en una hoja de Excel prediseñada con este fin. Se hizo sobre esta base de datos un análisis estadístico descriptivo de los hallazgos.
Este trabajo es considerado una investigación sin riesgo por su naturaleza de investigación secundaria, en el que no se hace alguna manipulación intencionada de las variables biológicas, fisiológicas, sicológicas o sociales de individuos.
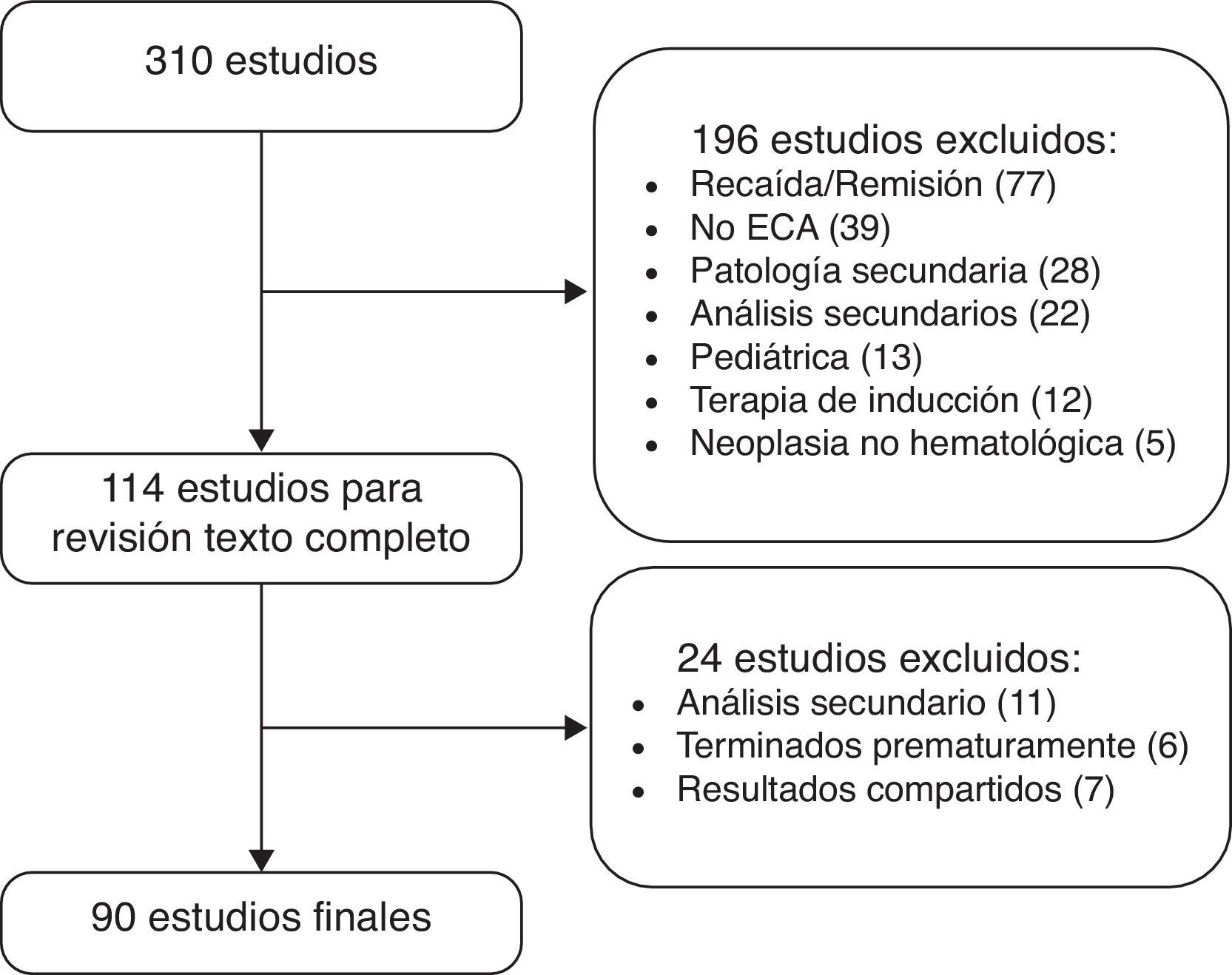
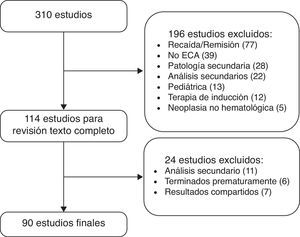
ResultadosLa figura 1 muestra el proceso de selección de los artículos que conformaron la muestra final de análisis. La enfermedad más estudiada en estos 90 estudios fue mieloma múltiple, con 29 estudios clínicos, seguida de linfoma no Hodgkin, con 26. Las otras fueron: leucemia mieloide aguda (12), leucemia linfocítica crónica (10), leucemia mieloide crónica (8), síndromes mielodisplásicos (3) y linfoma de Hodgkin (2). Los estudios de mieloma múltiple incluyeron un total de 12.047 pacientes: los de linfoma no Hodgkin, 11.135; leucemia mieloide aguda, 4.795; leucemia linfocítica crónica, 3.170; leucemia mieloide crónica, 4.050; síndromes mielodisplásicos, 721, y linfoma de Hodgkin, 3.036. En total, los 90 estudios analizaron 39.134 pacientes.
En total, se emplearon 6 desenlaces primarios. El más común de ellos, empleado en 50 estudios (56%), fue un desenlace compuesto, que agrupaba supervivencia libre de eventos, enfermedad libre de progresión, enfermedad libre de recaída y, en algunos casos, «falla al tratamiento». El segundo desenlace más utilizado en orden de frecuencia fueron las tasas de respuesta (compuesta en unos casos por tasas de respuesta citogenética, en otras respuesta molecular, dividida usualmente en completa o parcial) en 31 estudios (34%). La supervivencia global como desenlace primario se empleó en 20 estudios (22%). Los otros desenlaces primarios fueron tasa de infección en uno (1%) y seguridad del medicamento en uno (1%).
Al analizar los 20 estudios que usaron supervivencia global como desenlace principal, la mediana de las medianas de seguimiento fue de 47,5meses, con un rango de 19,1 y 90meses. Tan solo en 3 estudios (en mieloma múltiple, linfoma no Hodgkin y leucemia mieloide aguda) las diferencias encontradas fueron estadísticamente significativas.
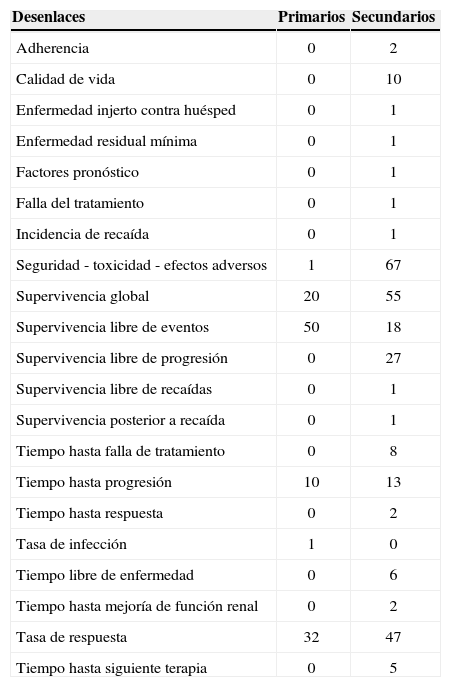
La tabla 1 muestra los desenlaces primarios y secundarios empleados en los estudios. En los desenlaces secundarios hubo aún más variabilidad. En total se emplearon 21 desenlaces diferentes; el más común fue la seguridad, que se evaluó como desenlace en 67 estudios (7%), seguida de la supervivencia global, que se consideró como tal en 55 estudios (61%).
Desenlaces primarios y secundarios empleados en los 90 estudios clínicos analizados12-101
| Desenlaces | Primarios | Secundarios |
|---|---|---|
| Adherencia | 0 | 2 |
| Calidad de vida | 0 | 10 |
| Enfermedad injerto contra huésped | 0 | 1 |
| Enfermedad residual mínima | 0 | 1 |
| Factores pronóstico | 0 | 1 |
| Falla del tratamiento | 0 | 1 |
| Incidencia de recaída | 0 | 1 |
| Seguridad - toxicidad - efectos adversos | 1 | 67 |
| Supervivencia global | 20 | 55 |
| Supervivencia libre de eventos | 50 | 18 |
| Supervivencia libre de progresión | 0 | 27 |
| Supervivencia libre de recaídas | 0 | 1 |
| Supervivencia posterior a recaída | 0 | 1 |
| Tiempo hasta falla de tratamiento | 0 | 8 |
| Tiempo hasta progresión | 10 | 13 |
| Tiempo hasta respuesta | 0 | 2 |
| Tasa de infección | 1 | 0 |
| Tiempo libre de enfermedad | 0 | 6 |
| Tiempo hasta mejoría de función renal | 0 | 2 |
| Tasa de respuesta | 32 | 47 |
| Tiempo hasta siguiente terapia | 0 | 5 |
La importancia de la mejoría en la supervivencia global, como un objetivo central de las terapias farmacológicas en hematoncología, se corrobora al observar que casi todos los estudios clínicos (5 de cada 6) la incluyen como uno de los desenlaces a medir; sin embargo, este tipo de desenlace se incluyó como desenlace secundario en la mayoría de los estudios revisados (61%). La razón podría ser la dificultad para encontrar diferencias estadísticamente significativas (solo 3 de los 20 estudios que consideraron supervivencia global como desenlace principal en esta revisión lograron encontrarla).
El uso de desenlaces intermedios o subrogados en investigación clínica se puede justificar por varias razones. De hecho, en 1992 la FDA modificó las normas de aceptación de estudios clínicos en enfermedades que amenazan la vida, como cáncer o VIH/sida102. Antes de esa normatividad, se esperaba que los estudios clínicos en cáncer modificaran la supervivencia global. Los primeros desenlaces intermedios en ser aceptados fueron supervivencia libre de enfermedad, en cáncer tratado quirúrgicamente, y tasa de respuesta completa en leucemias102.
Aunque hay una estrecha correlación entre supervivencia libre de enfermedad y supervivencia global103,104, la supervivencia global sigue siendo el estándar de oro en estudios clínicos: su importancia es inobjetable, y su medición no depende para nada en interpretación por parte del investigador. Este desenlace tiene varios inconvenientes, como requerir un tamaño de muestra mayor así como más tiempo de seguimiento de los pacientes. Esa demora, que puede ser de años, lleva a que haya un número importante de sujetos que no se beneficien de la terapia, y a que los desarrolladores vean transcurrir el tiempo de la patente, lo que reduce sus márgenes de ganancia.
Saad et al.105, por ejemplo, analizaron 76 estudios clínicos en cáncer de seno avanzado y encontraron que en solo 15 de ellos (20%) se lograba demostrar un aumento estadísticamente significativo en supervivencia global. Una razón, según ellos, es que por razones éticas las pacientes del grupo control suelen también recibir el medicamento que muestra mayor efectividad, contaminando los resultados. Ellos resaltan también que en formas menos agresivas de cáncer las diferencias significativas serían aún más difíciles de demostrar.
Este estudio tiene como limitación haber revisado solo una base de datos y de tan solo hacerse la búsqueda mediante palabras clave (términos MeSH), y haber mezclado enfermedades oncológicas tan diversas como mieloma múltiple, leucemias y linfomas. La extrapolación de los resultados a los estudios en otras formas de cáncer también puede ser limitada.
En conclusión, el empleo de desenlaces intermedios es una práctica común. Estos desenlaces son a veces específicos para cada tipo de enfermedad neoplásica, lo que hace difícil establecer comparaciones entre ellas. Es esencial, sin embargo, que un desenlace «intermedio» tenga una correlación clara, ya sea con la supervivencia global o con la calidad de vida del paciente1,6,105. A medida que mejora la supervivencia de los pacientes con cáncer, los desenlaces intermedios se van haciendo más útiles, y el uso de supervivencia global como desenlace primario se ha ido reservando a las formas más agresivas de la enfermedad, o a aquellos tratamientos que tienen ya seguimiento de muchos años.
FinanciaciónEste trabajo recibió el apoyo económico de Biotoscana.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.