Identificar aquellos factores que impactan en la respuesta terapéutica para alcanzar una segunda remisión (2RC) en pacientes con leucemia aguda linfoblástica (LAL) en recaída.
MétodosEstudio observacional y analítico anidado en una cohorte retrospectiva de adultos (>18 años) portadores de LAL que fueron atendidos durante 2008-2014 y que interrumpieron el protocolo HGMLAL07 al detectarse recaída e iniciaron otro esquema.
ResultadosSe estudiaron 69 pacientes y el 62,3% (n=43) correspondía a hombres. La media de edad fue de 29 años. Los regímenes terapéuticos empleados fueron: alta intensidad (55,1%) [Hyper-CVAD (n=34), IDA-Flag (n=1), mitoxantrona-DARAC (n=3)], moderada intensidad (4,3%) [Esquemas de reinducción (n=3)] y tratamiento paliativo de baja intensidad con soporte transfusional (40,6%, n=28).
Solo 19 pacientes (27,5%) integraron una 2RC. La media de supervivencia fue 120 (2- 575) días y el 29% sobrevivió al año de seguimiento. El uso de un segundo régimen intensivo o moderado no brindó ventaja sobre el esquema conservador (prueba log-Rank, p=0,812). Ninguna variable demostró valor pronóstico sobre la supervivencia a 1 año.
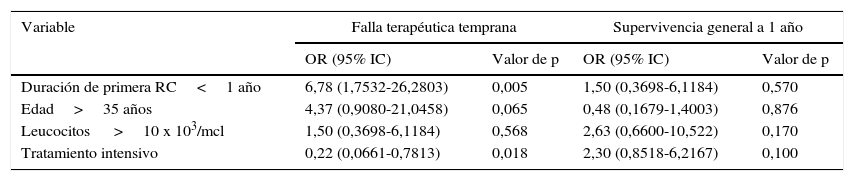
La duración de la primera RC (OR 6,78, p=0,005, 95% IC: 1,7532-26,2803) y recibir un primer tratamiento intensivo (OR 0,22, p=0,018, 95% IC: 0,0661-0,7813) fueron variables pronósticas de falla terapéutica para alcanzar la 2RC.
ConclusionesPoseer una primera RC<1 año fue un factor de riesgo importante para no integrar una 2RC. No se identificaron factores pronósticos de supervivencia ni superioridad de alguno de los esquemas de rescate empleados.
To identify those factors that affect therapeutic response to achieve a second remission (2RC) in patients with acute lymphoblastic leukaemia (ALL) in relapse.
MethodsObservational, descriptive and analytical study nested in a retrospective cohort of adults (> 18 years-old) ALL carriers treated during the period from 2008 to 2014 that disrupted the HGMLAL07 protocol when relapse was detected and began another therapeutic scheme.
ResultsThe study included 69 patients, of whom 62.3% (n=43) were males, and the mean age was 29 years-old. The therapeutic regimens used were: high intensity (55.1%) [Hyper-CVAD (n=34), IDA-Flag (n=1), mitoxantrone-DARAC (n=3)], moderate intensity (4.3%) [Re-induction schemes (n=3)], and palliative treatment of low intensity with transfusion support (40.6%, n=28).Only 19 patients (27.5%) achieved a 2RC. The median overall survival was 120 (2- 575) days, 29% of patients were alive at one year. Using a high or moderate intensity regime as the rescue scheme gave no advantage over the conservative one (log-rank test, P=.812). None of the variables showed prognostic value of survival at one year. The duration of the first RC (OR 6.78, P=.005, 95% CI; 1.75 - 26.28) and receiving high intensity treatment (OR 0.22, P=018, 95% CI: 0.06 - 0.78) were predictors of treatment failure to achieve 2RC.
ConclusionsTo achieve a first RC<1 year was an important risk factor for not achieving a 2RC. No prognostic factors for survival were identified. None of the schemes used for rescue showed superiority.
La leucemia aguda linfoblástica (LAL) es una neoplasia caracterizada por una proliferación descontrolada de precursores linfoides B o T, cuyo tratamiento requiere dosis secuenciales de quimioterapia, inmunoterapia, anticuerpos monoclonales y trasplante de progenitores hematopoyéticos1. En adultos, a pesar de que las tasas de remisiones completas (RC) son en general por encima del 85%, la supervivencia global a 3 años continúa siendo alrededor del 30-40%2,3. A pesar de la incorporación a la quimioterapia de fármacos innovadores altamente dirigidos (dasatinib, nilotinib o rituximab), la tasa de recaídas es de alrededor del 50% durante el primer año de tratamiento, siendo en su mayoría asociadas a alteraciones citogenéticas específicas de mal pronóstico [t(4;11)/ALL1-AF4, t (1;19)/PBX-E2A, t(9;22)/BCR-ABL1, t(1;19)/ E2A-PBX] o a la falta de respuesta durante las primeras 4 semanas de reinducción4–7. El protocolo MRC UKALL/ECOG E2993 que consideró más de 1.500 pacientes, identificó los siguientes factores independientes que influyeron sobre la supervivencia libre de enfermedad: la citogenética, el inmunofenotipo, la edad y la cuenta de leucocitos al diagnóstico. De esta última, la cifra de corte con implicaciones pronósticas fue de 30 x 109/L para el linaje B y de 100 x 109/L para el T3. Dicha cifra de leucocitos se ha validado en otras poblaciones que han utilizado el esquema MRC UKALL/ECOG E29938. Larson et al. también consideraron dicha cifra de leucocitos para determinar los grupos de riesgo para los protocolos terapéuticos del Cancer and Leukemia Group B (CALGB) extendiéndolo a la mayoría de sus ensayos9.
Debido a que la supervivencia continúa siendo pobre posterior a una recaída, diversos autores han intentado identificar factores clínicos y biológicos que puedan influenciar en la respuesta. Fielding et al., basándose en la cohorte del MRC UKALL/ECOG, identificaron que la media de supervivencia posterior a una recaída es de alrededor de un año por lo que el trasplante de progenitores hematopoyéticos es la única opción curativa para estos pacientes10.
En un primer registro en el Hospital General de México se identificó que únicamente el 15% de los pacientes en recaída lograron integrar una segunda remisión completa (2RC) presentando una mortalidad en inducción cercana al 42%11. Enciso et al. en Colombia describe una situación similar al emplear el esquema IDA FLAG en pacientes refractarios o en recaída de donde se obtuvo una mediana de supervivencia de 175 días y se concluyó la imperiosa necesidad de aumentar el número de trasplantes de médula ósea para estos pacientes12.
El objetivo de este estudio fue identificar aquellos factores que impactan en la respuesta terapéutica para alcanzar una segunda remisión en pacientes con LAL en primera recaída, y como objetivo secundario identificar la mejor conducta terapéutica en estos casos.
MetodologíaDiseño del estudioEstudio observacional y analítico anidado en una cohorte retrospectiva de pacientes portadores de LAL atendidos en el Hospital General de México con el protocolo institucional de primera línea en adultos HGMLAL0713 desde junio del 2008 a mayo del 2014.
Criterios de selecciónSe estudiaron pacientes mayores de 18 años diagnosticados con LAL en primera recaída mediante morfología e inmunofenotipo, considerándose a esta como a la presencia de>5% de blastos en cualquier momento del tratamiento. Fueron recabados los perfiles bioquímico-hematológicos de los pacientes al momento del diagnóstico y al ocurrir la primer recaída. Se excluyeron: mujeres embarazadas, casos con recaída inicial a sistema nervioso central y posteriormente a médula ósea, así como pacientes con recaídas múltiples. La falla terapéutica temprana fue definida como una respuesta insatisfactoria (progresión de la enfermedad) al tratamiento durante las primeras 4 semanas de iniciado el esquema.
TratamientoTodos los pacientes recibieron en primera instancia el protocolo HGMLA07 para lograr la primera remisión. Este protocolo institucional se fundamenta en el ampliamente conocido protocolo GIMEMA ALL0288 con cuatro etapas secuenciales: preinducción (prednisona), inducción a la remisión (daunorrubicina, vincristina y prednisona), consolidación (doxorrubicina, vincristina, prednisona, metotretate, etopósido y citarabina, además de aplicación intratecal de metotrexate, citarabina y dexametasona como profilaxis para sistema nervioso central) y mantenimiento (6-mercaptopurina y metotrexate)13,14. Una vez ocurrida la recaída, este se suspendía y se iniciaba un segundo esquema. Para el análisis se clasificó a los pacientes en aquellos que recibieron tratamiento intensivo (Hyper-CVAD15, IDA-FLAG [idarrubicina, fludarabina, citarabina, factor estimulante de granulocitos]16, esquema institucional 2-3-5 [mitoxantrona 12mg/m2 días 1 y 2, etopósido 150mg/m2 días 1-3, citarabina 100mg/m2 días 1-5])11, tratamiento intermedio (reinducción con daunorrubicina 60mg/m2, vincristina 1mg/m2 a un máximo de 2mg plus prednisona o dexametasona) o un tratamiento de baja intensidad con base en una modificación del esquema ambulatorio denominado CVBP (ciclofosfamida 350mg/m2, vincristina 0.8mg/m2, bleomicina 10 UI durante el día 1 plus prednisona 60mg/m2 días 1-5)17 con soporte transfusional. Debido a la naturaleza retrospectiva de esta investigación no se tuvo ningún control ni criterios unificados para la elección del segundo esquema, siendo el médico tratante quien tomaba la elección en previo acuerdo con el paciente. Ningún paciente incluido fue sometido a trasplante de médula ósea.
Clasificación de riesgoTodo paciente fue considerado con riesgo habitual y como de riesgo alto aquellos que tuvieran al menos una de las siguientes características: edad>35 años; cifra de leucocitos>30 x 103/mcL para linajes B y>100 x 103/mcL para linajes T; remisión completa hasta después de las 4 semanas; infiltración a sistema nervioso central; inmunofenotipo con estirpe B madura; expresión del transcrito BCR/ABL4,18.
Consideraciones éticasEl protocolo de cohorte retrospectiva fue revisado y aprobado por el Comité de Ética e Investigación del Hospital General de México, bajo el registro: DI/14/103/03/073. El acceso y el uso de los registros médicos se apegó a la normativa vigente en territorio mexicano, concordante a las recomendaciones internacionales.
Análisis estadísticoSe utilizó el software estadístico IBM SPSS versión 22.0 para Windows (Armonk: New York, IBM Corp). Las variables cualitativas fueron resumidas mediante frecuencias y porcentajes. Las variables cuantitativas fueron sometidas a la prueba X2 de Pearson para evaluar la normalidad y determinar la medida de tendencia central: media, si se ajustaba a la normalidad; mediana, en caso contrario. La diferencia de medianas entre el perfil hemático entre el diagnóstico y la recaída fue analizada mediante la prueba de Mann-Whitney para muestras independientes. Para la comparación entre grupos se utilizó la prueba de ji-cuadrada (X2). Los resultados se consideraron significativos cuando las pruebas de hipótesis reportaban un valor de p≤ 0,05. Para estimar el impacto entre las variables sobre la posibilidad de integrar una segunda remisión se calcularon Odds Ratio con un intervalo de confianza del 95%. La supervivencia se estimó mediante curvas de Kaplan-Meier estableciendo las diferencias entre estratos (esquemas ambulatorios vs. esquemas con ingreso hospitalario; esquemas de alta intensidad vs. moderada y baja intensidad) mediante la prueba de log-Rank.
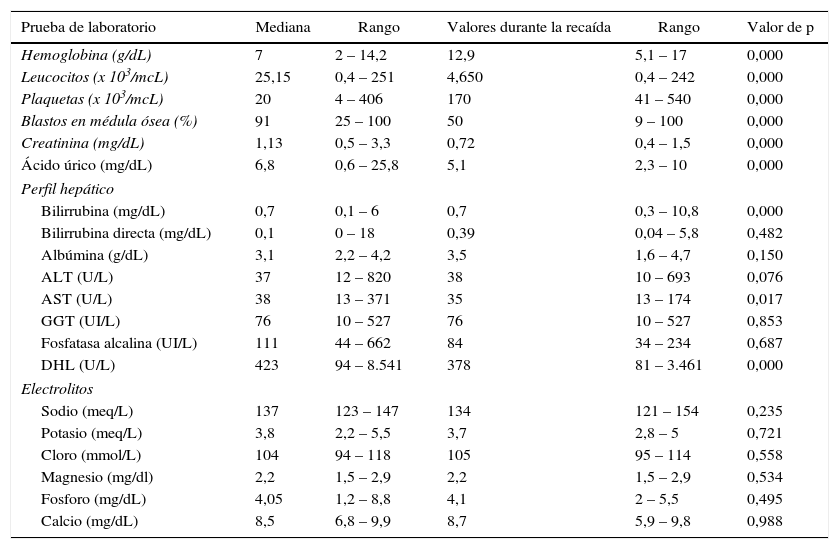
ResultadosCaracterísticas generalesSe estudiaron 69 pacientes con diagnóstico de LAL en recaída, de estos el 37,7% (n=26) eran mujeres y 62,3% (n=43) fueron hombres. La mediana de leucocitos al diagnóstico fue de 25,1 x 103/mcL (rango de 0,4 – 388 x 103/mcL), y al subdividir según al tipo de riesgo, la mediana de leucocitos fue de 3,9 x 103/mcL para aquellos con riesgo habitual y 59,15 x 103/mcL para riesgo alto. La mediana de edad fue 24 años (rango de 18 – 61 años). Acorde al tipo de riesgo, la mediana de edad fue de 22 años (rango 18 – 34 años) para aquellos de riesgo habitual y 38,6 años para pacientes con riesgo alto (rango de 35 – 61 años), sin significancia estadística (p>0,05). Mediante inmunofenotipo se identificó que todos los casos correspondieron a la estirpe linfoide B. Ningún paciente tenía afección a nivel central al diagnóstico. El resto del perfil bioquímico y hemático al diagnóstico se describe en la tabla 1.
Características bioquímico-hematológicas de los pacientes con LAL al momento del diagnóstico y al momento de la primera recaída
| Prueba de laboratorio | Mediana | Rango | Valores durante la recaída | Rango | Valor de p |
|---|---|---|---|---|---|
| Hemoglobina (g/dL) | 7 | 2 – 14,2 | 12,9 | 5,1 – 17 | 0,000 |
| Leucocitos (x 103/mcL) | 25,15 | 0,4 – 251 | 4,650 | 0,4 – 242 | 0,000 |
| Plaquetas (x 103/mcL) | 20 | 4 – 406 | 170 | 41 – 540 | 0,000 |
| Blastos en médula ósea (%) | 91 | 25 – 100 | 50 | 9 – 100 | 0,000 |
| Creatinina (mg/dL) | 1,13 | 0,5 – 3,3 | 0,72 | 0,4 – 1,5 | 0,000 |
| Ácido úrico (mg/dL) | 6,8 | 0,6 – 25,8 | 5,1 | 2,3 – 10 | 0,000 |
| Perfil hepático | |||||
| Bilirrubina (mg/dL) | 0,7 | 0,1 – 6 | 0,7 | 0,3 – 10,8 | 0,000 |
| Bilirrubina directa (mg/dL) | 0,1 | 0 – 18 | 0,39 | 0,04 – 5,8 | 0,482 |
| Albúmina (g/dL) | 3,1 | 2,2 – 4,2 | 3,5 | 1,6 – 4,7 | 0,150 |
| ALT (U/L) | 37 | 12 – 820 | 38 | 10 – 693 | 0,076 |
| AST (U/L) | 38 | 13 – 371 | 35 | 13 – 174 | 0,017 |
| GGT (UI/L) | 76 | 10 – 527 | 76 | 10 – 527 | 0,853 |
| Fosfatasa alcalina (UI/L) | 111 | 44 – 662 | 84 | 34 – 234 | 0,687 |
| DHL (U/L) | 423 | 94 – 8.541 | 378 | 81 – 3.461 | 0,000 |
| Electrolitos | |||||
| Sodio (meq/L) | 137 | 123 – 147 | 134 | 121 – 154 | 0,235 |
| Potasio (meq/L) | 3,8 | 2,2 – 5,5 | 3,7 | 2,8 – 5 | 0,721 |
| Cloro (mmol/L) | 104 | 94 – 118 | 105 | 95 – 114 | 0,558 |
| Magnesio (mg/dl) | 2,2 | 1,5 – 2,9 | 2,2 | 1,5 – 2,9 | 0,534 |
| Fosforo (mg/dL) | 4,05 | 1,2 – 8,8 | 4,1 | 2 – 5,5 | 0,495 |
| Calcio (mg/dL) | 8,5 | 6,8 – 9,9 | 8,7 | 5,9 – 9,8 | 0,988 |
Pie de Tabla 1: GGT: Gamma-glutamil transpeptidasa; DHL: Deshidrogenasa láctica
La mediana de leucocitos, hemoglobina y plaquetas durante la recaída fueron: 4,65 x 103/mcL (0,4 – 242 x 103/mcL), 12,9g/dL (5,1 – 17g/dL) y 170 x 103/mcL (41 – 540 x 103/mcL); siendo los tres valores estadísticamente significativos menores que al momento del diagnóstico. El perfil bioquímico se indica en la tabla 1.
Tipo de tratamientoAl momento de la recaída, los pacientes fueron asignados a diferentes regímenes de tratamiento (tabla 2). El 40,6% de los casos (n=28) decidieron no iniciar tratamiento de mediana o alta intensidad, optando por cuidados paliativos con soporte transfusional y quimioterapia a baja dosis de manera ambulatoria. Poco más de la mitad de pacientes incluidos (55,1%, n=38) recibieron tratamientos de alta intensidad, y solo el 4,3% (n=3) recibieron una quimioterapia de mediana intensidad.
Esquemas de tratamiento empleados en pacientes con LAL en primer recaída
| Esquema de quimioterapia | n | Porcentaje (%) |
|---|---|---|
| Alta Intensidad | 38 | 55,1 |
| Hyper-CVAD | 34 | 49,3 |
| IDA-FLAG | 01 | 1,4 |
| Institucional 2-3-5 | 03 | 4,3 |
| Media Intensidad | 03 | 4,3 |
| DAU-VCR-PRED | 01 | 1,4 |
| VCR-DAU-DEX | 01 | 1,4 |
| AL87 | 01 | 1,4 |
| Baja intensidad | ||
| Soporte transfusional plus quimioterapia ambulatoria | 28 | 40,6 |
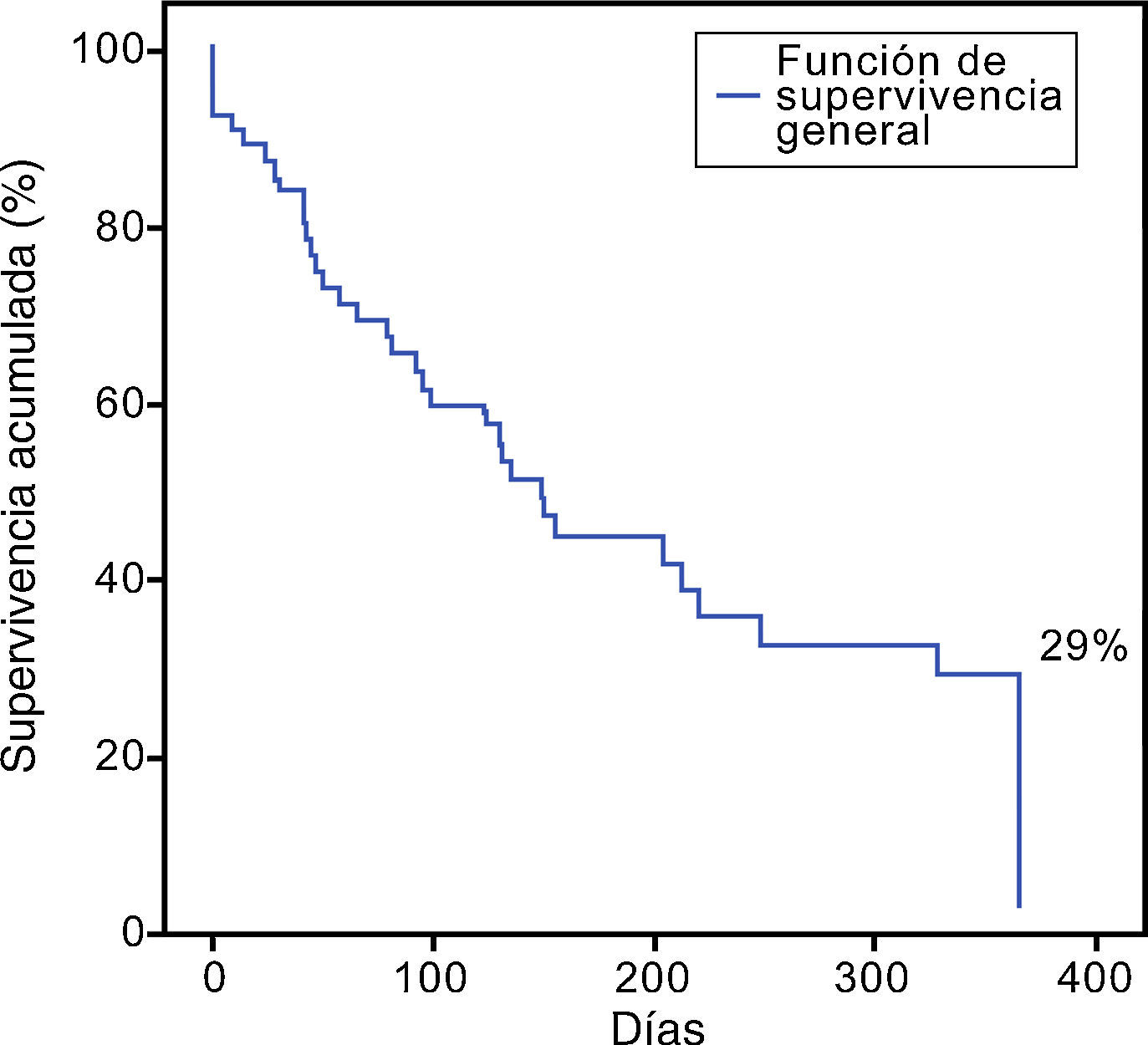
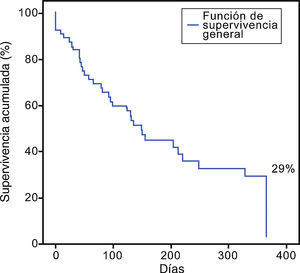
Se analizó a todos los pacientes independientemente del tipo de conducta terapéutica. La media de supervivencia fue 120 días (rango 2 - 575 días), donde el 29% sobrevivió al año de seguimiento (fig. 1). Alrededor del 27,5% (n=19) de los pacientes integraron una segunda remisión completa, con una mortalidad del 72,5% al año de seguimiento.
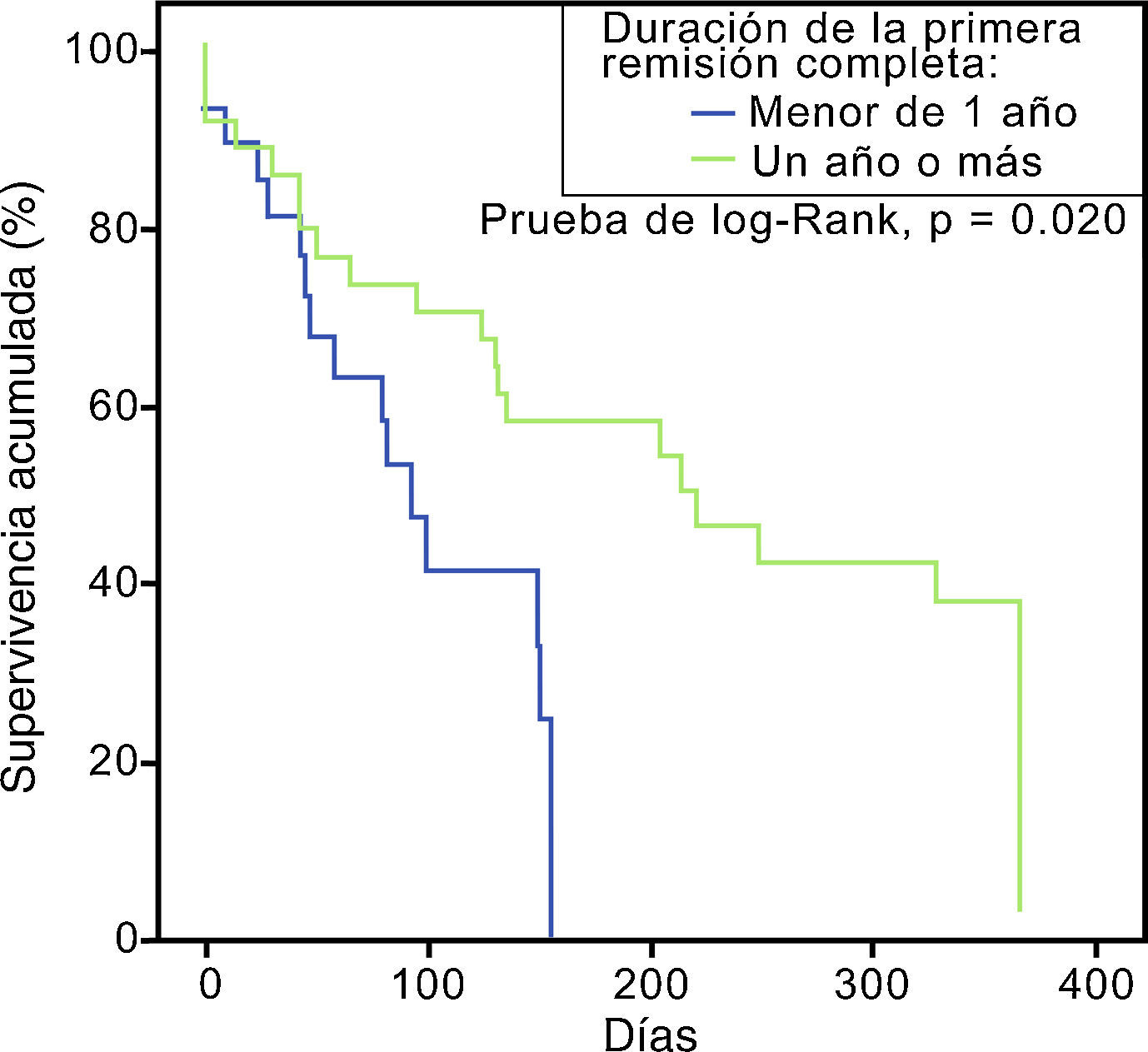
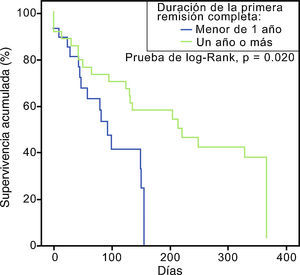
Asociación entre diversas variables y la supervivenciaLa cifra de leucocitos al momento de la recaída fue estadísticamente menor que al momento del diagnóstico (p=0,000, 95% IC), pero a pesar de contar con una menor carga tumoral no se correlacionó con el éxito de una segunda remisión completa. Los Odds ratio para las principales variables estudiadas se muestran en la tabla 3. Aquellos con una primer RC con duración mayor a un año mostraron una mejor supervivencia global en comparación con aquellos con recaída temprana. La curva de supervivencia de esta comparación se ilustra en la figura 2.
Valores de Odds ratio para la falla terapéutica temprana y supervivencia a 1 año
| Variable | Falla terapéutica temprana | Supervivencia general a 1 año | ||
|---|---|---|---|---|
| OR (95% IC) | Valor de p | OR (95% IC) | Valor de p | |
| Duración de primera RC<1 año | 6,78 (1,7532-26,2803) | 0,005 | 1,50 (0,3698-6,1184) | 0,570 |
| Edad>35 años | 4,37 (0,9080-21,0458) | 0,065 | 0,48 (0,1679-1,4003) | 0,876 |
| Leucocitos >10 x 103/mcl | 1,50 (0,3698-6,1184) | 0,568 | 2,63 (0,6600-10,522) | 0,170 |
| Tratamiento intensivo | 0,22 (0,0661-0,7813) | 0,018 | 2,30 (0,8518-6,2167) | 0,100 |
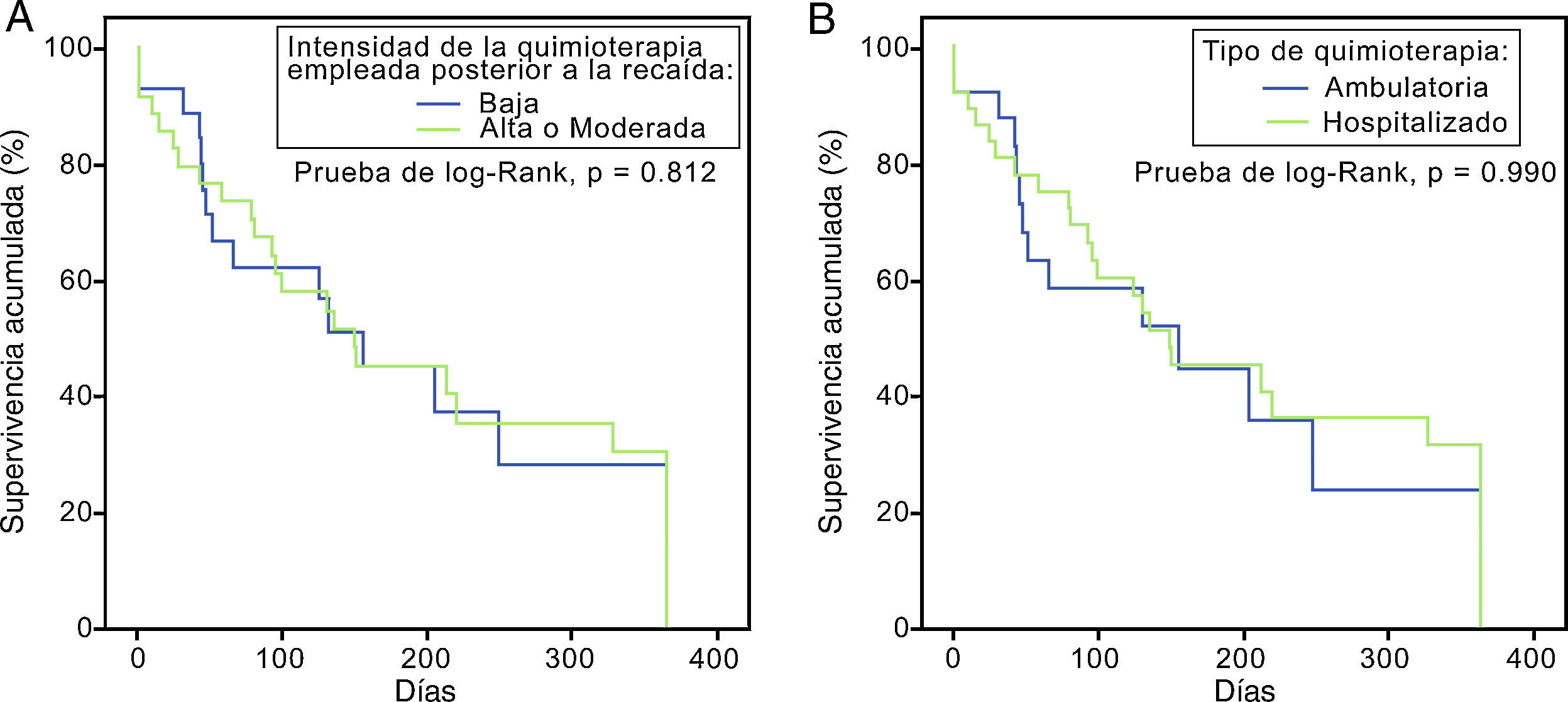
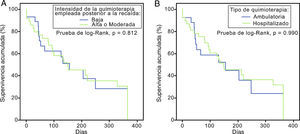
Inicialmente se dividió a los pacientes acorde a la intensidad de su tratamiento. El 55,1% (n=38) recibió un esquema de alta intensidad y el 44,9% (n=31) un esquema de mediana o baja intensidad, sin existir diferencia en la supervivencia entre grupos (prueba de log-Rank, p=0,812) (fig. 3A). Un segundo subanálisis se comparó entre pacientes que recibieron quimioterapia con necesidad de internamiento hospitalario (alta y mediana intensidad) con quienes recibieron quimioterapia de baja intensidad de forma ambulatoria con soporte transfusional. Tampoco existieron diferencias en estas curvas de supervivencia (prueba de log-Rank, p=0,990) (fig. 3B).
DiscusiónEn la actualidad el abordaje de los pacientes con LAL requiere no solamente quimioterapia, sino la identificación de diversos factores que puedan ser potenciales modificadores de la respuesta terapéutica e impactar negativamente en la expectativa de vida. La recaída puede ser única en médula ósea, sistema nervioso central o inclusive combinada, sin embargo en cualquiera de los tres escenarios el pronóstico es malo en la mayoría de los casos ya que la posibilidad de integrar una segunda remisión es menor al 50% y, en caso de integrarlo, la única opción curativa es el trasplante de progenitores hematopoyéticos12,19,20.
El perfil bioquímico al momento del diagnóstico mostraba una clara actividad tumoral, deterioro renal y hepático al momento del diagnóstico y al momento de la recaída se reducía significativamente (p<0,05) las medianas (y la dispersión de los valores). Los electrolitos séricos permanecieron sin cambios significativos (p>0,05) (tabla 1). Al analizar el punto de corte de leucocitos al momento de la recaída ningún valor por encima de 10 x 103/mcl mostró impactar la supervivencia, ni tampoco la edad.
En nuestro análisis ninguna variable demostró utilidad pronóstica sobre la supervivencia general a 1 años posterior a la primera recaída, pero la duración de la primera RC si demostró utilidad para predecir la falla terapéutica temprana. Esta observación ya había sido identificada por Tavernier et al. en un estudio muy similar al presente que analizó 421 adultos con LAL en recaída, de los cuales el 44% logró una 2RC y una media de 6,3 meses de supervivencia general, encontrando como principal factor de pronóstico de supervivencia el tener una primera RC con duración de más de un año (p=0,04), y cifras de plaquetas>100 x 103/mcL. Destaca el hecho que en esta investigación los pacientes que recibieron únicamente quimioterapia tuvieron una supervivencia mayor que aquellos pacientes que recibieron trasplante alogénico o autólogo (6,7 meses vs. 4,8 y 5,4 meses respectivamente)21. Oriol et al. encontraron que en aquellos pacientes con remisiones completas menores a 7 meses, la supervivencia fue del 14%, en comparación con 36% en RC que duraron entre 7 - 8 meses, y del 57% en aquellos con RC mayores de 18 meses22.
A diferencia de la recaída aislada a sistema nervioso central donde se cuenta con la terapia intretecal, la irradiación corporal o la administración de dosis altas de Metotrexate, la decisión del mejor esquema terapéutico de segunda línea todavía es controversial. Algunos autores han optado por esquemas como idarrubicina-fludarabina (IDA-FLAG), Hyper-CVAD o re-inducciones basadas en las drogas utilizadas en la inducción a la remisión. En general, con estos esquemas las tasas de 2RC fueron del 45%. A pesar de contar con series pequeñas el esquema IDA-FLAG se mantiene como referente de segunda línea12,23. Specchia et al. reportaron en 23 pacientes una tasa de remisiones completas de 39,1% con una media de supervivencia de 4,5 meses24. Como respuesta a esto Paydas et al. en carta al editor reportaron su experiencia del esquema IDA- FLAG en 56 casos con leucemia aguda, reportando una tasa de 2RC del 42%23. La comparación entre Mitoxantrona/AraC versus Hyper-CVAD fue publicado hace 15 años por Koller et al., de los 66 pacientes que iniciaron la segunda línea con HyperCVAD, el 44% integró una 2RC en comparación con el 38% del grupo con dosis altas de ARAC/mitoxantrona, una menor toxicidad y una mayor supervivencia lo convirtieron al Hyper-CVAD como una buena opción en segunda línea15.
En la serie del presente estudio el uso de un régimen intensivo (Hyper-CVAD, IDA-Flag, mitoxantrona-DARAC) no brindó una ventaja sobre un régimen conservador (moderada o baja intensidad). Debido a los resultados obtenidos con la mayor parte de los regímenes de quimioterapia, durante los últimos años se han logrado avances significativos en el tratamiento de la LLA en recaída19. Debido a que todas las células leucémicas de linaje B expresan CD20, CD22 y CD19, diversos anticuerpos monoclonales se han desarrollado como monoterapia o tratamiento combinado25. Inicialmente la adición de rituximab (anti-CD20) mejoró las respuestas de un 35% a un 50% en la LAL subtipo B. Posteriormente con el inotuzumab ozogamicin (anti-CD22) se consiguió una tasa de 2RC del 55%26. Posiblemente el tratamiento más prometedor es el anticuerpo monoclonal bialélico CD3-CD19 (blinatumomab). Este nuevo tipo de inmunoterapia en conjunto con la terapia basada en linfocitos T con un antígeno quimérico (CAR-T) es la nueva esperanza a corto plazo del tratamiento de la LAL27,28. La eficacia de blinatumomab se basa en la capacidad de enganchar a los linfocitos T mediante su parte bialélica CD3 al receptor CD19 de las células B induciéndoles una citotoxicidad directa29. Su eficacia se ha evaluado en un estudio fase 2 dirigido por Topp et al. donde se reportó que con el blinatumomab se alcanzó un 69% de RC y de estos el 88% lograron un impacto sobre la enfermedad mínima residual30.
Se siguen desarrollando otras estrategias inspiradas en blancos moleculares. Una de ellas son los bloqueadores de la vía mTOR, de los cuales Daver et al. publicaron un estudio fase I/II con un inhibidor de la vía mTOR (everolimus) en conjunto con Hyper-CVAD, de donde obtuvieron hasta un 25% de RC; a pesar de ser una tasa no tan exitosa como los nuevos monoclonales, se debe considerar que esta serie se constituyó por pacientes con múltiples recaídas31.
Entre las limitantes de esta investigación es importante recordar que la naturaleza retrospectiva del análisis imposibilitó tener control sobre los criterios unificados para la elección del esquema quimioterapéutico, siendo esta decisión tomada a criterio del médico tratante. La cantidad reducida de pacientes recabados y los subgrupos de análisis dispares son más factores a considerar para tomar con cautela los hallazgos descritos.
Es importante mencionar que la población atendida en el Hospital General de México es en su mayoría de escasos recursos, motivo por el cual tampoco fue posible disponer de estudios de citogenética y, por consiguiente, estos pacientes no fueron candidatos a recibir inhibidores de tirosin-quinasa.
En conclusión, la duración de la primera RC fue el principal factor de riesgo detectado para no integrar una segunda remisión. Además, el recibir un primer esquema de alta intensidad es un factor protector ante la falla terapéutica con un esquema de rescate. Hasta no contar con estrategias más eficaces, es importante considerar si realmente es necesario el uso de esquemas de alta intensidad durante la recaída, ya que ninguno de los esquemas analizados mostró superioridad respecto a la supervivencia obtenida.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Fuentes de financiamientoLa investigación presentada fue realizada con recursos institucionales del Hospital General de México “Dr. Eduardo Liceaga”, perteneciente a la Secretaria de Salud. No se percibió ninguna ayuda económica externa.
Conflicto de interesesLos autores declaran no tener algún tipo de conflicto de interés respecto este trabajo.