La leucemia linfoide aguda (LLA) es el cáncer más frecuente en niños. A nivel mundial se estima que cerca del 30% corresponde a la totalidad de las neoplasias malignas que se presentan en niños y, de estas, más del 75% son LLA.
En Colombia no existe aún un registro nacional de cáncer que nos permita evaluar exactamente la carga de la enfermedad por esta patología; sin embargo, se estima que se presentan aproximadamente 2.080 casos nuevos por año de cáncer en pacientes pediátricos y de estos 500 corresponden a LLA. Con el objetivo de disminuir la mortalidad y mejorar la oportunidad en el diagnóstico y en el tratamiento de los niños afectados por esta patología, se desarrolló esta Guía de práctica clínica (GPC) como producto del trabajo durante meses de un grupo organizado y motivado de médicos especialistas en el área (epidemiólogos, economistas, entre otros), quienes elaboraron recomendaciones para las diferentes etapas tanto para la prevención, sospecha, diagnóstico, tratamiento, seguimiento de los niños y adolescentes con diagnóstico de LLA.
Acute lymphocytic leukaemia (ALL) is the most common cancer in children. Globally, it is estimated that nearly 30% correspond to the total of malignant tumours in children, and 75% of them are ALL.
There is no national cancer registry in Colombia that would allow us to precisely assess the burden of the disease for this condition; however, calculations have shown that there are 2,080 new paediatric cancer cases every year, and of those 500 correspond to ALL. With the goal of reducing mortality and improving the chances for a diagnosis and treatment of children affected by this condition, the present clinical practice guide (CPG) was developed after a work of months carried out by an organised and motivated group of physicians specialised in the field (epidemiologists and economists, among others), who formulated recommendations for the different stages: prevention, suspicion, diagnosis, treatment and follow-up of children and teens diagnosed with ALL.
En Colombia la situación de las leucemias en niños constituye un problema que debe ser considerado como una enfermedad de interés en salud pública, la tasa de curación es cercana al 56% de acuerdo a datos aún no publicados por el INC, cifra aún distante a la descrita a nivel mundial. Las explicaciones para este resultado pobre son múltiples y van desde las precarias condiciones socioculturales de la mayoría de nuestros pacientes y las barreras de acceso al diagnóstico y tratamiento oportuno.
La presente Guía, basada en la mejor evidencia disponible, está dirigida a los profesionales de salud para facilitar la atención integral de los pacientes pediátricos con leucemia linfoblástica aguda cuyo diagnóstico, tratamiento y seguimiento corresponde a los centros de tercer o cuarto nivel que cuenten con especialistas en hematooncología pediátrica. El objetivo general de la guía es disminuir la mortalidad y mejorar la oportunidad en el diagnóstico y en el tratamiento de los niños afectados por leucemia linfoide aguda.
Luego de plantear preguntas sobre factores de riesgo asociados con la enfermedad, exámenes para el diagnóstico, aspectos relacionados con el tratamiento y seguimiento, se realizó una revisión exhaustiva de la literatura, y después, a partir de lo anterior, se dieron recomendaciones.
La metodología con el texto completo de la Guía, y una Guía para pacientes, padres y cuidadores, están disponibles para consulta y descarga libre, en el sitio: http://gpc.minsalud.gov.co. Para el desarrollo de la guía en general, se siguió la metodología del manual para el desarrollo de guías del Ministerio de Salud y Protección Social, se llevó a cabo la definición de preguntas clínicas, búsqueda sistemática de literatura, evaluación crítica de la evidencia y formulación de recomendaciones. El equipo de trabajo identificó los aspectos específicos que la GPC debería abordar (diagnóstico, factores de riesgo, tratamiento, factores pronóstico y seguimiento) y sobre estos se formularon una serie de preguntas clínicas como punto de partida. De esta manera, se creó un mapa de decisiones de manejo clínico de la enfermedad a partir del cual se generaron las preguntas preliminares de cada patología. Luego se efectuó una bu¿squeda de los mu¿ltiples desenlaces para las actividades, procedimientos e intervenciones de diagno¿stico, tratamiento, seguimiento y prono¿stico, los cuales fueron calificados basados en la magnitud del efecto reportado, el nivel de evidencia y la factibilidad de la medición.
Adicionalmente, se tuvieron en cuenta las metas de gestión y de resultado en salud establecidas, es decir se identificaron los desenlaces más importantes asociados a morbilidad, mortalidad, características operativas de pruebas diagnósticas o costos, así como los resultados esperados del proceso de difusión, diseminación y adherencia de la GPC.
Posteriormente, se realizó un primer filtro de los desenlaces listados y se seleccionaron los más importantes de acuerdo a su pertinencia y utilidad para medir los resultados esperados del proceso de implementación de las recomendaciones de la GPC. Una vez fueron identificados se incluyeron dentro de las preguntas aprobadas y estas a su vez fueron estructuradas en el formato PICOT/PECOT.
Factores de riesgoEntre los factores de riesgo que se han asociado con el desarrollo de las leucemias en niños están: la radiación ionizante; exposición prenatal y postnatal a rayos X o dosis altas de radiación1,2; contacto con pesticidas e hidrocarburos durante la concepción; el uso de alcohol y de sustancias psicoactivas en la madre gestante3,4. En un metaanálisis se analizó la relación entre peso al nacer y riesgo de leucemia en niños. Incluyó en su revisión 32 estudios y 16.501 casos de todos los tipos de leucemia (90% LLA). El OR para la asociación de alto peso al nacer para todas las leucemias fue de 1,35 (IC 95%:1,24-1,48) para LLA: 1,23 (IC 95%: 1,15-1,32)5,6. Una historia familiar de tumor sólido en los familiares en primer o segundo grado se asoció con mayor probabilidad de LLA7.
Evitar la exposición prenatal a rayos X y cualquier exposición durante el embarazo o infancia temprana a pesticidas, fungicidas. Grado de recomendación: B
Que los niños con peso mayor de 4.000 gramos al nacer sean valorados y vigilados por su médico tratante. Grado de recomendación: B
Incluir el peso al nacer en la elaboración de la historia clínica oncológica. Buena práctica
Tener en cuenta la historia familiar de cáncer, esta debe poner en alerta al médico pediatra ante la consulta de un niño con signos y síntomas sospechosos de LLA. Grado de recomendación: C
Diagnóstico oportuno de leucemiasUna de las principales causas por las que Colombia no ha podido lograr las tasas de sobrevida de otros países es la falta de un diagnóstico y el tratamiento oportuno y adecuado. La demora en la remisión a un especialista ante la sospecha de cáncer y la iniciación tardía, o suspensión del tratamiento pueden significar la diferencia entre la vida y la muerte (OPS, 2011).
El módulo de diagnóstico temprano de cáncer en la niñez dentro de AIEPI (Atención Integrada a las Enfermedades Prevalentes de la Infancia) cuenta con un formato validado por expertos del país (incluyendo miembros del GDG) que permite una adecuada identificación de la sospecha diagnóstica de esta patología. El formato permite clasificar cada caso de la siguiente forma: posible cáncer o enfermedad muy grave, algún riesgo de cáncer, poca probabilidad de cáncer. La clasificación posible cáncer o algún riesgo de cáncer se consideran sospecha diagnóstica (AIEPI, 2011)8.
Se recomiendaQue el personal de salud que atiende niños en nivel primario y secundario de atención utilice el formato del módulo de diagnóstico temprano del cáncer de la Estrategia de Atención Integral para las Enfermedades Prevalentes de la Infancia (AIEPI). Grado de recomendación: D
Que ante la clasificación de posible cáncer o sospecha diagnóstica de leucemia aguda se realice remisión inmediata a un centro asistencial de tercer o cuarto nivel de alta complejidad que cuente con servicio y especialistas en oncología, hematología, oncohematología pediátrica. Grado de recomendación: D
El centro asistencial debe contar con interdependencia e integralidad con los servicios de atención avanzada de soporte, atención hospitalaria y de urgencias 24 horas. Buena práctica
Signos y síntomas de LLA para primer nivel de atenciónLos signos y síntomas de la leucemia linfoide aguda en edad pediátrica pueden ser muy variados y son derivados tanto del compromiso de la médula ósea: anemia (palidez), trombocitopenia (síndrome purpúrico), neutropenia (fiebre, la mayoría de las veces por infección intercurrente), y la infiltración extramedular leucémica como son adenopatías, hepatoesplenomegalia, dolores óseos, aumento de volumen testicular, compromiso del SNC, entre otros. Grado de recomendación: D
Se recomienda tomar hemograma con recuento de plaquetas, extendido de sangre periférico, función hepática, renal, electrolitos (Na, K, Cl, Ca, fósforo), DHL, ácido úrico, hemoclasificación, fenotipo del Rh, pruebas de coagulación, coprológico. Descartar existencia de infecciones bacterianas, virales (CMV, VEB, hepatitis B/C y HIV). Diagnóstico de imágenes: ecografía abdomino–pélvica, radiografía de tórax. Grado de recomendación: D
Diagnóstico de leucemia linfoide agudaEn algunos casos el diagnóstico de LLA no es fácil, se requiere de un grupo multidisciplinario e integral en un centro especializado donde se deberá hospitalizar al paciente para ser atendido por dicho equipo: oncohematólogos pediatras, otros especialistas (cirujano pediatra, psicólogo, nutricionista, odontólogo, trabajador social, entre otros según el caso), enfermeros oncólogos con experiencia en niños.
Se convocó a un grupo de 20 expertos hematopatólogos, patólogos clínicos y especialistas en oncología, oncohematología o hematología pediátrica para definir las recomendaciones por consenso de expertos. A continuación las recomendaciones:
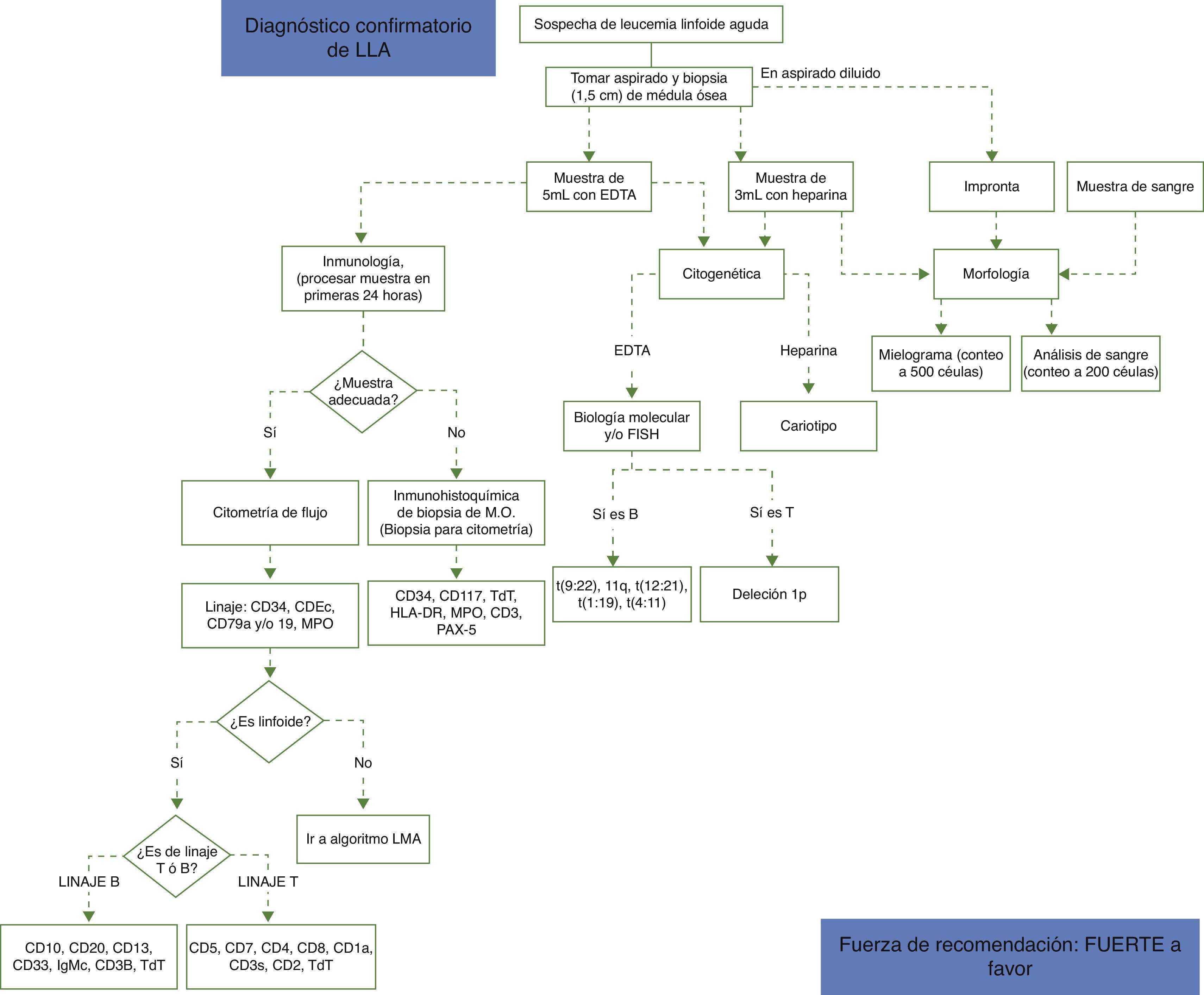
Recomendaciones diagnóstico-patológicas LLA, a continuación un diagrama del proceso diagnóstico para LLA (fig. 1).
Se recomiendaTomar biopsia de médula ósea en todos los pacientes con sospecha diagnóstica de leucemia linfoide aguda sin importar la edad, las características de la muestra del aspirado ni la presencia o no de pancitopenia. Fuerza de recomendación: Fuerte a favor
A todos los pacientes tomar muestra de sangre periférica, aspirado de médula ósea y biopsia para el diagnóstico confirmatorio. A todos los pacientes se les debe realizar estudio morfológico, inmunológico, genético y biología molecular. Fuerza de recomendación: Fuerte a favor
Separar la muestra en dos tubos, un tubo con una muestra de 5ml con EDTA para estudio morfológico inmunología y de biología molecular, y un tubo con una muestra de 3ml con heparina para citogenética y cariotipo. Fuerza de recomendación: Fuerte a favor
Hacer el diagnóstico morfológico con mielograma con conteo a 500 células. Fuerza de recomendación: Fuerte a favor
Citología convencional en líquido cefalorraquídeo para determinar el compromiso del sistema nervioso central en pacientes con LLA. Fuerza de recomendación: Fuerte a favor
Citometría de flujo adicional a la citología convencional para determinar el compromiso del sistema nervioso central solamente en pacientes que requieren estadificación, que no han recibido tratamiento y que recibieron esteroides u otros citotóxicos como tratamiento para comorbilidad diferente a cáncer. Fuerza de recomendación: Fuerte a favor
Estratificación de riesgo para pacientes pediátricos con diagnóstico confirmado de LLALos pacientes con LLA por lo general se clasifican en grupos de riesgo definidos por características clínicas y de laboratorio: edad al diagnóstico, recuento de leucocitos al diagnóstico, linaje de las células leucémicas, compromiso por infiltración del sistema nervioso central, anomalías citogenéticas, y más recientemente de acuerdo a la respuesta al tratamiento y enfermedad mínima residual (EMR)9,10.
Se recomienda 3 grupos de riesgo: bajo, intermedio y alto teniendo en cuenta la edad, recuento de leucocitos, linaje, genética, molecular y respuesta a día 8, 15 y fin de inducción. Fuerza de recomendación: Fuerte a favor (tabla 1).
Estratificación de riesgo para pacientes pediátricos con diagnóstico confirmado de LLA, adaptado de los criterios del protocolo ALL IC-BFM 200210
| Riesgo bajo | Riesgo intermedio | Riesgo alto* | |
|---|---|---|---|
| Edad | >1 a 9,9 años | <1 o > 9,9 años | Cualquier edad |
| Leucocitos | < 20.000/uL | > 20.000/uL | Cualquier recuento |
| Linaje | B | T | T o B |
| Respuesta a prednisona día 8 | < 1.000 blastos absolutos en sangre periférica (buena respuesta a prednisona) | < 1.000 blastos absolutos en sangre periférica (buena respuesta a prednisona) | > 1.000 blastos absolutos en sangre periférica (mala respuesta a prednisona) |
| Respuesta día 15 | Blastos < 25% | Blastos < 25% | > 25% |
| EMR al día 15: | < 0,1% | > 0,1-10% | > 10% |
| Fin inducción, remisión morfológica | Blastos < 5% | Blastos < 5% | Blastos > 5% |
| EMR al final de inducción | EMR < 0,01% | EMR entre 0,01% - <1% | EMR > 1% |
| SNC | negativo | positivo | Positivo o negativo |
| Genética | 12:21. No tener t:(9:22) ni t(4:11) | No tener t:(9:22) ni t(4:11) | t(4;11), t(9;22), MLL, BCR/ABL |
Al analizar la citometría de flujo y la PCR para detectar la EMR en niños con LLA, se concluye que ambos métodos son efectivos. Sin embargo, la PCR tuvo una sensibilidad más consistente (0,001%) en detectar los re-arreglos genéticos de las células leucémicas11.
Un estudio de cohorte evaluó EMR en las diferentes etapas del tratamiento y su correlación entre las características inmunofenotípicas y biomoleculares de la leucemia y la recaída con niveles de EMR >1% al día 15 (p=0,04), >0,01% al final de la inducción (p=0,02)12,13.
Realizar EMR por PCR en médula ósea como prueba para estratificación de riesgo en primera opción dada la alta sensibilidad y especificidad. Grado de recomendación: B
En caso de no contar con PCR, realizar enfermedad mínima residual (EMR) por citometría de flujo como prueba para estratificación de riesgo al día 15 y al final de la inducción. Grado de recomendación: B
Manejo de la leucemia linfoblástica agudaEl manejo de la LLA comprende un tratamiento sistémico para control de la enfermedad hematológica y extrahematológica (sistema nervioso central, testículos, ojo y otros sitios). A nivel mundial existen grupos colaborativos de investigación que apoyan el estudio de la LLA en niños (el grupo alemán Berlin-Frankfurt-Münster (BFM), los norteamericanos Children Oncology Group (COG) o el de St Jude, y el italiano Associazione Italiana Oncología Ematología Pediátrica (AIEOP), entre otros). Los protocolos de estos grupos en forma general incluyen las siguientes etapas: inducción a la remisión; profilaxis al sistema nervioso central con radioterapia o sin esta; consolidación/intensificación; tratamiento de continuación o mantenimiento y en algunos casos específicos trasplante de células progenitoras hematopoyéticas y otras terapias14,15.
Manejo de leucemia linfoide aguda en adolescentesHistóricamente, los adultos jóvenes entre 16 y 21 años de edad con leucemia linfoblástica aguda han tenido menor sobrevida global y sobrevida libre de evento comparado con pacientes de menor edad. Esto en parte relacionado a otros factores de riesgo como mayor incidencia de linaje T y presencia de cromosoma Filadelfia16. Una cohorte con 81 pacientes adolescentes y adultos jóvenes recibió un protocolo pediátrico alcanzando una remisión completa después de la inducción del 98%17. Se presentó mayor toxicidad en el grupo de mayores de 16 años (p<0,001)18.
Se recomiendaQue los adolescentes sean tratados con protocolos pediátricos. Fuerza de recomendación: Fuerte a favor
Vigilar estrechamente a los adolescentes y adultos jóvenes por mayor toxicidad. Buena práctica
Tratamiento de la leucemia linfoblástica aguda por etapa de manejoLa descripción del manejo se refiere a todos los pacientes con LLA independiente del riesgo. En cada etapa se hace una anotación especial dirigida según riesgo y se divide el tratamiento en dos fases principales: la inducción y la postinducción. Todos los pacientes con diagnóstico de LLA para entrar y mantener la remisión requieren de la adherencia a un protocolo de quimioterapia19, que incluye los cuatro elementos principales establecidos en la mayoría de los grupos cooperativos internacionales de investigación, estos son: inducción y postinducción, la cual incluye: consolidación, reinducción, profilaxis a sistema nervioso central y la terapia de mantenimiento20.
Que todos los pacientes reciban una fase de inducción tan pronto se confirme el diagnóstico y una postinducción. Fuerza de recomendación: Fuerte a favor
Para los pacientes de bajo riesgo el manejo con protocolos de menor intensidad y/o dosis con un solo ciclo de re-inducción. Fuerza de recomendación: Fuerte a favor
Los pacientes con LLA deben mantener la continuidad del protocolo de tratamiento sin interrupciones no justificadas. Buena práctica
Fase de InducciónTodos los pacientes con diagnóstico de leucemia linfoide aguda requieren de esta etapa inicial denominada Inducción, que como su nombre lo indica es inducir la eliminación a través de medicamentos de por lo menos el 95% o más de las células tanto malignas como normales en la médula ósea, que es el sitio donde se producen las células sanguíneas21.
Un estudio evaluó vincristina con prednisona comparada con vincristina con dexametasona. Para vincristina+prednisolona: SLE a 5 años: 70,1% vs. 62,0% OR: 0,71 IC 95%:0,61-0,84 p=0,0000422. La fase de inducción para los pacientes con LLA incluye el uso de un glucocorticoide (prednisona o dexametasona), el rango de dosis de la prednisona es de 40-60mg/m2 y de la dexametasona de 6-10mg/m223.
Se recomiendaUso de prednisona en todos los pacientes con diagnóstico de LLA en la fase de inducción independiente del riesgo. Fuerza de recomendación: Fuerte a favor
En la fase de inducción el uso de la prednisona a 60mg/m2 y en la postinducción dexametasona oral en dosis de 6-10mg/m2. Fuerza de recomendación: Fuerte a favor
Un EC de 509 pacientes estratificados en tres grupos de riesgo estándar, intermedio y alto para recibir protocolo LLA-BFM-90. No se observó beneficio en la intensificación de altas dosis de L-asparaginasa; la SLE a 5 años entre los pacientes aleatorizados fue 82%±6% para asparaginasa y 88%±5% sin asparaginasa (p=0,58)24. Una cohorte con 653 pacientes de muy bajo riesgo evaluó la respuesta de antimetabolitos sin el uso de alquilantes, epidofilotoxinas y antraciclinas y terapia de radiación. La SLE a los 6 años fue de 86,6%, la SG fue de 97,2%25.
Se recomiendaQue los pacientes de bajo riesgo sean manejados con protocolos con menos intensidad/dosis que incluyan corticoide (prednisolona 60mg/m2), asparaginasa (5.000u/m2×8 dosis), vincristina (1,5mg/m2 semanal×4 semanas) y antraciclina (daunorrubicina o doxorrubicina a 30mg/m2 semanal×2 dosis). Fuerza de recomendación: Fuerte a favor
Que los pacientes de riesgo intermedio y riesgo alto en inducción sean manejados con protocolos de intensidad/dosis aumentada de medicamentos que incluyan prednisolona (60mg/m2), asparaginasa (5.000 u/m2 x 8 dosis), vincristina (1,5mg/m2 semanal x 4 semanas) y antraciclina daunorrubicina o doxorrubicina (30mg/m2 semanal x 4 semanas). Fuerza de recomendación: Fuerte a favor
Mejorar el monitoreo y evaluaciones de la función cardíaca en los pacientes tratados con antraciclinas y otros antineoplásicos. Fuerza de recomendación: Fuerte a favor
En un estudio comparativo del año 2000, se analizaron tres cohortes de 1983-1998. La L-asparaginasa E. Coli fue más eficaz y tóxica que la Erwinina26,27.
Se recomiendaUtilizar L-asparaginasa E. Coli como parte del manejo de la LLA, la dosis varía de acuerdo al protocolo en un rango de 5.000 a 25.000 U/m2. Fuerza de recomendación: Fuerte a favor
La L-asparaginasa Erwinia y/o pegilada se recomienda en casos de alergia a la E.Coli. Buena práctica
En un estudio del grupo alemán se incluyeron en el protocolo BFM-95: 2.169 pacientes. A los pacientes de riesgo bajo (n=758) se les disminuyó el número de dosis de antraciclinas a dos dosis de 30mg/m2 en la fase de inducción. La SLE a 6 años fue de 89,5%±1,1 (p=0,001). Cuando se comparó con la cohorte de BFM-90 quienes habían recibido cuatro dosis de antraciclinas no hubo diferencias en la SLE a 6 años (88,7±1,1). No hubo diferencias en la incidencia acumulada de recaídas28.
Se recomiendaPara los pacientes de bajo riesgo en la fase de inducción dos dosis de daunorrubicina y para los de riesgo intermedio y alto cuatro dosis de daunorrubicina a 30mg/m2. Fuerza de recomendación: Fuerte a favor
La dosis total acumulada de antraciclina menor de 300mg/m2 por riesgo de cardiotoxicidad. Fuerza de recomendación: Fuerte a favor
Administrar la antraciclina en infusión continua entre 6 a 24 horas para disminuir la cardiotoxicidad, pero se debe vigilar mielotoxicidad. Fuerza de recomendación: Fuerte a favor
Fase de PostinducciónLa postinducción es la etapa de tratamiento que sigue a la fase de inducción y luego de lograr la remisión o sea de lograr la desaparición de las células neoplásicas. La terapia de consolidación/reinducción se define como uno o más periodos de tratamiento intensificados administrados después de la inducción, cuyo objetivo es mantener la remisión leucémica continuada y limitar un nuevo crecimiento de células malignas resistentes a los antineoplásicos14,21,28. La postinducción puede incluir radioterapia craneal, la cual es utilizada en algunos casos específicos. De acuerdo al protocolo establecido algunas de estas fases se repiten secuencialmente29,30. Todos los grupos de riesgo se benefician del tratamiento consolidación/reinducción llamado también por algunos grupos, intensificación. Esta fase puede abolir el impacto de los factores pronósticos adversos sin modificar el grupo de riesgo preestablecido.
La sobrevida global a 8 años en el estudio UKALL X fue de 74% (72-76%) y en el estudio UKALL XI fue de 81% (79-83%) p<de 0,001. La mejor sobrevida libre de evento fue vista en los pacientes que recibieron dos intensificaciones como parte del protocolo de quimioterapia31. Un EC evaluó a 436 pacientes de 1-21 años con diagnóstico de LLA linaje T, quienes recibieron dosis de methotrexate a 5g/m2 en fase de consolidación alcanzado mejoría en la supervivencia global a 5 años32. En otro EC el CCG organizó tres estudios para evaluar dosis altas de metotrexate en lugar de radioterapia33.
Se recomiendaQuimioterapia postinducción intensiva para todos los pacientes independiente del riesgo. Fuerza de recomendación: Fuerte a favor
Tratamiento con fases de consolidación, reinducción y mantenimiento a todos los pacientes independiente del riesgo. Fuerza de recomendación: Fuerte a favor
Una reinducción para los pacientes de riesgo bajo que incluye corticoide, vincristina, antraciclina, asparaginasa, citarabina y ciclofosfamida. Fuerza de recomendación: Fuerte a favor
Una o dos reinducciones para los pacientes de riesgo intermedio y riesgo alto que incluya corticoide, vincristina, antraciclina, asparaginasa, citarabina y ciclofosfamida. Fuerza de recomendación: Fuerte a favor
Hacer reinducción, 1 ciclo, para los pacientes de riesgo bajo. Se recomienda 1 o 2 ciclos de reinudcción para los pacientes de riesgo intermedio y riesgo alto. Fuerza de recomendación: Fuerte a favor
Administrar fase de consolidación. Se recomiendan en fase de consolidación para los pacientes de bajo riesgo dosis de metotrexato de 1 a 2,5 gr/m2 en infusión de 24 horas en la fase de consolidación. Fuerza de recomendación: Fuerte a favor
Dosis de metotrexato a 5 gr/m2 en infusión de 24 horas en la fase de consolidación para los pacientes con LLA linaje T y de alto riesgo. Fuerza de recomendación: Fuerte a favor
Medir niveles séricos de metotrexato a los pacientes que reciban dosis de metotrexato de 5 gr/m2. Buena práctica
Todos los pacientes con diagnóstico de LLA de riesgo intermedio y alto se benefician de la quimioterapia intratecal triple con metotrexato, dexametasona y citarabina. Fuerza de recomendación: Fuerte a favor
Quimioterapia intratecal solamente con metotrexato en pacientes con LLA de bajo riesgo. Fuerza de recomendación: Fuerte a favor
Fase de MantenimientoEn la etapa de mantenimiento, última fase del tratamiento llamada también «de continuación», se utilizan medicamentos que no han sido administrados en la fase de inducción. A lo largo del tiempo se han propuesto diferentes esquemas obteniendo mejores resultados con antimetabolitos como mercaptopurina diaria en comparación con tioguanina por ser menos tóxica y methotrexate semanal. Los refuerzos con diferentes agentes también han sido estudiados a lo largo del tiempo sin mejorar los resultados en la supervivencia global22.
Un EC evaluó el ajuste de mercaptopurina (75mg/m2/día) y methotrexate (20mg/m2 semanal) según conteo de blancos en 538 pacientes de riesgo estándar34.
Se recomiendaPara todos los pacientes en fase de mantenimiento el uso de mercaptopurina (50-75mg/m2/día) y metotrexato (20-25mg/m2/ semanal). Fuerza de recomendación: Fuerte a favor
El reajuste de las dosis de mercaptopurina y metotrexato con base en el recuento de los leucocitos. Fuerza de recomendación: Fuerte a favor
Radioterapia en los pacientes con LLA y compromiso de sistema nervioso central.
El uso de radioterapia cada día es más limitado por las secuelas neurocognitivas, neuroendocrinas y segundas neoplasias, lo que obliga a un manejo integral con neuropediatría, neuropsicología, endocrinología, rehabilitación, apoyo escolar, entre otros. Los grupos de investigación la omiten en pacientes de riesgo estándar y otros grupos reportan el beneficio para los de alto riesgo mostrando resultados similares con dosis de 1200 cGy y 1800 cGy35,36.
El estudio L89-12 basado en BFM tenía como objetivo determinar la efectividad de la radioterapia craneal en pacientes de riesgo estándar y fueron aleatorizados para recibir 18Gy y 3 dosis de triple intratecal o altas dosis de methotrexate (3g/m2), más 3 ciclos de doble intratecal. SLE a 15 años radioterapia 66,5±6% vs. quimioterapia 72,7±5,1% (p=0,399)37.
No se recomienda la radioterapia en los pacientes de bajo riesgo. Fuerza de recomendación: Débil en contra
Se recomiendaRadioterapia encefálica profiláctica (12Gy) en los pacientes con LLA linaje T. Fuerza de recomendación: Débil a favor
Radioterapia holoencefálica (12 Gys) profiláctica en pacientes con alto riesgo de recaída en quienes se programa quimioterapia intratecal triple sin importar las dosis de metotrexato sistémico recibidas en fase de consolidación. Fuerza de recomendación: Fuerte a favor
Factor estimulante de colonias de granulocitos como tratamiento complementario para disminuir las complicaciones asociadasLos factores estimulantes de colonias de granulocitos son un grupo de citoquinas que regulan la proliferación y diferenciación de células hematopoyéticas. Tiene como función: disminuir la incidencia y la duración de la neutropenia febril, el tiempo de hospitalización y los requerimientos de antibióticos; existen algunos grupos colaborativos que no lo recomiendan y otros estudios no han sido concluyentes38.
No se recomienda el uso del factor estimulante de colonias de granulocitos como tratamiento complementario en pacientes pediátricos con LLA. Recomendación por consenso de expertos
En un ensayo clínico se analizaron 100 niños con doxorrubicina y 105 con doxorrubicina+dexrazoxane con LLA riesgo alto. Los resultados fueron: SLE a 8,7 años doxorrubicina 77% (IC 95%: 67-84) vs. doxorrubicina dexrazoxane 76% (IC 95%: 67-84) (p=0,99); fracción eyección 5a doxorrubicina -0,82 vs. doxorrubicina/dexrazoxane -0,41(diferencia –0,41, IC 95%: –1,07 a 0,26)39.
No existe suficiente evidencia para recomendar de forma rutinaria los agentes cardioprotectores o formulación de las formas liposomales de las antraciclinas. Fuerza de recomendación: Incierta
SeguimientoAl finalizar el tratamiento es importante citar al paciente de forma periódica, los objetivos de este seguimiento son determinar secuelas tempranas y tardías, identificar recaída, velar por la integración del paciente con su entorno social y familiar.
Niños entre 0 y 18 años con diagnóstico de LLA, tratados en protocolo GBTLI-99, la prueba de reacción de cadena de polimerasa para tratamiento temprano tuvo una correlación en la estratificación de riesgo bueno o pobre de acuerdo a la ERM mostrada el día 14 y 2840.
El grupo italiano y el alemán evaluaron en conjunto la EMR basada en los rearreglos de inmunoglobulina y receptor celular T con PCR – EMR para estratificar los grupos de riesgo en pacientes con LLA. Se consideraron riesgo estándar si la EMR fue negativa al día 33 (con una sensibilidad de al menos 10x-4)41. En el análisis de concordancia entre dos pruebas diagnósticas de citometría de flujo y PCR para la detección de EMR en niños con LLA de linaje B, Los niveles de EMR medidos por los dos métodos se correlacionaron bien; sin embargo, la PCR tuvo una sensibilidad más constante, fue de 0,001%11.
Se recomiendaRealizar enfermedad mínima residual (EMR) por PCR como prueba para estratificación de riesgo en primera opción dada la alta sensibilidad y especificidad. Grado de recomendación: B
En caso de no contar con PCR, realizar EMR por citometría de flujo como prueba para estratificación de riesgo al día 15 y al final de la inducción. Grado de recomendación: B
Realizar la EMR como predictor de recaída en LLA. Grado de recomendación: C
A todos los pacientes tomar muestra de sangre periférica, aspirado de médula ósea y biopsia para la evaluación de EMR. Fuerza de recomendación: Fuerte a favor
A todos los pacientes realizar estudio morfológico, citometría de flujo y estudio de genética y biología molecular. Fuerza de recomendación: Fuerte a favor
Realizar citometría de flujo usando el panel de inmunofenotipo presente al diagnóstico en la evaluación de EMR. Se recomienda realizar estudios de genética molecular según las alteraciones genéticas diagnosticadas en el estudio inicial. Fuerza de recomendación: Fuerte a favor
Realizar consulta de seguimiento de fin de tratamiento con oncohematología, oncología o hematología pediátrica con la siguiente periodicidad: cada 2 meses durante el primer año, cada 3 a 4 meses durante el segundo año, cada 6 meses durante el tercer año, cada año desde el cuarto año en adelante. Fuerza de recomendación: Fuerte a favor
Realizar hemograma y extendido de sangre periférica en cada consulta de seguimiento solamente durante el primer año. Fuerza de recomendación: Fuerte a favor
Realizar otros paraclínicos adicionales al hemograma solamente si la condición clínica del paciente lo amerita. Fuerza de recomendación: Fuerte a favor
Secuelas en pacientes pediátricos con LLA que finalizan tratamientoEl incremento de la supervivencia y las posibilidades reales de curación de los niños con LLA ha hecho que se preste más atención a los efectos a largo plazo de su tratamiento. La poliquimioterapia y la radioterapia pueden originar secuelas orgánicas relacionadas con el crecimiento y desarrollo, la capacidad intelectual, la función cardiopulmonar y la función gonadal, y pueden aparecer además neoplasias secundarias y afectaciones de distintos aparatos y sistemas.
Desde el punto de vista psicológico y social se destacan problemas escolares, dificultades laborales, conflictos psicosociales y crisis de autoestima42,43.
Se recomiendaSeguimiento para todos los pacientes tratados con quimioterapia y/o radioterapia por riesgo de desarrollar secuelas: talla baja, osteonecrosis, obesidad, diabetes, alteraciones del desarrollo sexual u otros trastornos hormonales, que deben ser valorados por endocrinología pediátrica. Grado de recomendación: B
Seguimiento para todos los pacientes tratados con quimioterapia y/o radioterapia por riesgo de desarrollar secuelas neuropsicológicas: valoración por neuropediatría y neuropsicología. Grado de recomendación: C
Que los pacientes tratados con quimioterapia y/o radioterapia deben tener un seguimiento médico por riesgo de desarrollar segunda neoplasia. Grado de recomendación: C
A las instituciones educativas brindar a los pacientes el apoyo académico ajustado de acuerdo a las necesidades durante y después del tratamiento. Buena práctica
Fuente de financiaciónEl desarrollo de la presente guía ha sido financiado por el Ministerio de la Protección Social y el Departamento Administrativo de Ciencia, Tecnología e Innovación COLCIENCIAS, mediante Contrato No. 1609 de 2010 suscrito con la Universidad Nacional de Colombia, institución seleccionada entre quienes se presentaron a la convocatoria 500 de 2009 para la elaboración de Guías de Atención Integral GAI en el Sistema General de Seguridad Social en Salud.
Declaración de conflictos de interésLos responsables y participantes en la generación de las recomendaciones de esta guía declaramos no tener conflictos de interés frente a las mismas, no estar involucrados como investigadores en ensayos clínicos en curso sobre el tema, no haber recibido donaciones o beneficios por parte de los grupos interesados en las recomendaciones y no hacer parte de grupos profesionales con conflictos de interés. La elaboración, desarrollo y publicación de las recomendaciones contaron con el soporte financiero exclusivo del Ministerio de la Protección Social y el Departamento Administrativo de Ciencia, Tecnología e Innovación COLCIENCIAS y los derechos de autor son propiedad de los mismos.
Participantes de esta GPC: Líder General: Adriana Linares B; Coordinador Metodológico: Marcela Torres A; Investigador Cualitativo: Helvert Felipe Molina L; Líder Guía de LLA: Martha Vizcaíno V; Colaboradores: Leila Martínez, John Lopera, Iliana de los Reyes, Pablo Vásquez, Fernando Peralta Pizza, Winston Torres, Diana Duarte; Coordinador Epidemiológico: Jhon Feliciano; Director General: Rodrigo Pardo T; Coordinadora Académica: Paola Andrea Mosquera; Coordinador de Guías: Edgar Cortés R; Gerente Administrativo: Ricardo Losada S; Documentalista: Sara Julieta Romero; Equipo De Evaluaciones Económicas: Mario García, Liliana Alejandra Chicaiza, Jorge Augusto Díaz, Carlos Javier Rincón, Giancarlo Romano, José Ricardo Urrego, Jairo Alexander Moreno, Nelly Astrid Moreno, Mabel Juliet Moreno, Sandra Paola Oviedo, Víctor Alfonso Prieto, Hoover Quitian; Equipo de Comunicaciones: Carlos Hernán Caicedo Escobar, Vivian Marcela Molano Soto.