La terapia fotodinámica (TFD) es un método tópico, no invasivo y selectivo para lesiones orales potencialmente malignas, el objetivo de esta revisión bibliográfica es el de revisar la evidencia científica existente sobre el empleo de la terapia fotodinámica (TFD) en el tratamiento de dichas lesiones orales.
Se realizó una búsqueda bibliográfica en Pubmed, limitando la búsqueda a los últimos 20 años. Se incluyeron 24 artículos entre estudios y reportes de casos.
Utilizando diferentes fuentes de luz para la activación del fotosensibilizante acumulado en las células a tratar, prácticamente todos los estudios revisados encontraron buenos resultados, clínicos y estéticos, con efectos adversos leves (dolor) y con reducciones tanto de la incidencia como de la gravedad de las lesiones orales encontradas.
Photodynamic therapy (PDT) is a topical, non-invasive and selective method for potentially malignant oral lesions. The aim of this article is to present a literature review of the scientific evidence for the use of photodynamic therapy (PDT) in the treatment of these oral lesions.
A literature search was conducted in PubMed, limiting the search to the last 20 years. Finally, 24 articles including studies and case reports were selected.
Using different light sources for the activation of the photosensitising agent accumulated in the cells to treat, practically all of the studies reviewed showed good clinical and aesthetic results, with minor adverse effects (pain) and with reductions in both incidence and severity of the oral lesions found.
La terapia fotodinámica (TFD) es una técnica terapéutica de dos pasos: la aplicación de un fotosensibilizante (FS) tópico o sistémico que se administra por vía sistémica (intravenosa u oral) o de forma tópica y es acumulado en el tejido diana por un período de tiempo1 y la irradiación con luz visible, en una dosis que no es dañina, que se aplica a través de una fuente de luz con una longitud de onda adecuada sobre el tejido diana para la activación del fotosensibilizante y producir la muerte celular de las células que absorben el FS2. Es en este punto cuando la sustancia FS transfiere la energía de la luz al oxígeno del tejido generando radicales libres y formas de oxígeno altamente reactivas al proceso y que se llamarán oxígeno singlete y otras especies reactivas de oxígeno que son las que causan efectos citotóxicos en los tejidos diana2.
Los FS son sustancias naturales o sintéticas con componentes fotoactivos. Existen numerosos tipos y los más comunes son las tinturas médicas, porfirinas y clorinas. Los FS tópicos más utilizados son el AAL y metil aminolevulinato (MAL). El AAL es un aminoácido endógeno sintetizado en la mitocondria de la célula a partir de glicina y succinil CoA; es hidrofílico y en sí mismo no es un FS pero es metabolizado a protoporfirina IX (PpIX) fotosensible a través del metabolismo biosintético del hemo3. El MAL corresponde a un metil éster de AAL; es un compuesto lipofílico que se transporta por difusión transmembrana pasiva que es un mecanismo que no requiere energía y es insaturable. Poco después de la penetración celular el MAL es demetilado a AAL por lo que los mecanismos metabólicos subsecuentes son los explicados anteriormente1,4.
La tasa de síntesis de porfirina inducida por el AAL y su acumulación en los tejidos es más alta en células malignas y premalignas. Ello hace al AAL una sustancia útil en el diagnóstico de neoplasias y células displásicas2.
Los FS sistémicos tienen una estructura química tetrapirólica y se administran preferiblemente por vía intravenosa. Este grupo incluye los derivados de hematoporfirinas naturales o “FS de primera generación” Photofrin® y un amplio grupo de compuestos sintéticos o “FS de segunda generación”2 que son compuestos sintetizados químicamente como puros y tienen composición constante.
Las fuentes de luz en TFD deben considerar estos factores: el espectro de absorción del FS y la longitud de onda y profundidades de penetración de la luz en tejidos diana4. Las fuentes de luz disponibles para TFD pertenecen a tres grandes grupos: lámparas de banda ancha, LED y láseres. Los dos primeros son fuentes de luz no coherentes y el último es luz coherente4. Las longitudes de onda en el rango de los 600-800nm (ventana terapeútica) son consideradas óptimas para la TFD y en este rango la energía de cada fotón es lo suficientemente alta para excitar al FS y a la vez lo suficientemente baja para que la luz penetre en el tejido5.
Los efectos citotóxicos en la TFD son dependientes del oxígeno. Cuando el FS absorbe un fotón, activa las moléculas del oxígeno desde su estado de reposo a un estado de excitación corto o singlete y a un estado de excitación relativamente más largo que el anterior o estado triplete del oxígeno1. La citotoxicidad en la TFD ocurre a través de dos mecanismos de reacción oxidativa principalmente2:
Reacción tipo I: ocurre cuando en un estado de triplete oxidado el FS puede reaccionar con un sustrato como la membrana celular y transferir un electrón o un protón para formar un catión o anión respectivamente.
Reacción tipo II: ocurre cuando los radicales anteriores reaccionan posteriormente con oxígeno para producir oxígeno tóxico y otras especies de oxígeno reactivas como peróxido de hidrógeno, superóxido y radicales hidroxilos.
Alternativamente el FS excitado puede transferir directamente su energía al oxígeno para producir oxígeno singlete. Estas reacciones suelen ocurrir simultáneamente y es difícil diferenciarlas.
Los mecanismos de muerte celular relacionados con la citotoxicidad de la TFD son apoptosis, necrosis y autofagia2. Una dosis de luz baja y una concentración de FS baja causan muerte celular por apoptosis, mientras que una concentración más alta de estos factores llevan a muerte celular relacionada con necrosis2,4,6. Las principales ventajas de la técnica son la ausencia o escasa cicatrización, necrosis de los tejidos altamente selectiva, realización del tratamiento de forma ambulatoria, y la posibilidad de repetir la terapia cuantas veces como sea necesario sin crear resistencia7.
El efecto adverso principal de la TFD es el dolor, pues durante el procedimiento hay sensación de disconfort e inmediatamente después de la irradiación el área se torna eritematosa y edematosa como componente normal de la reacción fototóxica7. El dolor no es significativo hasta el momento en el que empieza la radiación y la mayoría de los pacientes completa el tratamiento sin alivio del dolor. La TFD con MAL es menos dolorosa que con AAL, que induce a una mayor fluorescencia de PpIX8.
El objetivo de la investigación fue revisar la evidencia científica existente sobre la utilización de la TFD en las lesiones orales potencialmente malignas, liquen plano oral, leucoplasia y queilitis actínica, dado el auge de la TFD en el tratamiento de lesiones malignas y premalignas.
Material y métodoPara realizar una búsqueda bibliográfica limitada a los últimos 20 años (1994 - marzo 2014) de artículos en español e inglés que traten sobre el tratamiento de las lesiones orales potencialmente malignas con TFD se consultó la base de datos MEDLINE/Pubmed (Ebsco host).
Las palabras clave empleadas fueron “photodynamic therapy”, “oral leukoplakia”, “oral lichen planus” y “actinic cheilitis”. Se incluyeron artículos publicados en español e inglés en los últimos 20 años. Se excluyeron artículos que tratasen de otro tipo de terapias o de tratamiento de lesiones malignizadas o con displasia.
ResultadosSe revisaron 24 estudios clasificados de la siguiente manera:
TFD y liquen plano oral
Reporte de caso: 1
Estudios prospectivos: 4
TFD y leucoplasia oral
Estudios prospectivos: 7
Estudio experimental no controlado y no aleatorizado: 1
TFD y queilitis actínica
Reporte de caso: 4 estudios
Estudios prospectivos: 6
Estudio experimental no controlado y no aleatorizado: 1
La TFD ha ido emergiendo como tratamiento de lesiones orales potencialmente malignas. Algunos estudios han utilizado fotosensibilizantes tópica o sistémicamente administrados para tratar lesiones displásicas en la cavidad oral aunque hasta el momento ningún FS ha obtenido la aprobación de la FDA o de la AEM para estos usos clínicos2. Entre los problemas encontrados en estos estudios incluyen el pequeño tamaño de la muestra, variaciones entre las patologías y tiempos cortos de seguimiento2.
La aplicación tópica de AAL en forma de emulsión en concentraciones al 10% y al 20% es la forma más común de realizar TFD en lesiones displásicas reportada en la literatura; sin embargo, no existen protocolos consensuados2,9.
Para poder impulsar a la TFD a la primera línea de tratamiento de las lesiones potencialmente malignas se necesita considerar la creación de protocolos en cuanto a: esquemas de iluminación, número de ciclos de tratamiento, período de incubación del FS y fuente de luz. Otros factores a considerar son el tamaño de la lesión a tratar, el espesor de la superficie queratinizada y la presencia o grado de displasia epitelial2.
En cuanto a los tipos de lesiónLin et al. (2010) reportan que el tamaño de la lesión es un factor significativamente influyente en el número de sesiones de TFD. Shafirstein et al. (2011) observaron que las lesiones delgadas y superficiales muestran respuestas mucho mejores que lesiones más grandes e hiperqueratósicas. Para lesiones de mayor espesor se recomienda un FS más poderoso como mTHPC o porfirina sódica2.
Otro reto en la aplicación de la TFD en lesiones potencialmente malignas es la anatomía de la cavidad oral debido a que es difícil de realizar la distribución uniforme y precisa de la fuente de luz en regiones específicas de la boca durante sesiones repetidas y prolongadas, así como el acceso a zonas posteriores linguales y mucosas para que la fuente de luz sea colocada en el ángulo correcto y permita la activación del FS2.
Sobre la elección del FSEl AAL es eliminado del tejido diana y del organismo en las primeras 48 horas, lo que resulta en una fotosensibilidad de la piel corta y esto lo hace superior a otros FS. La presentación tópica de AAL se usa ampliamente en lesiones de la cavidad oral porque el acceso a las mismas es más fácil de obtener y los efectos sistémicos de la administración del FS se pueden evitar2. Se deben tomar en cuenta algunas consideraciones para que el FS tópico sea retenido en la lesión dentro de la cavidad oral y prevenir la disolución del mismo por parte de la saliva durante los 30-60 minutos que el FS permanece en la cavidad oral2. Otro gran reto de la TFD tópica es la profundidad del tratamiento, especialmente cuando es aplicado en lesiones gruesas hiperqueratósicas. Es esencial que el FS llegue a la capa epitelial basal donde se encuentra mayor cantidad de células genéticamente alteradas y con capacidad de transformación maligna2.
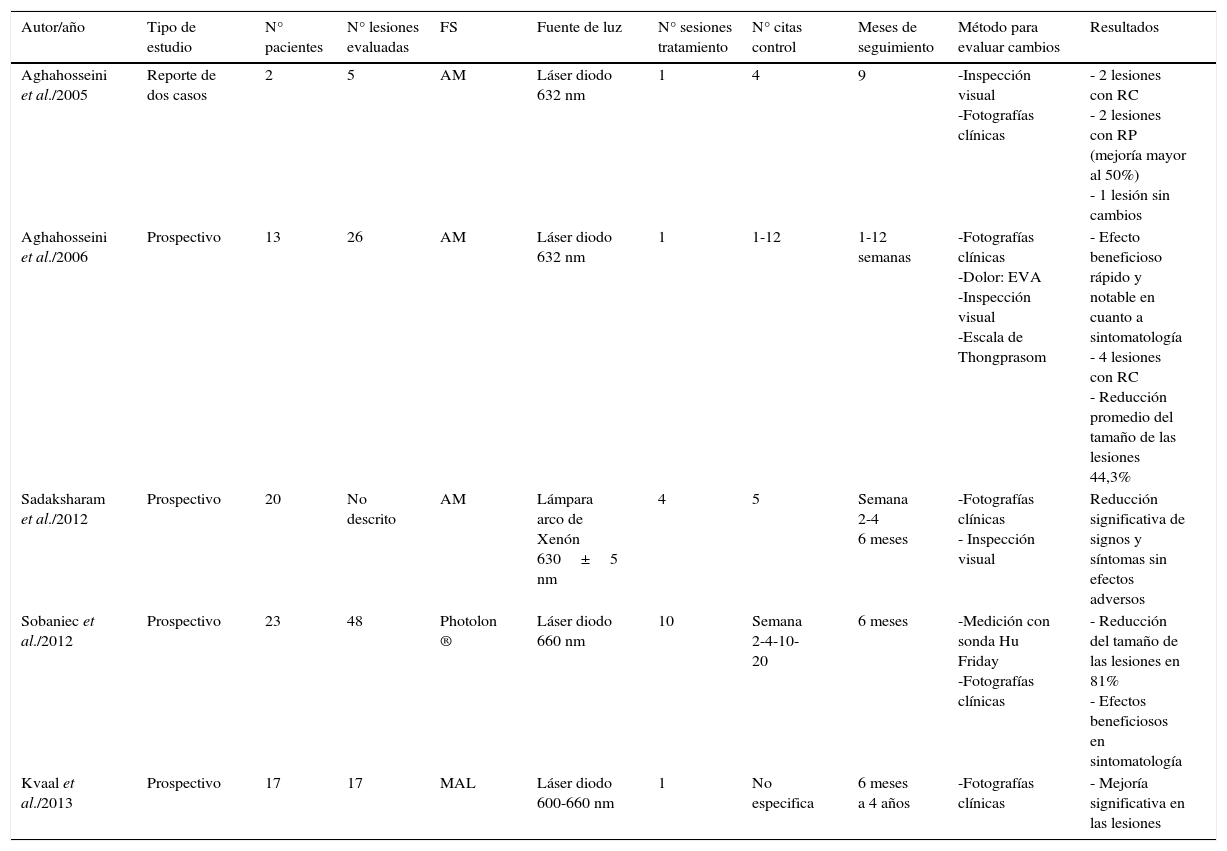
TFD y liquen plano oral (LPO)Los estudios encontrados para evaluar la eficacia de la TFD en el tratamiento del LPO y sus características principales se exponen en la tabla 1:
Estudios que utilizan TFD para el tratamiento del LPO
| Autor/año | Tipo de estudio | N° pacientes | N° lesiones evaluadas | FS | Fuente de luz | N° sesiones tratamiento | N° citas control | Meses de seguimiento | Método para evaluar cambios | Resultados |
|---|---|---|---|---|---|---|---|---|---|---|
| Aghahosseini et al./2005 | Reporte de dos casos | 2 | 5 | AM | Láser diodo 632 nm | 1 | 4 | 9 | -Inspección visual -Fotografías clínicas | - 2 lesiones con RC - 2 lesiones con RP (mejoría mayor al 50%) - 1 lesión sin cambios |
| Aghahosseini et al./2006 | Prospectivo | 13 | 26 | AM | Láser diodo 632 nm | 1 | 1-12 | 1-12 semanas | -Fotografías clínicas -Dolor: EVA -Inspección visual -Escala de Thongprasom | - Efecto beneficioso rápido y notable en cuanto a sintomatología - 4 lesiones con RC - Reducción promedio del tamaño de las lesiones 44,3% |
| Sadaksharam et al./2012 | Prospectivo | 20 | No descrito | AM | Lámpara arco de Xenón 630±5 nm | 4 | 5 | Semana 2-4 6 meses | -Fotografías clínicas - Inspección visual | Reducción significativa de signos y síntomas sin efectos adversos |
| Sobaniec et al./2012 | Prospectivo | 23 | 48 | Photolon ® | Láser diodo 660 nm | 10 | Semana 2-4-10-20 | 6 meses | -Medición con sonda Hu Friday -Fotografías clínicas | - Reducción del tamaño de las lesiones en 81% - Efectos beneficiosos en sintomatología |
| Kvaal et al./2013 | Prospectivo | 17 | 17 | MAL | Láser diodo 600-660 nm | 1 | No especifica | 6 meses a 4 años | -Fotografías clínicas | - Mejoría significativa en las lesiones |
RC: Remisión completa; RP: Respuesta parcial.
Aghahosseini et al. en 200510 trataron a dos pacientes con cinco lesiones de LPO mediante TFD tópica usando 0,05 gramos de azul de metileno (AM) por 100 cc como FS. Los pacientes hicieron gárgaras con esta solución durante cinco minutos en los diez minutos previos a la irradiación con láser. Estos mismos autores11 realizaron otro estudio prospectivo de 26 lesiones de LPO que se sometieron a una sesión de TFD con AM. En los 10 minutos previos a la irradiación con láser se les pidió a los pacientes que realizaran gárgaras con una solución de AM en agua al 5% de concentración durante 5 minutos para posteriormente irradiar las lesiones. El cambio de algunas lesiones de tipo erosivo a lesiones atróficas disminuye el potencial de malignización de las mismas por lo que los autores pueden suponer que la TFD con AM disminuye el riesgo de transformación maligna de LPO.
Sadaksharam et al. en 201212 realizaron un estudio clínico del tratamiento del LPO con TFD empleando AM. Se incluyeron 20 pacientes en el estudio que buscaban un tratamiento para los síntomas de LPO como dolor y sensación de ardor. El AM se preparó mezclando 0,05 gramos del mismo en 100ml de agua. Diez minutos antes de la irradiación con la fuente de luz se les pidió a los pacientes que realizaran gárgaras con la solución de AM durante 5 minutos. Los autores encontraron una respuesta significativa en lesiones de corta duración.
Sobaniec et al. en 2013 13 realizaron un estudio para la valoración clínica de la eficacia de la TFD en el tratamiento del LPO, utilizando como FS Photolon® gel (20% cloro e6 y 10% de dimetil sulfóxido). La TFD empleando Photolon® no tiene efectos adversos, comparado con otros protocolos, en especial los que usan AAL como FS (donde los pacientes suelen referir dolor agudo post TFD, eritema e inflamación) puede ser un tratamiento beneficioso para pacientes con un curso crónico de la enfermedad.
Kvaal et al. en el 201314 realizaron un estudio cuyo FS fue MAL en crema. Una vez aplicada, el lugar de estudio fue cubierto con puntas o rollos de algodón por 15 minutos y se repitió la aplicación de la crema después de una hora. La irradiación se realizó tres horas después de la primera aplicación del FS. Todos los pacientes mejoraron después de tres meses. La ventaja de la TFD con MAL en el LPO es que solo requiere de una sesión de tratamiento y la mejoría en las lesiones perduró a lo largo de los controles realizados en el presente estudio.
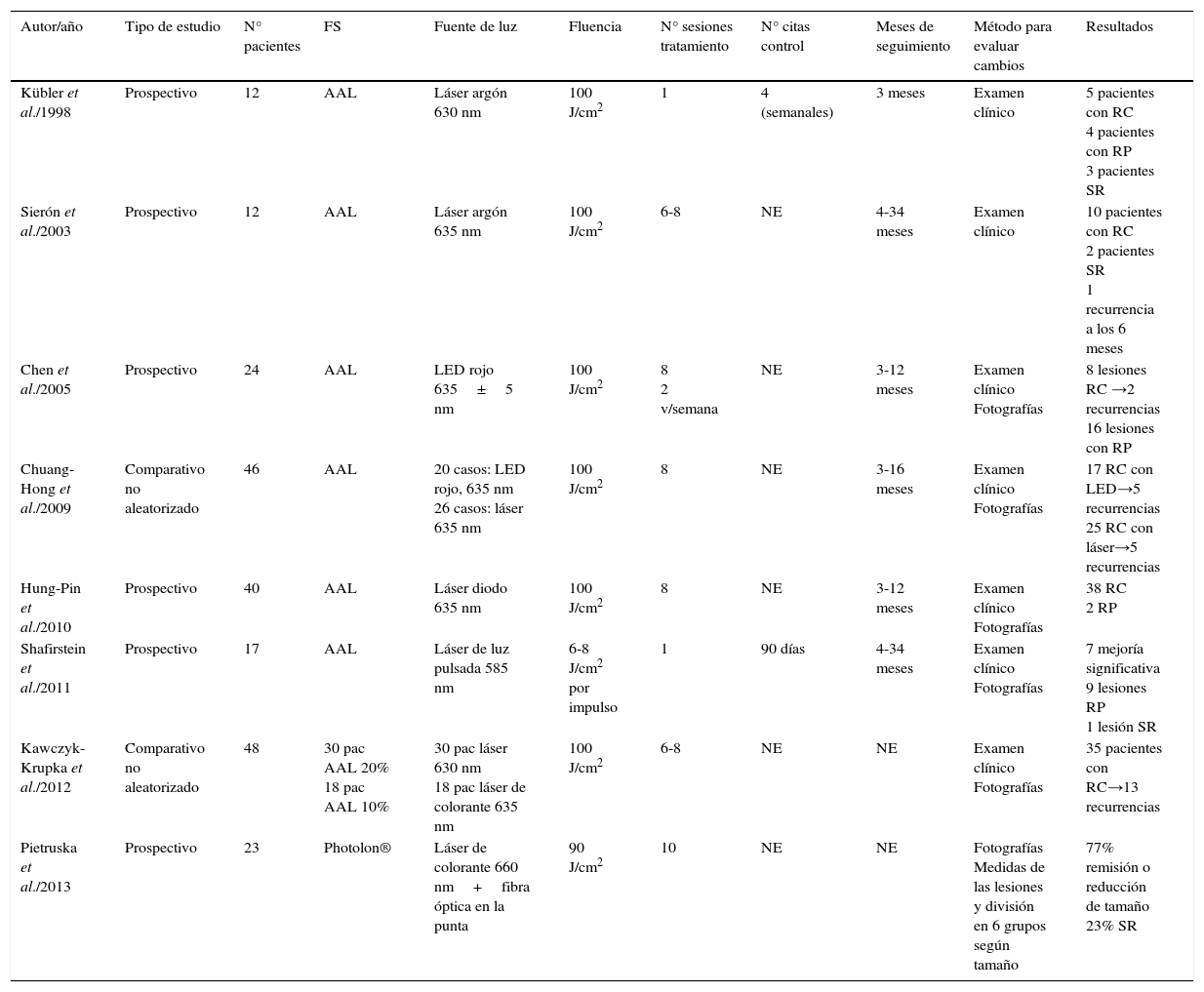
TFD y leucoplasia oral (LO)Los estudios encontrados para evaluar la eficacia de la TFD en el tratamiento de la LO y sus características principales se exponen en la tabla 2:
Estudios que utilizan TFD para el tratamiento de LO
| Autor/año | Tipo de estudio | N° pacientes | FS | Fuente de luz | Fluencia | N° sesiones tratamiento | N° citas control | Meses de seguimiento | Método para evaluar cambios | Resultados |
|---|---|---|---|---|---|---|---|---|---|---|
| Kübler et al./1998 | Prospectivo | 12 | AAL | Láser argón 630 nm | 100 J/cm2 | 1 | 4 (semanales) | 3 meses | Examen clínico | 5 pacientes con RC 4 pacientes con RP 3 pacientes SR |
| Sierón et al./2003 | Prospectivo | 12 | AAL | Láser argón 635 nm | 100 J/cm2 | 6-8 | NE | 4-34 meses | Examen clínico | 10 pacientes con RC 2 pacientes SR 1 recurrencia a los 6 meses |
| Chen et al./2005 | Prospectivo | 24 | AAL | LED rojo 635±5 nm | 100 J/cm2 | 8 2 v/semana | NE | 3-12 meses | Examen clínico Fotografías | 8 lesiones RC →2 recurrencias 16 lesiones con RP |
| Chuang-Hong et al./2009 | Comparativo no aleatorizado | 46 | AAL | 20 casos: LED rojo, 635 nm 26 casos: láser 635 nm | 100 J/cm2 | 8 | NE | 3-16 meses | Examen clínico Fotografías | 17 RC con LED→5 recurrencias 25 RC con láser→5 recurrencias |
| Hung-Pin et al./2010 | Prospectivo | 40 | AAL | Láser diodo 635 nm | 100 J/cm2 | 8 | NE | 3-12 meses | Examen clínico Fotografías | 38 RC 2 RP |
| Shafirstein et al./2011 | Prospectivo | 17 | AAL | Láser de luz pulsada 585 nm | 6-8 J/cm2 por impulso | 1 | 90 días | 4-34 meses | Examen clínico Fotografías | 7 mejoría significativa 9 lesiones RP 1 lesión SR |
| Kawczyk- Krupka et al./2012 | Comparativo no aleatorizado | 48 | 30 pac AAL 20% 18 pac AAL 10% | 30 pac láser 630 nm 18 pac láser de colorante 635 nm | 100 J/cm2 | 6-8 | NE | NE | Examen clínico Fotografías | 35 pacientes con RC→13 recurrencias |
| Pietruska et al./2013 | Prospectivo | 23 | Photolon® | Láser de colorante 660 nm+fibra óptica en la punta | 90 J/cm2 | 10 | NE | NE | Fotografías Medidas de las lesiones y división en 6 grupos según tamaño | 77% remisión o reducción de tamaño 23% SR |
RC: Remisión completa; RP: Respuesta parcial; SR: Sin respuesta; NE: No especificado.
Kübler et al. en 199815 utilizaron AAL como FS en una sola sesión de tratamiento. El FS se disolvió en una crema (eucerin® anhídrido) en una concentración del 20% y pH 5. Esta preparación se realizó como máximo una hora antes de cada tratamiento y se dejaba actuar por dos horas.
Sierón et al. en 200316 utilizaron AAL en una emulsión de aceite en agua al 10% de producto aplicándolo en una fina capa tópicamente sobre las lesiones y 4mm de tejido sano circundante. Las lesiones fueron cubiertas con una lámina de papel albal autoadhesiva durante cuatro horas y transcurrido este tiempo se procedió a la irradiación.
Chen et al. en 200517 realizaron un estudio en 24 pacientes que tenían como hábito la masticación de nuez de betel y ser fumadores. Durante el estudio dejaron la nuez de betel pero continuaron fumando. En cuanto al FS, los autores realizaron un gel con 25% de Pluronic F127 y 1% de Carbopol 971P en el que se mezclaron 200mg de AAL por cada 800mg del gel y se colocó la mezcla en jeringas de 1 cc sin agujas. Esta preparación se realiza el día de la TFD. El gel en el que se preparó el AAL se adhiere a la mucosa oral y es parcialmente resistente a la dilución de la saliva, lo que ayudó a la absorción del FS en la superficie de la lesión. Los autores refieren que los resultados clínicos insatisfactorios pueden ser debido al aspecto clínico y a la estructura interna de las lesiones de LO.
Chuan-Hang et al. en 200918: realizaron un estudio comparativo no aleatorizado que buscó comparar los resultados clínicos de 46 lesiones de eritroleucoplasia (EL) con TFD usando AAL como FS siguiendo el mismo patrón de preparación del estudio anterior.
Shafirstein et al. en 201119: realizaron un estudio del tratamiento de LO con AAL como FS en una solución al 20% que se embebió en una gasa que fue colocada directamente sobre la lesión por 1,5 horas.
Kawczyk-Krupka et al. en 201220: realizaron un estudio comparativo no aleatorizado del tratamiento de LO con TFD y crioterapia. Los pacientes que recibieron TFD se dividieron en 2 grupos: en 30 pacientes se realizó la TFD con la aplicación tópica de AAL al 20% por 2 horas antes de iniciar la irradiación y el otro grupo de 18 pacientes recibió AAL al 10% siguiendo el mismo protocolo. Ambas formas de tratamiento fueron bien toleradas por la mayoría de los pacientes, pues en los pacientes con TFD se observó edema y eritemas localizados y un 30% de los pacientes presentó dolor agudo post irradiación. Se puede concluir que las ventajas de la TFD se relacionan con el carácter mínimamente invasivo y localizado del tratamiento. Los autores también concluyen que la TFD es más conveniente para los pacientes, menos dolorosa y ofrece mejores resultados estéticos.
Pietruska et al. en 201321: realizaron un estudio para evaluar la respuesta clínica de la LO a la TFD utilizando Chlorine e6 (Photolon®) como FS, que es un gel que se aplica directamente sobre la lesión y el tejido sano adyacente en una capa de 2mm de espesor.
Los autores señalan que a pesar de que las propiedades de Photolon® parecen ser más ventajosas que las de las porfirinas, este FS es raramente utilizado en la TFD. En este estudio se escogió el Photolon® como FS ya que su absorción de luz en varias longitudes de onda conlleva a mejores efectos terapéuticos ya que puede alcanzar lesiones localizadas en planos más profundos sin incrementar su fototoxicidad.
Wong et al. en 201322: publicaron la primera fase de un ensayo clínico que examinaba la TFD con AAL para tratar LO buscando obtener la dosis máxima tolerada y la toxicidad de los componentes de la TFD. Los autores mencionan que en trabajos anteriores no se examina la toxicidad en relación con la dosis óptima o el esquema de la intensidad lumínica. El objetivo de su trabajo es determinar la intensidad óptima de luz, toxicidad, tolerabilidad y asociación con factores de riesgo mucosos de la TFD en LO utilizando una dosis fija de AAL por vía oral. El estudio no cumplió con sus objetivos en cuanto a la dosis de luz óptima para el tratamiento de LO.
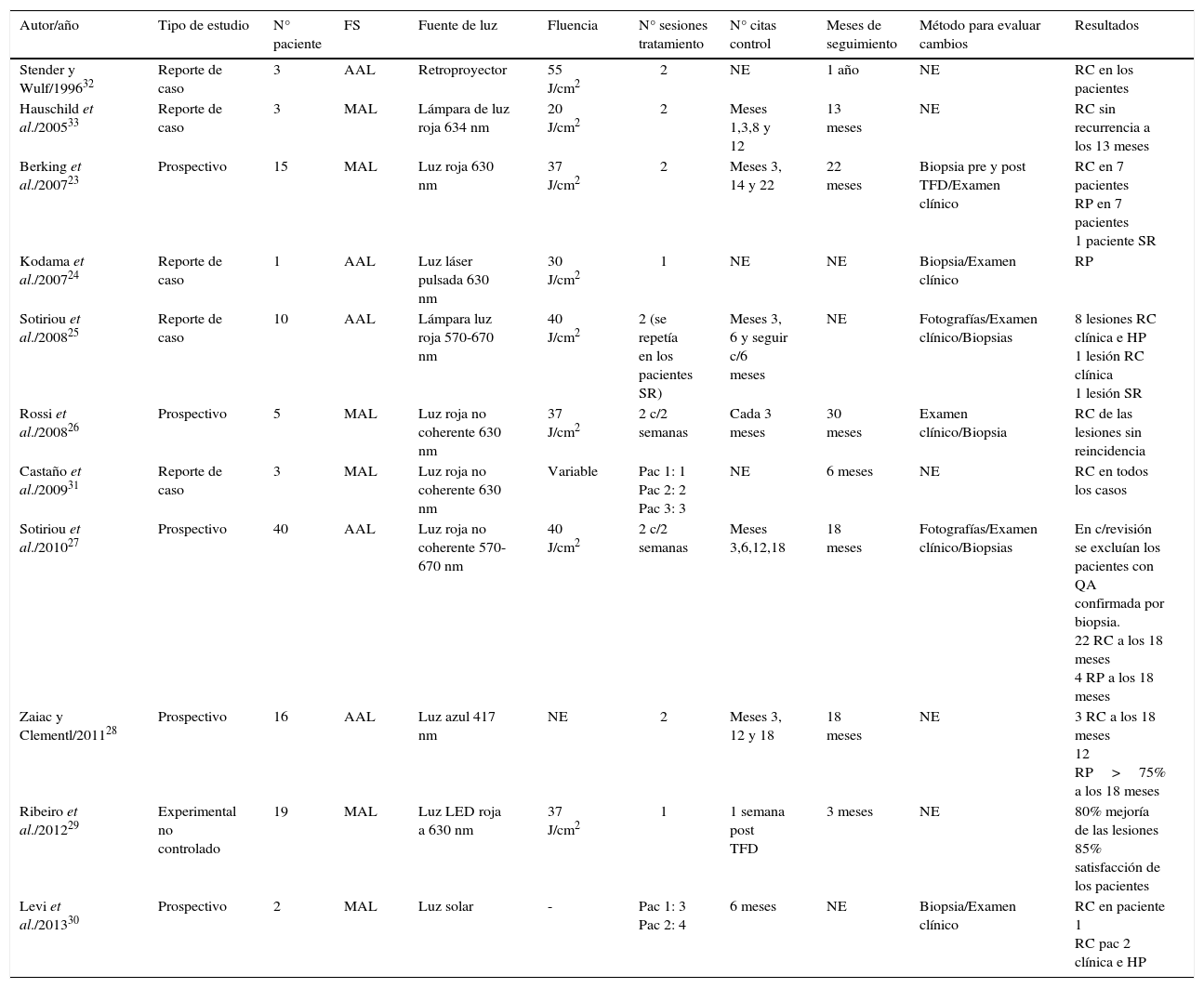
TFD y queilitis actínica (QA)Los estudios encontrados para evaluar la eficacia de la TFD en el tratamiento de la QA y sus características principales se exponen en la tabla 3:
Relación de los estudios TFD como tratamiento de QA
| Autor/año | Tipo de estudio | N° paciente | FS | Fuente de luz | Fluencia | N° sesiones tratamiento | N° citas control | Meses de seguimiento | Método para evaluar cambios | Resultados |
|---|---|---|---|---|---|---|---|---|---|---|
| Stender y Wulf/199632 | Reporte de caso | 3 | AAL | Retroproyector | 55 J/cm2 | 2 | NE | 1 año | NE | RC en los pacientes |
| Hauschild et al./200533 | Reporte de caso | 3 | MAL | Lámpara de luz roja 634 nm | 20 J/cm2 | 2 | Meses 1,3,8 y 12 | 13 meses | NE | RC sin recurrencia a los 13 meses |
| Berking et al./200723 | Prospectivo | 15 | MAL | Luz roja 630 nm | 37 J/cm2 | 2 | Meses 3, 14 y 22 | 22 meses | Biopsia pre y post TFD/Examen clínico | RC en 7 pacientes RP en 7 pacientes 1 paciente SR |
| Kodama et al./200724 | Reporte de caso | 1 | AAL | Luz láser pulsada 630 nm | 30 J/cm2 | 1 | NE | NE | Biopsia/Examen clínico | RP |
| Sotiriou et al./200825 | Reporte de caso | 10 | AAL | Lámpara luz roja 570-670 nm | 40 J/cm2 | 2 (se repetía en los pacientes SR) | Meses 3, 6 y seguir c/6 meses | NE | Fotografías/Examen clínico/Biopsias | 8 lesiones RC clínica e HP 1 lesión RC clínica 1 lesión SR |
| Rossi et al./200826 | Prospectivo | 5 | MAL | Luz roja no coherente 630 nm | 37 J/cm2 | 2 c/2 semanas | Cada 3 meses | 30 meses | Examen clínico/Biopsia | RC de las lesiones sin reincidencia |
| Castaño et al./200931 | Reporte de caso | 3 | MAL | Luz roja no coherente 630 nm | Variable | Pac 1: 1 Pac 2: 2 Pac 3: 3 | NE | 6 meses | NE | RC en todos los casos |
| Sotiriou et al./201027 | Prospectivo | 40 | AAL | Luz roja no coherente 570-670 nm | 40 J/cm2 | 2 c/2 semanas | Meses 3,6,12,18 | 18 meses | Fotografías/Examen clínico/Biopsias | En c/revisión se excluían los pacientes con QA confirmada por biopsia. 22 RC a los 18 meses 4 RP a los 18 meses |
| Zaiac y Clementl/201128 | Prospectivo | 16 | AAL | Luz azul 417 nm | NE | 2 | Meses 3, 12 y 18 | 18 meses | NE | 3 RC a los 18 meses 12 RP>75% a los 18 meses |
| Ribeiro et al./201229 | Experimental no controlado | 19 | MAL | Luz LED roja a 630 nm | 37 J/cm2 | 1 | 1 semana post TFD | 3 meses | NE | 80% mejoría de las lesiones 85% satisfacción de los pacientes |
| Levi et al./201330 | Prospectivo | 2 | MAL | Luz solar | - | Pac 1: 3 Pac 2: 4 | 6 meses | NE | Biopsia/Examen clínico | RC en paciente 1 RC pac 2 clínica e HP |
RC: Remisión completa; RP: Respuesta parcial; SR: Sin respuesta; NE: No especificado.
Berking et al. en 200723: realizaron un estudio con 15 pacientes con QA (con una afectación mínima del 50% del labio) aplicando TFD con MAL como FS que se aplicó sobre la lesión con un hisopo, luego se cubre con un vendaje de polietileno autoadhesivo y encima se coloca papel de aluminio para proteger la zona de la radiación lumínica del ambiente. Pasadas tres horas se remueve el recubrimiento, se coloca anestesia local (inyección de mepivacaina 1% 5-15ml) antes de realizar la irradiación. Los autores confirman con este estudio las diversas ventajas de la TFD sobre otras opciones: efectos adversos medios tolerados bastante bien por los pacientes, una alta tasa de satisfacción con el resultado y que es una técnica ambulatoria y sencilla de realizar.
Kodama et al. en 200724: hicieron el reporte de un caso de un paciente con QA tratada con TFD. El FS utilizado fue AAL en solución al 20%. Una vez aplicada la solución sobre la lesión se cubre con un envoltorio de celofán y sobre este se pone papel de aluminio durante dos horas; pasado este tiempo se irradia la lesión.
Sotoriou et al. en 200825: realizaron un reporte de 10 casos de QA tratada con TFD mediante aplicación tópica de AAL al 20% en todo el labio inferior, sellando el labio con un recubrimiento de celofán y papel de aluminio. Antes de aplicar el FS se removieron cuidadosamente escamas y costras de los labios. Tres horas después de empezar el tratamiento se aplicó la fuente de luz.
Rossi et al. en 200826: hicieron un estudio con 5 pacientes. Una vez preparado el labio, se aplicaba sobre la lesión y 5mm del tejido adyacente una capa de aproximadamente 1mm de MAL (Metvix®) y se cubre con un apósito oclusivo. Después de tres horas, se procede a la irradiación de la lesión. Los pacientes del estudio tuvieron una respuesta óptima al tratamiento con curación completa de la lesión y excelente estética.
Sotiriou et al. en 201027: realizaron un estudio con 40 pacientes en los que la TFD se realiza con AAL al 20% en crema que se aplicó en el labio inferior entero durante tres horas, el labio se cubre con apósitos para que la luz del ambiente no active el FS. A las tres horas se retiraron los apósitos y el exceso de crema y se procedió a la radiación de las lesiones. Los pacientes midieron el dolor que sintieron mediante la EVA, una hora antes de la irradiación se le dió a los pacientes 1 gramo de paracetamol.
Zaiac y Clement en 201128: realizaron un estudio prospectivo con 16 pacientes que recibieron 2 sesiones de TFD con una separación de 3 a 5 semanas entre ellas. Para la primera sesión de TFD se aplicaba AAL (Levulan®) siguiendo las recomendaciones del fabricante y se dejaba actuar durante una hora y transcurrido este tiempo el área tratada fue irradiada. Para la segunda sesión el tiempo de incubación del AAL se aumentó a 90 minutos. Como efectos adversos se reportaron costras muy pequeñas en algunos pacientes; no hubo infecciones ni enrojecimiento severo, tampoco se observó dolor durante la TFD.
Ribeiro et al. en 201229: realizaron un estudio experimental y no controlado utilizando crema MAL al 16% en las lesiones del labio inferior y 5mm de tejido adyacente sano en un cuarto oscuro, una vez colocado el FS se cubre la zona con papel film y encima una gasa para mantener la luz del ambiente fuera del labio. Tres horas después se aplica la fuente de luz.
Levi et al. en 201330: reportaron 2 casos de QA tratada con TFD activada por la luz solar ya que en la literatura se han reportado buenos resultados con esta modalidad en el tratamiento de la queratosis actínica y buscando evitar el dolor que es el principal efecto adverso de la TFD.
Por todo lo discutido anteriormente se podría decir que la TFD se perfila para ser un tratamiento prometedor para las lesiones orales potencialmente malignas revisadas, ya que prácticamente todos los estudios revisados encontraron buenos resultados clínicos (a pesar de presentarse dolor como efecto adverso en algunos casos) y se debe recalcar que los resultados estéticos en el caso de QA por parte de los pacientes son más que satisfactorios.
Como contraparte habría que señalar que los estudios revisados no tienen una buena metodología, los parámetros empleados, los diferentes tipos de pacientes incluidos en los estudios, las diferentes escalas de medición empleadas y los diversos parámetros de uso de fuentes de luz hacen difícil su comparación; además de no encontrar ningún ensayo clínico aleatorizado controlado y doble ciego entre los estudios revisados.
Sería bueno para el reconocimiento de la TFD, como tratamiento de elección en lesiones orales potencialmente malignas, que se realizaran ensayos clínicos controlados aleatorizados con parámetros equivalentes de fuentes de luz, FS y grupos de pacientes similares; así como realizar estudios a largo plazo de la técnica para observar la evolución de las lesiones tratadas, y si es posible lograr disminuir el dolor al momento de la irradiación del FS en la TFD o inmediatamente finalizada la misma que manifiestan la mayoría de los pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.