El pez cebra es un modelo establecido para el estudio del desarrollo en vertebrados y es especialmente útil para la investigación del proceso de hematopoyesis y las enfermedades asociadas a esta. Los linajes principales, los genes y los procesos de desarrollo con los seres humanos son conservados. En los últimos años, el pez cebra se ha utilizado cada vez más como un modelo para estudiar enfermedades hematopoyéticas humanas, incluyendo la leucemia linfoblástica aguda. Esta revisión evidencia la importancia del estudio de esta enfermedad en Colombia debido a las diferencias de la etiología que presenta este tipo de leucemia en comparación con otros países. Además, describe la aplicación del pez cebra como una herramienta alternativa para investigaciones preclínicas de la leucemia linfoblástica aguda. Este modelo es asequible, facilita la experimentación, su manipulación es relativamente simple y tiene gran versatilidad para estudios moleculares y genéticos del cáncer y está disponible en Colombia.
The zebrafish is an established model for the study of vertebrate development, and it is specially useful for the research into haematopoiesis and diseases associated with this process. Major lineages, genes, and developmental processes are conserved between zebrafish and humans. Thus it has been increasingly used as a model for a number of haematopoietic human diseases, such as acute lymphoblastic leukaemia. This review highlights the importance of the study of this disease in Colombia, because of the differences in its aetiology compared to other countries. It also describes the application of the zebrafish as an alternative tool for pre-clinical research of acute lymphoblastic leukaemia. This model is affordable, facilitates experimentation and handling, and is extremely versatile for molecular and genetic studies into cancer, and it is now available in Colombia.
Las leucemias son enfermedades neoplásicas que afectan el tejido hematopoyético y se caracterizan por la proliferación anormal y la detención en el desarrollo de leucocitos en la médula ósea1–4. Esta patología se clasifica de acuerdo al linaje de células afectadas, ya sea mieloide o linfoide y que puede ser originada en células precursoras con alta capacidad de proliferación denominados blastos, o en células con un nivel de diferenciación mayor5. De acuerdo a este nivel de diferenciación de las células tumorales las leucemias se clasifican en agudas y crónicas1,2.
A nivel mundial, según los registros GLOBOCAN 2012, la tasa de incidencia de leucemia es del 4,7% por 100.000 habitantes para ambos sexos y la tasa de mortalidad es de 3,2% por 100.000 habitantes6. Con los tratamientos existentes el 80% de los pacientes con leucemia alcanzan la remisión completa (RC). Sin embargo, entre 40-55% presentan recaídas y aproximadamente solo el 30% alcanza una supervivencia global a 5 años3,7–9.
Colombia es uno de los países con las tasas de incidencia más altas de leucemia en el mundo4,10. En niños menores de 15 años se presentan 6 casos nuevos por cada 100.000 menores y una tasa de mortalidad de 3,5%10. Asimismo, las leucemias ocuparon el octavo lugar de muertes por cáncer en el país durante el periodo del 2000-2006. Mientras que en hombres ocuparon el quinto lugar y en mujeres el séptimo.
Dado que estas estadísticas varían de acuerdo al tipo de leucemia, al grupo de riesgo y al esquema de tratamientos utilizados, es de gran importancia estudiar la biología de esta enfermedad. Es fundamental entender mejor su etiología y de esta manera desarrollar tratamientos más eficientes que mejoren la supervivencia global7,11. Por esta razón, la comunidad científica desde hace más de una década ha buscado mejorar el diagnóstico, el pronóstico y optimizar los tratamientos para los pacientes que padecen esta enfermedad.
Esta revisión se centró en la situación actual de la leucemia linfoblástica aguda (LLA) y en los beneficios del pez cebra como un modelo alternativo y eficiente para estudiar esta y otras neoplasias en Colombia. Para este trabajo se realizaron búsquedas de información en diferentes bases de datos de los estudios realizados durante los últimos diez años relacionados con la etiología y la biología de la LLA.
Situación en ColombiaLa leucemia linfoblástica aguda (LLA) es una de las leucemias más comunes en infantes y es muy agresiva en adultos; esta presenta un panorama desalentador en la población colombiana. La última edición del Atlas de Mortalidad de Cáncer en Colombia, determinó que este tipo de leucemia presenta un comportamiento bimodal donde el mayor número de muertes se encuentra en el grupo de 15-44 años, seguido del grupo de 0-14 años12.
De manera particular, la tasa de incidencia de la LLA se encuentra por encima del promedio mundial con un valor de ∼2,12 por 100.000 habitantes y parece tener una mayor incidencia en hombres que en mujeres, coincidiendo con la de poblaciones hispanas y latinas4,13,14. Sumado a esto, la tasa de incidencia en adultos mayores de 20 años es de ∼1,47 personas por 100.000 habitantes, una de las tasas de incidencia más altas a nivel mundial. Se ha visto que en Colombia los pacientes adultos con LLA corresponden al 57,2% de los casos de leucemia, un porcentaje mucho mayor al 25% de la población global15. Además alcanzan una tasa de RC aproximada del 75% con una supervivencia libre de enfermedad menor al 30%13,15–17.
Por otra parte, de acuerdo con varios registros poblacionales: el 1,6% de los casos de cáncer corresponden a leucemias linfoides; el 0,8% a leucemias mieloides, y el 0,1% a otros tipos de leucemias12,18,19. También, se ha determinado que existen regiones del país con mayor riesgo de incidencia. Estas zonas corresponden principalmente a los departamentos de Quindío, Antioquia, Valle del Cauca, Santander, Norte de Santander, Meta y Bogotá20. Sin embargo, estas localidades han reportado una disminución de la tasa de mortalidad debido a la facilidad de acceso a tratamientos21.
Desafortunadamente los datos obtenidos de los registros y los estudios actuales locales no son extrapolables al resto del país21–23. En la actualidad no se cuentan con datos consolidados o un registro estandarizado para tener un panorama completo de la situación de la LLA en Colombia. A nivel nacional hacen falta procedimientos estandarizados, personal especializado y accesibilidad a las pruebas que permitan un buen diagnóstico y seguimiento de los pacientes con leucemia en el país.
Por esta razón, actualmente el Programa de Investigación e Innovación en Leucemia Aguda y Crónica (PILAC) está realizando un consenso nacional para estandarizar los procedimientos de diagnóstico y los tratamientos para cada grupo etario de pacientes con sospecha o que padecen leucemia en el país24. Se espera que la aplicación de esta guía contribuya a mejorar la supervivencia global de pacientes adultos con LLA, determinando los síntomas, la atención pre-remisión y los procedimientos adecuados para el diagnóstico. También se identificarán y unificarán los factores pronósticos de nuestra población.
Aunque en Colombia se están llevando a cabo estudios destinados a la investigación del cáncer estos aún son insuficientes22,25. Entre los cinco tipos de cáncer asociados con el mayor número de artículos se encuentra la leucemia, de los cuales predominan: las series de casos, los estudios de cohortes y las pruebas diagnósticas en las principales ciudades como Bogotá, Medellín y Cali25–27.
Cabe resaltar que se han realizado análisis de mortalidad de leucemia infantil a nivel nacional con el fin de establecer y evaluar la efectividad de la atención en salud y los efectos de esta atención en el pronóstico de los pacientes28,29. Asimismo, se han venido implementando campañas como el plan de manejo para el control del cáncer en Colombia 2012-2020 y el protocolo centinela de vigilancia en salud pública de leucemias agudas pediátricas con el fin de garantizar un diagnóstico oportuno y un tratamiento adecuado para los pacientes pediátricos y adultos10,15,24,30.
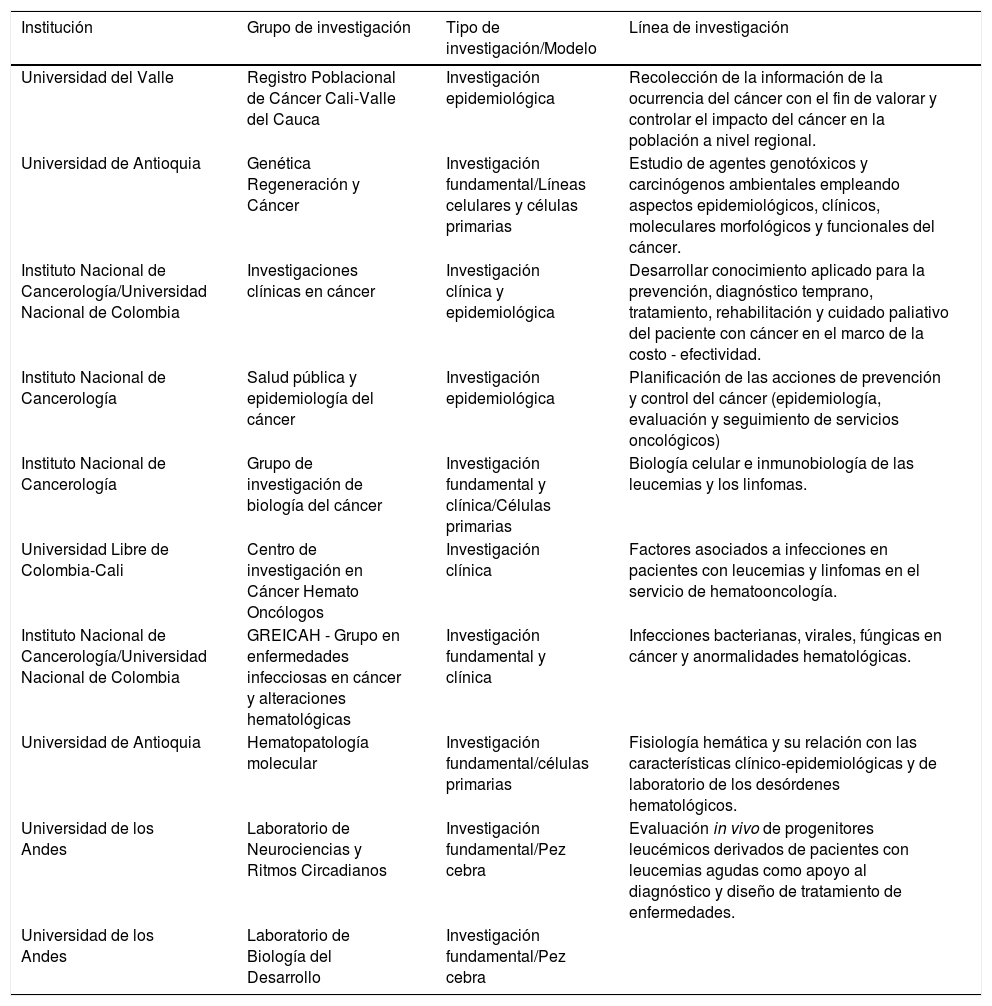
A pesar de los estudios realizados, la mayoría de investigaciones en Colombia se han centrado en estudios epidemiológicos y clínicos, mientras que unos pocos en la biología de la enfermedad y en el comportamiento de la misma como lo resume la tabla 117,31 Teniendo en cuenta que en Colombia la etiología de la enfermedad parece presentar diferencias en comparación con otros países, posiblemente debido al perfil genómico de la población 17,32, los resultados no son concluyentes. Por consiguiente, se hace necesario fortalecer la investigación básica y preclínica que permitirá entender los aspectos biológicos y moleculares de la LLA y resaltar la particular etiología de esta enfermedad en Colombia.
Investigación de leucemia en Colombia
| Institución | Grupo de investigación | Tipo de investigación/Modelo | Línea de investigación |
|---|---|---|---|
| Universidad del Valle | Registro Poblacional de Cáncer Cali-Valle del Cauca | Investigación epidemiológica | Recolección de la información de la ocurrencia del cáncer con el fin de valorar y controlar el impacto del cáncer en la población a nivel regional. |
| Universidad de Antioquia | Genética Regeneración y Cáncer | Investigación fundamental/Líneas celulares y células primarias | Estudio de agentes genotóxicos y carcinógenos ambientales empleando aspectos epidemiológicos, clínicos, moleculares morfológicos y funcionales del cáncer. |
| Instituto Nacional de Cancerología/Universidad Nacional de Colombia | Investigaciones clínicas en cáncer | Investigación clínica y epidemiológica | Desarrollar conocimiento aplicado para la prevención, diagnóstico temprano, tratamiento, rehabilitación y cuidado paliativo del paciente con cáncer en el marco de la costo - efectividad. |
| Instituto Nacional de Cancerología | Salud pública y epidemiología del cáncer | Investigación epidemiológica | Planificación de las acciones de prevención y control del cáncer (epidemiología, evaluación y seguimiento de servicios oncológicos) |
| Instituto Nacional de Cancerología | Grupo de investigación de biología del cáncer | Investigación fundamental y clínica/Células primarias | Biología celular e inmunobiología de las leucemias y los linfomas. |
| Universidad Libre de Colombia-Cali | Centro de investigación en Cáncer Hemato Oncólogos | Investigación clínica | Factores asociados a infecciones en pacientes con leucemias y linfomas en el servicio de hematooncología. |
| Instituto Nacional de Cancerología/Universidad Nacional de Colombia | GREICAH - Grupo en enfermedades infecciosas en cáncer y alteraciones hematológicas | Investigación fundamental y clínica | Infecciones bacterianas, virales, fúngicas en cáncer y anormalidades hematológicas. |
| Universidad de Antioquia | Hematopatología molecular | Investigación fundamental/células primarias | Fisiología hemática y su relación con las características clínico-epidemiológicas y de laboratorio de los desórdenes hematológicos. |
| Universidad de los Andes | Laboratorio de Neurociencias y Ritmos Circadianos | Investigación fundamental/Pez cebra | Evaluación in vivo de progenitores leucémicos derivados de pacientes con leucemias agudas como apoyo al diagnóstico y diseño de tratamiento de enfermedades. |
| Universidad de los Andes | Laboratorio de Biología del Desarrollo | Investigación fundamental/Pez cebra |
La LLA es una enfermedad heterogénea, considerada como un desorden de proliferación clonal de células progenitoras comprometidas a un linaje linfoide ya sea B o T1,2,13,33–37. El 85% de los casos afecta precursores linfoides B y en el 15% restantes a los precursores linfoides T28,36–38.
Este tipo de leucemia es el cáncer más común en la población pediátrica con un 25% de los casos de cáncer en menores de 15 años39. En adultos únicamente el 1% de las leucemias son casos de LLA, sin embargo, en este grupo etario la enfermedad es mucho más agresiva6,37,38,40.
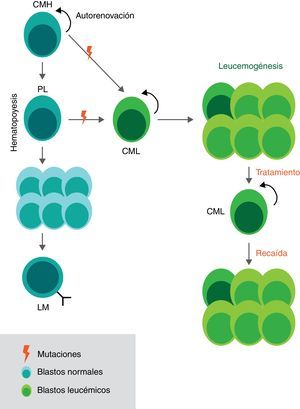
Esta enfermedad conlleva a fallas en la función medular e invasión local y a distancia de la sangre periférica, hígado, riñones, bazo, entre otros órganos28. El desarrollo de las células linfocíticas está altamente regulado por procesos que involucran la diferenciación y la proliferación de precursores de células en: el timo, los ganglios linfáticos, el bazo y en la médula ósea40,41. La detención en el desarrollo de los precursores de linfocitos se genera debido a la presencia de anormalidades genéticas en estas células, que eventualmente producen la LLA (fig. 1). Estas anormalidades molecularmente corresponden a aberraciones cromosomales o mutaciones que se encuentran, por lo general, cerca o entre las regiones promotoras y de regulación de la expresión de genes encargados de procesos de proliferación y muerte celular. Ejemplos de estos genes son: ETV6- RUNX1, BCR-ABL1, TAL1, entre otros40,42,43. Algunas de estas alteraciones se generan por translocaciones cromosómicas, tales como la translocación t (9;22) o cromosoma Filadelfia o la translocación cromosómica específica, t (1;19)(q23;p13)9,38,44. Mutaciones en genes reguladores como protoncogenes, genes supresores de tumor y en genes asociados a cascadas de señalización como NOTCH o RAS también están asociados y tienen un peor pronóstico33,35,37,45,46.
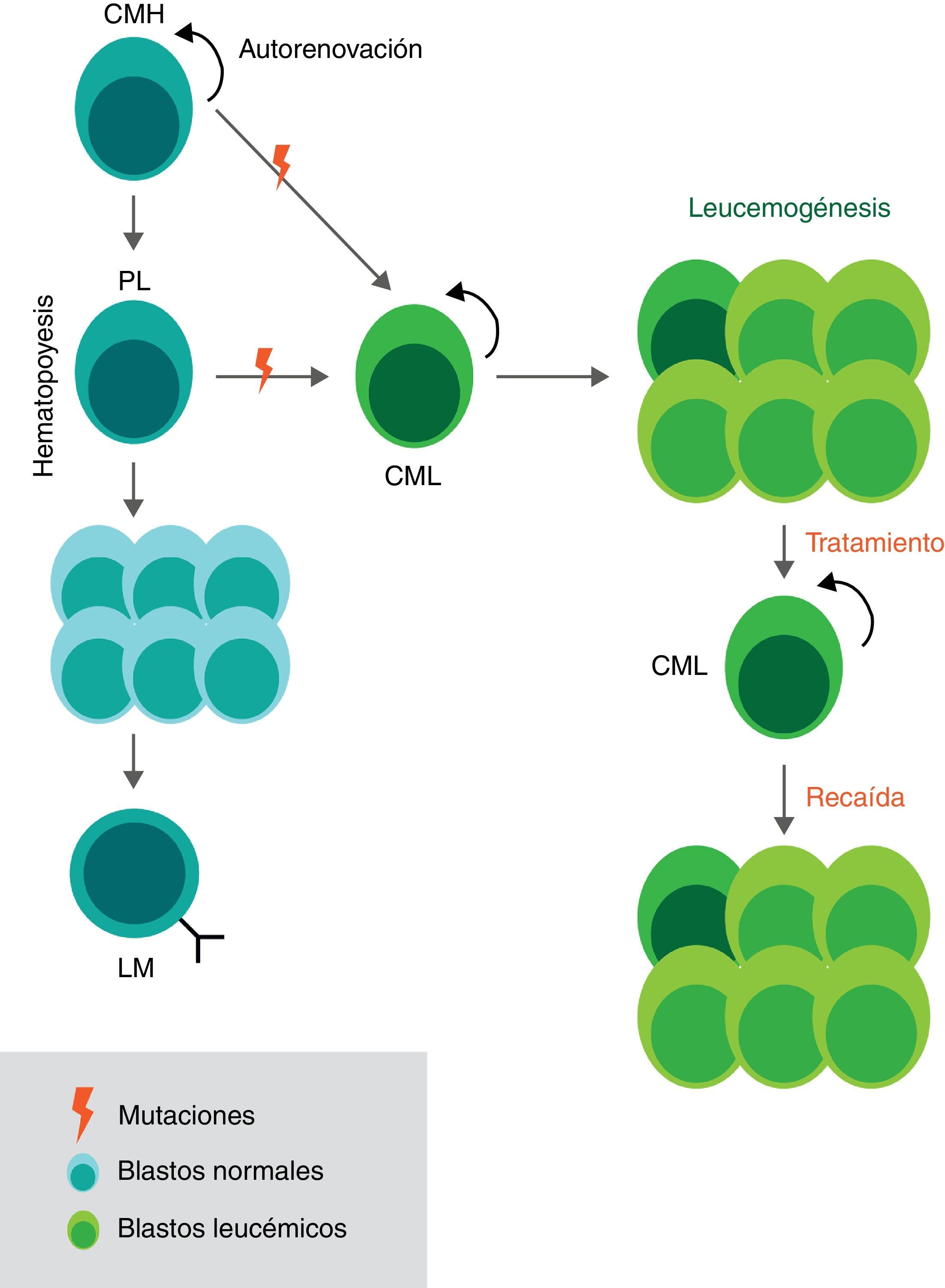
Hematopoyesis y leucemogénesis de la LLA. Durante el proceso de hematopoyesis las células madre hematopoyéticas (CMH), células con división asimétrica, dan origen a los precursores linfoides (PL) que a su vez dan paso a una expansión de células inmaduras (blastos) para una final diferenciación en linfocitos maduros. En el caso de la leucemogénesis algunas células con poco grado de diferenciación (CMH) acumulan mutaciones que generan alteraciones en el ciclo y en el desarrollo celular. Estas células iniciadoras de la leucemia son denominadas células madre leucemogénicas (CML) debido a que producen una descendencia que se caracteriza por una proliferación anormal y un reclutamiento en estadios tempranos de maduración. Las CML se mantienen gracias a sus características de células madre (autorrenovación y quiescencia) y son las responsables de las recaídas en los pacientes tras los tratamientos. CMH: Célula madre hematopoyética CML: Célula madre leucemogénica PL: Precursor linfoide, LM: Linfocito maduro.
Se ha determinado que la enfermedad se mantiene debido a una población de células neoplásicas con división asimétrica, autorrenovación y baja actividad mitótica, denominadas células madre leucemogénicas (CML), que dan origen a linajes heterogéneos de células34,47–50(fig. 1). Estas CML tienen un rol importante en las respuestas heterogéneas frente a los tratamientos y se considera que son las responsables de las recaídas, de la resistencia a la quimioterapia y de la eventual metástasis34,36,43. Esto se debe a que las CML no han podido ser blanco específico de los tratamientos del cáncer porque comparten múltiples características y mecanismos de regulación con las células madre hematopoyéticas normales40,48,51.
Tanto las CML como las células madre hematopoyéticas se encuentran localizadas en la médula ósea, nicho fundamental que asegura su supervivencia, y que produce los factores de crecimiento necesarios para mantener estas poblaciones celulares43,52,53. También se han reportado casos donde estas células migran y colonizan órganos extramedulares que ofrecen un microambiente similar como el hígado y el bazo43,53. Sin embargo, todavía se requiere de mayores estudios para dilucidar las interacciones de estas CML con su nicho y de esta manera desarrollar terapias con ellas como blanco específico.
Factores de riesgoNo se han determinado agentes causales de la enfermedad pero se han establecido factores asociados a esta. Existen condiciones genéticas consideradas factores de riesgo: Por ejemplo, las personas con síndrome de Down son más propensas al desarrollo de LLA-B54,55 y se ha determinado que los pacientes con el síndrome de Bloom, síndrome de Nijmegen y ataxia-telangiectasia representan aproximadamente el 5% de los casos de leucemias pediátricas1,56. Otros factores como la ocupación laboral, la exposición a campos magnéticos fuertes, el consumo de tabaco y la exposición a ciertos pesticidas y solventes también son considerados como factores externos que generan mayor riesgo de desarrollar esta enfermedad2,12,57. Adicionalmente, el género es otro factor importante, pues se ha visto que la LLA es una enfermedad más común en hombres con un 57% de casos de LLA7,17.
Factores pronósticoExisten factores que tienen implicaciones en la clasificación de la enfermedad y la predicción de la respuesta a los tratamientos58. Además de las lesiones genéticas, el pronóstico se ve influenciado por factores externos como: la edad, el conteo de leucocitos, la enfermedad mínima residual (EMR), y la etnia, entre otros9,12,17,59.
La edad y el conteo de leucocitos son los factores iniciales más importantes en el pronóstico de los pacientes9. Las LLA tienen una mayor prevalencia a medida que aumenta la edad4, no obstante, el comportamiento es bimodal presentando dos picos de incidencia: el primero es de los 2 a los 5 años y el segundo corresponde a los pacientes mayores a 60 años6,7,9,57. Por otra parte, un conteo elevado de leucocitos está asociado con una alta tasa de proliferación y una alta carga tumoral9.
Igualmente, la etnia ha sido considerada un factor importante. Aunque no se ha llegado a un consenso, diferentes estudios han demostrado que la incidencia es mayor en América y Oceanía y es más baja en Asia y Europa Oriental. Por otra parte, la respuesta a los tratamientos de los pacientes hispanos y afrodescendientes generalmente tiene un pronóstico desfavorable en comparación con los pacientes de otras poblaciones2,17,60.
Finalmente, uno de los factores pronóstico más relevantes para determinar el nivel de riesgo de los pacientes con LLA es la detección de la EMR. Después de las fases de inducción y consolidación de la quimioterapia, la detección de EMR parece ser uno de los factores fundamentales para tomar decisiones acerca de la continuación del tratamiento. Existe una correlación negativa entre la supervivencia y el tiempo de detección de EMR9,11.
TratamientosLa quimioterapia es el tratamiento más utilizado contra la LLA. Este tratamiento consiste en tres fases, y aunque los tratamientos son similares, los protocolos varían según la clasificación de los pacientes, la respuesta del paciente, y la región geográfica en donde se realice2,9,13,15,59,61.
La quimioterapia es un tratamiento altamente efectivo en la población pediátrica, resultando en una tasa de RC aproximadamente del 80% y una supervivencia a 5 años entre un 70%-75%50,62. No obstante, en adultos las recaídas son más frecuentes y menos del 40% de los pacientes mantienen la RC a largo plazo63. Adicionalmente, la supervivencia a 5 años es del 30%-40% debido a que hay una alta mortalidad principalmente por recurrencia de la enfermedad y debido a la toxicidad del tratamiento se identificó un porcentaje menor de muertes por patologías infecciosas y falla orgánica multisistémica15,44,45,50,62,64,65.
Se ha sugerido que las CML son responsables de las recaídas en la mayoría de pacientes dado que no han podido ser el blanco de estos tratamientos y esto dificulta la erradicación de la enfermedad13,15.
Durante los últimos años se han desarrollado nuevos tratamientos alternos y complementarios a la quimioterapia. Entre estos se encuentra la inmunoterapia y el trasplante de médula ósea: el primero está siendo utilizado como una terapia dirigida para la erradicación de células leucemogénicas12,34,36,44, y el segundo pretende reestablecer la hematopoyesis normal en los pacientes con LLA7,61,66. Sin embargo, los tratamientos actuales no son 100% efectivos y se requiere mayor conocimiento de la enfermedad para desarrollar nuevos y mejores tratamientos, por lo que la comunidad científica ha desarrollado modelos para estudiar la enfermedad y alcanzar este objetivo.
Modelos para el estudio del cáncerDurante las últimas décadas se han desarrollado modelos in vitro e in vivo que facilitan la obtención de datos fenotípicos, moleculares, morfológicos y genéticos necesarios para clasificar y caracterizar las leucemias y elucidar potenciales factores causales.
Los modelos preclínicos más utilizados para estudiar la biología del cáncer y para probar la eficacia de los tratamientos siguen siendo las líneas celulares derivadas de cánceres humanos67. Este modelo in vitro además de su fácil obtención ofrece facilidades de mantenimiento y manipulación por lo cual se utiliza a menudo en la investigación68. Las líneas celulares poseen marcadores morfológicos y bioquímicos similares a las células primarias, además representan un suministro ilimitado de material lo que implica contar con una población celular uniforme que permite obtener resultados consistentes y reproducibles67,68. Sin embargo, este modelo presenta algunas desventajas puesto que al ser homogéneas y mantenerse bajo condiciones in vitro no emula las condiciones fisiológicas del organismo46,65,69. Por otra parte, en los cultivos de líneas celulares de tumores sólidos las células se mantienen durante décadas en ambientes que promueven el crecimiento en monocapa alterando las interacciones en tres dimensiones que reproducirían el crecimiento en condiciones in vivo; dichas condiciones afectan las características celulares y conllevan a la selección de subpoblaciones de células que difieren radicalmente de las células en un cáncer primario46,68–70, por lo que la investigación in vivo usando modelos animales para el estudio del cáncer permite entender mejor los mecanismos del progreso de la enfermedad y los mecanismos que generan resistencia a los tratamientos.
Para el estudio de la leucemia se ha utilizado una gran variedad de modelos animales, desde invertebrados, como nemátodos y moscas, hasta modelos animales vertebrados como el embrión de pollo, el ratón, el perro y últimamente el pez cebra69,71. A continuación se detallarán los aspectos más relevantes para el estudio del cáncer y particularmente de la leucemia de dos modelos: ratón y pez cebra.
Modelo murinoLos ratones han sido por excelencia el modelo in vivo más utilizado para la caracterización de las bases moleculares de diferentes tipos de cáncer72,73. Esto se debe a que es el sistema más asequible y similar a los humanos en sus características fisiológicas y anatómicas, además del alto grado de similitud genética (85%)65,72,74,75(tabla 2). La comunidad científica ha generado modelos provenientes de mutaciones espontáneas e inducidas, modelos transgénicos, knock-in, knock-out y líneas consanguíneas, entre otros, que han permitido estudiar el desarrollo, la progresión de la enfermedad y los posibles agentes terapéuticos70,73,76. Por ejemplo, en el caso de la leucemia, tanto el trasplante como la propagación de células leucemogénicas humanas en el ratón han sido esenciales para determinar el origen de las neoplasias humanas e identificar las células madre asociadas a estas47,70,73,77.
Modelos animales
| Ratón | Pez cebra |
|---|---|
| Ventajas | Ventajas |
| • Vías genéticas conservadas74,75,81 • Cercanía filogenética con humanos74,81,85 • Recapitula características de la leucemia73,75 • Sitios de hematopoyesis homólogos74 Temperatura óptima igual a la de humanos96 | • Fertilización y desarrollo extrauterino93,97 • Alta fecundidad74,97 • Vías genéticas conservadas81,93 • Transparencia de los embriones46,69,74,93 • Sistema inmune inmaduro en embriones69,93 • Facilita seguimiento in vivo46,69,94 • Colección de líneas mutantes y transgénicas45,93 • Soporta temperatura de hasta 31°C46,94 • Fácil manipulación74,93 Comparten la mayoría de organización anatómica y celular con mamíferos81 |
| Desventajas | Desventajas |
| • Condicionamiento previo para erradicar respuesta inmune73 • Mayor cantidad de muestra70,73,74 • Número limitado de individuos para experimentación73,91 Ratones inmunodeficientes • Reducción de ∼50% de la progenie80,81 • Baja eficiencia del injerto en algunos modelos (25-30%)70,73,74,96 • Alta tasa de mortalidad73 Aumento en costos y mantenimiento74,80,94,96 | • Condicionamiento previo para erradicar respuesta inmune en adultos93 • Temperatura óptima 28,5°C94,96 • Difieren los sitios de hematopoyesis definitiva74,85 Difieren algunos destinos metabólicos46,93,94 |
Cheung et al. propusieron a los ratones NOD/SCID (diabéticos no obesos con inmunodeficiencia severa combinada) recién nacidos como alternativa para estudiar xenoinjertos de células leucémicas humanas de LLA-B. En este estudio las células xenoinjertadas presentaban los inmunofenotipos y las características de las células del injerto original. Los investigadores lograron identificar la actividad de las CML humanas en un modelo animal deficiente de linfocitos T y B, y comprobaron que las células leucemogénicas sobreviven dentro del modelo in vivo, ratificando al modelo NOD/SCID como una buena alternativa para el estudio de las células humanas leucémicas73.
Mezencev y McDonald desarrollaron un modelo en ratones atímicos desnudos para el estudio de la LLA-T. El propósito de esta investigación fue desarrollar un sistema apropiado para la validación in vivo de agentes activos contra las células Jurkat subcutáneas xenoinjertadas. Sin embargo, se determinó que los ratones atímicos desnudos reabsorben los tumores formados por los xenoinjertos como consecuencia de la respuesta inmune residual, lo que evidenció una desventaja de este modelo pues requiere de condicionamiento para erradicar la respuesta inmune del organismo necesaria para realizar los diferentes procedimientos experimentales, aumentando los costos de cuidado y mantenimiento78.
En los últimos años se ha desarrollado el modelo murino NOG (NOD/Shi-scid/IL- 2Rγnull), que muestra una mejor implantación de injertos de células y tejidos humanos en comparación con los NOD/SCID75,79. Los ratones NOG se caracterizan por ser deficientes en la producción de células T y B, células NK, reducción de macrófagos y en la función de células dendríticas entre otras características. En otras palabras, a este modelo se le atribuyen múltiples disfunciones inmunológicas que favorecen los xenotrasplantes de células humanas. Por ejemplo, en 2007 Ninomiya et al. encontraron que la localización primaria de las células leucemogénicas es igual a la de las células madre hematopoyéticas y determinaron que estas células reciben señales de los osteoblastos y del endotelio vascular inhibiendo su apoptosis. A partir de este tipo de investigaciones se ha establecido al ratón NOG como el mejor modelo murino para el estudio de la leucemia79.
A pesar de las ventajas del ratón como modelo de investigación, este se ve limitado por un conjunto de desventajas biológicas y metodológicas que reducen significativamente su eficiencia para el estudio del cáncer70,73,74,80,81, por ejemplo: la restricción en el número de animales de experimentación, los costos de manejo y manutención, la eficiencia de xenoinjertos, entre otros (tabla 2). Por esto, en la actualidad se está validando el uso de modelos alternativos que mejoren las condiciones para el estudio del cáncer.
Pez cebraEl pez cebra (Danio rerio) es un modelo que se ha venido popularizando en las últimas décadas para la investigación biomédica. Este modelo proporciona herramientas útiles para el estudio de procesos biológicos, tales como: regeneración, organogénesis y regulación de genes, entre otros82. Es considerado una herramienta genética de gran resolución pues ofrece una colección de líneas mutantes y transgénicas que permiten determinar la función de los genes involucrados en enfermedades humanas. Además, facilita la incorporación de xenoinjertos y permite realizar el seguimiento de poblaciones celulares específicas in vivo83,84.
En general es un modelo que se destaca por su accesibilidad, facilidad de experimentación y manipulación, además de su viabilidad para estudios moleculares y genéticos entre otras ventajas69,85(tabla 2). Por esta razón, se considera como una buena alternativa para el estudio de cáncer humano siendo un sistema que simula las condiciones y los aspectos moleculares relacionados con esta patología.
Desde la década de los 80 el pez cebra se sugirió como modelo para el estudio del cáncer tras la exposición a carcinógenos y la formación de tumores asociados. Para el 2000 se había utilizado como herramienta para el estudio de diversas neoplasias incluyendo: piel, papilomas, adenomas hepáticos, rabdomiosarcoma, entre otros. Sin embargo, fue después de la aparición de la tecnología transgénica que el pez cebra se convirtió en una excelente alternativa para ensayos preclínicos y ahora es una herramienta usada para diversas líneas de investigación81,86–92(tabla 3).
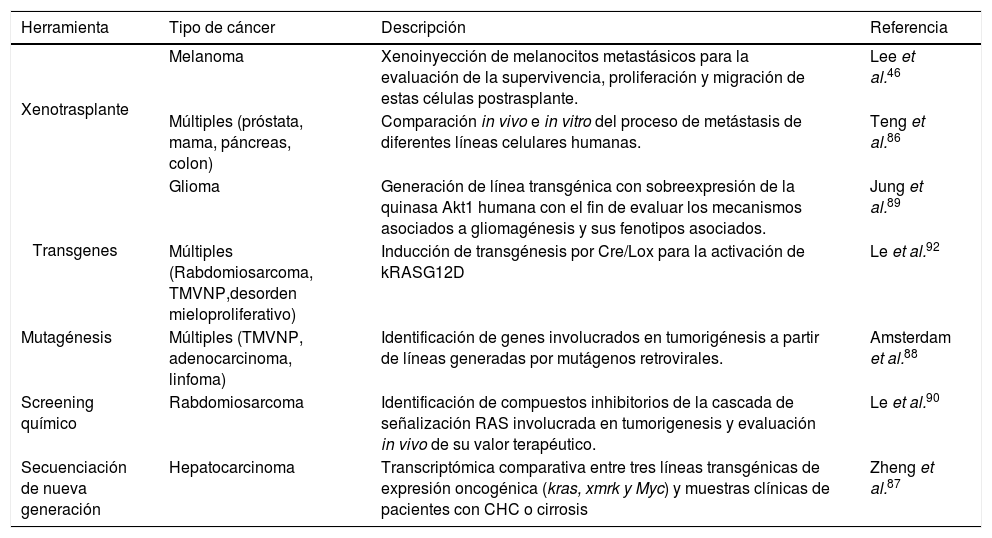
Pez cebra como modelo para el estudio del cáncer
| Herramienta | Tipo de cáncer | Descripción | Referencia |
|---|---|---|---|
| Xenotrasplante | Melanoma | Xenoinyección de melanocitos metastásicos para la evaluación de la supervivencia, proliferación y migración de estas células postrasplante. | Lee et al.46 |
| Múltiples (próstata, mama, páncreas, colon) | Comparación in vivo e in vitro del proceso de metástasis de diferentes líneas celulares humanas. | Teng et al.86 | |
| Transgenes | Glioma | Generación de línea transgénica con sobreexpresión de la quinasa Akt1 humana con el fin de evaluar los mecanismos asociados a gliomagénesis y sus fenotipos asociados. | Jung et al.89 |
| Múltiples (Rabdomiosarcoma, TMVNP,desorden mieloproliferativo) | Inducción de transgénesis por Cre/Lox para la activación de kRASG12D | Le et al.92 | |
| Mutagénesis | Múltiples (TMVNP, adenocarcinoma, linfoma) | Identificación de genes involucrados en tumorigénesis a partir de líneas generadas por mutágenos retrovirales. | Amsterdam et al.88 |
| Screening químico | Rabdomiosarcoma | Identificación de compuestos inhibitorios de la cascada de señalización RAS involucrada en tumorigenesis y evaluación in vivo de su valor terapéutico. | Le et al.90 |
| Secuenciación de nueva generación | Hepatocarcinoma | Transcriptómica comparativa entre tres líneas transgénicas de expresión oncogénica (kras, xmrk y Myc) y muestras clínicas de pacientes con CHC o cirrosis | Zheng et al.87 |
TMVNP: Tumor maligno de la vaina del nervio periférico.
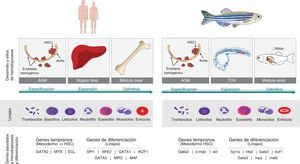
Existen varias técnicas disponibles que han convertido al pez cebra en un modelo único para el campo de la investigación del cáncer. Particularmente, se ha determinado que el pez cebra representa una nueva alternativa para el estudio de la leucemia proveyendo una aproximación a la comprensión del proceso de la leucemogénesis humana y de los genes involucrados en esta enfermedad. Esto se debe no solo al conjunto de ventajas que favorecen la investigación en este modelo, como su progenie de gran tamaño, la transparencia de sus embriones y su sistema inmune inmaduro en estadios tempranos46,69,74,93,94 (tabla 2), y también las similitudes que comparte con los humanos. Por ejemplo, la hematopoyesis en los vertebrados es un proceso conservado tanto a nivel génico, y molecular como fisiológico45,81,93. Aunque los sitios de hematopoyesis del pez difiere con el de los humanos estas estructuras son análogas45 y los linajes celulares, las vías de señalización y regulación son homólogas en la mayoría de los casos45,74,85. Asimismo, los mecanismos moleculares de la leucemogénesis40,45,95 al igual que los tumores son similares en el pez a los humanos molecular e histopatológicamente (fig. 2) 81.
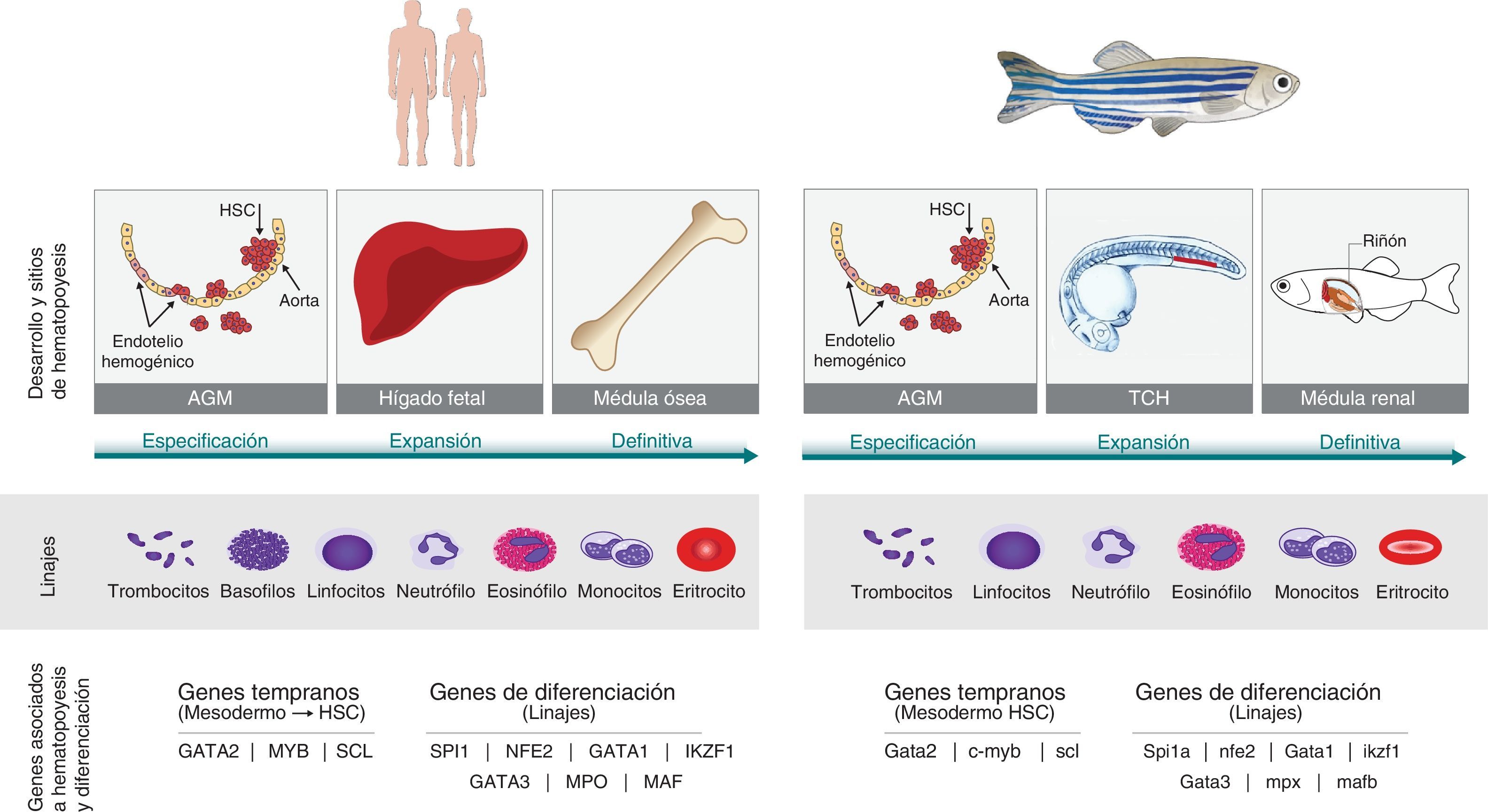
Humano vs. pez cebra. La hematopoyesis es un proceso conservado en los vertebrados. El pez cebra se ha propuesto como un modelo para estudiar este proceso debido a las características que comparte con los humanos. El origen embrionario del tejido hematopoyético en las dos especies es la placa lateral del mesodermo (PLM) que va a dar lugar al hemangioblasto y este a su vez se diferencia en los diferentes linajes celulares. Tanto en pez como en humanos la hematopoyesis se divide en dos fases, la fase primitiva y la definitiva. Durante la fase definitiva se generan las células madre hematopoyéticas (CMH) que van a mantener las diferentes poblaciones celulares durante el resto de la vida del organismo. En los humanos, esta fase comienza a partir de la generación de CMH en la región de la aorta-gónadas-mesonefros (AGM), posteriormente estas células migran al hígado fetal donde hay una expansión de los precursores hematopoyéticos y finalmente migran y colonizan la médula ósea, sitio definitivo de hematopoyesis. En el pez algunos sitios de hematopoyesis difieren al humano. Tras la diferenciación de la PLM, y la generación de CMH en la región de la AGM, las células migran al tejido caudal hematopoyético (TCH), análogo al hígado fetal. Finalmente, los precursores hematopoyéticos migran a la médula renal (análogo a médula ósea), siendo este el sitio de hematopoyesis durante la adultez. A pesar de no compartir los mismos sitios de hematopoyesis, los linajes celulares son los mismos tanto en pez como en humanos a excepción de los basófilos que no se encuentran en el pez. Adicionalmente, las rutas génicas que gobiernan este proceso son conservadas desde la especificación de mesodermo hasta la diferenciación de los linajes. En la figura se observan algunos de estos genes presentes en los dos organismos.
Existen múltiples investigaciones que describen la utilización del pez cebra como modelo para estudiar la leucemia. Por ejemplo, Traver et al. utilizaron peces adultos irradiados para estudiar la trasformación de trasplantes alogénicos de células leucemogénicas de pez de la misma manera como se ha venido realizando en ratones, con lo que se evidenció que las células leucemogénicas colonizaban inicialmente el timo y después se distribuían por todo el pez, demostrando que los injertos en el pez se comportan de manera similar que en mamíferos96.
En otro estudio, se trasplantaron células de pacientes con leucemia mieloide aguda y células de líneas celulares leucemogénicas (Jurkat, NB4 y K562) en embriones silvestres de pez cebra de 48 horas postfertilización (hpf). Los autores evaluaron la utilidad del modelo para probar la efectividad de drogas antileucemia94.
Se han utilizado líneas de peces transgénicos para el modelamiento de la leucemia y se han desarrollado líneas transgénicas que expresan oncogenes ortólogos a los genes humanos relacionados con esta patología95. Aunque, el pez cebra exhibe diferencias en comparación con los humanos, los mecanismos conservados permiten el entendimiento de la patogénesis humana, validando a este modelo como una alternativa para el estudio de la LLA al igual que otros tipos de cáncer46,69,74,94,97.
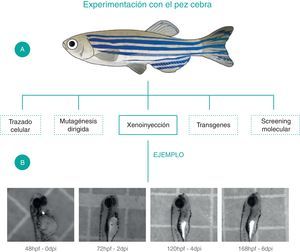
A nivel nacional, nuestro equipo de trabajo ha implementado al pez cebra como modelo para el estudio preclínico de la LLA en los laboratorios de Biología del Desarrollo (BIOLDES) y el Laboratorio de Neurociencia y Ritmos Circadianos de la Universidad de los Andes. Hemos realizado experimentos de xenoinjertos de células Jurkat, con los cuales se estableció que las células xenoinjertadas sobreviven y migran en el pez. A partir de estos resultados preliminares se ha podido establecer al pez cebra como un modelo prometedor para los estudios de la biología de la enfermedad en nuestro país31(fig. 3).
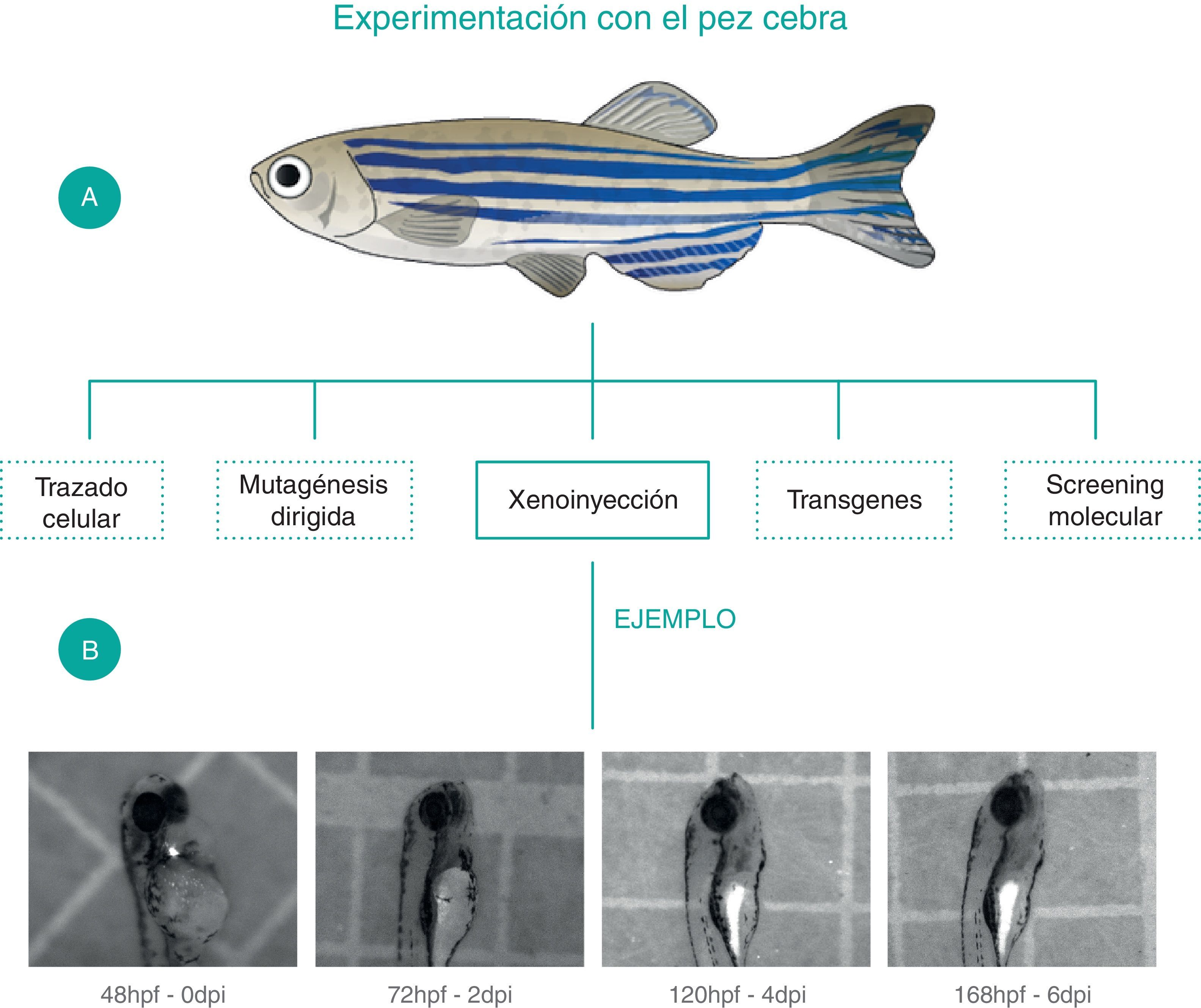
El pez cebra es un modelo muy utilizado para el estudio de leucemias debido a que su fácil manipulación y mantenimiento permite realizar múltiples procedimientos y técnicas moleculares y celulares. A. Procedimientos que se pueden realizar para el estudio preclínico de la leucemia linfoblástica aguda utilizando al pez cebra como modelo experimental. B. Ejemplo de xenoinjertos de células de la línea linfoide-T, Jurkat, marcadas con CFSE en embriones de Pez Cebra de 48h. Se observa la presencia de células humanas en el pez desde los 0 dpi hasta los 6 dpi y se expone al pez cebra como modelo útil para la supervivencia y migración de las células cancerosas. Además, se evidencia la facilidad y accesibilidad de este modelo para experimentos como el trazado celular in-vivo.
Dpi: días post-inyección, hpf: horas postfertilización.
Finalmente, el análisis detallado de la información pertinente a la LLA en Colombia nos permite exponer la importancia de estudiar esta enfermedad en el país para entender su etiología y las diferencias con otros países del mundo. Hemos mostrado el potencial de realizar estudios utilizando al pez cebra como modelo animal en nuestro país, el cual no solo representa una alternativa novedosa en Colombia, sino que también es una herramienta accesible, económica y eficiente para el desarrollo de nuevas investigaciones relacionadas con leucemia y otras enfermedades neoplásicas. Este modelo, permitirá esclarecer los mecanismos del inicio, la progresión y el mantenimiento de la enfermedad, particularmente de pacientes en nuestro país, así como la respuesta y laresistencia a tratamientos facilitando la evaluación de nuevas alternativas.
FinanciaciónFondos Inversión Nación del Instituto Nacional de Cancerología a LE, ZVG, VAproyecto C41030610608 vigencia Enero 2, 2014 a Septiembre 2, 2014. Fondo Profesor Asistente Universidad de los Andes a ZVG vigencia Marzo 2014-Marzo 2017. Fondos a VA y ZVG Proyecto Uniandes-FSFB convocatoria conjunta cuarta Bolsa 2015.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A los equipos del Laboratorio de Biología del Desarrollo y del Laboratorio de Neurociencias y Ritmos Circadianos de la Universidad de los Andes por discusiones enriquecedoras para la preparación de este artículo.