Los sarcomas originados en las paredes de los grandes vasos son tumores de escasa presentación. El leiomiosarcoma de la vena cava es una enfermedad compleja que requiere ser manejado por un grupo multidisciplinario. Su tratamiento es quirúrgico. Poco se conoce de sus resultados oncológicos. Se presenta el caso de una paciente de 56 años, con diagnóstico de leiomiosarcoma de la vena cava inferior, su evaluación, manejo quirúrgico y seguimiento a corto plazo. Se hace una revisión de la literatura existente hasta la fecha, evaluando además la fisiopatología y la necesidad de reconstruir la vena cava inferior.
Sarcomas Sarcomas originating in the walls of the large vessels are tumors of unusual presentation. Leiomyosarcoma of the vena cava is a complex disease that needs to be managed by a multidisciplinary team. Its management is surgical. Little is known of their oncologic results. We report the case of a 56 year-old patient, diagnosed with leiomyosarcoma of the inferior vena cava, including her evaluation, surgical management, and short-term follow-up. An updated review of the literature is presented, along with an evaluation of the pathophysiology and the need for reconstruction of the inferior vena cava.
Los sarcomas de tejidos blandos del retroperitoneo son tumores poco frecuentes. El leiomiosarcoma de la cava es aún más raro, siendo descrito por primera vez por Perl1. La cirugía es el principal manejo de estos pacientes, sin que haya un consenso sobre la necesidad de reconstruir la vena cava inferior (VCI) luego de su resección2. Por ser tumores de alto grado, a menudo se requiere el uso de radioterapia y terapia sistémica con quimioterapia, con beneficios limitados3.
Hasta la fecha, se han reportado menos de 300 casos en la literatura mundial3. Dada la baja incidencia, la agresividad de la enfermedad y la dificultad en su abordaje terapéutico, comentamos el caso de una paciente manejada en el Instituto Nacional de Cancerología en 2013 y revisamos la literatura referente a esto.
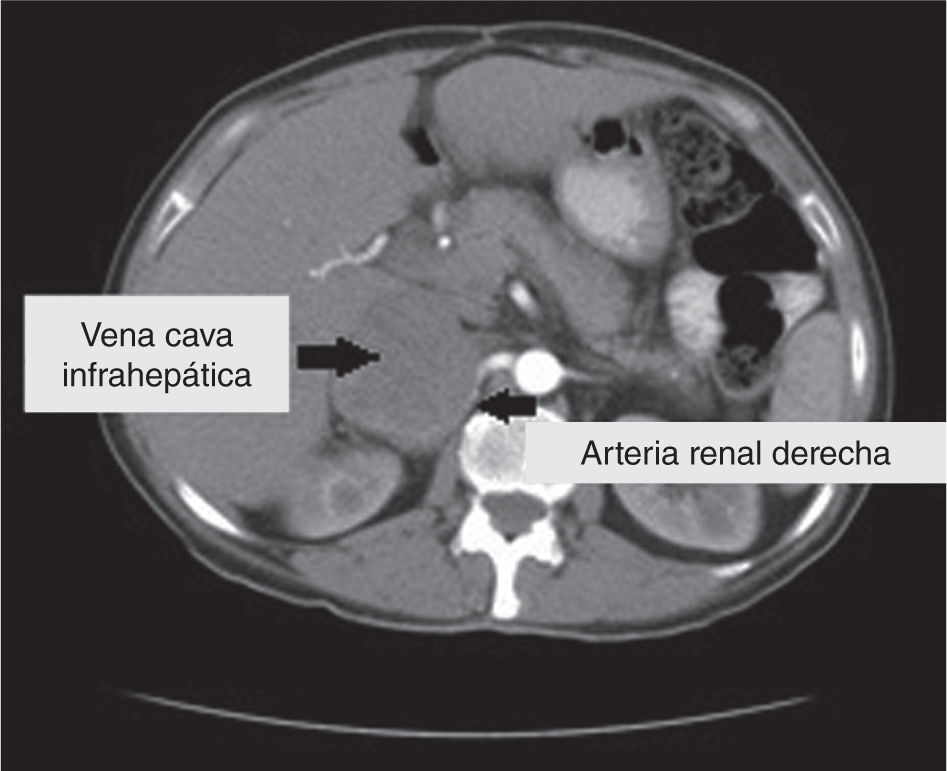
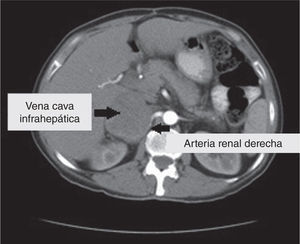
Descripción del caso clínicoSe trata de una paciente femenina de 56 años con diagnóstico de leiomiosarcoma retroperitoneal realizado en noviembre de 2012 (fig. 1). Presentaba dolor abdominal generalizado de predominio en hemiabdomen derecho de intensidad 9/10, asociado a náuseas y emesis ocasional.
Fue valorada por una junta multidisplinaria extrainstitucional quien consideró que el tumor era irresecable, por lo que se inició quimioterapia con ifosfamida + doxorrubicina en febrero de 2013, por 2 ciclos. Remiten al Instituto Nacional de Cancerología para realizar radioterapia con intención paliativa.
Fue valorada por el Servicio de Seno y Tejidos Blandos de la Institución, en marzo de 2013, cuando se consideró que la paciente se beneficiaba de manejo quirúrgico en conjunto con cirugía vascular.
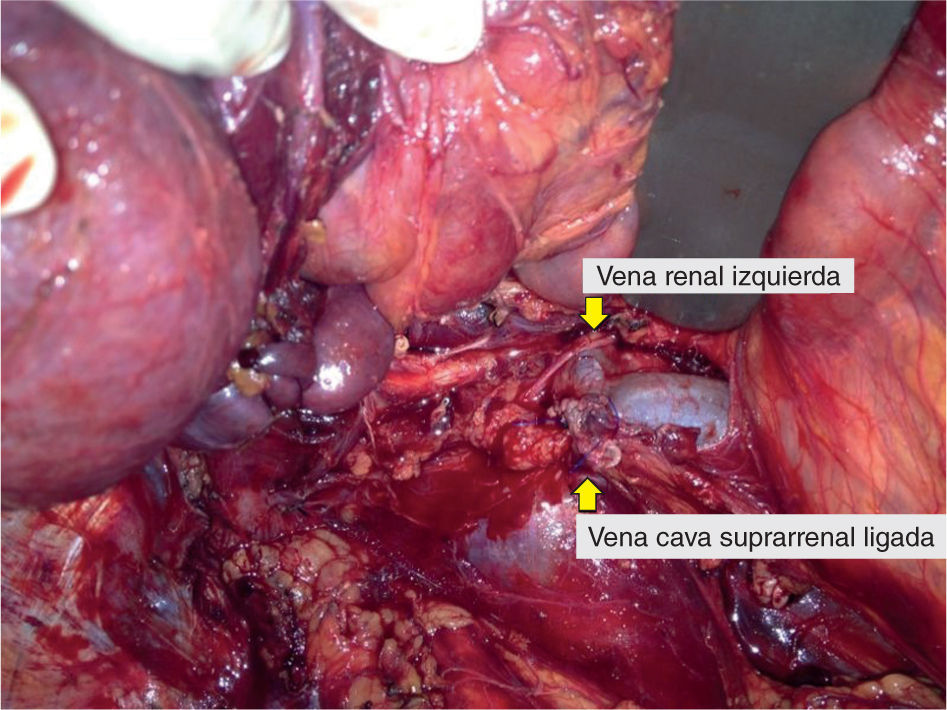
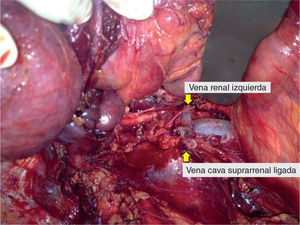
Fue llevada a cirugía en mayo de 2013, donde se encontró un tumor retroperitoneal que comprometía el hilio renal derecho y la vena cava, de 15 × 7cm aproximadamente. Se realizó resección del tumor retroperitoneal, nefrectomía derecha, ureterectomía derecha y ligadura de vena cava por encima de las renales (fig. 2). Durante el procedimiento, la paciente presentó inestabilidad hemodinámica, por lo cual se dejó con empaquetamiento abdominal y no se realizó ningún procedimiento vascular adicional.
Lecho posquirúrgico, luego de la resección de un tumor retroperitoneal, en una paciente de 56 años. El tumor comprometía el hilio renal derecho y la vena cava, requiriendo para la resección del tumor: nefrectomía derecha, ureterectomía derecha y ligadura de la vena cava por encima de las venas renales.
La paciente presentó una adecuada evolución postoperatoria, inicialmente en la unidad de cuidados intensivos, con estancia hospitalaria total de 7 días. No se realizó reconstrucción de la vena cava ni ningún otro procedimiento vascular en el postoperatorio, dado que la paciente evolucionó con estabilidad hemodinámica, edema leve de las extremidades, y no presentó una alteración significativa de la función renal (el mayor valor postoperatorio de creatinina sérica fue de 1,23mg/dl al segundo día, con normalización al tercer día, cuando presentó un valor de 1,16mg/dl).
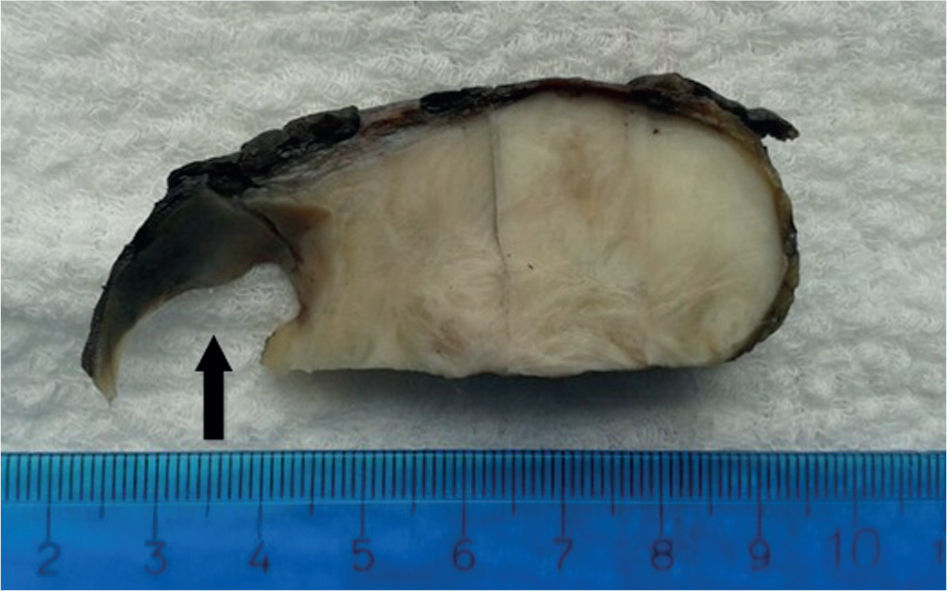
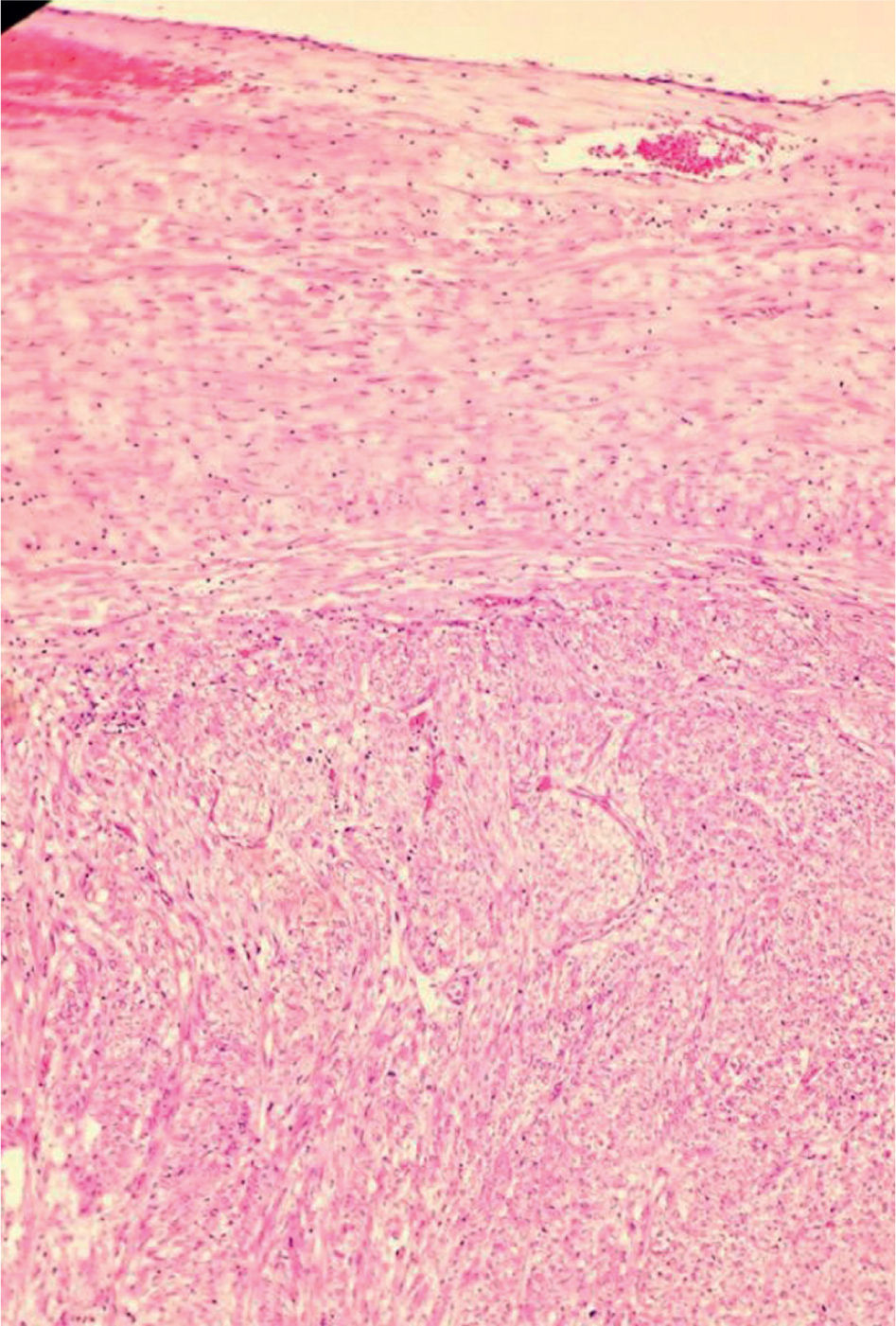
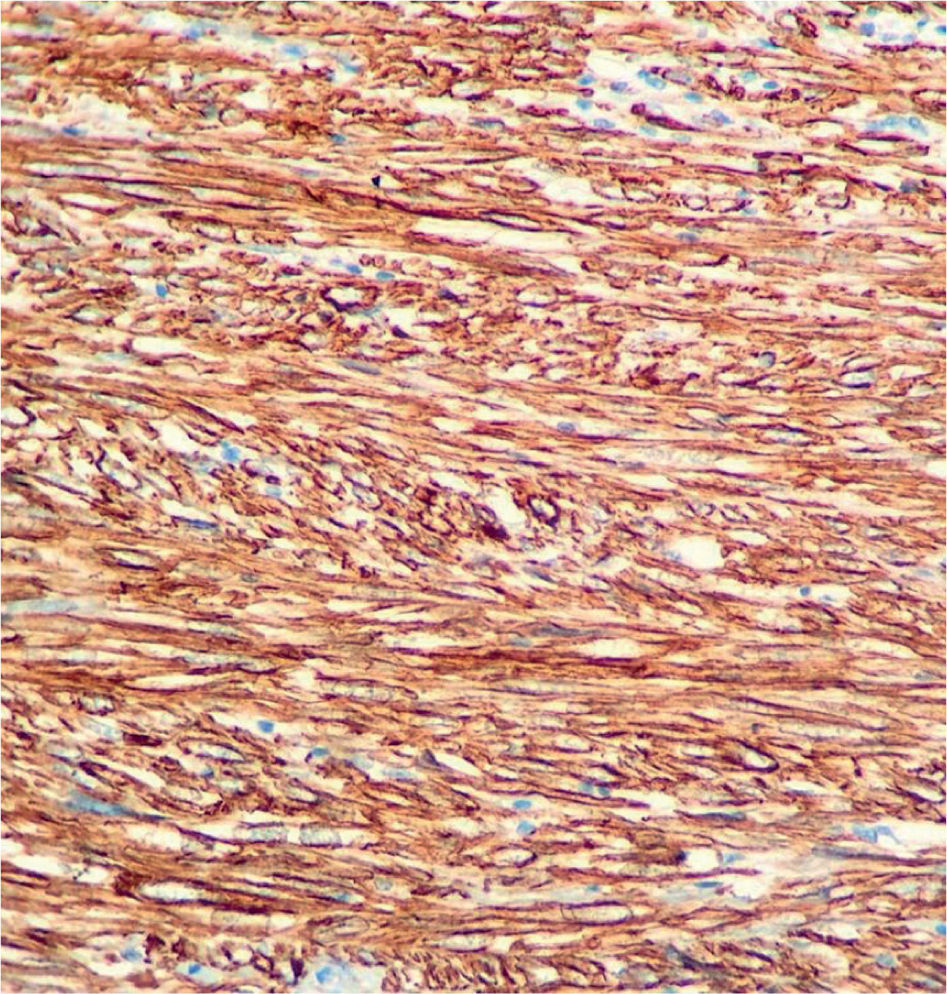
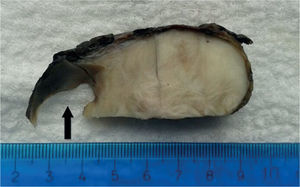
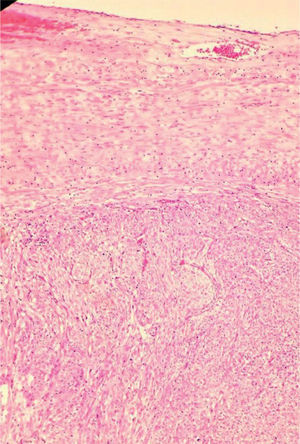
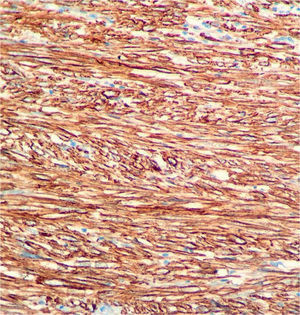
En el estudio patológico, en la macroscopía (fig. 3), se recibió un tumor sólido gris homogéneo de 10 × 7cm; dicho tumor se encontraba adherido a la vena cava provocando protrusión endoluminal. En el estudio microscópico se observó un sarcoma fusocelular con áreas hipercelulares con atipia, mitosis y necrosis (fig. 4). El estudio de inmunohistoquímica (fig. 5) fue positivo para desmina, H-caldesmón, AML y CD99 con Ki67 de 60% y negatividad para miogeni- na, DOG1, CD57, CD31, mioglobina, CD34, CD117 y EMA. La creatitina (AE1/AE3) y el S100 fueron positivos focales4. El diagnóstico definitivo fue leiomiosarcoma grado III, con márgenes libres de tumor.
Hasta la fecha, la paciente acude a controles sin comorbilidad importante, con mínimo edema de miembros inferiores.
Para la realización de este manuscrito, se obtuvo consentimiento informado de la paciente y se tomaron todas las precauciones necesarias para conservar su confidencialidad.
DiscusiónLos sarcomas de tejidos blandos representan el 1% de todas las neoplasias5. Los leiomiosarcomas representan el 0,5% de los sarcomas de tejidos blandos. Los sarcomas primarios de la VCI son infrecuentes, siendo los leiomiosarcomas el 95% de estos tumores6,7.
Los leiomiosarcomas son tumores de origen mesenquimal que se desarrollan a partir de las fibras musculares lisas de la túnica media. La primera intervención quirúrgica fue en 1928 por Mechior1,8.
Tienen un crecimiento lento y pueden permanecer asintomáticos por mucho tiempo, lo que retrasa el diagnóstico y determina un peor pronóstico9.
La clasificación más usada es de acuerdo con su localización, en la que se divide la VCI en 3 segmentos9–12:
- •
Segmento I (bajo): está por debajo de las venas renales, se presenta en el 36% de los casos.
- •
Segmento II (medio): entre las venas hepáticas y las venas renales son el 44% de los casos. Son de mejor pronóstico.
- •
Segmento III (superior): desde la aurícula derecha a las venas hepáticas son el 20% de los casos.
El caso de nuestra paciente se clasifica como un leiomiosarcoma ubicado en el segmento medio de la vena cava. Esta localización nos enfrenta a una mayor posibilidad de injuria renal, la cual en esta paciente no se dio, probablemente por la extensa circulación retroperitoneal, tal como se comentará más adelante.
El único tratamiento con intención curativa de estos pacientes es la resección quirúrgica con márgenes negativos, de hecho es el único tratamiento que mejora la supervivencia. Esta está relacionada con la posibilidad de alcanzar márgenes negativos, siendo a 5 años del 0% con márgenes positivos, y del 68% con márgenes negativos7,10,13. El tipo de cirugía que se ha de realizar depende de la localización:
- •
Segmento I: resección total del tumor y de la porción de la VCI comprometida, con reconstrucción vascular14. Si la VCI está crónicamente ocluida, con gran circulación colateral y sin comprometer la vena renal, puede ser ligada sin grandes repercusiones13.
- •
Segmento II: la restauración del flujo renal debe ser considerada. La vena renal izquierda puede ser ligada debido al flujo colateral desde las venas gonadales, adrenales y lumbares. El flujo desde la vena renal derecha puede ser preservado, realizando reimplantación, interposición, reconstrucción usando la vena gonadal o autotrasplante de riñón a la fosa ilíaca derecha15,16.
- •
Segmento III: se han utilizado varias técnicas como: exclusión vascular total del hígado, shunt veno-venosos, bypass cardiopulmonar, detención circulatoria con hipotermia profunda, utilización de politetrafluoroetileno y creación de fístulas arteriovenosas. Requieren procedimientos toracoabdominales o por 2 vías con esternotomía y laparotomía, con alta morbimortalidad17.
Hasta el momento, en la literatura no es constante la necesidad de reconstruir la VCI, dado que cuando esta se ocluye crónicamente puede derivarse el flujo de este vaso a través de circulación colateral. Esta se da según el segmento de vena cava que haya sido ligado. Así, cuando se realiza una ligadura por encima de las venas renales, la ruta de circulación colateral se lleva a cabo por las venas capsular renal, lumbares, adrenales, vertebrales, ileolumbar, frénica inferior, diafragmática, hemiácigos, ácigos y vena cava superior18,19. Cuando la ligadura se realiza por debajo de las venas renales, generalmente se produce edema de los miembros inferiores3,20, y su circulación colateral depende de las venas: lumbar ascendente y segmentaria; vertebral, intervertebral y espinales; ácigos y hemiácigos; epigástricas y mamaria interna y capsulares renales, tal como probablemente sucedió en nuestra paciente.
Histopatológicamente, los sarcomas intímales por definición de la Organización Mundial de la Salud (OMS, 2012), corresponden a neoplasias malignas originadas en los grandes vasos sanguíneos tanto sistémicos como de la circulación pulmonar21,22; como criterio diagnóstico de dicha entidad, se define el “predominante crecimiento intraluminal”; estos tumores clásicamente corresponden a sarcomas de alto grado, pobremente diferenciados, positivos para desmina y actina, y la mayoría descritos en vasos pulmonares. El pronóstico es pobre, con una sobrevida de hasta 13 meses.
Genéticamente, se han demostrado alteraciones en la región 12q12–15 (genes CDK4, TSPAN32, MDM2, GLMI Y4Q2) con análisis de FISH que han revelado amplificaciones de PDGFRA Y Kit (CD117); se han encontrado amplificaciones de PDGFRA hasta el 81% de dichos tumores en análisis hechos por FISH23. En el Servicio de Patología del Instituto Nacional de Cancerología, se realizaron en este tumor estudios de FISH para FIPL1L-PDGFRA en la región cromosómica 4q12, donde analizamos 200 núcleos sin encontrar alteración; en un 30% de los núcleos evaluados se observó tendencia a la triploidía.
Si bien nuestro caso cumple algunos criterios de los descritos para sarcoma intimal, como crecimiento endoluminal, origen en pared muscular, morfología fusocelular y alto grado de malignidad, la localización en la vena cava y la clara positividad por inmunohistoquímica para desmina y H-caldesmón aclaran el origen en músculo liso, y favorecen el diagnóstico de leiomiosarcoma. Dicha entidad esta soportada en varias publicaciones ya descritas24,25.
Hay poca información en la literatura con respecto al pronóstico preciso de los pacientes con leiomiosarcoma de la VIC. En general, es pobre.
En una serie publicada por Jason et al., en 2005, en un centro con experiencia y manejo multidisciplinario, reportan una mediana de supervivencia de 60 meses, con una supervivencia global y libre de enfermedad a 5 años del 31% para cada uno3.
En otro trabajo publicado por Mingoli et al., luego de la resección curativa del tumor, se reporta una tasa de recurrencia tan alta como del 57%, y una supervivencia a 5 años del 50%26,27. Hasta un cuarto de las recurrencias son locales28. La enfermedad metastásica es más común a hígado y pulmón28.
El tratamiento adyuvante con radioterapia y quimioterapia no ha demostrado impacto en la mejoría de la supervivencia de estos pacientes27,28.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.