El cáncer es una enfermedad compleja de etiología desconocida. Factores genéticos y epigenéticos se asocian al incremento en el riesgo de desarrollar esta enfermedad.
A pesar del avance en los tratamientos tradicionales contra el cáncer, el pronóstico de los pacientes no ha mejorado significativamente. Estudios en la patogénesis molecular del cáncer han evidenciado la existencia de dianas moleculares con potencial terapéutico que permiten trasladar los conocimientos de la investigación básica a la clínica implementando nuevas terapias para el beneficio del paciente.
El conocimiento del genoma viral, su función, replicación y los mecanismos de infección a la célula tumoral han permitido el desarrollo de la terapia génica viral que puede ser la herramienta ideal para el tratamiento del cáncer.
Este artículo revisa diferentes metodologías desarrolladas para el diseño de una terapia génica contra el cáncer, abordada desde diferentes contextos biológicos, y su aplicación clínica para el tratamiento del cáncer.
Cancer is a complicated disease of unknown etiology. Genetic and epigenetic factors are associated with an increased risk for developing this disease.
Despite the progress in the traditional cancer therapies, the prognosis of patients has not improved significantly. Studies on the molecular pathogenesis of cancer have demonstrated the existence of molecular targets with therapeutic potential. Furthermore, knowledge of the viral genome function and replication, as well as of the mechanisms of tumor cell infection, have made it possible to develop an ideal tool for gene therapy against cancer and thus, enable the transfer of knowledge from basic to clinical research for the benefit of patients.
This article reviews different methodologies developed to design a cancer gene therapy and its clinical application for treating cancer, addressed from various biological contexts.
El cáncer es un problema de salud pública cuya incidencia y mortalidad se han incrementado durante las últimas décadas. Según estudios realizados por la Agencia Internacional para la Investigación en Cáncer, en el año 2015, aproximadamente 7.564.802 personas morirán por esta enfermedad1. A pesar de los avances quirúrgicos y del desarrollo de nuevos fármacos, el pronóstico de los pacientes con cáncer no ha mejorado significativamente, por lo cual se requiere el desarrollo de nuevas intervenciones terapéuticas como la terapia génica, una aproximación viable y segura para el tratamiento de pacientes con cáncer. Esta terapia se basa en la introducción de genes funcionales en células somáticas para corregir defectos genéticos o ejercer un efecto terapéutico2,3. Se utilizó por primera vez con intención terapéutica en 1990 para el tratamiento de la inmunodeficiencia severa combinada ADA-SCID4,5, y posteriormente, para la inmunodeficiencia severa combinada SCID-X16,7. Pese a que los resultados no fueron muy alentadores en su momento8, se demostró que la terapia génica humana es factible y puede ser útil para el tratamiento de enfermedades genéticas, por lo cual se han desarrollado estrategias para aplicarla en el tratamiento de enfermedades complejas como el cáncer9,10.
Durante la última década, los vectores virales se convirtieron en la herramienta ideal para mejorar el tratamiento del cáncer. Dada la complejidad de esta enfermedad, es indispensable conocer la secuencia de eventos genéticos y epigenéticos implicados en la transformación maligna para aplicar este conocimiento al desarrollo racional de vectores que puedan utilizarse para el tratamiento del cáncer. El sistema viral más eficiente para la transferencia génica contra el cáncer in vivo es el basado en adenovirus. Estos virus poseen características biológicas deseables en un vector viral: transfieren y expresan el gen terapéutico en células quiescentes o en división, son de fácil manipulación y propagación in vitro, no se integran en el genoma celular y tienen ciclo de vida lítico. Adicionalmente, inducen una fuerte respuesta inmune in vivo que potencializa la inmunidad antitumoral y permite la rápida eliminación del vector, lo que garantiza un efecto antitumoral de corta duración que protege las células sanas de la exposición prolongada a productos tóxicos. Los ensayos clínicos dirigidos contra diferentes dianas moleculares utilizando adenovirus han arrojado resultados alentadores11.
El objetivo de este artículo es revisar los conceptos básicos en terapia génica y su aplicación para el tratamiento primario del cáncer o como coadyuvante en los tratamientos tradicionales. Además, se describen diferentes estrategias terapéuticas que están siendo evaluadas para su uso y aplicación clínica.
La búsqueda de bibliografía se realizó con las palabras clave: compensación de mutaciones, quimioterapia molecular o terapia génica suicida, terapia antiangiogénesis, oncólisis viral, e inmunopotenciación genética, en las bases de datos PubMed, MedLine, LILACS, (Literatura Latinoamericana y del Caribe en Ciencias de la Salud), the Cochrane Library y CANCERLIT.
Sistemas para la introducción de material genético en las célulasLa transferencia de genes terapéuticos en células eucariotas puede realizarse por métodos físicos o químicos (transferencia no viral), y biológicos (transferencia viral)2. La transferencia génica no viral se denomina transfección (infección de una célula con un ácido nucleico libre) y depende de los sistemas de transporte celulares para internalizar el ácido nucleico y expresar el gen terapéutico. Los métodos más empleados para la transfección son: electroporación, bombardeo de partículas y liposomas catiónicos. En contraste, la transferencia génica viral depende de un virus para transferir el material genético en el interior celular, se denomina transducción (el virus conduce el gen terapéutico a través de la membrana al interior celular) o infección, y el gen terapéutico se denomina transgén.
Aunque los sistemas no virales para la transferencia de genes al interior celular tienen muchas ventajas12,13, en ensayos clínicos se emplean más los sistemas virales por su tamaño, su cápside proteica que protege al gen terapéutico de la degradación enzimática, y sus mecanismos de internalización eficientes. Además, el genoma viral se puede manipular para eliminar los genes de patogénesis y diseñar virus con alta capacidad de infección y con espacio suficiente para el transgén terapéutico (tabla 1)14. Los virus más utilizados en terapia génica incluyen miembros de las familias Retroviridae (gammaretrovirus y lentivirus)15,16, Adenoviridae17,18, y Herpesviridae (HSV)19, y Parvoviridae (virus adenoasociados)20.
Técnicas de transferencia génica con sus ventajas y desventajas.
| Sistema | Técnica | Ventajas | Desventajas |
| No-viral | Inyección directa ADN/Plásmido | Transferencia local, no tóxica. Simple. Más eficiente en músculo cardíaco o esquelético | Solo tejidos accesiblesBaja eficiencia de transfecciónExpresión génica transitoria |
| Pistola de genes | Técnicamente simple | No específica | |
| Transfección de grandes cantidades de ADN | Daño celular al insertar el ADNBaja eficiencia de transfección | ||
| Electropo ración | Requiere uso de electroporador | ||
| Liposomas catiónicos | Transfección local, simple | No hace blanco en una célula específica | |
| Para cualquier tipo celularNo inmunogénico | Baja eficiencia de transfección | ||
| Viral | Adenoviridae | Transducción de cualquier tipo celular | Muy inmunogénico |
| Células quiescentes, o en división, no se integra en el genoma de la célula diana, Eficiente para transfección in vivo, sobreexpresa proteínas humanas, se pueden producir fácilmente y en altos títulos | Expresión transitoriaPotencial desarrollo de virus silvestrePequeño tamaño de inserción (8Kb de ADN) | ||
| Parvoviridae: virus adenoasociados | Transducción de células en división o quiescentes | Difícil de obtener en altos títulos | |
| Riesgo de mutagénesis insercional | |||
| Integración sitio-específica (Cr 19) | Pequeño tamaño de inserción (4,7Kb) | ||
| Expresión génica de larga duración | Posible inmunogenicidad | ||
| GammaRetroviridae 5 elementos genéticos | Transducción de cualquier tipo celular en división | Transduce únicamente células en división Ineficiente in vivo | |
| Integración en el genoma | Riesgo de mutagénesis insercional | ||
| Expresión permanente del transgén | Pequeño tamaño de inserción (8 kb) | ||
| Son los vectores más adecuados para la transferencia génica ex vivo | |||
| Virus Herpes Simplex | NeurotropismoGran capacidad de inserción (30Kb)Expresión génica duradera | Difícil de manipular debido a su ciclo de vida complejo. Riesgo de reversión a virus silvestre. Pequeño tamaño de inserción (4kb) y riesgo de mutagénesis insercional | |
| Vaccinia virus agente oncolítico | Muy utilizado especialmente comoSe puede utilizar contra enfermedades infecciosas o tumores | Se requiere el uso de cepas altamente atenuadas para garantizar la seguridad de su uso con humanos | |
| Baculovirus | Vehículo alternativo y seguro para dirigir la terapia génica hacia células tumorales | Necesidad de modificarlo para mejorar su tropismo hacia células de mamífero |
La transferencia génica viral puede realizarse in vivo o ex vivo. In vivo implica la transferencia génica dentro del organismo. Este método es de fácil aplicación clínica, pero la diana no es completamente específica y la eficiencia de transducción es muy baja. Ex vivo implica la remoción de las células del huésped, su modificación genética in vitro, y su reimplantación dentro del tejido original. Este es el método de elección para los protocolos que utilizan células dendríticas21, o células CD34+22,23 porque garantiza la especificidad de la diana y permite cuantificar la eficiencia de la transducción10,24,25.
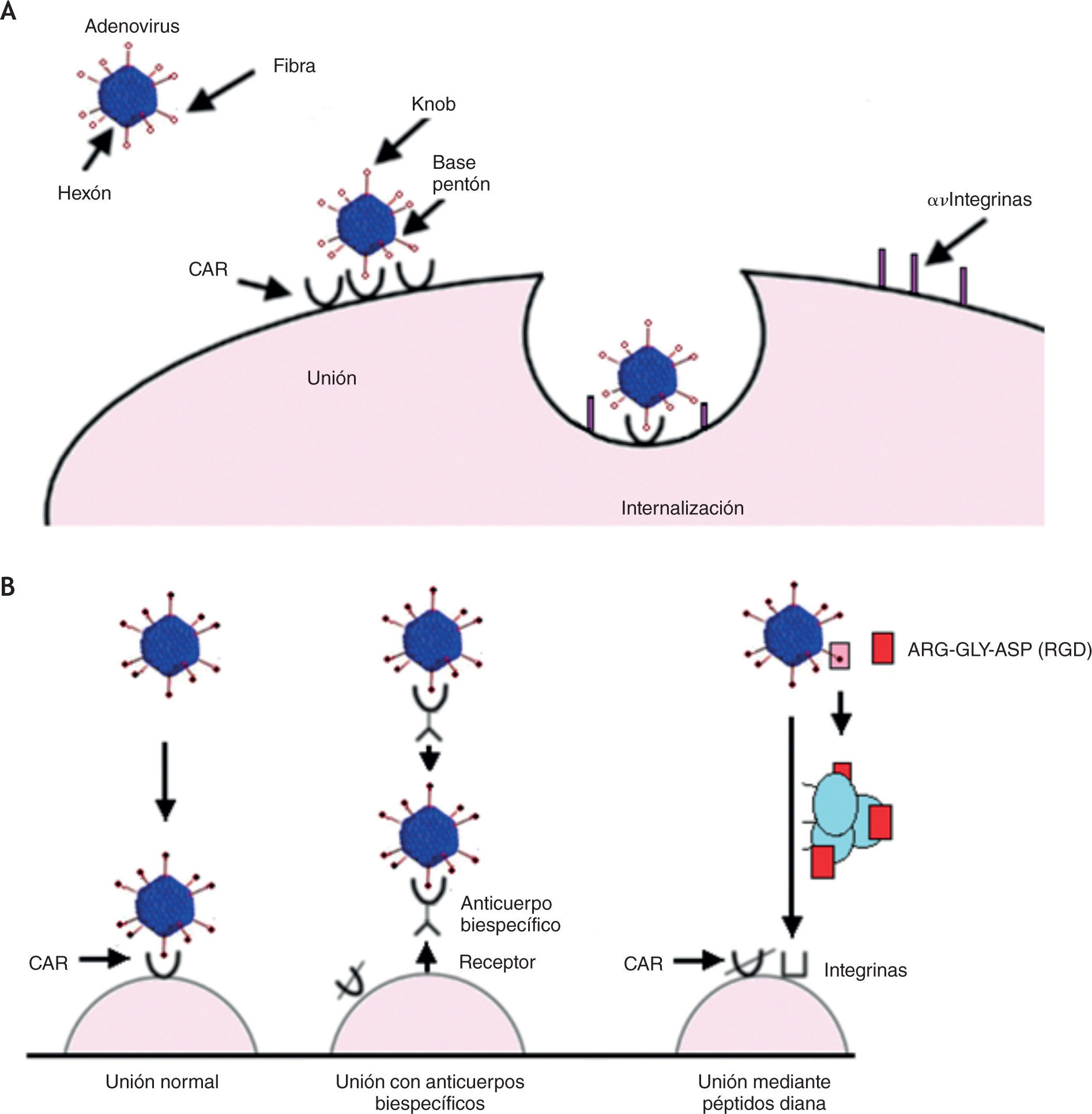
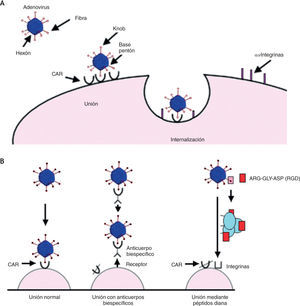
Los adenovirus son muy eficientes para la transferencia génica in vivo. Se han identificado 51 serotipos que infectan humanos, pero los más utilizados en terapia génica son el Ad5 y el Ad2, cuya internalización en la célula diana ocurre por la unión de alta afinidad entre la fibra Knob y el receptor coxsackie/adenovirus, seguida por la interacción entre la base pentón y las integrinas (fig. 1A).
A. Representación esquemática de la unión e internalización de los adenovirus vía CAR e integrinas. B. Unión del adenovirus a la célula diana: unión normal y adaptaciones moleculares para mejorar la eficiencia de la transducción.
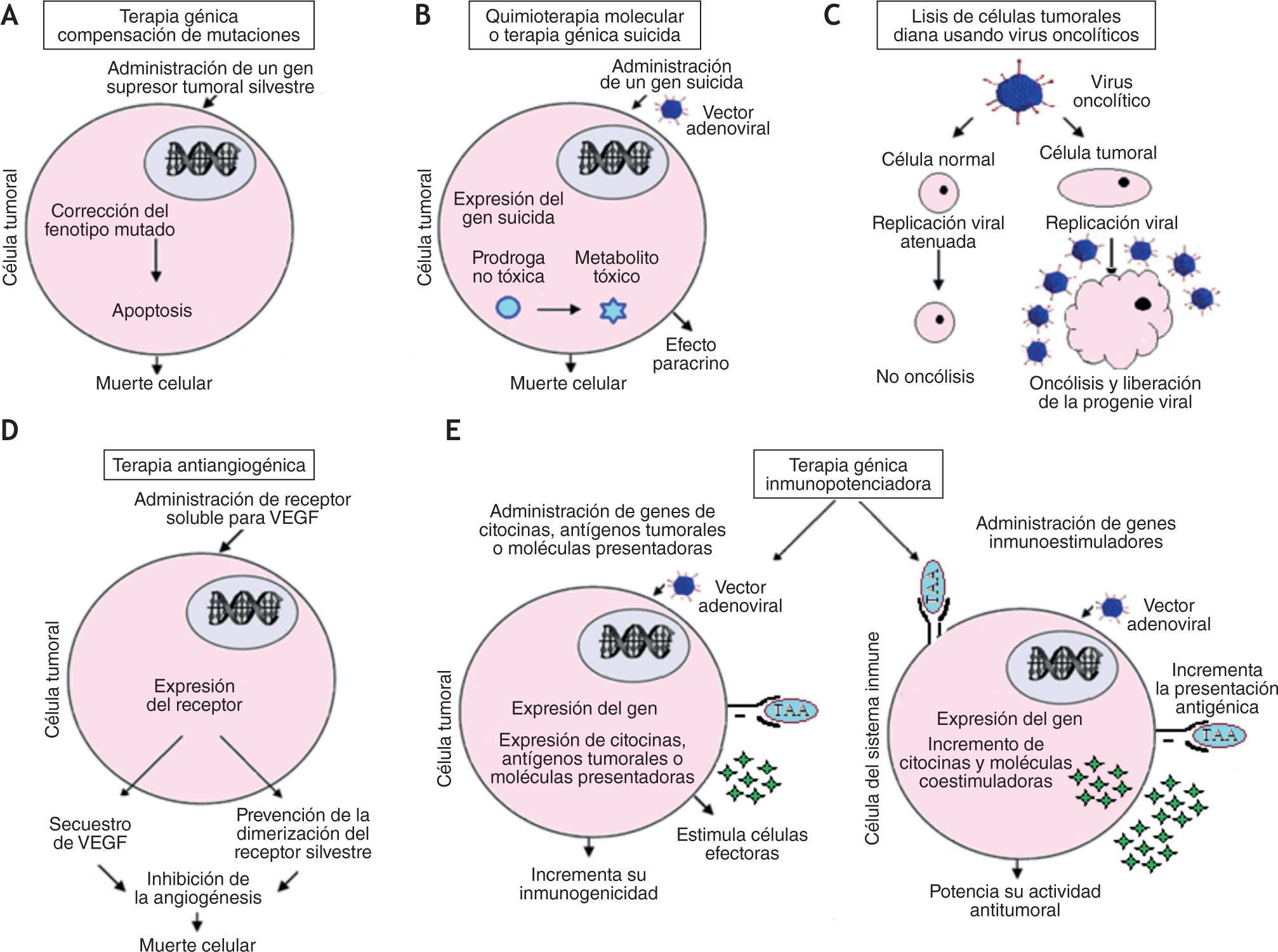
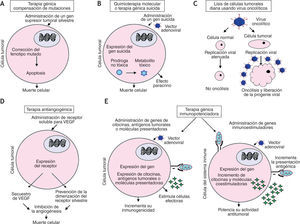
La transformación maligna es un proceso secuencial mediante el cual una célula adquiere nuevas características que le permiten proliferar sin control e invadir localmente y a distancia. Estas características pueden ser dianas para el diseño de terapias que eliminen las células tumorales, mejoren la respuesta inmune o bloqueen la proliferación tumoral. La eliminación de células tumorales puede llevarse a cabo mediante la terapia por compensación de mutaciones (corrección de genes supresores de tumor o inhibición de oncogenes activados); la terapia génica suicida (infección del tumor con un virus de replicación selectiva que codifique una enzima capaz de activar un profármaco en el tumor) y la terapia oncolítica (infección de las células tumorales con un virus lítico). La respuesta inmune del huésped se puede mejorar mediante una terapia inmunopotenciadora (que incremente la inmunogenicidad del tumor o potencie la actividad antitumoral de las células del sistema inmune), y la proliferación de células tumorales se puede inhibir mediante una terapia antiangiogénesis26 (fig. 2).
Diferentes enfoques de la terapia génica antitumoral mediada por adenovirus. A. Sustitución de un gen supresor tumoral mutado: resulta en apoptosis y muerte de la célula tumoral. B. Quimioterapia molecular o terapia génica suicida: la transfección y expresión de un gen suicida resulta en la conversión de una prodroga no tóxica en un metabolito citotóxico. C. Oncólisis viral: la infección viral del tumor resulta en la replicación viral, oncólisis, y liberación de los viriones a las células circundantes. D. Terapia génica antiangiogénesis: la transfección de un receptor soluble para factor de crecimiento endotelial vascular resulta en el secuestro del factor de crecimiento endotelial vascular y la subsecuente inhibición de la neovascularización. E. Terapia génica inmunopotenciadora: su blanco pueden ser las células tumorales o las del sistema inmune y resulta en el incremento de la inmunogenicidad o en la potenciación de la respuesta inmune, respectivamente.
Dado que la mayoría de mutaciones que conducen al desarrollo tumoral afectan a protooncogenes, genes supresores de tumor y genes reparadores del ADN27, y teniendo en cuenta que estas mutaciones son comunes a muchos tumores, el restablecimiento de su función normal puede ser diana de una terapia génica contra el cáncer26. Por ejemplo, el gen p53, se encuentra mutado en más del 50% de tumores, y su expresión normal puede restablecerse mediante un adenovirus que codifique la copia silvestre del mismo (Ad-p53)28–34. En cáncer de próstata y de cuello uterino, Ad-p53 inhibe el crecimiento tumoral in vitro e in vivo29,30,34, y en osteosarcoma, incrementa la sensibilidad al cisplatino y la doxorrubicina31.
Un ensayo preclínico en cáncer de pulmón demuestra que Ad-p53 induce la regresión tumoral con una toxicidad aceptable cuando se usa solo o en combinación con radioterapia y/o quimioterapia32,35, y en carcinoma hepático, Ad-p53 combinado con TRAIL exógeno incrementa la muerte celular por apoptosis33, lo que demuestra que Ad-p53 ejerce un efecto antitumoral sinérgico al administrarse combinado con los tratamientos tradicionales de quimio/radioterapia o con nuevos medicamentos antitumorales, maximizando la eliminación del tumor, y minimizando los efectos colaterales.
Debido al excelente perfil de seguridad y a los efectos antitumorales significativos obtenidos con estos vectores36, se han conducido más de 100 ensayos clínicos (fase/I-III) utilizando Ad-p53. La primera patente de terapia génica utilizando Ad-p53 (Gendicine®), contra el cáncer de cabeza y cuello, se aprobó en octubre de 2003. Posteriormente, se aprobó Oncorine®, contra el carcinoma nasofaríngeo37,38. Ambos vectores demostraron un efecto sinérgico antitumoral en combinación con radio/quimioterapia, cirugía o hipertermia39. Posteriormente, se patentó Advexin®, similar a Gendicine®, cuya patente abarca cualquier adenovirus que porte p53 bajo el control de cualquier promotor40.
Otro gen supresor tumoral frecuentemente mutado en cáncer, y por lo tanto candidato para la terapia génica, es el del retinoblastoma (Rb), que desempeña un importante papel en el control de la proliferación celular. Estudios preclínicos en carcinoma escamocelular oral con adenovirus que portan la copia silvestre del gen Rb (Ad-RB110) demostraron la inhibición del crecimiento tumoral in vitro e in vivo41. Sin embargo, estudios realizados con un mutante de este gen, truncado en la región N-terminal (RB94), reportan mayor actividad antitumoral y supresión del crecimiento tumoral en varios tumores, incluido el cáncer de vejiga. Esta terapia activó mecanismos antitumorales como la erosión de los telómeros, la crisis cromosómica42, y la apoptosis independiente de activación de caspasas y de fragmentación del ADN43. Dado que esta terapia no afecta a las células normales, se han ensayado sistemas virales y no virales para administrar de manera sistémica el mutante Rb94. Millikan et al. están evaluando la expresión de un plásmido que porta el gen RB94 (SGT-94), encapsulado en liposomas en tumores sólidos Rb negativos, para demostrar que transfecta específicamente células tumorales, ocasiona muerte celular e incrementa la respuesta antitumoral de la quimio-radiación44.
Otros mecanismos indispensables para mantener la homeostasis celular en los tejidos sanos son la apoptosis (muerte celular programada) y la autofagia (muerte celular programada de tipo II). Alteraciones en la expresión de las proteínas que controlan estos procesos favorecen el desarrollo tumoral y se asocian con el desarrollo de resistencia a las terapias tradicionales. Se puede inducir la muerte celular por apoptosis y sensibilizar a las células tumorales frente a los tratamientos tradicionales utilizando como diana proteínas de la familia Bcl-2 (Bcl-x[S], Bcl-x[AK], Bik/Nbk y Bax) o ligandos de muerte relacionados con el factor de necrosis tumoral (CD95L/FasL, factor de necrosis tumoral a y TRAIL)45; Igualmente, se puede inducir la autofagia mediante el restablecimiento de la expresión de XAF1 (XIAP-associated factor-1) con Adeno-XAF1 en células de cáncer gástrico46. Cuando se co mbina esta terapia con TRAIL (Adeno-XIAF1/TRAIL), se observa un efecto sinérgico que resulta en la muerte por apoptosis47.
Terapia génica suicidaLa terapia génica suicida incrementa la susceptibilidad del tumor a la quimioterapia mediante la expresión de un gen suicida que codifica una enzima capaz de catalizar la conversión de un profármaco no toxico en un metabolito tóxico potente y de corta duración con capacidad para difundir desde la célula tumoral en la que se produce y eliminar las células tumorales que la rodean (efecto bystander) tras la administración del profármaco, sin entrar en la circulación sistémica ni causar efectos secundarios48.
Los sistemas suicidas (enzima/profármaco) más utilizados son: el gen de la timidina-cinasa del virus Herpes simplex (HSV-tk) (gen suicida), y como profármaco, el ganciclovir (GCV), cuyo producto metabólico tóxico es el deoxi-timidina trifosfato, un análogo de la purina que inhibe la ADN polimerasa e induce apoptosis como resultado del arresto del ciclo celular49, y el gen de la citosina desaminasa (CD) de Escherichia coli (gen suicida), y 5-fluorocitocina (5-FC) (profármaco), cuyo metabolito tóxico es el 5-fluorouracilo48. Se han desarrollado nuevos sistemas suicidas como el basado en el gen del citocromo P450 (gen suicida) y ciclofosfamida o isofosfamida como profármacos cuya actividad antitumoral se potencializa con la transferencia del gen del citocromo P45050.
Numerosos ensayos preclínicos para el tratamiento de glioma51,52, cáncer de vejiga53, colon46, gástrico54 y pulmón55, utilizando el sistema HSV-tk-GCV han arrojado resultados prometedores para aplicarlos a la clínica. En glioma de alto grado operable, se incrementó significativamente la supervivencia, y debido a que la citotoxicidad de este tratamiento en células normales es muy baja, se ha sugerido su posible utilización como tratamiento primario o adyuvante51,56.
Puesto que el cáncer es el resultado de múltiples alteraciones genéticas, el desarrollo de terapias génicas que puedan utilizarse simultáneamente con otras es de gran importancia. Estudios con xenoinjertos de glioma humano en ratas permitieron demostrar que la terapia génica suicida en combinación con la terapia por compensación de mutaciones tiene mayor efecto antitumoral. El tratamiento simultaneo de HSV-tk/GCV y AdCMVp53 arrojó resultados similares a los obtenidos con la terapia suicida sola, utilizando únicamente la mitad de la dosis de GCV52.
Lisis de células tumorales usando adenovirus de replicación selectiva (oncólisis viral)Los adenovirus son seguros, fáciles de manipular genéticamente y poseen ciclo de vida lítico, por lo cual, se han desarrollado variantes virales incapaces de replicarse en células normales pero capaces de infectar y lisar efectivamente células tumorales57. Una vez infectada la célula tumoral, el virus lítico se replica en su interior hasta que la lisa para liberar nuevas partículas virales que infectan las células tumorales vecinas, perpetuando los ciclos de infección, replicación y lisis mientras existan células tumorales que soporten la infección. Estos adenovirus actúan como un agente biológico antitumoral más que como vehículo para administrar genes terapéuticos, sin embargo, su efecto puede mejorarse al insertar genes de citocinas o enzimas58,59.
Con el fin de dirigir su actividad oncolítica, se desarrollaron los adenovirus de replicación selectiva, mediante la depleción de funciones virales no necesarias en células tumorales y la substitución de promotores virales por promotores selectivos del tumor como la alfa-fetoproteína, el antígeno prostático específico, la kallikreína, la mucina 1 y la osteocalcina, entre otros60,61.
El primer virus de replicación selectiva utilizado en ensayos clínicos aleatorios fue el ONYX-015, que permite la replicación y lisis de células tumorales deficientes en p53. Este vector demostró un nivel de eficacia satisfactorio en modelos preclínicos contra xenoinjertos de carcinoma de ovario humano deficiente de p53. Sin embargo, a pesar de su seguridad, su aplicación en un estudio clínico en mujeres con cáncer de ovario recurrente y refractario al tratamiento no mostró evidencia clara de respuesta clínica o radiológica en ningún paciente62.
En un estudio en fase II, tras haberse demostrado una modesta actividad antitumoral con el tratamiento oncolítico en pacientes con cáncer de cabeza y cuello63, se observó que cuando las pacientes recibieron el tratamiento oncolítico combinado con quimioterapia (cisplatino y 5-fluorouracilo), tuvieron una respuesta completa sin progresión a los 6 meses de seguimiento, mientras que todos los tratados únicamente con quimioterapia, progresaron64. Adicionalmente, un ensayo aleatorio de fase III, en el que se utilizó el adenovirus H101 en 160 pacientes con cáncer de cabeza y cuello o esófago, demostró que el tratamiento combinado con quimioterapia (cisplatino o adriamicina combinados con 5-fluorouracilo) duplica la respuesta y es bien tolerado65,66.
La oncólisis viral puede combinarse con otras terapias génicas. El adenovirus oncolítico que porta E1A bajo el control del promotor de hTERT, y el gen suicida CD bajo el control del promotor del CMV (Ad.hTERT-E1A/CMV-CD) se replican selectivamente en células tumorales humanas e incrementan el efecto letal sobre células tumorales67.
También se pueden diseñar virus que complementen su actividad oncolítica con la enzimática. El virus oncolítico (Ad5/3-Delta24-FCU1) es una quimera (Ad5/3) en la cual se reemplaza la fibra Knob del serotipo 5 por la del serotipo 3 para mejorar la eficiencia de transfección de los virus con cápside silvestre68. Adicionalmente, tiene una depleción de 24-bp (Ad5/3-Δ24) en la región constante del gen E1A que restringe su expresión a las células tumorales deficientes en Rb69,70, y porta el gen FCU1 (Ad5/3-Delta24-FCU1) que codifica una enzima con doble actividad catalítica: metaboliza la 5-Fluorocitosina, en 5-fluorouracilo y monofosfato de 5-fluorouridina. Un estudio preclínico en carcinoma escamoso de cabeza y cuello múrido demostró el efecto antitumoral sinérgico cuando se administró el Ad5/3-Delta24FCU1 con 5-Fluorocitosina en comparación con los tratados sin el profármaco64.
Terapia génica inmunopotenciadoraDado que las células tumorales son poco inmunogénicas, y debido a que durante su desarrollo el cáncer no causa inflamación ni daño tisular (señales de peligro), no se activa una respuesta inmune efectiva que controle su crecimiento. La terapia génica inmunopotenciadora o vacunación genética en cáncer se ha desarrollado con base en la inducción de una inmunización activa que module los componentes celulares del sistema inmune e incremente su capacidad para reconocer y rechazar los antígenos tumorales. Esta estrategia solo es posible en tumores que expresen antígenos tumorales específicos71.
Numerosos ensayos clínicos se han centrado en la introducción de genes de citocinas estimuladoras como interleucina (IL)-2, IL-12 o interferón (fig. 2). Modelos de hepatocarcinoma en ratas tratadas con AdCMV-IL-12 demostraron una inhibición dosis-dependiente del crecimiento tumoral72, y en modelos múridos, se demostró que la cantidad de citocinas expresadas de novo en el tumor es importante, puesto que la regresión es mayor cuando el tratamiento de realiza con adenovirus que codifican la IL-2 bajo el control de un promotor fuerte (citomegalovirus) que cuando se realiza con adenovirus que la codifican bajo el control de un promotor débil como el del Rous Sarcoma Virus73.
Las múltiples alteraciones que pueden estar presentes en un tumor dificultan la escogencia de un blanco molecular único para el tratamiento del cáncer. La posibilidad de transferir varios genes para estimular diferentes componentes de la inmunidad y ejercer un efecto aditivo se demostró en un modelo de mieloma múltiple in vitro, donde la transferencia de Ad-p53/GM-CSF/B7-1 indujo apoptosis, proliferación de linfocitos y citotoxicidad específica contra células tumorales28. Adicionalmente, células del sistema inmune pueden modificarse para optimizar los protocolos de inmunopotenciación. Las más utilizadas son: presentadoras de antígeno y linfocitos infiltrantes de tumor (NK o LT citotóxicos específicos para antígenos tumorales)74.
Terapia antiangiogénesisLa angiogénesis es la formación de nuevos vasos sanguíneos a partir de los preexistentes como consecuencia del desbalance en la concentración de factores anti y proangiogénesis por parte de células endoteliales, monocitos, células de músculo liso y plaquetas. La angiogénesis, común a los tumores sólidos, es fundamental para la vascularización y el desarrollo del microambiente favorable que garantiza la supervivencia y progresión tumoral, y el desarrollo de metástasis75. Su inducción requiere factores de crecimiento (factor de crecimiento endotelial vascular, factor de crecimiento de fibroblastos, factor de crecimiento epidérmico, factor estimulante de colonias de granulocitos y monocitos, factor de crecimiento derivado de plaquetas), citocinas, (IL-1, IL-6, IL-8, factor de necrosis tumoral a) proteínas de la matriz extracelular (colágeno, endostatina, e integrinas) y enzimas proteolíticas (catepsina, activador del plasminógeno tipo uroquinasa, y gelatinasas A y B), cuya expresión desequilibrada favorece la formación de vasos sanguíneos que irrigan el tumor. Un tumor incapaz de inducir la angiogénesis permanece en estado latente76, por lo cual, una terapia antiangiogénesis conducirá a la muerte de las células tumorales al impedir su irrigación sanguínea77.
Numerosos ensayos clínicos han demostrado que la endostatina es el inhibidor endógeno de la angiogénesis con mayor espectro antitumoral y menor toxicidad, por lo cual se aprobó su uso para el tratamiento del cáncer. Sin embargo, no ha tenido mucha aplicación clínica por la dificultad para producirla a gran escala y por su inestabilidad in vitro. Se han desarrollado metodologías que permiten producir y purificar la endostatina humana recombinante mediante la infección de células Ad293 con el vector adenoviral Ad-rhEndo. Esta proteína es más efectiva y estable que la obtenida a partir de levaduras, y su administración no genera resistencia en modelos animales ni en humanos78. Diferentes vectores que portan el gen de la endostatina han demostrado actividad antitumoral: el vector E10A incrementó significativamente el efecto inhibidor del crecimiento tumoral del cisplatino en xenoinjertos de carcinoma escamocelular de cabeza y cuello79, y exhibió un excelente perfil de seguridad dado que cuando se evaluó su toxicidad, producción viral y respuesta antitumoral, se encontró que la inyección intratumoral de 1 × 1012 partículas virales por semana en pacientes con tumores sólidos ejerce un efecto antitumoral moderado y es bien tolerado80.
También se han ensayado adenovirus recombinantes deficientes de replicación, que codifican las formas secretadas de endostatina: el rAd, que codifica la endostatina múrida, inhibe la formación de vasos sanguíneos, la migración y proliferación de células endoteliales, e induce apoptosis en células del endotelio vascular in vitro e in vivo81; y el Ad-rhE que codifica la endostatina humana, genera una alta expresión de endostatina in vivo. Tanto el adenovirus como la proteína son metabolizados en el hígado82, y se está llevando a cabo un ensayo clínico de fase 1 para evaluar la seguridad y eficacia del adenovirus (Ad-rhE) en pacientes con tumores sólidos avanzados83.
La inducción de un microambiente antioncogénico que anule el prooncogénico se puede lograr mediante la terapia génica. El vector Ad-HBx-mIL-12 combina la actividad antiangiogénesis e inhibidora de apoptosis de la proteína X del virus de la hepatitis B con la actividad de la IL-12, y en carcinoma hepatocelular, conduce a la acumulación masiva de células inmunes, la apoptosis de células tumorales y la reducción de los vasos sanguíneos angiogénicos84.
Terapia génica neoadyuvante para el tratamiento tradicional del cáncerLa terapia génica en combinación con los tratamientos tradicionales (neoadyuvancia) mejora la respuesta clínica de los pacientes. Nokisalmi et al. analizaron la dosis de radiación, la modificación de la cápside viral y 5 diferentes promotores para el transgén con el fin de evaluar los mecanismos que median la sobrerregulación del transgén inducida por la radioterapia, y la respuesta al tratamiento combinado con adenovirus deficientes de replicación y radioterapia, en líneas celulares de cáncer de mama, próstata y pulmón. Un amplio rango de dosis de radiación incrementa la expresión del transgén independientemente de la línea celular, el transgén, el promotor o la modificación de la cápside viral. La radiación induce una respuesta celular global y mayor producción de ARN y proteínas, incluidos los productos transgénicos del adenovirus85.
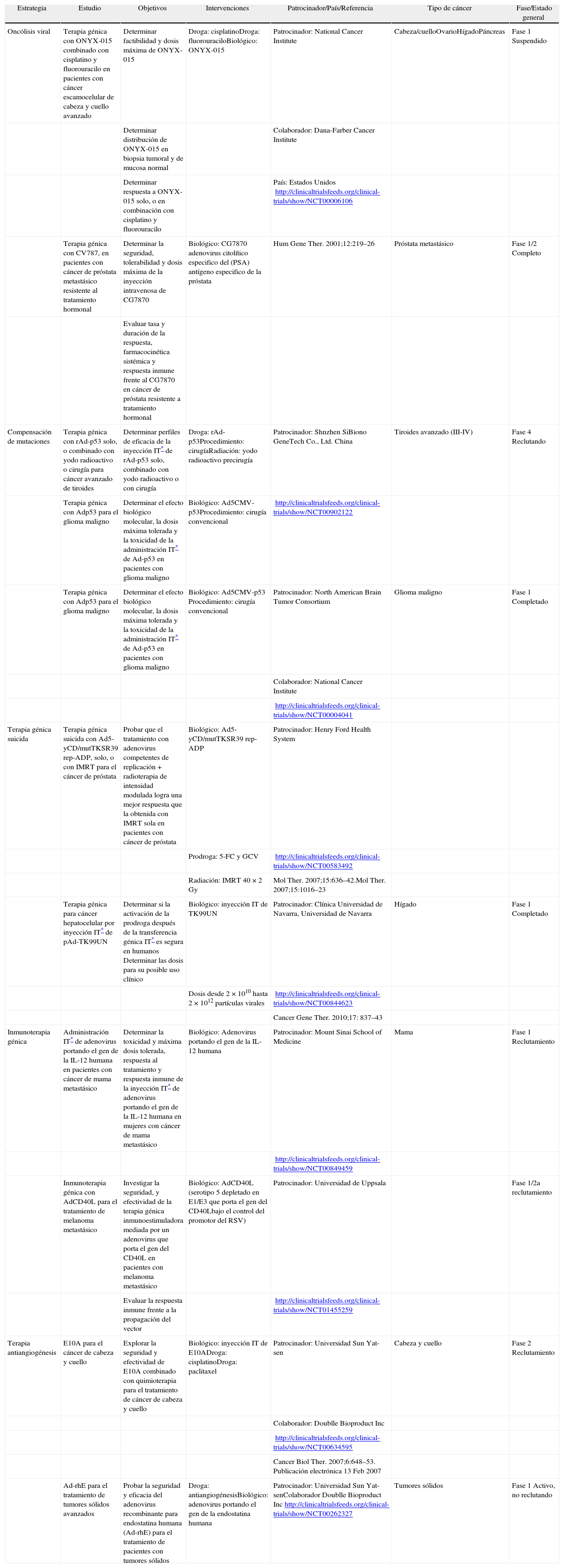
La terapia génica suicida es un claro ejemplo de tratamiento neoadyuvante para mejorar la eficacia del tratamiento quimioterapéutico. Predina et al. reportaron una terapia génica con el sistema AdV-tk/GCV para el tratamiento neoadyuvante en carcinoma de esófago. La combinación entre cirugía, quimioterapia y AdV-tk/GCV mejora la supervivencia y disminuye la recurrencia de la enfermedad por el efecto citotóxico y el incremento del tráfico de células T-CD8 intratumorales86. En la tabla 2 se muestran algunos ejemplos de ensayos clínicos que han sido desarrollados mediante las diferentes modalidades de terapia génica exclusiva o en combinación con las terapias convencionales.
Algunos ejemplos de ensayos clínicos llevados a cabo mediante diferentes modalidades de terapia génica.
| Estrategia | Estudio | Objetivos | Intervenciones | Patrocinador/País/Referencia | Tipo de cáncer | Fase/Estado general |
| Oncólisis viral | Terapia génica con ONYX-015 combinado con cisplatino y fluorouracilo en pacientes con cáncer escamocelular de cabeza y cuello avanzado | Determinar factibilidad y dosis máxima de ONYX-015 | Droga: cisplatinoDroga: fluorouraciloBiológico: ONYX-015 | Patrocinador: National Cancer Institute | Cabeza/cuelloOvarioHígadoPáncreas | Fase 1 Suspendido |
| Determinar distribución de ONYX-015 en biopsia tumoral y de mucosa normal | Colaborador: Dana-Farber Cancer Institute | |||||
| Determinar respuesta a ONYX-015 solo, o en combinación con cisplatino y fluorouracilo | País: Estados Unidos http://clinicaltrialsfeeds.org/clinical-trials/show/NCT00006106 | |||||
| Terapia génica con CV787, en pacientes con cáncer de próstata metastásico resistente al tratamiento hormonal | Determinar la seguridad, tolerabilidad y dosis máxima de la inyección intravenosa de CG7870 | Biológico: CG7870 adenovirus citolítico especifico del (PSA) antígeno especifico de la próstata | Hum Gene Ther. 2001;12:219–26 | Próstata metastásico | Fase 1/2 Completo | |
| Evaluar tasa y duración de la respuesta, farmacocinética sistémica y respuesta inmune frente al CG7870 en cáncer de próstata resistente a tratamiento hormonal | ||||||
| Compensación de mutaciones | Terapia génica con rAd-p53 solo, o combinado con yodo radioactivo o cirugía para cáncer avanzado de tiroides | Determinar perfiles de eficacia de la inyección IT* de rAd-p53 solo, combinado con yodo radioactivo o con cirugía | Droga: rAd-p53Procedimiento: cirugíaRadiación: yodo radioactivo precirugía | Patrocinador: Shnzhen SiBiono GeneTech Co., Ltd. China | Tiroides avanzado (III-IV) | Fase 4 Reclutando |
| Terapia génica con Adp53 para el glioma maligno | Determinar el efecto biológico molecular, la dosis máxima tolerada y la toxicidad de la administración IT* de Ad-p53 en pacientes con glioma maligno | Biológico: Ad5CMV-p53Procedimiento: cirugía convencional | http://clinicaltrialsfeeds.org/clinical-trials/show/NCT00902122 | |||
| Terapia génica con Adp53 para el glioma maligno | Determinar el efecto biológico molecular, la dosis máxima tolerada y la toxicidad de la administración IT* de Ad-p53 en pacientes con glioma maligno | Biológico: Ad5CMV-p53 Procedimiento: cirugía convencional | Patrocinador: North American Brain Tumor Consortium | Glioma maligno | Fase 1 Completado | |
| Colaborador: National Cancer Institute | ||||||
| http://clinicaltrialsfeeds.org/clinical-trials/show/NCT00004041 | ||||||
| Terapia génica suicida | Terapia génica suicida con Ad5-yCD/mutTKSR39 rep-ADP, solo, o con IMRT para el cáncer de próstata | Probar que el tratamiento con adenovirus competentes de replicación + radioterapia de intensidad modulada logra una mejor respuesta que la obtenida con IMRT sola en pacientes con cáncer de próstata | Biológico: Ad5-yCD/mutTKSR39 rep-ADP | Patrocinador: Henry Ford Health System | ||
| Prodroga: 5-FC y GCV | http://clinicaltrialsfeeds.org/clinical-trials/show/NCT00583492 | |||||
| Radiación: IMRT 40 × 2 Gy | Mol Ther. 2007;15:636–42.Mol Ther. 2007;15:1016–23 | |||||
| Terapia génica para cáncer hepatocelular por inyección IT* de pAd-TK99UN | Determinar si la activación de la prodroga después de la transferencia génica IT* es segura en humanos Determinar las dosis para su posible uso clínico | Biológico: inyección IT de TK99UN | Patrocinador: Clínica Universidad de Navarra, Universidad de Navarra | Hígado | Fase 1 Completado | |
| Dosis desde 2 × 1010 hasta 2 × 1012 partículas virales | http://clinicaltrialsfeeds.org/clinical-trials/show/NCT00844623 | |||||
| Cancer Gene Ther. 2010;17: 837–43 | ||||||
| Inmunoterapia génica | Administración IT* de adenovirus portando el gen de la IL-12 humana en pacientes con cáncer de mama metastásico | Determinar la toxicidad y máxima dosis tolerada, respuesta al tratamiento y respuesta inmune de la inyección IT* de adenovirus portando el gen de la IL-12 humana en mujeres con cáncer de mama metastásico | Biológico: Adenovirus portando el gen de la IL-12 humana | Patrocinador: Mount Sinai School of Medicine | Mama | Fase 1 Reclutamiento |
| http://clinicaltrialsfeeds.org/clinical-trials/show/NCT00849459 | ||||||
| Inmunoterapia génica con AdCD40L para el tratamiento de melanoma metastásico | Investigar la seguridad, y efectividad de la terapia génica inmunoestimuladora mediada por un adenovirus que porta el gen del CD40L en pacientes con melanoma metastásico | Biológico: AdCD40L (serotipo 5 depletado en E1/E3 que porta el gen del CD40Lbajo el control del promotor del RSV) | Patrocinador: Universidad de Uppsala | Fase 1/2a reclutamiento | ||
| Evaluar la respuesta inmune frente a la propagación del vector | http://clinicaltrialsfeeds.org/clinical-trials/show/NCT01455259 | |||||
| Terapia antiangiogénesis | E10A para el cáncer de cabeza y cuello | Explorar la seguridad y efectividad de E10A combinado con quimioterapia para el tratamiento de cáncer de cabeza y cuello | Biológico: inyección IT de E10ADroga: cisplatinoDroga: paclitaxel | Patrocinador: Universidad Sun Yat-sen | Cabeza y cuello | Fase 2 Reclutamiento |
| Colaborador: Doublle Bioproduct Inc | ||||||
| http://clinicaltrialsfeeds.org/clinical-trials/show/NCT00634595 | ||||||
| Cancer Biol Ther. 2007;6:648–53. Publicación electrónica 13 Feb 2007 | ||||||
| Ad-rhE para el tratamiento de tumores sólidos avanzados | Probar la seguridad y eficacia del adenovirus recombinante para endostatina humana (Ad-rhE) para el tratamiento de pacientes con tumores sólidos | Droga: antiangiogénesisBiológico: adenovirus portando el gen de la endostatina humana | Patrocinador: Universidad Sun Yat-senColaborador Doublle Bioproduct Inchttp://clinicaltrialsfeeds.org/clinical-trials/show/NCT00262327 | Tumores sólidos | Fase 1 Activo, no reclutando |
Actualmente, se están llevando a cabo múltiples ensayos clínicos utilizando una gran variedad de enfoques terapéuticos para el tratamiento del cáncer. Únicamente en los institutos nacionales de salud en Estados Unidos, se encuentran reportes de 1.886 ensayos clínicos con terapias génicas para el tratamiento del cáncer, de los cuales 81 están utilizando adenovirus.
Se han desarrollado múltiples agentes virales y no virales para la terapia génica del cáncer con resultados prometedores. En la actualidad, los adenovirus son los más populares y estudiados ya que, además de sus características deseables, han demostrado poseer un excelente récord de seguridad en pacientes con cáncer. Los adenovirus seguirán desarrollándose, y se descubrirá la manera de hacerlos más competitivos al minimizar el efecto de los factores limitantes para su desarrollo y utilización en el tratamiento del cáncer.
Factores como la imposibilidad para identificar un único gen que funcione en una terapia antitumoral, la falta de selectividad hacia el tumor, la corta duración de la expresión del gen terapéutico87, la dificultad para transfectar toda la masa tumoral y la fuerte respuesta inmune antiviral generada en el hospedero son las principales limitaciones para la aplicación de la terapia génica88,89.
Dado que inicialmente se determinó que la respuesta inmune antiviral y la falta de selectividad hacia el tumor eran las principales limitaciones para la administración del vector terapéutico90, se diseñaron vectores capaces de garantizar la llegada del virus al tumor, la activación de la respuesta inmune antitumoral y la infección selectiva de las células tumorales. Los adenovirus dependientes de virus auxiliar (gutless) poseen amplias depleciones del genoma, por lo que expresan pocas proteínas virales y no inducen una respuesta inmune vigorosa in vivo. Adicionalmente, mantienen su tropismo y la eficiencia para la transducción y expresión del gen terapéutico91.
La vía de administración juega un papel importante en la respuesta al tratamiento con adenovirus recombinantes. La inyección intratumoral del interferón —mediante un adenovirus— induce mayor inmunidad antitumoral y genera menor toxicidad que la inyección intravenosa del mismo vector92. Un ensayo clínico de fase 1 evaluó la eficacia terapéutica, biodistribución y neurotoxicidad de los adenovirus de gran capacidad (HC-Ad) en ratas con glioblastoma y demostró que su administración intratumoral induce inmunidad sistémica antiadenovirus sin afectar a su eficacia terapéutica93. Para salvar la dificultad de la selectividad hacia el tumor, se diseñaron vectores con los genes terapéuticos bajo el control de promotores específicos de células tumorales como hTERT67, PMSA94 o survivina54, o con motivos que permiten visualizar el virus (mRFP1) y que lo dirigen a la célula diana (polilisina), donde ejerce el efecto terapéutico (HSV-1/TK)87.
Avances como el desarrollo de sistemas celulares monocito-macrófagos para administrar adenovirus oncolíticos en zonas de hipoxia en tumores de próstata permitieron utilizar 3 niveles de especificidad: el homming de los macrófagos en zonas de hipoxia, la inducción de proliferación viral en el macrófago por hipoxia y la replicación selectiva del virus en células tumorales de próstata. Este sistema permitió la transducción de células tumorales en zonas de hipoxia y en las metástasis, que son difíciles de transfectar95.
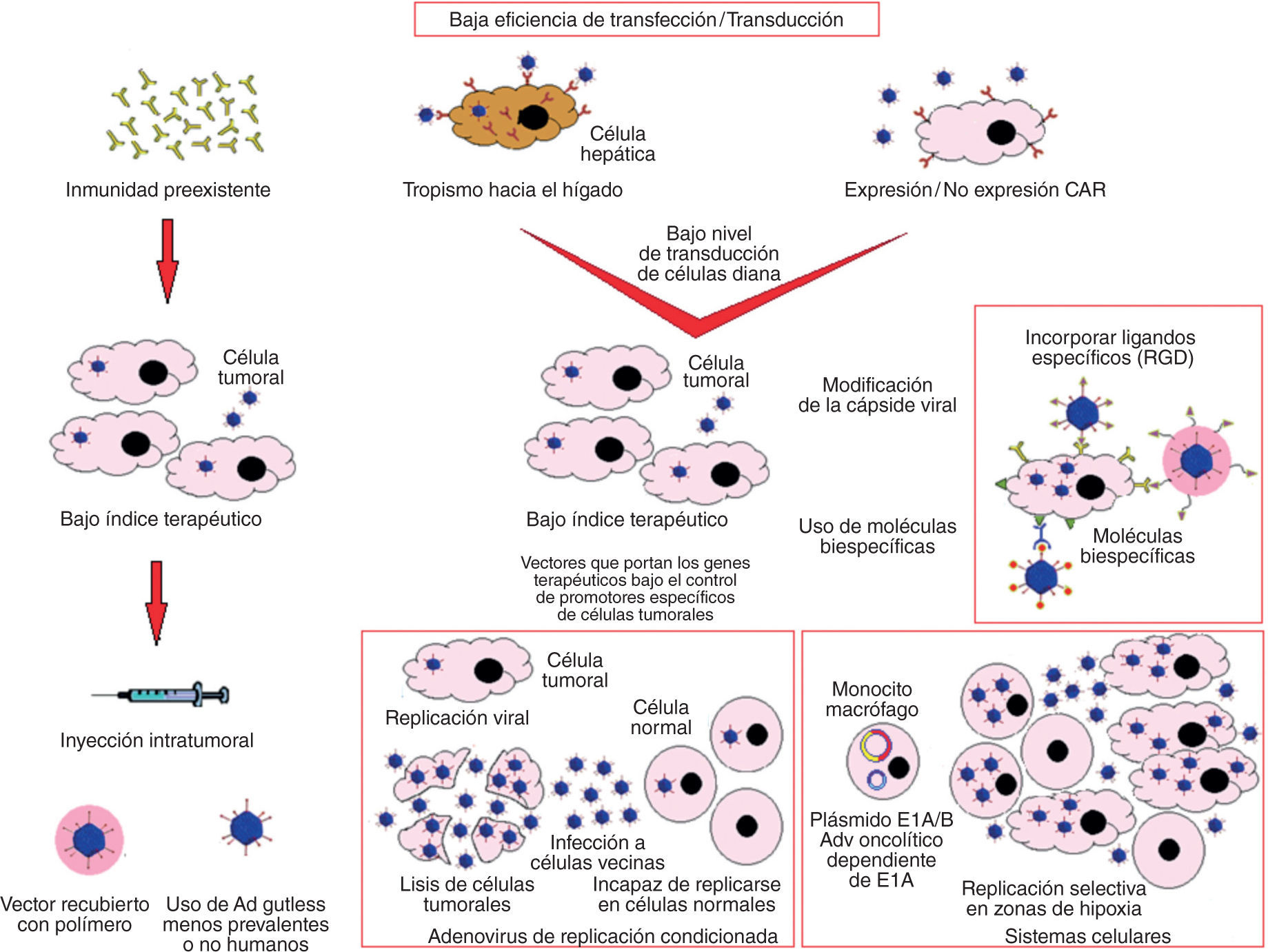
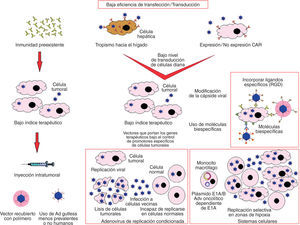
Muchos factores resultan en una baja eficiencia de transfección: el tropismo viral hacia el hígado, los anticuerpos preexistentes, la gran variedad de células que expresan el receptor coxsackie/adenovirus y la no expresión del receptor coxsackie/adenovirus en algunas células. Estas dificultades pueden salvarse mediante diversas estrategias de terapia génica (figs. 1B y 3)94.
Factores que limitan la aplicación de la terapia génica y estrategias empleadas para minimizar su efecto: la inmunidad preexistente, el tropismo viral hacia el hígado y la falta de selectividad del vector hacia las células tumorales son los principales obstáculos para una terapia génica efectiva. Estas dificultades pueden superarse mediante la construcción de adenovirus modificados para disminuir su inmunogenicidad, mejorar la eficiencia de la transfección y hacerlos selectivos de las células tumorales.
Por último, si se considera que tumores como el cáncer colorrectal hereditario no poliposo, normalmente posee mutaciones en los genes de la maquinaria de reparación de apareamientos erróneos, y que este “fenotipo mutador” puede anular el efecto de la transferencia génica, se podría pensar en una terapia génica que además del gen terapéutico incluya la copia silvestre del gen de la reparación de apareamientos erróneos que esté alterado (MLH1, MSH2, MSH6 y PMS2) para revertir el fenotipo mutador.
ConclusionesLa terapia génica es un grupo de modalidades terapéuticas únicas proyectadas para introducir ácidos nucleicos en las células y reemplazar material genético defectuoso o perdido para tratar o curar una enfermedad. Estas terapias, que inicialmente arrojaron resultados inesperados que justificaron su fuerte regulación para garantizar su seguridad, han demostrado una clara evidencia de su eficacia terapéutica con una toxicidad extraordinariamente menor que la generada por los tratamientos tradicionales.
Se espera que durante la próxima década se aprueben y regulen diferentes terapias génicas para el tratamiento del cáncer, aunque los resultados preclínicos en modelos animales no son muy alentadores. La mayoría del trabajo preclínico se realiza por xenoinjerto en animales inmunosuprimidos cuyos resultados no se pueden extrapolar a los que se obtendrían en un animal inmunocompetente. Incluso si se contara con modelos inmunocompetentes, los datos obtenidos pueden no ser extrapolables a los seres humanos.
Queda mucho por aprender sobre la biología de la terapia génica viral en pacientes con cáncer. Aunque existe evidencia del potencial terapéutico y de la seguridad en el uso de estos agentes terapéuticos, la mayor conclusión de los ensayos clínicos que se han llevado a cabo es que la penetración del tumor y la eficiencia de transducción son muy bajas para permitir un efecto antitumoral significativo. Actualmente, se están llevando a cabo numerosos estudios que permitirán desarrollar vectores más eficientes que generen una inmunidad antitumoral sistémica reforzada por la respuesta antiviral que genere el vector terapéutico.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.