Describir las características clínicas y los resultados del tratamiento inicial de los pacientes con linfoma de células del manto atendidos en el Instituto Nacional de Cancerología (INC) entre los años 2007 y 2011.
MétodosEstudio descriptivo y retrospectivo, tipo serie de casos basado en fuentes secundarias institucionales.
ResultadosSe incluyeron 41 pacientes con una edad promedio de 60,5 años (DE±10,5) y que tenían en su mayoría un estado funcional adecuado. La mayor parte tenía enfermedad avanzada al momento de la presentación (85%). El compromiso de la médula ósea y la afectación extranodal fueron frecuentes, encontrándose en 73% y 39% respectivamente. El diagnóstico histopatológico de la malignidad se realizó en tejido ganglionar en la mayoría de los casos (56%). Los esquemas de quimioterapia de primera línea empleados con más frecuencia fueron R-CHOP y R-HyperCVAD, en 37% y 29% de los casos respectivamente. Tras la quimioterapia de primera línea se logró alcanzar una respuesta completa en 64% de los pacientes, la mediana de duración de la primera remisión fue 9 meses (RIQ 0,9 - 15). La neutropenia febril fue una complicación común presentándose en 42% de los casos. Dieciocho individuos recibieron quimioterapia de segunda línea, los esquemas más frecuentemente empleados fueron R-DHAP y R-HyperCVAD.
ConclusionesLas características clínicas de los pacientes son similares a las descritas en series de referencia. Las tasas de respuesta completa y la duración de la primera remisión son inferiores a las publicadas por otros grupos con esquemas similares de tratamiento.
To describe the clinical features and the treatment results achieved with the initial therapy among patients with mantle cell lymphoma treated at the National Cancer Institute (INC) between 2007 and 2011.
MethodsDescriptive study, based on secondary institutional sources.
ResultsA total of 41 patients were included, with a mean age of 60.5 years (Standard deviation SD±10.5) and a good functional status. Most of them had advanced disease at initial presentation (85%). Bone marrow involvement and extra-nodal disease were frequent, as they were seen in 73% and 39% of the patients, respectively. Histopathological diagnosis of the malignancy was mainly made on lymph node tissue (56%). First line chemotherapy regimens used with an increased frequency were R CHOP and R- HyperCVAD, in 37% and 29% of the cases, respectively. After first line therapy, a complete response was achieved in 64% of the patients, median duration of the first remission was 9 months (Interquartile range IQR 0.9 - 15). Febrile neutropenia was a frequent complication, seen in 42% of the cases. Eighteen individuals received a second line of chemotherapy, with R DHAP and R HyperCVAD being the regimens most commonly administered.
ConclusionsThe clinical features of the patients are similar to those described in larger series of patients with the disease described elsewhere. The rate of complete responses, as well as the duration of the first remission after chemotherapy, is inferior when compared with the results of other groups that used similar treatment regimens.
El linfoma de células del manto (LCM) es un tipo infrecuente de linfoma no Hodgkin (LNH) y representa entre el 3% y el 10% de todos los linfomas en adultos1. La enfermedad se presenta en estadio avanzado y es más frecuente en hombres. Datos de una cohorte de pacientes incluidos en el registro nacional de linfoma de Suiza y Dinamarca entre 2001 a 2011 y que incluyó en total 1.389 pacientes, encontró que la mediana de edad al momento del diagnóstico era de 71 años y la razón entre hombres y mujeres de 2,5:1. En este grupo de pacientes, el 70,9% se encontraba en estadio IV del sistema de Ann Arbor al momento del diagnóstico y el 66,9% de los pacientes era mayor de 65 años2.
El LCM es una entidad con características histológicas muy bien definidas que reflejan un conjunto de anormalidades citogenéticas y moleculares específicas. Desde el punto de vista histológico, el LCM es una neoplasia de linfocitos B de aspecto maduro que puede adquirir diferentes patrones histológicos de presentación como un patrón de zona del manto, un patrón nodular o un patrón difuso.
El inmunofenotipo muestra en la mayoría de los casos que las células son positivas para IgM/IgD y CD5 y negativas para CD23, CD10 o BCL6 y que expresan marcadores de linaje B (CD20, CD19, CD22, CD79a y CD79b). Las células son positivas para ciclina D1 (CCND1), siendo esta la característica histológica más distintiva y uno de los aspectos fundamentales para el diagnóstico3. La determinación de los perfiles de expresión génica ha permitido reconocer que un grupo de linfomas cuyo perfil de expresión génica es idéntico al de otros casos de LCM no presentan expresión de CCND1. La expresión del factor de transcripción SOX-11, la cual se ha encontrado que se presenta prácticamente en el 100% de los casos de LCM con CCND1 negativo, permite una adecuada clasificación de los casos cuyas características inmunofenotípicas son aberrantes3–5.
La expresión anormal de CCND1 se presenta como consecuencia de la yuxtaposición de los genes IGH y CCND1 producida por la t(11;14)(q13;q32) por un mecanismo de sustitución del promotor. Esta translocación puede ser detectada hasta en el 65% de los casos por técnicas de citogenética convencional y hasta en el 99% de los casos mediante técnicas de citogenética de interfase como la fluorescencia por hibridización in situ (FISH) utilizando sondas específicas6. La ciclina D1 no se expresa en los linfocitos B normales y regula la transición en el ciclo celular desde la fase G1 a la fase S, mediante la promoción de la fosforilación del retinoblastoma (Rb) en combinación con las quinasas dependientes de ciclina 4 y 6 (CDK4 y CDK6) y su sobreexpresión parece acelerar este proceso de transición. Adicionalmente a la t(11;14), algunos casos de LCM presentan anormalidades genéticas adicionales que alteran mecanismos de control del ciclo celular como son la deleción genómica en el locus CDKN2A ubicado en 9p21, que deriva en la pérdida de los genes INK4a y ARF que tienen acción como supresores de tumores. La cooperación entre la sobreexpresión de CCND1 y la deleción de INK4a aceleran la transición durante el ciclo celular favoreciendo la proliferación7. La alteración de las vías de respuesta al daño del DNA y múltiples vías de señalización intracelular, asociado con la existencia de inestabilidad genómica que permite la acumulación de daño genético, están implicadas en: la progresión de la enfermedad, la resistencia a la apoptosis, la menor respuesta al tratamiento y el pobre pronóstico8.
El reconocimiento de que el LCM es una entidad distinta desde el punto de vista citogenético, histólogico, molecular y clínico, sumado al pobre pronóstico, con una mediana de supervivencia cercana a los 3 años, ha llevado a buscar nuevas estrategias de tratamiento. La demostración de una mejoría en las tasas de respuesta y la supervivencia global y libre de evento con la adición del anticuerpo monoclonal dirigido contra el CD20 rituximab a la quimioterapia en pacientes con Linfoma B difuso de célula grande y linfoma folicular9–12, que son tumores igualmente originados en linfocitos B y con expresión de CD20, derivó en la utilización de esquemas de tratamiento que combinan diferentes tipos de quimioterapia con este agente en pacientes con LCM.
La utilización de esquemas de quimioterapia más intensivos y que incluyen altas dosis de citarabina adicionalmente a un esquema basado en antracíclicos seguido de consolidación de la respuesta obtenida con trasplante autólogo con purga in vivo con rituximab, ha demostrado mejorar la supervivencia global y libre de enfermedad en pacientes con LCM siendo la SLE de 7,4 años y sin haberse alcanzado la mediana de supervivencia con un seguimiento de 10 años13. Otros esquemas que utilizan combinaciones intensivas de quimioterapia, como el régimen Hyper-CVAD combinado con rituximab, han demostrado mejorar la respuesta y la supervivencia global pese a que que también implica una mayor toxicidad hematológica y no hematológica, particularmente en pacientes mayores de 65 años14.
En la gran mayoría de los pacientes en los que el tratamiento con estos esquemas no es factible, la combinación de rituximab con quimioterapia CHOP ha sido el esquema estándar de tratamiento. De forma reciente, Rummel et al. realizaron un ensayo clínico aleatorizado fase III de no inferioridad, comparando el tratamiento con R-Bendamustine contra R-CHOP en 549 pacientes con LNH, de los cuales el 18% tenían linfoma de células del manto, encontrando que el régimen con bendamustine era más efectivo y menos tóxico. Sin embargo, los resultados del subgrupo de pacientes con LCM no han sido presentados de forma independiente15.
Aunque diferentes variables pueden determinar el pronóstico, la descripción de índice pronóstico internacional para linfoma del manto (MIPI por sus siglas en inglés) parece ser la que discrimina de mejor forma los pacientes de acuerdo con su pronóstico. Una validación del puntaje pronóstico que toma como variables la edad, el estado funcional, la deshidrogenasa láctica y el recuento de leucocitos al diagnóstico publicada por Hoster et al., y que utilizó los datos de 958 pacientes incluidos en los ensayos del European Mantle Cell Lymphoma Network, encontró que la supervivencia global a 5 años de los pacientes clasificados como de bajo, intermedio o alto riesgo era de 83%, 63% y 34% respectivamente validando el uso de esta herramienta de determinación del pronóstico tanto en la investigación como en la práctica clínica16.
Las características clínicas y los resultados del tratamiento de los pacientes con LCM en nuestra población no han sido descritos. Tanto la introducción de nuevos esquemas de tratamiento y de medicamentos con nuevos mecanismos de acción, la definición de nuevos marcadores diagnósticos y pronósticos como la introducción de trasplante autólogo, como parte de la estrategia frontal de tratamiento hace interesante el reconocer las características de nuestra población y los resultados del tratamiento. Este estudio descriptivo tiene como objetivo describir las características clínicas y patológicas de los pacientes con LCM atendidos en el Instituto Nacional de Cancerología (INC) y los resultados iniciales del tratamiento en términos de respuesta, supervivencia global y supervivencia libre de evento.
Materiales y métodosEste estudio retrospectivo de tipo serie de casos, incluyó todos los pacientes mayores de 18 años de edad con diagnóstico histopatológico confirmado de LCM atendidos en el INC, entre enero de 2007 y diciembre de 2011. Fueron incluidos únicamente aquellos pacientes quienes tuvieran por lo menos una valoración y hubieran recibido al menos un ciclo de quimioterapia y cuya historia clínica, incluidos los datos de laboratorio estuvieran disponibles para revisión. Fueron excluidos los pacientes con diagnóstico de otra neoplasia hematológica diferente a LCM, ya fuera concomitante o previa y los casos en los cuales los hallazgos histopatológicos no fueron conclusivos.
Para la identificación de los pacientes se realizó una búsqueda inicial de todos los casos con diagnóstico de LCM en el periodo comprendido entre enero de 2007 y diciembre de 2011. Para tal fin se revisaron los registros físicos y digitales de muestras recibidas y analizadas en laboratorio de patología, morfología y citometria de flujo y los registros internos del servicio. Las historias clínicas del sistema de registros electrónicos institucional fueron revisadas y se verificaron los criterios de inclusión. De los casos incluidos, se extrajo la información de las características clínicas; el tipo de tratamiento; la estadificación incluyendo el estudio de la médula ósea; las características patológicas y los datos de respuesta, de acuerdo con los criterios de respuesta del grupo de trabajo internacional de linfoma.
El cálculo del MIPI se realizó utilizando la calculadora virtual disponible en la dirección electrónica del grupo europeo de estudio del linfoma del manto (http://www.european-mcl.net/en/clinical_mipi.php). El compromiso leucémico por el LCM se definió de acuerdo a lo sugerido por el grupo de Barcelona como la presencia simultánea de más de 5.000 linfocitos por mm3 con características morfológicas atípicas17. Todos los datos fueron consignados en un formulario aprobado previamente por el comité institucional de investigaciones. Un grupo de monitoreo independiente nombrado por el centro revisó que la información consignada en los registros correspondiera a la de los documentos fuente. Este estudio contó con la aprobación del comité de ética en investigaciones institucional y fue conducido de acuerdo con los principios de la declaración de Helsinki y las guías de buena práctica clínica.
Análisis estadísticoLa supervivencia libre de evento se definió como el tiempo transcurrido desde el diagnóstico hasta la falla en logra respuesta completa con el esquema de tratamiento inicial, la progresión de la enfermedad, la recaída o la muerte por cualquier causa. La supervivencia global se definió como el tiempo transcurrido desde la fecha del diagnóstico hasta la muerte por cualquier causa. Los pacientes que no presentaron ningún evento al momento del cierre del estudio, fueron censurados al último contacto. Las variables cuantitativas continuas se presentan como medianas con su respectivo rango intercuartil (RIQ, percentil 25 - percentil 75), o como medias con desviación estándar (DE), de acuerdo con la distribución de los datos. La prueba de Shapiro-Wilks fue empleada para la valoración de la distribución normal de los datos. Las variables cualitativas se presentan como frecuencias absolutas y proporciones resumidas en tablas. La supervivencia global y libre de evento fue estimada mediante el método de Kaplan-Meier. Las variables categóricas fueron comparadas mediante la prueba de Chi al cuadrado y la prueba exacta de Fisher. En los casos en los cuales se aplicaron pruebas de hipótesis, las diferencias obtenidas se consideraron estadísticamente significativas si el valor de p era menor a 0,05. Todos los análisis fueron realizados en R versión 2.14.1. y en SPSS versión 17.0.
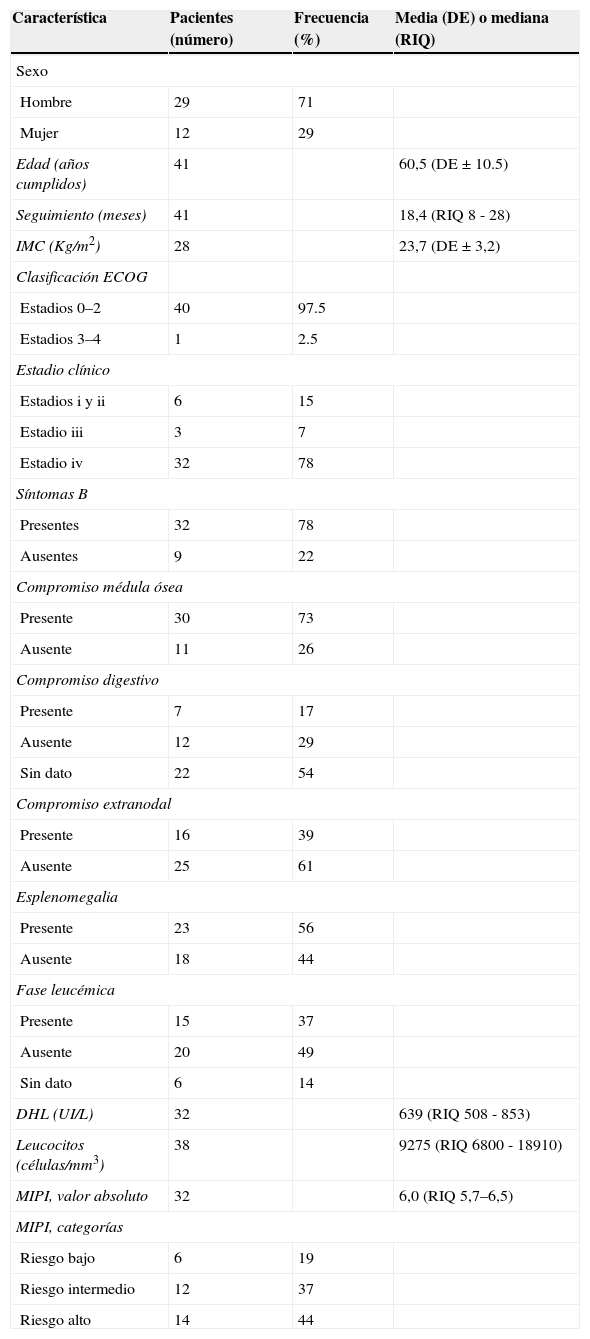
ResultadosLas características de los pacientes se muestran en la tabla 1. Fueron incluidos en total 41 pacientes de los cuales 29 (71%), eran hombres. El promedio de edad al momento del diagnóstico para toda la población fue de 60,5 años (DE±10,5) sin diferencias entre hombres y mujeres. En total, 35 de los 41 pacientes incluidos (87%) se encontraban en estadio III o IV de la clasificación de Ann Arbor y el 73% tenía compromiso de la médula ósea.
Características de los pacientes con linfoma de células del manto
| Característica | Pacientes (número) | Frecuencia (%) | Media (DE) o mediana (RIQ) |
|---|---|---|---|
| Sexo | |||
| Hombre | 29 | 71 | |
| Mujer | 12 | 29 | |
| Edad (años cumplidos) | 41 | 60,5 (DE±10.5) | |
| Seguimiento (meses) | 41 | 18,4 (RIQ 8 - 28) | |
| IMC (Kg/m2) | 28 | 23,7 (DE±3,2) | |
| Clasificación ECOG | |||
| Estadios 0–2 | 40 | 97.5 | |
| Estadios 3–4 | 1 | 2.5 | |
| Estadio clínico | |||
| Estadios i y ii | 6 | 15 | |
| Estadio iii | 3 | 7 | |
| Estadio iv | 32 | 78 | |
| Síntomas B | |||
| Presentes | 32 | 78 | |
| Ausentes | 9 | 22 | |
| Compromiso médula ósea | |||
| Presente | 30 | 73 | |
| Ausente | 11 | 26 | |
| Compromiso digestivo | |||
| Presente | 7 | 17 | |
| Ausente | 12 | 29 | |
| Sin dato | 22 | 54 | |
| Compromiso extranodal | |||
| Presente | 16 | 39 | |
| Ausente | 25 | 61 | |
| Esplenomegalia | |||
| Presente | 23 | 56 | |
| Ausente | 18 | 44 | |
| Fase leucémica | |||
| Presente | 15 | 37 | |
| Ausente | 20 | 49 | |
| Sin dato | 6 | 14 | |
| DHL (UI/L) | 32 | 639 (RIQ 508 - 853) | |
| Leucocitos (células/mm3) | 38 | 9275 (RIQ 6800 - 18910) | |
| MIPI, valor absoluto | 32 | 6,0 (RIQ 5,7–6,5) | |
| MIPI, categorías | |||
| Riesgo bajo | 6 | 19 | |
| Riesgo intermedio | 12 | 37 | |
| Riesgo alto | 14 | 44 | |
Datos corresponden a todos los pacientes incluidos. Las categorías del MIPI se determinaron de acuerdo al valor obtenido en los 32 pacientes que tenían información completa para el cálculo del mismo.
El estado funcional de los pacientes incluidos determinado por la escala del ECOG fue bueno y únicamente 4 pacientes (10%) tuvieron un ECOG mayor a 3 al momento de la presentación. En total 31 (78%) pacientes presentaban síntomas B sin que se encontrara diferencia entre los pacientes que presentaban o no compromiso de la médula ósea (Fisher p= 0,68). De los 19 pacientes a los cuales se realizó valoración endoscópica del tracto digestivo, siete (36,8%) presentaba compromiso por LCM demostrado histológicamente.
Si bien la determinación del pronóstico es compleja en pacientes con LCM, diversas características tanto clínicas como histológicas o de laboratorio al momento de la presentación permitan clasificar los pacientes en diversos grupos de riesgo. Como se describió previamente, dichas características han sido combinadas en el MIPI. Adicional a las variables incluidas en el mismo (edad; estado funcional; deshidrogenasa láctica, y el recuento de leucocitos), otras características como el número de mitosis por campo, el patrón histológico y el compromiso leucémico, han sido consideradas como potenciales determinantes del pronóstico.
De los 41 pacientes incluidos, se tuvo información respecto al compromiso leucémico en 35, estando presente en 15 (42%) de los mismos. Las características clínicas de los pacientes con compromiso leucémico fueron similares a las de la población total. Sin embargo, la mediana de edad de los pacientes con compromiso leucémico y sin este fue de 59 y 67 años respectivamente, siendo esta diferencia estadísticamente significativa (p= 0,040). No se encontraron diferencias estadísticamente significativas en otras variables.
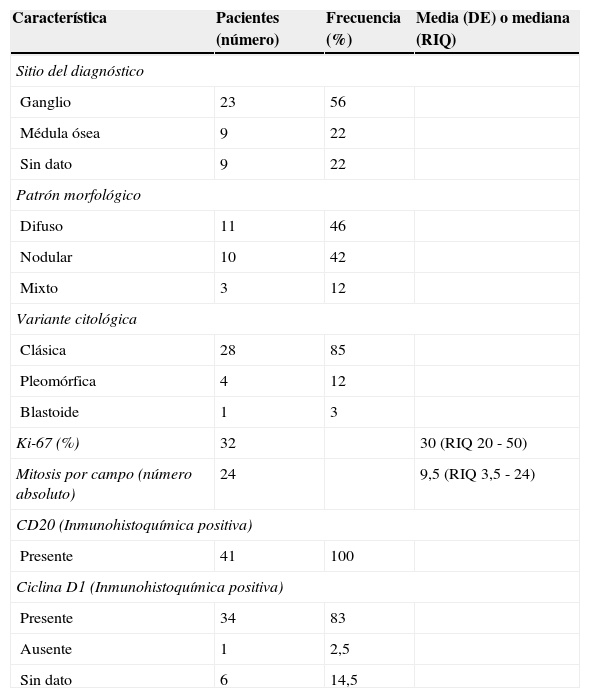
Con respecto a las características histológicas, el diagnóstico de LCM se realizó en tejido ganglionar en el 56% de los casos y en la médula ósea u otro tejido en el 22% de los casos respectivamente. De los 33 pacientes en los cuales la información respecto a la variante histológica estaba disponible, 28 (85%) presentaban una variante clásica y solamente en un paciente (3%) se encontró una variante blastoide. La información respecto al patrón histológico solo estaba disponible en 24 pacientes (58%), siendo el patrón difuso y nodular las formas más frecuentes. Estas y otras características se resumen en la tabla 2.
Características histopatológicas de los pacientes con linfoma de células del manto
| Característica | Pacientes (número) | Frecuencia (%) | Media (DE) o mediana (RIQ) |
|---|---|---|---|
| Sitio del diagnóstico | |||
| Ganglio | 23 | 56 | |
| Médula ósea | 9 | 22 | |
| Sin dato | 9 | 22 | |
| Patrón morfológico | |||
| Difuso | 11 | 46 | |
| Nodular | 10 | 42 | |
| Mixto | 3 | 12 | |
| Variante citológica | |||
| Clásica | 28 | 85 | |
| Pleomórfica | 4 | 12 | |
| Blastoide | 1 | 3 | |
| Ki-67 (%) | 32 | 30 (RIQ 20 - 50) | |
| Mitosis por campo (número absoluto) | 24 | 9,5 (RIQ 3,5 - 24) | |
| CD20 (Inmunohistoquímica positiva) | |||
| Presente | 41 | 100 | |
| Ciclina D1 (Inmunohistoquímica positiva) | |||
| Presente | 34 | 83 | |
| Ausente | 1 | 2,5 | |
| Sin dato | 6 | 14,5 | |
Las características histológicas del paciente con ciclina D1 negativa y los estudios genéticos verificaron el diagnóstico. En nueve pacientes se tuvo confirmación histológica de LCM sin tener reporte específico del órgano comprometido.
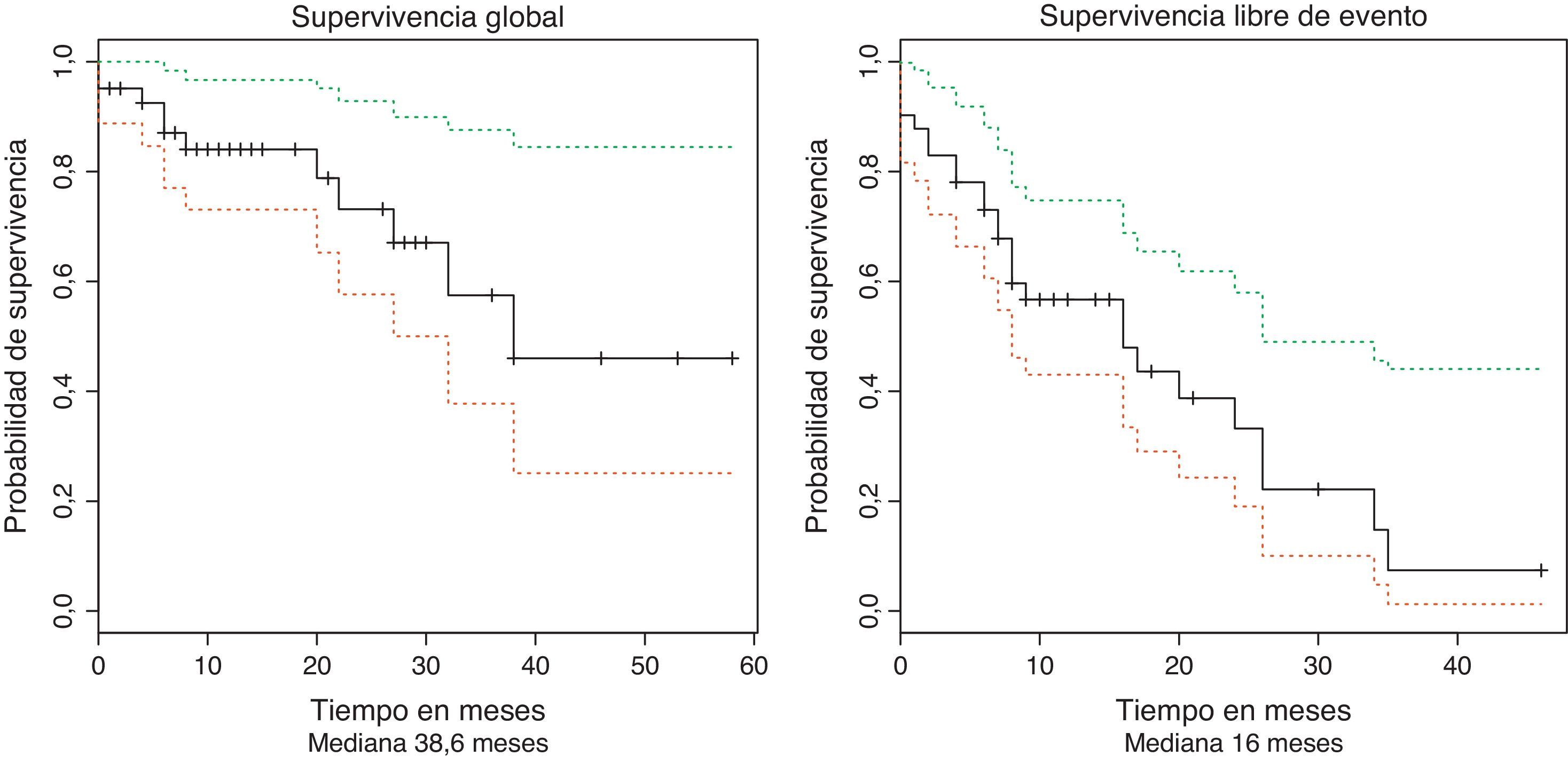
La fracción de células tumorales proliferantes, determinadas por la inmunotinción con el marcador Ki-67 u otras metodologías, ha demostrado tener implicaciones pronósticas tanto en el LCM como en otros tumores. De hecho, algunos investigadores han encontrado que el impacto pronóstico del Ki-67 es independiente de otras variables incluido el MIPI18. En total 32 pacientes tuvieron disponible para el análisis la información respecto al Ki-67 en los cuales la mediana de expresión fue de 30% (10%–90% IQR 30). No se ha definido con total claridad cuál es el punto de corte óptimo a partir del cual el Ki-67 identifica los pacientes con un peor pronóstico. Sin embargo, Determann et al. encontraron que los pacientes con un índice de Ki-67 menor a 10%; de 10% a 30% o mayor a 30% tenían diferencias en términos de supervivencia global19. Para identificar el punto de corte óptimo para nuestra población se utilizó la prueba de los rangos máximamente seleccionados (Maximally Selected Rank Statistics), de acuerdo con los postulados de Lausen y Schumaher20 y mediante el paquete maxstat implementado en R21. El punto de corte óptimo identificado fue de 25%. La mediana de supervivencia de los pacientes con un KI-67 mayor o menor de 25% fue de 32,9 y 38,6 meses respectivamente sin que esta diferencia alcanzara valores estadísticamente significativos (p (log-rank=0,126).
Las opciones de tratamiento para los pacientes con LCM varían dependiendo de características clínicas como la edad, las comorbilidades y la posibilidad de incluir trasplante autólogo como parte de la terapia de primera línea. En general, todos los pacientes recibieron rituximab en combinación con quimioterapia durante el tratamiento inicial, siendo los esquemas más frecuentemente utilizados el esquema R-CHOP 21 (15 pacientes (36,58%)) y R-HyperCVAD (12 pacientes (29,26%)). En total diez pacientes (24,4%) recibieron tratamiento de acuerdo al protocolo MCL-II del grupo nórdico, tres pacientes (7,31%) R-CVP y un paciente (2,8%) recibió el esquema R-ICE. El promedio de edad de los pacientes tratados con el esquema R-HyperCVAD fue de 48 años (DE±9,4) comparado con los pacientes tratados con R-CHOP en los cuales fue de 68 años (DE±8,48), siendo esta diferencia estadísticamente significativa (P=<0,01).
La información del desarrollo de neutropenia febril que requirió tratamiento intrahospitalario estuvo disponible en 38 de los 41 pacientes. En total, 17 pacientes (41,6%) presentaron por lo menos un episodio de neutropenia febril de los cuales 12 correspondieron al grupo total de pacientes tratados con el esquema R-HyperCVAD quienes correspondieron al 70,5% de los casos. De los pacientes incluidos, 15 (36,5%) no terminó el número de ciclos de tratamiento planeado debido a toxicidad del tratamiento o progresión en 4 casos respectivamente y a otras causas en 7 pacientes.
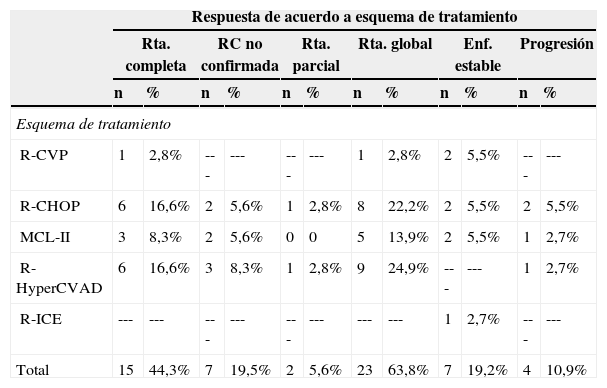
De los 41 pacientes incluidos 36 tuvieron disponible la información respecto a la respuesta al tratamiento. De los mismos, 23 (63,8%) lograron respuesta completa (RC) o respuesta completa no confirmada (RCu); dos (5,5%) respuesta parcial y siete (19,44%) se clasificaron como enfermedad estable. La respuesta de acuerdo al esquema de tratamiento se presenta en la tabla 2. Los 14 pacientes que lograron una respuesta completa con esquemas de quimioterapia diferentes al R-HyperCVAD se consideraban candidatos potenciales para recibir manejo de consolidación. Cuatro fueron sometidos a trasplante autólogo de la médula ósea y dos recibieron radioinmunoterapia. Un paciente adicional logró una respuesta completa no confirmada tras seis ciclos de R-HyperCVAD y fue llevado a trasplante autólogo. Dieciocho pacientes requirieron la administración de una segunda línea de quimioterapia pues recayeron o no lograron una respuesta óptima tras el primer esquema de tratamiento. Los protocolos de quimioterapia de segunda línea más frecuentemente empleados fueron R-DHAP y R-HyperCVAD, en seis y tres casos respectivamente. La información sobre la respuesta lograda es limitada pues solo hay datos de trece individuos, cuatro de los cuales lograron algún grado de respuesta (completa o parcial). (tabla 3)
Respuesta de acuerdo al esquema de tratamiento inicial
| Respuesta de acuerdo a esquema de tratamiento | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Rta. completa | RC no confirmada | Rta. parcial | Rta. global | Enf. estable | Progresión | |||||||
| n | % | n | % | n | % | n | % | n | % | n | % | |
| Esquema de tratamiento | ||||||||||||
| R-CVP | 1 | 2,8% | --- | --- | --- | --- | 1 | 2,8% | 2 | 5,5% | --- | --- |
| R-CHOP | 6 | 16,6% | 2 | 5,6% | 1 | 2,8% | 8 | 22,2% | 2 | 5,5% | 2 | 5,5% |
| MCL-II | 3 | 8,3% | 2 | 5,6% | 0 | 0 | 5 | 13,9% | 2 | 5,5% | 1 | 2,7% |
| R-HyperCVAD | 6 | 16,6% | 3 | 8,3% | 1 | 2,8% | 9 | 24,9% | --- | --- | 1 | 2,7% |
| R-ICE | --- | --- | --- | --- | --- | --- | --- | --- | 1 | 2,7% | --- | --- |
| Total | 15 | 44,3% | 7 | 19,5% | 2 | 5,6% | 23 | 63,8% | 7 | 19,2% | 4 | 10,9% |
La evaluación de la respuesta estuvo disponible en 36 de los 41 pacientes incluidos. La Rta. global fue definida como la suma de Rta. completa y RC no confirmada y no incluye los pacientes con Rta. parcial. Aunque el 82% de los pacientes tratados con R-HyperCVAD logró respuesta completa comparado con el 56% de pacientes tratados con otros esquemas, esta diferencia no fue estadísticamente significativa (P=0,25).
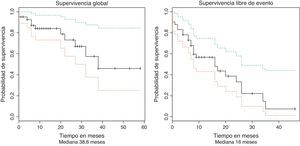
La mediana de seguimiento fue de 18,4 meses (RIQ 8 - 28). Durante el periodo de seguimiento once pacientes murieron y nueve se consideraron pérdidas del seguimiento. La supervivencia global para todo el grupo fue estimada en 38,6 meses (IC 95% 29,7–47,4). La mediana de supervivencia libre de evento fue estimada en 16 meses (IC 95% 8–26,6), como se muestra en la figura 1.
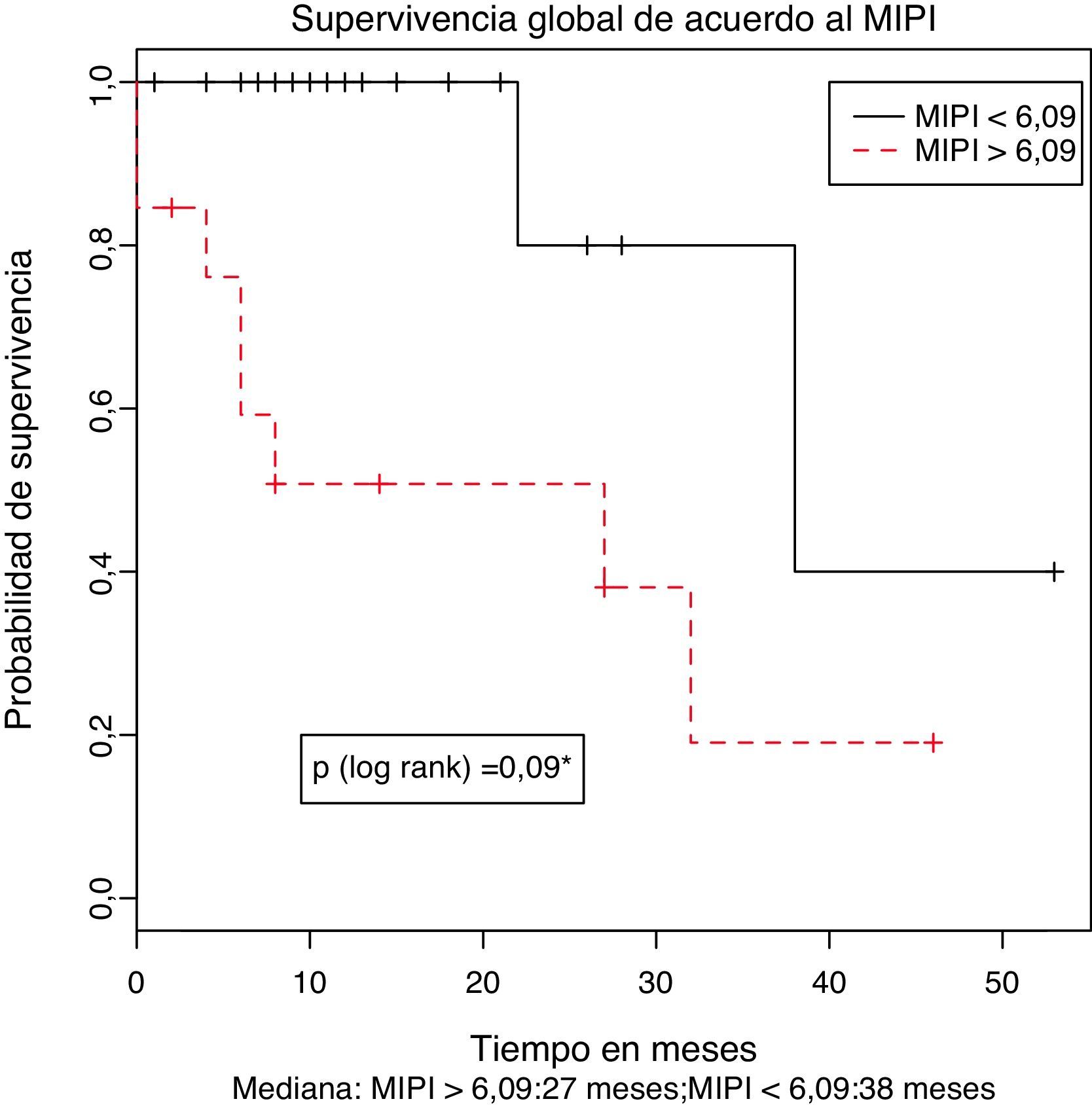
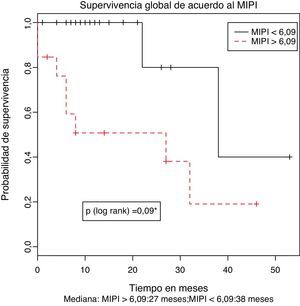
Uno de los principales determinantes del pronóstico en los pacientes con LCM es el MIPI calculado al momento del diagnóstico. Aunque el MIPI simplificado clasifica los pacientes en categorías de riesgo, el valor absoluto del mismo calculado al momento del diagnóstico puede establecerse en la mayoría de los pacientes y tratado como una variable continua identifica un grupo de pacientes con pobre pronóstico que en la cohorte original de desarrollo correspondió a aquello con un puntaje mayor de 6,222. El cálculo del MIPI se realizó como se especificó en los métodos y el punto de corte óptimo para nuestra población fue identificado utilizando la prueba de los rangos máximamente seleccionados y se estableció en 6,09. Este valor es intermedio entre el del grupo de alto riesgo y mayor respecto al del grupo de riesgo intermedio de la cohorte de desarrollo el cual fue de 5,7.
De los 32 pacientes con información sobre el MIPI disponible, 13 (40,6%) tenían un MIPI mayor a 6,09, siendo clasificados como de alto riesgo. De este grupo, solamente un paciente presentaba un MIPI inferior a 6,2. La mediana de supervivencia global de los pacientes con MIPI menor o mayor a 6,09 se estimó en 38,6 y 27,7 meses respectivamente. Esta diferencia fue estadísticamente significativa (p (log-rank)=0,009) como se muestra en la figura 2. En razón del limitado número de pacientes y eventos no se consideró apropiado la realización de análisis multivariados.
DiscusiónEl tratamiento de los pacientes con linfoma de células del manto ha sufrido grandes modificaciones de forma que han derivado en una mejoría del pronóstico, como son: la adición de rituximab al tratamiento y la incorporación de esquemas de tratamiento que incluyen altas dosis de citarabina y trasplante autólogo, como parte de la terapia de primera línea que ha derivado en medianas de supervivencia mayores que las obtenidas con esquemas basados en antraciclinas2,13,14. Pese al limitado número de pacientes, la serie de casos de este estudio es una de las más grandes de pacientes con LCM de un país latinoamericano publicada a la fecha.
Las características demográficas básicas de los pacientes de este estudio como la edad y la distribución de acuerdo al sexo son similares a las reportadas por otros autores, tanto norteamericanos como europeos23,24. Tanto en estudios de tipo descriptivo poblacional23,25,26, como en estudios de intervención27,28 se ha encontrado que la mayoría de pacientes afectados por este linfoma tienen una adecuada funcionalidad. Este hallazgo ha sido igualmente evidenciado en la presente serie donde el 97,5% de los individuos incluidos tenían puntajes de la escala ECOG de 2 o menos. Lo anterior es especialmente relevante, pues la funcionalidad aparentemente se conserva pese a la agresividad clínica de la neoplasia y este es un criterio determinante al momento de definir un posible régimen terapéutico.
Las características clínicas de los pacientes con LCM han sido ampliamente descritas en diversas series23,26,29,30, de acuerdo con las cuales entre 78% y 95% de los pacientes se presentan inicialmente con una enfermedad avanzada, correspondiente a los estadios III y IV de la clasificación de Ann Arbor. En la serie actual 85% de los afectados estarían incluidos en estas categorías. La realización de estudios endoscópicos a un limitado número de pacientes refleja la práctica habitual en el INC, en donde no se considera su realización de forma rutinaria y se reserva para pacientes sintomáticos.
Es muy llamativo que en casi la tercera parte de los individuos evaluados se encontró compromiso por la neoplasia. Cabe resaltar que la relevancia clínica de este hallazgo ha sido cuestionada, pues solo en raras ocasiones el compromiso gastrointestinal conduce por sí mismo a modificaciones en las intervenciones terapéuticas31,32. Las frecuencias de compromiso extranodal y de presentación leucémica encontradas en la presente serie son diferentes a lo reportado por otros autores. Sin embargo, las diferencias en las definiciones entre los diferentes grupos explicarían este comportamiento23,29,30,33.
En 2008 el grupo europeo de estudio del linfoma de células del manto propuso la utilización de un índice pronóstico específico conocido como MIPI, desarrollado para identificar a los pacientes con mayor riesgo de morir a causa de este linfoma. Este índice permite clasificar a los pacientes en tres grupos de riesgo diferentes, a partir de un valor derivado de una ecuación que incluye la edad, la relación entre el valor de DHL del paciente y el valor normal de referencia, la cifra de leucocitos totales y la funcionalidad34.
De 32 de los pacientes de esta serie se disponía de suficiente información para calcular el MIPI, pues desde el momento de la publicación del estudio original se ha incorporado esta herramienta al cuidado de los enfermos. Vale la pena resaltar que la distribución de los pacientes en las diferentes categorías de riesgo es completamente opuesta a la reportada en los más recientes estudios que emplean esquemas de quimioterapia altamente activos contra esta neoplasia, pues tanto en el estudio de Romaguera et al.27,35 como en el de Geisler et al.28,36, más de la mitad de los pacientes incluidos tenían un bajo riesgo de acuerdo al índice MIPI, lo cual contrasta con nuestra población en la que únicamente el 19% de los pacientes pertenecían a este mismo grupo de riesgo. La diferencia puede deberse a la alta selección de los individuos incluidos en los estudios antes mencionados, así como al tipo de centro donde se llevó a cabo el presente estudio, que es un sitio de referencia nacional para enfermedades malignas hematológicas en cual los pacientes frecuentemente son evaluados tras largos periodos de evolución de su enfermedad. El hallazgo de que la supervivencia global de los pacientes con un MIPI mayor de 6,09 es claramente inferior por más de 10 meses que la de los pacientes con un MIPI menor a este valor, explica el comportamiento de la supervivencia global, al considerar que representaban más del 40% de los pacientes incluidos.
El patrón morfológico más frecuentemente encontrado en los pacientes fue el difuso, mientras que la variante citológica predominante fue la clásica. Estos hallazgos son similares a lo reportado en una gran serie europea que incluyó a 304 pacientes con LCM23. Por el bajo número de individuos no fue posible establecer la relevancia pronóstica de las diferentes variantes histológicas. Aunque se cuenta en la institución con técnicas de citogenética molecular tipo FISH (hibridación fluorescente in situ) que permiten detectar la translocación (11;14)(q13:q32), característica del LCM, solo se realizó esta prueba en 13 pacientes. Fue positiva en diez de ellos.
No existe un consenso vigente en el INC que determine la elección del esquema de primera línea a emplear en los pacientes con LCM siendo la selección en la mayoría de los casos decisión del médico tratante. El tratamiento más frecuentemente utilizado fue el esquema R-CHOP, seguido por los esquemas R-HyperCVAD y MaxiCHOP/HD AraC (MCL II). Esta distribución es probablemente un reflejo de la gradual transición que se ha experimentado en el manejo de estos pacientes, pues recientemente los esquemas de alta intensidad han sido considerados como alternativas más atractivas ante los mejores desenlaces obtenidos a largo plazo37,38. La frecuencia de respuestas completas logradas con la primera línea de tratamiento fue cercana al 60%, cifra difícil de comparar con otras series ante la heterogeneidad en los tratamientos. Sin embargo, se debe resaltar que 82% de los individuos que se trataron con el esquema R HyperCVAD lograron una respuesta completa, cifra comparable con el 87% reportado en la serie original27. En forma exploratoria se realizó una comparación entre la frecuencia de logro de una respuesta completa con el esquema R-HyperCVAD y los demás esquemas, aunque no se alcanzó una significancia estadística la tendencia en favor del primer esquema es evidente (81,8% vs. 56%).
Es importante resaltar que la población de pacientes tratada con el esquema R-HyperCVAD tuvo una edad significativamente menor que la de los pacientes tratados con R-CHOP y es posible que esto también tenga influencia en la respuesta y supervivencia, siendo imposible establecerlo con la naturaleza de nuestros datos. Quince pacientes no recibieron la totalidad de ciclos de quimioterapia que hacían parte de la primera línea de tratamiento. Las causas que explican este comportamiento fueron la progresión de la enfermedad y la toxicidad asociada a la quimioterapia.
Poco más de 40% de los pacientes presentó al menos un episodio de neutropenia febril durante el curso de los ciclos de la primera línea de tratamiento. La frecuencia de neutropenia febril encontrada en este estudio es bastante elevada, pues en las series recientes de pacientes con LCM que reciben quimioterapia intensiva se ha reportado esta complicación en no más de 20% de ellos28,39,40. Es especialmente llamativo el desarrollo de al menos un episodio de neutropenia febril en la totalidad de pacientes que recibieron tratamiento con R-HyperCVAD, mientras en la serie original descrita por Romaguera et al. la frecuencia de este evento fue del 15%27. No hay claridad sobre las causas que son responsables de este comportamiento en los pacientes, pero una sensibilidad aumentada de los mismos a los efectos tóxicos del esquema pudiera ser factible. Se debe recordar que tal y como se recomienda en el estudio original3, este esquema no se administró en ningún paciente mayor de 65 años por su toxicidad hematológica intrínseca.
Las estrategias de consolidación de la respuesta inicial fueron evaluadas igualmente. Catorce pacientes eran candidatos a recibir manejo de consolidación, tres de ellos se llevaron a trasplante autólogo de la médula ósea de acuerdo con lo incluido en el protocolo MCL II del grupo nórdico28, mientras un solo paciente se trasplantó tras recibir manejo con el esquema R-CHOP. La radioinmunoterapia con ibritumomab tiuxetan fue utilizada como una estrategia de consolidación en dos pacientes que lograron respuestas completas tras la administración de seis ciclos de quimioterapia R-CHOP, de forma similar a lo propuesto por Smith et al. 41. Los datos del seguimiento de estos pacientes son limitados, motivo por el que no se realizaron análisis adicionales.
La supervivencia libre de evento de los pacientes de esta serie fue de 16 meses, cifra considerablemente menor a los 7,4 años reportados por Geisler et al. en un informe reciente del seguimiento de los pacientes tratados con el protocolo MCL II36. Aunque la diferencia es grande, se debe hacer la salvedad que dentro del protocolo MCL II además de realizar trasplante como parte del manejo estándar de los pacientes se contemplaba la posibilidad de realizar un monitoreo molecular posterior y en caso de detectar positividad se podía administrar rituximab en manera preventiva, intervención que finalmente se llevó a cabo en una quinta parte de los pacientes. Como ya se mencionó, solo cinco de nuestros pacientes se trasplantaron y ninguno de ellos recibió rituximab como manejo preventivo tras el trasplante. Los datos del seguimiento de los pacientes tratados con R-HyperCVAD no son comparables con los de nuestra serie, pues los desenlaces informados son diferentes25.
La supervivencia libre de evento de los pacientes de nuestro estudio es comparable con la reportada por Andersen et al., en la serie danesa de 105 pacientes donde se informó un valor de 15 meses. Este estudio se publicó en 2002 y, aunque se trata de un estudio poblacional en el que no se seleccionaron los pacientes el tratamiento administrado a los enfermos, no es un fiel reflejo de la práctica actual26. La información sobre el tratamiento de segunda línea es bastante limitada, motivo por el cual no pueden extraerse conclusiones relevantes.
Las debilidades de este estudio incluyen: el potencial sesgo del diseño; el reducido número de pacientes incluidos; el seguimiento relativamente corto, y la marcada heterogeneidad de los tratamientos. Sin embargo, tanto la disponibilidad de un sistema electrónico de historias clínicas, un grupo de patología ampliamente experimentado en el diagnóstico como un registro confiable de los eventos, se constituyen en fortalezas que han permitido la realización de análisis exploratorios cuyos resultados en lo posible deben validarse en series prospectivas.
En conclusión las características clínicas y paraclínicas de los pacientes con LCM de la presente serie son comparables con lo reportado en la literatura. El modelo de tratamiento de estos enfermos ha venido experimentando una transición hacia esquemas de quimioterapia de mayor intensidad y esta tendencia ha sido igualmente evidenciada en este estudio. La heterogeneidad en el tratamiento impide establecer comparaciones respecto al logro de respuestas completas tras la quimioterapia de primera línea. Aunque el esquema R-HyperCVAD pareciera ser altamente efectivo en pacientes jóvenes para lograr este tipo de respuesta, la toxicidad asociada es considerable. En cuanto a los estudios futuros, se deberá evaluar con mayor profundidad el manejo de los individuos ancianos con esta neoplasia y la implementación de otras estrategias de consolidación de la respuesta inicial.