Describir las características clínico-patológicas, evolución postoperatoria y desenlaces oncológicos de los pacientes con diagnóstico de tumor retroperitoneal operados en el Instituto Nacional de Cancerología en un periodo de 11 años.
MétodosSe realizó un estudio descriptivo retrospectivo, incluyendo los pacientes operados en el INC entre los años 2000 y 2011.
ResultadosEn total fueron 101 pacientes. La mediana de la edad fue de 52 años con un 56,4% de mujeres. Entre los pacientes operados, 60,4% presentaban enfermedad primaria, el 23,8% enfermedad recurrente y 15,8% (n=16) eran remitidos como irresecables.
El principal método de imagen fue la tomografía abdominal helicoidal con doble contraste (89,1%). El tipo histológico más frecuente fue el liposarcoma bien diferenciado. Se alcanzó resección completa en el 74,3%, con resecciones viscerales en bloque en 68,3% de los pacientes. Se presentaron complicaciones intraoperatorias en 55,4% de los pacientes, siendo la más frecuente el sangrado. La mediana de seguimiento fue de 549 días, con una supervivencia global de 41,1% a 5 años. La recaída local fue de 54,2% y la progresión sistémica de 25%.
ConclusiónLos tumores retroperitoneales son tumores raros que se suelen diagnosticar en estadio avanzado, tienen pobre pronóstico oncológico principalmente por alto porcentaje de recaída local. El manejo óptimo tiene como pilar la cirugía idealmente en centros de referencia. Inicia desde la sospecha diagnóstica e incluye el uso racional de imágenes, el análisis histológico por patólogos con experiencia, la planeación preoperatoria y la decisión de terapias neoadyuvantes o adyuvantes de acuerdo al tipo y estadio tumoral.
To describe the clinical-pathological features, postoperative and oncological outcomes of patients diagnosed with retroperitoneal soft tissue tumors operated at the National Cancer Institute (NCI), over a period of 11 years.
MethodsA retrospective and descriptive study was performed that included patients operated in the NCI between years 2000 and 2011.
ResultsIn total there were 101 patients. The median age was 52 years, with 56.4% of them women. Among the operated patients, 60.4% had primary disease, 23.8% recurrent disease, and 15.8% (n=16) were submitted as unresectable.
The main method of imaging was abdominal helical double-contrast tomography (89.1%). The most common histological type was well differentiated liposarcoma. Complete resection was achieved in 74.3%, with en bloc resections of involved structures in 68.3% of patients. Intraoperative complications occurred in 55.4% of patients, the most frequent being bleeding. Median follow-up was 549 days, with an overall survival of 41.1% at 5 years. Local recurrence was 54.2% and the systemic progression was 25%.
ConclusionRetroperitoneal tumors are rare tumors that are usually diagnosed in advanced stages. They have a poor prognosis, mainly due to a high rate of local relapse. The mainstay of optimal management is surgery, and starts from the suspected diagnosis, encompassing the rational use of images, histological analysis by experienced pathologists, preoperative planning, and the decision of neoadjuvant or adjuvant therapies according to the type and tumor stage.
Los tumores retroperitoneales son neoplasias infrecuentes; sin embargo, dentro del grupo de tumores de tejidos blandos, el retroperitoneo es uno de los sitios de presentación más común1. La mayoría de estos tumores (80%) son malignos y una tercera parte de estos corresponden a sarcomas2. Debido a la diversidad de órganos y tejidos en esta localización3, los tumores de tejidos blandos originados en el retroperitoneo son un grupo heterogéneo de lesiones con múltiples diagnósticos diferenciales4,5, siendo los tipos histológicos más comunes de sarcomas retroperitoneales el liposarcoma y el leiomiosarcoma6. En nuestro país durante el año 2010 en el Instituto Nacional de Cancerología (INC), se diagnosticaron 26 casos nuevos de sarcomas retroperitoneales7.
La cirugía es el pilar del tratamiento y la única terapia curativa, debido especialmente a que los tratamientos sistémicos no suelen ser efectivos y la aplicación de la radiación es limitada en esta zona anatómica8,9. El control local de la enfermedad depende de radicalidad de la cirugía, comprometiendo no solo la recurrencia local sino la supervivencia10,11. Suele ser un reto en el manejo debido a que por su localización alcanzan grandes tamaños, con sintomatología tardía e invasión a estructuras contiguas, lo cual dificulta el logro de márgenes negativos de resección y ocasiona frecuentes resecciones multiviscerales12,13.
El manejo debe ser multimodal en centros de alto volumen, lo cual impacta significativamente en el pronóstico y supervivencia de estos pacientes11,14–16. A pesar de ser un centro de referencia en el país, no contamos con un estudio que nos permita conocer su epidemiología, manejo y evolución. Los estudios conocidos corresponden a experiencias internacionales6.
El objetivo del presente trabajo fue describir las características clínico-patológicas, la evolución postoperatoria y los desenlaces oncológicos de los pacientes con diagnóstico de tumor de tejidos blandos retroperitoneal operados en el servicio de mama y tejidos blandos del Instituto Nacional de Cancerología (INC), en un periodo de 11 años.
MétodosSe realizó un estudio descriptivo retrospectivo, incluyendo los pacientes mayores de 18 años, con diagnóstico confirmado de tumor retroperitoneal operados en el Servicio de Mama y Tejidos Blandos del INC entre el 1 de enero de 2000 y 31 de diciembre de 2011 (se incluyó la primera cirugía realizada al paciente en el INC por tumor retroperitoneal, tanto manejo primario como recaídas). Para la identificación de los casos se llevaron a cabo búsquedas en los archivos de patología, mama y tejidos blandos, y en la base de datos de epidemiología. Los datos fueron consignados en el formulario de recolección de datos previamente aprobado en el protocolo del estudio, para después ser digitados en un formato elaborado en Excel®. Las fases de recolección y digitación se efectuaron siguiendo las normas de buenas prácticas clínicas con la revisión respectiva de la calidad del dato a cargo del grupo de monitoría. El análisis de la información fue realizado en Stata® 11.0 por la unidad de análisis del INC. Se realizó análisis univariado de las variables teniendo en cuenta medidas de frecuencia y tendencia central según su naturaleza. El tiempo de seguimiento se calculó como el tiempo en meses entre la fecha de la cirugía y la fecha del último control o llamada. Las variables de supervivencia calculadas fueron: supervivencia libre de recaída local, como el tiempo en meses desde la cirugía hasta la fecha de recaída local; supervivencia libre de recaída sistémica, como el tiempo en meses desde la cirugía hasta la recaída sistémica; supervivencia global, como el tiempo en meses desde la cirugía hasta la fecha de muerte, fecha del último control o llamada. Con el fin de plantear una hipótesis de trabajo para futuros estudios, se realizó análisis bivariado entre los posibles factores relacionados con la estancia prolongada, las complicaciones perioperatorias y las variables de supervivencia. Para la realización del estudio se tuvo en cuenta el cumplimiento a cabalidad de los principios éticos de la investigación en seres humanos, este proyecto fue presentado y avalado por el Comité de Investigación y Ética del Instituto Nacional de Cancerología. Ninguno de los investigadores tiene conflictos de interés.
ResultadosSe identificaron 220 historias clínicas potenciales, de las cuales 97 no cumplían con los criterios de inclusión. Entre los 123 tumores retroperitoneales, 18 (14,6%) fueron considerados irresecables y 4 (3,3%) fueron operados por fuera del periodo de estudio. Entre los 18 pacientes excluidos por irresecabilidad, encontramos que 5 fueron llevados a cirugía con intención de resección; sin embargo, debido a los hallazgos intraoperatorios, solo se realizó biopsia o procedimiento derivativo (ileostomia o colostomia). En los otros 13 pacientes los hallazgos imaginológicos indicaron inoperabilidad debido a tamaño (n=11) y compromiso peritoneal extenso (sarcomatosis, n=2). Por estas razones el grupo de estudio correspondió a 101 pacientes con diagnóstico de tumor retroperitoneal intervenidos desde el 1 de enero del 2000 hasta el 31 de diciembre del 2011 (fig. 1).
La mediana de la edad fue de 52 años con un 56,4% de mujeres. Entre los pacientes operados, el 60,4% (n=61) fueron evaluados por enfermedad primaria, el 23,8% (n=24) por enfermedad recurrente posterior a una intervención fuera del INC y 15,8% (n=16) remitidos como enfermedad irresecable. Las características de la población se muestran en la tabla 1.
Características demográficas y clínicas de los pacientes operados por tumor retroperitoneal en el periodo 2000-2011 en el INC
| Edad, años. Mediana (min-max) | 52 | (21-85) |
| n | % | |
|---|---|---|
| Sexo (Hombres) | 44 | (43,6) |
| Comorbilidades | 40 | (39,6) |
| Presentación | ||
| Primarios | 61 | (60,4) |
| Recurrentes | 24 | (23,8) |
| Remitidos por irresecabilidad | 16 | (15,8) |
| Subtipo histológico | ||
| Sarcomas | 80 | (79,2) |
| Otras lesiones malignas | 9 | (8,9) |
| Neuroblastoma suprarrenal | 1 | |
| Timomametastásico | 1 | |
| Tumores epiteliales | 3 | |
| Linfoma | 1 | |
| Tumor de células germinales | 1 | |
| Paraganglioma | 1 | |
| Tumores vasculares | 1 | |
| Lesiones benignas | 7 | (6,9) |
| Fibromatosis | 2 | |
| Tumor benigno de la vaina neural | 1 | |
| Cordoma | 2 | |
| Otros | 2 | |
| GIST | 5 | (4,9) |
| Tamaño. Mediana (rango IQ) | ||
| Imaginológico | 13 | 5–30 |
| Espécimen quirúrgico | 22 | 8–55 |
La confirmación histológica se realizó principalmente en el INC (67,3%). Entre los pacientes con enfermedad primaria (n=61), la mitad (54,1%, n=33) tenían biopsia previa realizada por fuera del INC. En todos los pacientes remitidos con biopsia se realizó revisión de bloques de parafina o nueva biopsia. En la mitad de los casos remitidos con biopsia extrainstitucional, este resultado no coincidió con la patología realizada en el INC, los motivos de discordancia fueron diagnósticos inespecíficos por falta de inmunohistoquímica y diferencias tanto en la clasificación histológica como el subtipo tumoral. Al momento de la cirugía 2 pacientes no tenían biopsia prequirúrgica.
El principal método de imagen para el diagnóstico de tumor retroperitoneal fue la tomografía helicoidal de abdomen con doble medio de contraste, esta se realizó en 90 pacientes (89,1%). La resonancia se utilizó como método de diagnóstico inicial en 7 (6,9%) pacientes, pero solo en 2 se consideró como única imagen para el diagnóstico, los otros 5 requirieron tomografía o ecografía complementaria. Otras imágenes realizadas fueron: endoscopia digestiva superior (6,9%), colonoscopia (8,9%), gamagrafía renal (9,9%), doppler de vasos abdominales (1,9%) y urografía excretora en 1 paciente (1%).
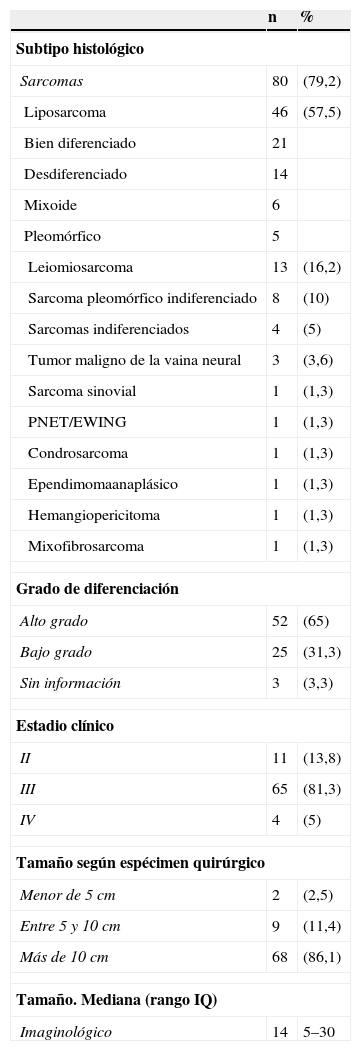
Se realizó análisis de las características clínicas y demográficas de los pacientes con diagnóstico de sarcoma retroperitoneal (n=80). Debido a que se trata del grupo más representativo de la población total del estudio, la distribución por edad, sexo y frecuencia de comorbilidades, así como las características del tumor en cuanto a tamaño y forma de presentación, fueron similares a la de la población completa de todos los tumores retroperitoneales (no se muestran en la tabla). El tipo histológico más frecuente fue el liposarcoma (LPS), bien diferenciado. A pesar de ser esta la histología más frecuente, en todo el grupo de estudio fueron más frecuentes los tumores de alto grado representando un 65%. Las otras características tumorales se describen en la tabla 2.
Características tumorales de los pacientes operados por sarcoma retroperitoneal durante el periodo 2000-2011 en el INC
| n | % | |
|---|---|---|
| Subtipo histológico | ||
| Sarcomas | 80 | (79,2) |
| Liposarcoma | 46 | (57,5) |
| Bien diferenciado | 21 | |
| Desdiferenciado | 14 | |
| Mixoide | 6 | |
| Pleomórfico | 5 | |
| Leiomiosarcoma | 13 | (16,2) |
| Sarcoma pleomórfico indiferenciado | 8 | (10) |
| Sarcomas indiferenciados | 4 | (5) |
| Tumor maligno de la vaina neural | 3 | (3,6) |
| Sarcoma sinovial | 1 | (1,3) |
| PNET/EWING | 1 | (1,3) |
| Condrosarcoma | 1 | (1,3) |
| Ependimomaanaplásico | 1 | (1,3) |
| Hemangiopericitoma | 1 | (1,3) |
| Mixofibrosarcoma | 1 | (1,3) |
| Grado de diferenciación | ||
| Alto grado | 52 | (65) |
| Bajo grado | 25 | (31,3) |
| Sin información | 3 | (3,3) |
| Estadio clínico | ||
| II | 11 | (13,8) |
| III | 65 | (81,3) |
| IV | 4 | (5) |
| Tamaño según espécimen quirúrgico | ||
| Menor de 5 cm | 2 | (2,5) |
| Entre 5 y 10 cm | 9 | (11,4) |
| Más de 10 cm | 68 | (86,1) |
| Tamaño. Mediana (rango IQ) | ||
| Imaginológico | 14 | 5–30 |
En 12 pacientes (11,9%) se indicó tratamiento con intención neoadyuvante, correspondiente a quimioterapia en 6 pacientes (5,9%), radioterapia en 4 pacientes (4%) y quimio-radioterapia en 2 pacientes (1,9%). El grupo restante (88%) fue tratado inicialmente con cirugía. La mediana de tiempo para tratamiento quirúrgico fue de 59 días (rango IQ 7-281 días). Un paciente con tiempo a cirugía de 487 días corresponde a un caso de recaída operada fuera del INC, con manejo inicial no quirúrgico debido al tamaño de la recaída.
La cirugía se realizó a través de laparotomía mediana en el 82,2% (n=83) de los casos, otros abordajes fueron incisión abdomino-subcostal (6,9%, n=7), lumbotomía (1%, n=1), paramediana (3%, n=3), Chevron (1,9%, n=2), abordaje toracoabdominal (1,9%, n=2) y combinaciones de abordaje anterior-posterior (1,9%, n=2) y anterior-perineal (0,9%, n=1). El 74,3% de las resecciones fueron consideradas como completas por el cirujano. Entre los 16 pacientes remitidos por irresecabilidad, a 11 pacientes (68,7%) se les realizó resección completa en la intervención en el INC. Se realizó resección de algún órgano en bloque con el tumor retroperitoneal en 69 pacientes (68,3%). Siendo el más frecuente el colon (35,6%) en cualquiera de sus segmentos (tabla 3). A pesar del porcentaje de resecciones colónicas la frecuencia de ileostomía o colostomía fue de 16,8%.
Descripción de los procedimientos quirúrgicos de los pacientes operados por tumor retroperitoneal durante el periodo 2000-2011 en el INC
| Tiempo quirúrgico, minutos. Mediana (rango IQ) | 180 | 70-360 |
| Sangrado (ml). Mediana (rango IQ) | 1300 | 100-8000 |
| n | % | |
|---|---|---|
| Transfusión de hemoderivados | 71 | (70,3) |
| Estado de la resección según el cirujano | ||
| Completa | 75 | (74,3) |
| Incompleta unifocal | 7 | (6,9) |
| Incompleta multifocal | 19 | (18,8) |
| Intervención de otras especialidades en la cirugía | ||
| Ninguna | 58 | (57,4) |
| Gastroenterología | 22 | (21,8) |
| Urología | 14 | (13,9) |
| Ginecología | 5 | (4,9) |
| Vascular | 4 | (3,9) |
| Neurocirugía | 2 | (1,9) |
| Tórax | 2 | (1,9) |
| Resección de órganos durante la cirugía | ||
| Ninguno | 32 | (31,7) |
| Univisceral | 24 | (23,8) |
| Multivisceral | 45 | (44,5) |
| Órgano resecado | ||
| Riñón | 26 | (25,7) |
| Colon izquierdo | 19 | (18,8) |
| Intestino delgado | 11 | (10,9) |
| Colon derecho | 10 | (9,9) |
| Bazo | 8 | (7,9) |
| Útero y/o anexos | 8 | (7,9) |
| Colon transverso | 7 | (6,9) |
| Pared abdominal o reja costal | 7 | (5,9) |
| Otros(epiplón, vejiga, pulmón, testículo, estómago, testículo, suprarrenal, cuerpos vertebrales) | 20 | (20,8) |
| Pacientes con algún procedimiento vascular realizado | 15 | (14,9) |
| Rafias | ||
| Cava | 6 | (5,9) |
| Mesentéricas | 2 | (1,9) |
| Vasos iliofemorales | 3 | (2,9) |
| Resección e injerto | ||
| Cava | 2 | (1,9) |
| Vasos iliofemorales | 1 | (0,9) |
| Aorta | 2 | (1,9) |
| Ligaduras | ||
| Cava | 2 | (1,9) |
| Renales | 1 | (0,9) |
| Aorta | 1 | (0,9) |
| Empaquetamiento | 36 | (35,6) |
| Cierre de abdomen por segunda intención | 3 | (3) |
En 15 pacientes fue necesario algún procedimiento vascular durante la resección del tumor retroperitoneal. La principal estructura involucrada fue la vena cava en la cual se realizó rafia en 6 pacientes (5,9%), resección e injerto en 2 pacientes (1,9%) y ligadura en 2 pacientes (1,9%) (tabla 3).
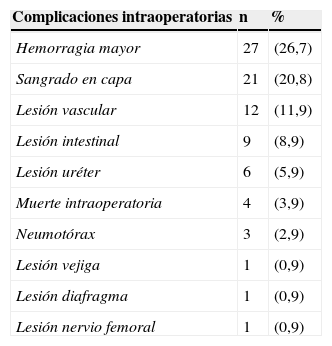
Se presentaron complicaciones intraoperatorias en 56 pacientes (55,4%), las más frecuentes están relacionadas con hemorragia mayor por lesión vascular o sangrado tumoral (26,7%) y sangrado en capa del retroperitoneo posterior a la disección (20,7%). Las otras complicaciones se muestran en la tabla 4.
Complicaciones de los pacientes operados por tumor retroperitoneal durante el periodo 2000-2011 en el INC
| Complicaciones intraoperatorias | n | % |
|---|---|---|
| Hemorragia mayor | 27 | (26,7) |
| Sangrado en capa | 21 | (20,8) |
| Lesión vascular | 12 | (11,9) |
| Lesión intestinal | 9 | (8,9) |
| Lesión uréter | 6 | (5,9) |
| Muerte intraoperatoria | 4 | (3,9) |
| Neumotórax | 3 | (2,9) |
| Lesión vejiga | 1 | (0,9) |
| Lesión diafragma | 1 | (0,9) |
| Lesión nervio femoral | 1 | (0,9) |
| Complicaciones postoperatorias quirúrgicas | ||
|---|---|---|
| Reintervención no planeada | 14 | (13,9) |
| Infecciones | 12 | (11,9) |
| Profunda | 5 | (3,9) |
| Órgano o espacio | 7 | (6,9) |
| Fístula entérica | 6 | (5,9) |
| Íleo | 3 | (3,9) |
| Evisceración | 3 | (2,9) |
| Dehiscencia de fascia contenida | 1 | (0,9) |
| Hemoperitoneo por dehiscencia de vagina | 1 | (0,9) |
| Mortalidad postquirúrgica | ||
|---|---|---|
| Primeras 24 h | 2 | (1.9) |
| Postoperatorio temprano (2 a 30 días) | ||
| Choque hipovolémico | 3 | (2,9) |
| Trombosis mesentérica | 1 | (0,9) |
| Postoperatorio tardío(más de 30 días) | ||
| Sepsis abdominal, fístula | 1 | (0,9) |
| Complicaciones postoperatorias médicas | ||
|---|---|---|
| Trastorno hidroelectrolítico | 12 | (11,8) |
| Neumonía | 9 | (8,9) |
| Trombosis venosa profunda | 2 | (1,9) |
| Infección urinaria | 2 | (1,9) |
| Tromboembolismo pulmonar | 1 | (0,9) |
| Accidente cerebrovascular | 1 | (0,9) |
| Problemas sociales | 1 | (0,9) |
| Insuficiencia renal | 1 | (0,9) |
| Pancreatitis | 1 | (0,9) |
La estancia hospitalaria mediana fue de 6 días (rango IQ 1–42 días), con una mediana de estancia en UCI de 5 días (rango IQ 0–14 días). Se presentó muerte intraoperatoria en 4 pacientes y en el postoperatorio inmediato en 2 pacientes. En todos estos casos, la causa de muerte fue el choque hipovolémico asociado a sangrado mayor durante el procedimiento (tabla 4). Las complicaciones postquirúrgicas más frecuentes fueron la infección (10,9%), fístula entérica (5,94%) y evisceración (2,97%). Las dos primeras complicaciones fueron la causa de muerte en el postoperatorio tardío en 1 de los pacientes. La complicación médica más frecuente fue el trastorno hidroelectrolítico (11,8%) seguido de neumonía (8,9%).
Entre el grupo de pacientes con sarcomas retroperitoneales se realizó algún tipo de tratamiento adyuvante en 41,7% (30 pacientes): el 23,6% (n=17) recibió radioterapia externa postoperatoria, 1 paciente (1,39%) radioterapia intraoperatoria y 16,7% quimioterapia (n=18). El principal esquema de quimioterapia utilizado fue la combinación de ifosfamida y doxorrubicina. La dosis de radioterapia administrada estuvo entre 20Gy y 66Gy.
El análisis de supervivencia se realizó solamente en los pacientes con diagnóstico de sarcoma, incluyendo los pacientes vivos al egreso (n=72). La mediana del tiempo de seguimiento fue de 549 días (rango IQ 15 - 3148 días), con una proporción de pérdidas de 27,8% (n=20).
Al final del seguimiento (incluyendo la información obtenida de las llamadas), el 29,2% de los pacientes (n=21) se encontraban vivos sin enfermedad, el 29,2% (n=21) vivos con enfermedad y 41,7% (n=30) muertos. La mortalidad fue debida a tumor retroperitoneal en 27 pacientes y a otra causa no relacionada con el tumor en 3 pacientes. La supervivencia global fue de 77,8%, 53,3% y 41,1% a 1, 3 y 5 años respectivamente (fig. 2).
El 54,2% de los pacientes presentaron recaída local, con una mediana de tiempo a la recaída de 241 días (rango IQ 48–1067 días). No se encontró la fecha de recaída en 2 de los pacientes. La supervivencia libre de recaída local fue de 40,5%, 10,1%, 5,8% a 1, 3 y 5 años respectivamente (fig. 2). En los pacientes con resección quirúrgica completa la mediana de tiempo a la recaída local fue de 452,2 días. En los pacientes con resección incompleta el tiempo a la progresión local (aumento en el número de las lesiones) fue de 205,6 días. Según el tipo histológico, los pacientes con liposarcoma de cualquier tipo presentaron un promedio de tiempo a la recaída de 497 días (DE 492,5), mientras que los sarcomas pleomórficos indiferenciados y leiomiosarcomas presentaron tiempos a la recaída de 124 días (DE 382,2) y 376 días (DE 37,9) respectivamente.
La frecuencia de progresión sistémica fue de 25% (18 pacientes). Los principales sitios de progresión fueron tejidos blandos (9,7%, n=7), hígado (6,9%, n=5) y pulmón (2,8%, n=2). En 3 pacientes (4,2%) se documentó progresión como sarcomatosis y en 1 metástasis óseas (1,4%). La mediana de tiempo a la progresión a distancia fue de 314 días (rango IQ 90 - 1166 días). Sin embargo, en 4 pacientes no se obtuvo información del sitio ni la fecha de progresión sistémica. La supervivencia libre de recaída sistémica fue de 81,5%, 70,8% y 66,6% a 1, 3 y 5 años respectivamente (fig. 2). En los pacientes a los cuales se les realizó resección completa del tumor, la progresión sistémica fue del 19%, en los pacientes con resección incompleta fue del 25%.
DiscusiónEn este artículo reportamos la experiencia en el manejo quirúrgico de los pacientes con diagnóstico de tumores retroperitoneales que fueron atendidos en el Instituto Nacional de Cancerología (INC) en un periodo de 11 años, constituyendo así la serie más representativa a nivel nacional y una de las más grandes publicadas de Latinoamérica17–19. El INC es una institución de referencia nacional en donde se realiza el tratamiento integral oncológico de múltiples neoplasias, específicamente el Servicio de Mama y Tejidos blandos concentra los pacientes con esta patología y posee amplia experiencia en su manejo. Esto se constituye en una fortaleza del estudio, si tenemos en cuenta el hecho de que el pronóstico de los pacientes con sarcomas retroperitoneales es mejor en centros de alto volumen11,14–16,20.
Los tumores retroperitoneales son tumores raros aún en un centro de referencia de cáncer como el nuestro. Según la literatura, la mayoría son malignos y un tercio de ellos corresponden a sarcomas6 principalmente de alto grado21. El liposarcoma es el subtipo más frecuente, representando entre el 20,8% al 41%22,23. En nuestra serie, los sarcomas representaron el 80% del total de tumores retroperitoneales, lo cual, sin embargo, se debe interpretar teniendo en cuenta que somos un centro de referencia, y que la serie corresponde a los tumores operados, por lo que se excluyen otras histologías que no son de manejo quirúrgico. Similar a lo descrito en la literatura, nuestros pacientes presentaron con mayor frecuencia tumores de alto grado y el liposarcoma fue el subtipo más común.
Los síntomas difusos de esta enfermedad y probables fallas en el sistema de salud, nos enfrentan al diagnóstico en estadios avanzados. Uno de los criterios fundamentales que definen el estadio es el tamaño tumoral24,25. En esta serie encontramos tumores con mayor tamaño en comparación a las series publicadas de países desarrollados. Lewis6 y Pirayesh21 describen un 60% de los tumores como mayores de 10cm, mientras que en nuestra serie esta proporción fue del 86%. Sin embargo, poblaciones latinoamericanas reportan tamaños similares en sus pacientes. Medina et al.18, en el hospital general de México, encontró que el 79,7% de los pacientes tenían más de 20cm. Este tamaño tumoral incide en los desenlaces operatorios y oncológicos de los pacientes, pues a la fecha está claramente aceptada la relación entre el pronóstico y el tamaño tumoral mayor a 10cm22.
Adicionalmente, encontramos que el tamaño por imágenes fue menor que el tamaño al momento de la cirugía, lo cual atribuimos tanto a retrasos entre el diagnóstico y la cirugía como a baja especificidad de las imágenes para la estimación del tamaño. Es discutido en algunos centros si la imagen ideal debe ser la resonancia nuclear magnética o la tomografía8; sin embargo, la tomografía helicoidal con doble contraste ofrece un rendimiento adecuado para la valoración prequirúrgica26 y en este caso fue el método de imagen más utilizado, similar a otras series como la de Figueroa y Castillo17,19.
Un aspecto fundamental para el manejo de estos tumores es la confirmación histológica. En este caso, la patología extrainstitucional y la institucional no coincidieron en el 50% de los casos. Para nosotros, este porcentaje de discordancia afirma la necesidad de realizar el estudio en centro de alta experiencia y el papel fundamental del patólogo oncólogo con experiencia en el diagnóstico histopatológico de este tipo de tumores. Debido a que todos nuestros pacientes son quirúrgicos, no es posible analizar en este grupo si el cambio en el resultado histológico influyó en la orientación de la terapéutica, es necesario realizar un estudio de todos los pacientes antes de la decisión quirúrgica con el fin de evaluar la proporción de cambio en la terapia con la revisión de la patología.
No existe alternativa de similar eficacia a la cirugía en la terapia de estos pacientes. Desde los primeros reportes publicados, su manejo ha sido esencialmente quirúrgico27,28. Se han descrito un amplio número de abordajes diferentes a la laparotomía mediana, entre ellos abordajes derivados de la cirugía de trasplantes29, abordajes retroperitoneales17 y la técnica abdomino-subcostal continua diseñada por Perry et al.30. La variedad de incisiones posibles a realizar demuestra la gran complejidad técnica de estas intervenciones y afirma la necesidad de un entrenamiento específico del cirujano que se enfrenta al manejo de estos tumores.
A pesar del tamaño tumoral descrito como superior en esta serie de pacientes, la frecuencia de resección quirúrgica completa fue del 74,3%. Aunque hay porcentajes superiores de resección quirúrgica completa (Karakousis et al.,96%20, en la revisión realizada sobre series de casos por Storm et al.23 se encontró un porcentaje de resección quirúrgica promedio de 53% con reportes entre 13% y 63%. En otros estudios publicados a la fecha la tasa de resección oscila entre el 48,1% y el 80%14,17,22,31–34.
Debido al comportamiento de este tipo de cáncer, es frecuente enfrentarse al manejo quirúrgico tanto de la enfermedad primaria como de las recaídas. En esta serie, el 60,4% tenían enfermedad primaria y el 23,8% se presentaron con recurrencia de la enfermedad. Esta presentación es comparable a la serie de Lewis, la cual reporta un porcentaje de pacientes operados con enfermedad primaria del 56% y con recurrencia local del 24%6. Aunque la presentación como recaída es importante, por cuanto puede aumentar la frecuencia de complicaciones10,22 nosotros no encontramos como significativa esta relación. Adicionalmente, es importante mencionar que se presentaron 16 pacientes remitidos como inoperables, a quien solo se había realizado biopsia o exploración en otras instituciones fuera del INC. Luego de ser revalorados por el Servicio de Mama y Tejidos Blandos, en 11 (68,7%) de ellos se logró la resección quirúrgica completa. Otros autores también han encontrado que posterior a la reevaluación de los pacientes en centros de referencia, es posible realizar resecciones completas en pacientes previamente considerados irresecables19. En un análisis exploratorio se evaluó la mortalidad en este grupo en comparación con los pacientes operados por enfermedad primaria, no encontrando aumento en la mortalidad por el procedimiento quirúrgico. Por estas razones, consideramos fundamental priorizar la remisión de estos pacientes a centros especializados con el fin de intentar el manejo quirúrgico como opción terapéutica.
Además del tamaño tumoral y la presentación como recaída, las características anatómicas del espacio retroperitoneal hacen frecuente enfrentarse a la necesidad de resección en bloque del tumor con órganos adyacentes. El porcentaje de resecciones multiviscerales y univiscerales en nuestra serie fue del 68,32%, estando en el intervalo de lo reportado por la literatura que oscila entre el 27% y 92%6,8,15,17,34. En esta serie el órgano más comúnmente resecado fue el colon (35,6%) y el riñón (26%). En analogía con lo encontrado por nosotros, en la serie de Lochan et al.22 en el 57,5% de los pacientes se realizaron resecciones intestinales y en el 33% nefrectomía. En la serie de Pirayesh et al.21, el órgano más frecuentemente resecado fue el colon en 9% y el riñón en 4,5%. Además de demostrar la gran complejidad quirúrgica de estos tumores, es necesario tener en cuenta estos valores en la planeación preoperatoria, por cuanto es necesario evaluar la función renal del paciente y considerar según criterio del cirujano la preparación preoperatoria del paciente para resecciones de colon y/o ostomías.
El porcentaje de intervenciones vasculares (15%) fue superior a lo reportado en la mayoría de estudios. Lochan et al.22 informa procedimientos vasculares en el 8,4% de los pacientes (3,7% en la vena cava inferior, 3,7% resecciones de la arteria ilíaca y 1% sobre la aorta). En la serie de Figueroa, el 21% de los pacientes tenían compromiso de los vasos abdominales17.
La morbilidad de nuestro estudio difiere a la encontrada en otros artículos. Nosotros encontramos como principal morbilidad postoperatoria quirúrgica la infección (11,8%), fístula entérica (5,9%) y evisceración (2,9%). En la serie de Karakousis et al.20 se presentaron complicaciones en el 48%, siendo la más común la infección del sitio operatorio (10%), íleo prolongado (7%) y la dehiscencia de la herida quirúrgica en (6%). En la publicación de Pirayesh et al.21 encontraron la bronconeumonía (9%), la lesión del nervio femoral (4,5%) y la infección del sitio operatorio (4,5%). En el estudio de Lochan et al.22 la morbilidad específica se elevó al 16%, incluyendo sepsis 8,4% de los pacientes y la isquemia intestinal en 1,8%. La serie de Medina et al. presentó como principal complicación las infecciones del sitio operatorio y en menor frecuencia el sangrado del lecho18.
La mortalidad intraoperatoria (3,9%) y postoperatoria temprana (5,9%) fue alta en nuestra serie, en todos los casos asociada a choque hipovolémico, lo que difiere de lo reportado en otras series. La mortalidad temprana en la serie de Pirayesh et al.21 fue del 9%, debido a enfermedad cerebrovascular e insuficiencia respiratoria. Lewis et al.6 reportan una mortalidad postoperatoria del 4% asociada a sangrado, sepsis, infarto agudo de miocardio y falla orgánica multisistémica. La mortalidad reportada en nuestra serie se correlaciona con que la principal complicación intraoperatoria fue el sangrado. Consideramos que esto se debe probablemente al mayor tamaño tumoral. El sangrado operatorio se relaciona con el íntimo contacto entre los grandes vasos y el tumor, y la alta posibilidad de lesión durante la disección. Adicionalmente la gran neovascularización tumoral aumenta la dificultad técnica para el control del sangrado durante la intervención. Ambas condiciones mencionadas, generan sangrado masivo que lleva al paciente a la triada de acidosis, hipotermia y coagulopatía, que desencadena la alta morbimortalidad32.
Aunque en general, la literatura muestra tasas bajas de neoadyuvancia y adyuvancia, en este estudio fue inferior respecto a otras series. En nuestra serie solo el 11,9% recibió algún tipo de terapia neoadyuvante y el 41,7% algún tipo de adyuvancia. Por una parte se ha demostrado un pobre beneficio con la terapia sistémica, la toxicidad limitante de la radioterapia en estos tumores y la ausencia de guías de uso de radioterapia en estos tumores, que en la institución limitan su aplicación en nuestros pacientes6,24. En la serie de Singer et al.35, el 19% de los pacientes recibieron algún tipo de neoadyuvancia y el 51% algún tipo de adyuvancia. En la serie de Toulmonde et al.34, el 29% de los pacientes recibieron radioterapia y el 17% quimioterapia, en algún momento del tratamiento, principalmente con intención adyuvante.
El seguimiento de nuestros pacientes con diagnóstico de sarcoma fue corto (mediana de 17,2 meses) en comparación con otros estudios, lo cual limita el análisis de los desenlaces oncológicos. En la serie Toulmonde et al.34 el seguimiento fue de 78 meses, en la serie de Lewis et al.6 40 meses y en la de Pirayesh et al.21 34 meses. Consideramos que esto es debido al sistema de salud que obliga a los pacientes a regresar a su sitio de origen y no permite la continuidad del tratamiento en la institución.
Los sarcomas retroperitoneales son una patología de pobre supervivencia y alta tasa de recaída. Los rangos de supervivencia global a 5 años oscilan entre 22% y 66%6,21,33,34, lo cual concuerda con nuestra serie con una supervivencia global de 53,3% y 41,1% a 3 y 5 años respectivamente.
La frecuencia de progresión sistémica fue de 25%. Los principales sitios de progresión fueron tejidos blandos (38,8%), hígado (27,7%) y pulmón (11%). En la serie de Lewis et al.6 la progresión sistémica fue del 26%: el 38% fue pulmón, 44% hígado y ambos 18%. En la serie de Toulmonde et al.34 la progresión sistémica fue del 22%: el 57% pulmón, el 33% hígado, y 35% otras ubicaciones. En la serie de Figueroa et al.17 la recaída sistémica fue del 29% principalmente en hígado y pulmón. Fue llamativa la alta frecuencia de metástasis extrapulmonares en nuestro grupo. Extrapolando datos de sarcomas de extremidades, esta tendencia se suele observar principalmente en los liposarcomas mixoides, en los cuales se da un mayor número de metástasis a tejidos blandos. Sin embargo, en esta serie el liposarcoma mixoide solo representa el 6% de los sarcomas36–38.
En un análisis exploratorio, medimos los diferentes desenlaces (mortalidad, recaída local y sistémica) en subgrupos según el grado y el tipo de resección. Como era de esperar, los pacientes que presentaban sarcomas de alto grado y resecciones incompletas presentaron los peores desenlaces. Esto afirma lo conocido en la literatura, que el grado histológico y el margen quirúrgico son factores pronóstico independientes para la supervivencia en estos pacientes6,20–22,35,39. Esto sumado a nuestra alta tasa de éxito en la resección aun para los pacientes considerados previamente irresecables, justifica la remisión de los pacientes a centros de referencia en esta patología. Dado que existe una mayor posibilidad de alcanzar resecciones (R0) que redunda en la mejoría de los desenlaces oncológicos6,21.
En conclusión, los tumores retroperitoneales son tumores raros incluso en un centro de referencia de cáncer como el INC. Los síntomas difusos y probables fallas en el sistema de salud generan diagnósticos en estadios avanzados, principalmente por un gran tamaño tumoral y alto porcentaje de inoperabilidad (14,6%), a pesar de esto, los pacientes con resecciones parciales o biopsias tratados en hospitales de menor complejidad tienen opción quirúrgica en centros de experiencia como lo mostramos en esta serie. Consideramos que el manejo óptimo de los pacientes inicia desde la sospecha diagnóstica temprana e incluye el uso racional de imágenes, el análisis histológico de las muestras por patólogos con experiencia, la planeación preoperatoria teniendo en cuenta los posibles órganos comprometidos y la decisión de terapias adicionales previas o postoperatorias de acuerdo al tipo y estadio tumoral. En esta serie la principal complicación intraoperatoria fue el sangrado del lecho tumoral, que ocasionó una mortalidad operatoria alta en relación con lo publicado en otras series. Debido a nuestro sistema de referencia, no contamos con seguimiento estricto de los pacientes y el porcentaje de pérdidas fue alto, lo cual limita la evaluación de sus desenlaces oncológicos. Sin embargo, el análisis de supervivencia mostró que estos pacientes presentan un porcentaje alto de recaída local y pobre supervivencia global. La cirugía continúa siendo la opción terapéutica de elección, y el manejo de estos pacientes debe ser realizado en forma oportuna en centros de experiencia desde el inicio de sus síntomas. En esta serie describimos datos que apoyan esta tendencia como son la alta tasa de resecabilidad incluyendo pacientes previamente considerados irresecables y mayor precisión en el diagnóstico histológico de los pacientes, en el contexto de desenlaces oncológicos seguros.
La naturaleza retrospectiva del estudio, el porcentaje alto de pérdidas en el seguimiento y la falta de objetividad en la valoración de las características del procedimiento (dependiente del criterio del cirujano) son las principales limitantes de este trabajo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses