Reportar la supervivencia global, libre de evento, la respuesta histológica a quimioterapia neoadyuvante y los resultados de la cirugía de preservación de la extremidad en pacientes con osteosarcoma convencional tratados sin altas dosis de metotrexato en el Instituto Nacional de Cancerología de Colombia.
Pacientes y métodosuna cohorte de pacientes menores de 21 años de edad con diagnóstico de osteosarcoma convencional, con o sin metástasis, fueron tratados con quimioterapia preoperatoria por doce semanas; seguidos de cirugía de control local en la semana 15 y tres ciclos de quimioterapia posoperatoria. En el tratamiento se administraron cuatro medicamentos (ifosfamida, doxorrubicina, cisplatino y etopósido) y no se incluyo el uso de metotrexato.
La supervivencia global y libre de evento fue calculada por el método de Kaplan-Meier. Se realizó análisis multivariable para predictores de supervivencia mediante el modelo de riesgos proporcionales de Cox. Los análisis estadísticos se realizaron para α 0,05.
ResultadosEntre enero de 1997 y diciembre de 2007 ingresaron 122 pacientes con osteosarcoma convencional, para una mediana de seguimiento de 25,4 meses (rango 1,13 a 169). La edad promedio fue 13,7 años (DE: 2,9) y de los procedimientos quirúrgicos la cirugía de salvamento correspondió al 52% y la cirugía ablativa al 38%. La supervivencia global y libre de evento fue mayor en los buenos respondedores a quimioterapia que en malos respondedores (HR=4,33; IC 95% 1,77–10,58)) y (HR=2,90; IC 95% 1,60–5,27). La supervivencia global y libre de evento fue diferente entre los pacientes con y sin metástasis al diagnóstico (HR=2,13; IC 95% 0,97–4,72) y (HR=2,07; (IC 95% 1,10 - 3,90).
ConclusiónEl osteosarcoma puede ser tratado con quimioterapia sin altas dosis de metotrexato logrando supervivencia moderadamente efectiva y comparable con la de países desarrollados.
To report event-free overall survival rates and histological response results for neoadjuvant chemotherapy and limb-salvage surgery in conventional osteosarcoma patients treated without high methotrexate doses in the National Cancer Institute of Colombia.
Patients and MethodsA cohort of under 21-year old patients diagnosed with conventional osteosarcoma, with or without metastasis, underwent preoperative chemotherapy for twelve weeks, followed by local control surgery in week 15, and three postoperative chemotherapy cycles. Treatment did not include methotrexate. Four drugs were administered: ifosfamide, doxorubicin, cisplatin, and etoposide. The Kaplan-Meier method was used to calculate overall survival and event-free rates. A multivariate analysis of survival predictors was carried out with the Cox proportional hazards method. Statistical analysis was based on an α of 0.05.
ResultsFrom January 1997 to December 2007, a total of l22 conventional osteosarcoma patients received treatment, with a median follow-up of 24.4 months (range 1.13 to 169). The mean patient age was 13.7 years (SD±2.9 yrs). Limb-salvage surgery was performed in 52% and ablative surgery in 38%. Overall survival and event-free rates were higher in the good responders to chemotherapy than in the poor responders: (HR=4.33; 95% CI; 1.77-10.58) and (HR=2.90; 95% CI; 1.60–5.27. The overall survival and event-free rates were different between patients with and without metastasis at diagnosis: (HR=2.13; 95% CI; 0.97–4.72) and (HR=2.07; (95% CI; 1.10–3.90.
ConclusionOsteosarcoma can be treated with chemotherapy without high methotrexate doses to achieve moderately effective survival rates comparable with those in developed countries
El osteosarcoma es el tumor óseo maligno más común en niños y adolescentes. Representa aproximadamente el 2,5% de todos los cánceres en menores de 15 años y el 4,2% en jóvenes de entre 15 a 19 años de edad1,2. La tasa de incidencia anual varía entre 3,5 y 8,8 casos/millón en menores de 15 y entre 15 a 19 años respectivamente. El registro poblacional de Cali (Colombia) reporta una incidencia ajustada por edad y sexo de 4,2 casos por millón en menores de 15 años de edad3.
Desde 1970 la supervivencia a cinco años de los pacientes con osteosarcoma mostró una gran mejoría cuando se introdujo la quimioterapia adyuvante y se pasó del 20%, cuando los pacientes fueron tratados exclusivamente con cirugía, hasta llegar al 60% y 70% para los pacientes con enfermedad localizada tratados con poliquimioterapia4,5.
El tratamiento estándar del osteosarcoma incluía un control local quirúrgico del tumor primario, con cirugía radical o con preservación de la extremidad y la administración de poliquimioterapia6. El uso de quimioterapia multiagente incluyó, desde los estudios de Jaffe et al. y Rosen7,8, la aplicación de metotrexato endovenoso a dosis altas, y se le llegó a atribuir parte de la mejoría en la supervivencia a la inclusión del medicamento en los protocolos9. Sin embargo, el potencial beneficio de las dosis altas de metotrexato podía verse limitado, en primer lugar, por una significativa toxicidad que implicaba nefrotoxicidad, toxicidad gastrointestinal (mucositis y hepatoxicidad) y neurotoxicidad, y en segundo lugar, por el requerimiento de una infraestructura técnica para la dosificación de niveles séricos de metotrexato no disponible en todos los sitios donde se trata a los niños con osteosarcoma. Con el propósito de evitar la toxicidad de metotrexato sin reducción de la supervivencia surgen estrategias de tratamientos que no incluyen metotrexato en el protocolo de quimioterapia10,11.
El Instituto Nacional de Cancerología de Colombia (INC) no contaba con la posibilidad de monitorizar los niveles séricos de metotrexato hasta 2009, por lo que fue necesario tratar los pacientes con una estrategia que no incluyera las dosis altas (12 gramos/m2sc) de metotrexato.
Son pocos los estudios que reportan resultados de esquemas no basados en metotrexato; este estudio tiene por objetivo presentar los resultados de la evaluación de respuesta histológica a la quimioterapia neoadyuvante, la cirugía de preservación de la extremidad y la supervivencia de la cohorte de niños y adolescentes con osteosarcoma convencional tratados sin altas dosis de metotrexato en el INC entre 1997 y 2007.
Materiales y métodosPoblaciónSe realizó un estudio observacional tipo cohorte retrospectiva, que incluyó a todos los pacientes menores de 21 años de edad de ambos sexos con diagnóstico confirmado por histología de osteosarcoma convencional de alto grado con o sin metástasis al diagnóstico que no hubieran recibido tratamiento previo y tratados con el protocolo OS II-INC entre enero de 1997 y diciembre de 2007.
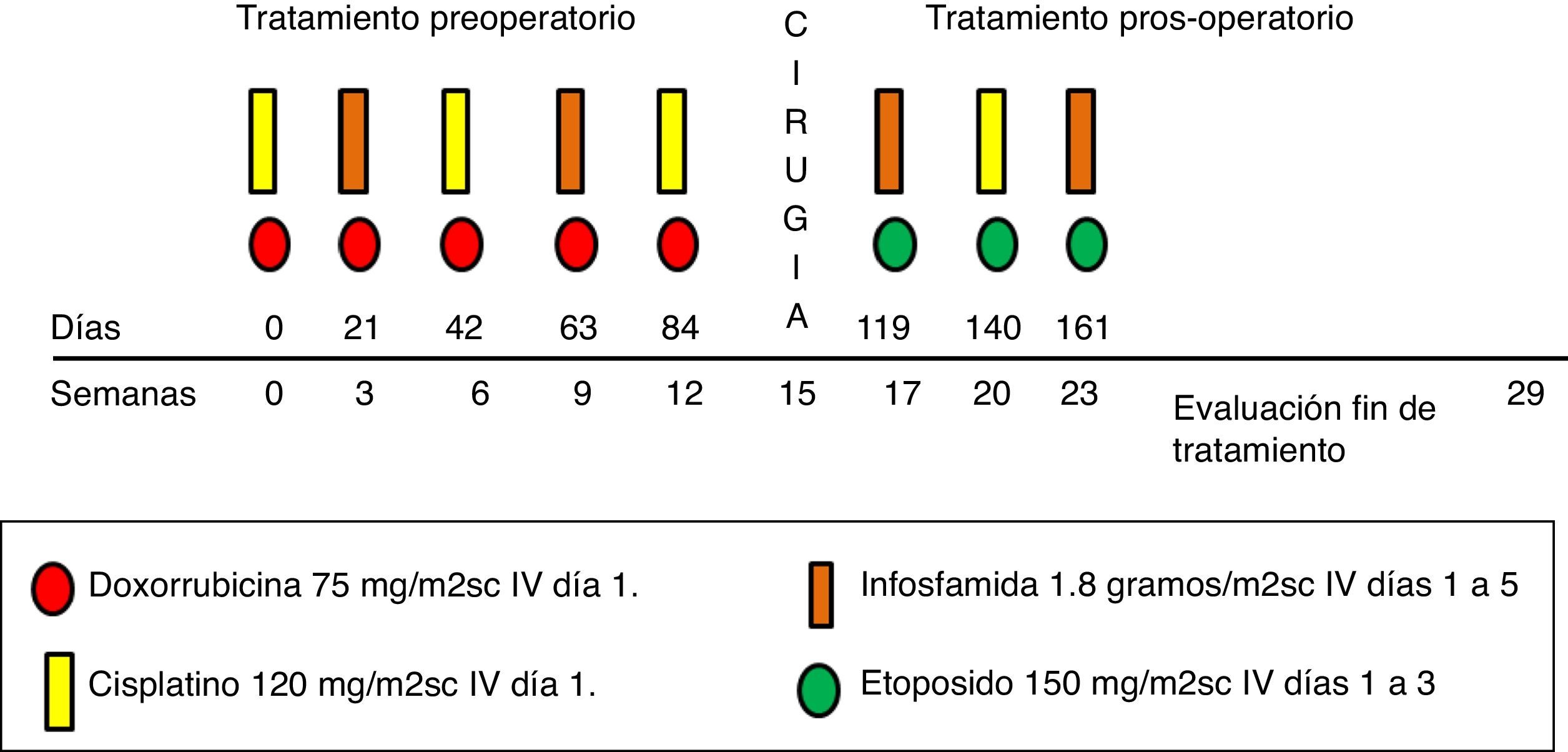
Tratamiento OS II-INCSe administraron cinco ciclos de quimioterapia preoperatoria, seguidos de cirugía de control local con salvamento de extremidad o amputación en la semana 15 y posteriormente tres ciclos de quimioterapia posoperatoria.
La dosis total acumulada de la quimioterapia fue: doxorrubicina 375mg/m2sc; ifosfamida 36 gramos/m2sc; cisplatino 480mg/m2sc, y etopósido 1350mg/m2sc. En la figura 1 se presenta el esquema de tratamiento y las dosis de los medicamentos.
Evaluación pretratamientoSe realizó biopsia abierta o percutánea del hueso comprometido. En los pacientes que a su ingreso ya estaban biopsiados se solicitaron los bloques de parafina y las láminas para revisión por el grupo de patología del INC para confirmar el diagnóstico.
Los pacientes fueron sometidos a una evaluación diagnóstica basal que incluyó la historia clínica y el examen físico, además de: cuadro hemático y química sanguínea para evaluación de función renal y hepática; fosfatasa alcalina; radiografía simple y TAC o resonancia magnética nuclear del hueso comprometido; radiografía y TAC simple del tórax; gammagrafía ósea; gammagrafía de filtración glomerular, y fracción de eyección ventricular por gammagrafía (FEVI).
Previo a cada ciclo de quimioterapia con cisplatino se realizó gammagrafía de filtración glomerular y antes de la administración de doxorrubicina se midió la FEVI.
Antes de la cirugía de control local se evaluó el paciente con TAC o RMN del tumor primario, TAC simple de tórax y gammagrafía ósea. El seguimiento de los pacientes consistió en examen físico con fosfatasa alcalina y radiografía de tórax cada 3 meses y TAC simple de tórax cada 6 meses durante el primer año. Posteriormente los pacientes se monitorizaron con TAC simple de tórax cada 6 meses hasta completar 5 años desde el diagnóstico.
La evaluación histológica de la respuesta a la quimioterapia preoperatoria se practicó en la pieza quirúrgica del tumor primario después de la resección tumoral; se utilizó el sistema de grados de respuesta clasificando en buena respuesta a los pacientes que tenían necrosis tumoral ≥ a 90% y mala respuesta a los que se le demostró<del 90% de necrosis tumoral, lo que se corresponde con los grados I–II y III–IV respectivamente de la clasificación descrita por Rosen et al11.
Métodos estadísticosSe realizaron análisis descriptivos mediante el uso de frecuencias absolutas y relativas para las variables nominales y ordinales. En las variables numéricas se utilizó la media como medida de tendencia central y la desviación estándar como medida de dispersión.
Se estimaron funciones de supervivencia mediante el método de Kaplan Meier y para la comparación de las curvas de supervivencia se utilizó la prueba de rangos logarítmicos. La supervivencia libre de evento (SLE) fue definida como el tiempo transcurrido desde la fecha de la primera consulta hasta la fecha del primer evento (primera recaída o muerte, lo que ocurra primero). La supervivencia global (SG) fue definida como el tiempo transcurrido desde la primera consulta hasta la fecha de muerte por cualquier causa. Los pacientes que no presentaron evento a la fecha de la recolección de la información fueron censurados en la fecha del último control.
Se compararon funciones de supervivencia usando la prueba de suma de rangos logarítmicos, en las variables continuas, como la edad o la fosfatasa alcalina. Se compararon los promedios entre los que presentaron o no el evento (recaída o muerte) usando la prueba t-student si cumplía el supuesto de normalidad verificado con la prueba de Shapiro Wilk y en el caso contrario se usó la prueba no paramétrica de suma de rangos de Wilcoxon. Se realizó análisis multivariado para evaluar factores predictores de supervivencia mediante el modelo de riesgos proporcionales de Cox, para el cual se verificó el supuesto de proporcionalidad. En el modelo multivariado se incluyeron las variables con resultados significativos en el análisis bivariado.
Los análisis estadísticos se realizaron a dos colas para un nivel de error tipo I de 0,05. Todos los cálculos fueron realizados con el programa Stata 12® y SPSS 20®.
Por tratarse de un estudio observacional analítico, este fue considerado como una investigación sin riesgos éticos para los pacientes y fue aprobado por el comité de ética en investigación del INC.
ResultadosEntre enero de 1997 y diciembre de 2007 ingresaron 122 pacientes con osteosarcoma convencional de alto grado de cualquier localización con o sin metástasis al momento del diagnóstico. La tabla 1 muestra las características basales de la cohorte de pacientes.
Características demográficas y clínicas de los pacientes con osteosarcoma tratados con el protocolo OS-INC II
| Características basales de los 122 pacientes | |
|---|---|
| Edad - media en años (DE) | 13,7 años (± 2,9) |
| Sexo masculino - No. (%) | 77 (63) |
| Síntomas - No. (%) | |
| Dolor | 122 (100) |
| Masa | 77 (63,1) |
| Eritema | 1 (0,8) |
| Fractura | 13 (10,7) |
| Localización - No. (%) | |
| Fémur | 80 (66) |
| Tibia | 27 (22) |
| Húmero | 10 (8) |
| Peroné | 4 (3) |
| Pelvis | 1 (1) |
| Estadio - No. (%) | |
| IIb | 81 (66) |
| III | 41 (34) |
| Histología - No. (%) | |
| Osteoblástico | 80 (66) |
| Fibroblástico | 14 (11) |
| Condroblástico | 12 (10) |
| Telangiectásico | 6 (5) |
| Mixto | 2 (2) |
| Células pequeñas | 2 (2) |
| Periostal | 1 (1) |
| Otros | 4 (3) |
| Sin dato | 1 (1) |
| Metástasis al diagnóstico - No. (%) | 41 (34) |
| Pulmonar n=41 | 40 (98) |
| Saltarina | 1 (1) |
| Tipo de quimioterapia | |
| Neoadyuvancia | 101 (83) |
| Adyuvancia | 21 (17) |
| Respuesta a quimioterapia–No.= 84 (%) | |
| Buena ≥ 90% necrosis tumoral | 36 (43) |
| Mala<90% necrosis tumoral | 48 (57) |
La edad promedio fue de 13,7 años (DE:±2,9), doce pacientes (9,8%) tenían menos de 10 años al diagnóstico y solo un paciente menor de 5 años (8%). Setenta y siete pacientes fueron del sexo masculino (63%).
La totalidad de los pacientes consultaron por dolor como síntoma inicial y 13 (10,7%) por fractura patológica. La localización más frecuente del tumor primario fue la extremidad inferior y comprometiendo principalmente el tercio distal del fémur y el tercio proximal de tibia y peroné. De los subtipos histológicos los más frecuentes fueron el osteosarcoma osteoblástico, fibroblástico, y condroblástico (tabla 1).
La presencia de enfermedad metastásica al diagnóstico se observó en 41 pacientes (34%), en estos el 97% de las metástasis se localizaron en pulmón.
La quimioterapia neoadyuvante se administró en 101 pacientes (83%) y 27 pacientes recibieron quimioterapia adyuvante debido a que no fueron candidatos a cirugía de preservación de extremidad desde el momento de su ingreso; solo fue posible evaluar la respuesta a la quimioterapia en 84 de ellos debido a que en 17 pacientes no había datos de la patología. Una buena respuesta al tratamiento neoadyuvante fue encontrada en 36/84 pacientes (43%) y la mala respuesta estuvo presente en 48 (57%).
En la tabla 2 se muestra lo relacionado a los procedimientos quirúrgicos realizados. Aproximadamente un tercio de los pacientes ingresaron a la institución con un procedimiento quirúrgico previo consistente en biopsia, tratamiento intralesional (curetaje) o colocación de osteosíntesis para inmovilización sobre sarcoma inadvertido. La cirugía de salvamento de la extremidad fue el procedimiento más frecuentemente realizado para el control local de la enfermedad y la cirugía ablativa con amputación o desarticulación fue necesaria en 47 pacientes (38%). El procedimiento de salvamento de extremidad más realizado fue la resección tumoral con reconstrucción con aloinjerto osteocondral. Únicamente 8 de los pacientes (7%) fueron beneficiarios de la colocación de una endoprótesis.
Tratamientos quirúrgicos realizados, el tipo de cirugía de salvamento y las complicaciones de la cirugía de reconstrucción de la extremidad
| Tratamiento quirúrgico n=122 | No. (%) |
|---|---|
| Tratamiento quirúrgico previo | 34 (27) |
| Solo biopsia | 32 (26) |
| Curetaje | 1 (1) |
| Osteosíntesis | 2 (2) |
| Cirugía | |
| Amputación | 47 (38) |
| Salvamento | 63 (52) |
| Rehusó la cirugía | 12 (10) |
| Tipo de cirugía de reconstrucción | n=63 |
| Aloinjerto intercalar | 11 (9) |
| Aloinjerto osteocondral | 42 (34) |
| Endoprótesis | 8 (7) |
| Resección sin reconstrucción | 1 (1) |
| Espaciador | 1 (1) |
| Complicaciones de las cirugías de reconstrucción n= 63 | 23 (36) |
| Mecánica | 14 (22) |
| Infecciosas | 6 (10) |
| N ecrosis de tejidos blandos | 1 (1) |
| Vascular | 1 (1) |
| Otro | 1 (1) |
| Complicaciones mecánicas. n=14 | |
| Falla del material de osteosíntesis | 5 (36) |
| Falla de la articulación | 5 (36) |
| Fractura | 3 (21) |
| Falla de la endoprótesis | 1 (7) |
Las complicaciones quirúrgicas más frecuentes fueron las alteraciones mecánicas (falla del material de osteosíntesis, falla de la articulación, fractura y falla de la prótesis) las cuales se documentaron en 14 de los 63 pacientes (22%) sometidos a conservación de la extremidad.
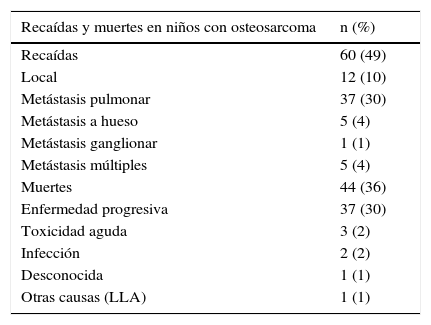
La mediana de seguimiento fue 25,4 meses (rango 1,13 a 169), durante este se presentaron 60 recaídas y 44 muertes. Los sitios de recaídas más frecuentes fueron pulmón (40 pacientes) y la recurrencia local (20 pacientes). La mayoría de las muertes ocurrieron por enfermedad progresiva; otras causas fueron toxicidad aguda (insuficiencia renal), sepsis y una muerte por leucemia linfoide aguda que se encontraba en remisión completa del osteosarcoma al momento de la muerte (tabla 3).
Recaídas y muertes en 122 niños tratados con protocolo OS-INC II
| Recaídas y muertes en niños con osteosarcoma | n (%) |
|---|---|
| Recaídas | 60 (49) |
| Local | 12 (10) |
| Metástasis pulmonar | 37 (30) |
| Metástasis a hueso | 5 (4) |
| Metástasis ganglionar | 1 (1) |
| Metástasis múltiples | 5 (4) |
| Muertes | 44 (36) |
| Enfermedad progresiva | 37 (30) |
| Toxicidad aguda | 3 (2) |
| Infección | 2 (2) |
| Desconocida | 1 (1) |
| Otras causas (LLA) | 1 (1) |
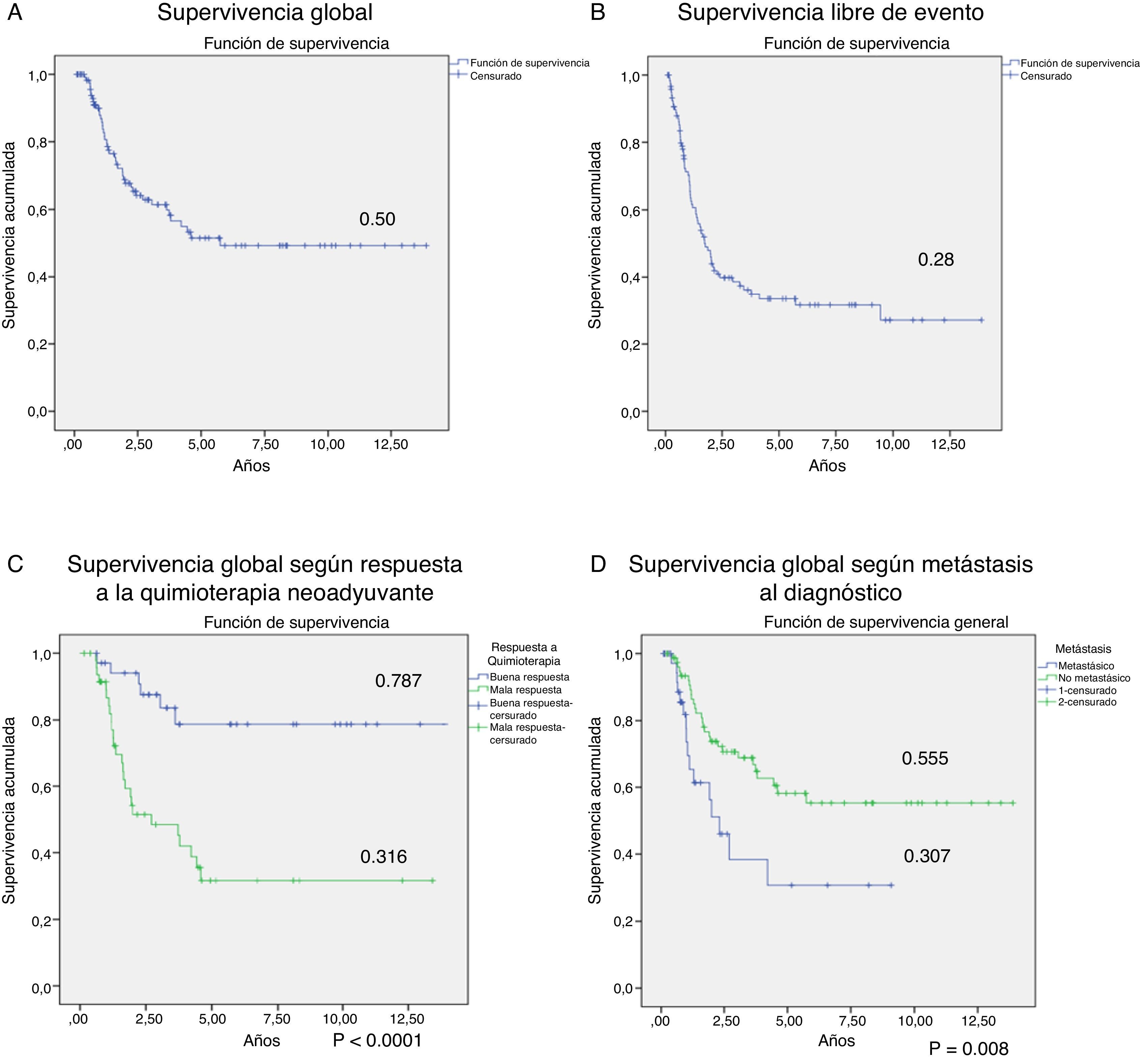
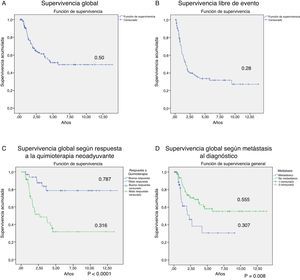
La supervivencia global y libre de evento a 5 años para todos los pacientes fue de 50% y 28% respectivamente (fig. 2). El tiempo en el que el 50% de los pacientes había muerto o presentado un evento de recaída o muerte fue de 69,87 y 21,23 meses respectivamente.
En la figura 2 también se muestra que la supervivencia global fue significativamente mayor en los pacientes buenos respondedores a la quimioterapia neoadyuvante y en los pacientes sin metástasis al diagnóstico (p <0,05).
No se encontraron diferencias estadísticamente significativas en las supervivencias tanto global como libre de evento para la variable sexo. La edad no fue diferente entre los que presentaron eventos de recaída o muerte (p= 0,18 y p= 0,08 respectivamente). Al igual que la edad la fosfatasa alcalina no fue diferente (p=0,26 y p= 0,11 respectivamente).
En el análisis multivariado, los pacientes con mala respuesta a la quimioterapia y con la presencia de metástasis al diagnóstico mostraron diferencias en las supervivencia global comparados con los buenos respondedores y sin metástasis al diagnóstico: HR=4,33 (IC 95%: 1,77–10,58) y HR= 2,13 (IC 95%: 0,97–4,72) respectivamente. La supervivencia libre de evento también fue diferente en presencia de enfermedad metastásica HR= 2,07 (IC 95%: 1,10–3,90) y con la mala respuesta a la quimioterapia neoadyuvante HR= 2,90 (IC 95%: 1,60–5,27). En la tabla 4 se muestran los resultados de supervivencia.
Supervivencia libre de evento y global por características del paciente y la enfermedad
| Variable | SLE | SG | ||||
|---|---|---|---|---|---|---|
| Mediana tiempo en meses (RIQ) | Valor p* | HR (IC 95%) | Mediana tiempo en meses (RIQ) | Valor p* | HR (IC 95%) | |
| Sexo | ||||||
| Hombre | 17,3 (7,97 - 40,03) | 0,7783 | - | 27,3 (9,9 - 54,87) | 0,2236 | - |
| Mujer | 14,47 (7,73 - 42) | - | 24,2 (12,07- 56) | - | ||
| Estadio | ||||||
| Localizado (IIb) | 24,13 (10,17 - 55,77) | 0,0072 | 1 | 37,23 (19,4 - 69,87) | 0,0086 | 1 |
| Metastásico (IV) | 8,17 (4,33 - 13,6) | 2,07 (1,10 - 3,90) | 11,57 (7,9 - 23,23) | 2,13 (0,97 - 4,72) | ||
| Respuesta a neoadyuvancia | ||||||
| Buena>90% necrosis tumoral | 31,73 (20,75 - 74,73) | 0,0001 | 1 | 43,9 (28,68 - 99,18) | 0,0003 | 1 |
| Mala ≤ 90% necrosis tumoral | 13,12 (7,72 - 25,88) | 2,9 (1,60 - 5,27) | 22,95 (13,33 - 54,53) | 4,33 (1,77 - 10,58) | ||
HR ajustado, para el ajuste se usaron las variables respuesta a neoadyuvancia y estadio
RIQ: rango intercuartílico
En nuestra cohorte se presentaron dos segundas neoplasias: una leucemia linfoblástica aguda y un carcinoma de mama.
DiscusiónLos progresos en la curación de los niños y los adolescentes con osteosarcoma son el resultado de un adecuado tratamiento quirúrgico combinado con la aplicación de poliquimioterapia basada en antineoplásicos con demostrada efectividad antitumoral contra sarcomas óseos que generalmente incluye: cisplatino, doxorrubicina, altas dosis de metotrexato y últimamente ifosfamida con o sin etopósido12,13.
Aunque las dosis altas de metotrexato son muy efectivas, su toxicidad neurológica, renal y gastrointestinal está asociada con una disminuida capacidad para metabolizar y depurar el medicamento, lo que además puede ser agravado por la coadministración de medicamentos nefrotóxicos que reducen la función renal y retardan su eliminación.
Existen dos argumentos utilizados en algunas instituciones para evitar la aplicación de las dosis altas de metotrexato10: en primer lugar, se hace referencia a que la toxicidad del metotrexato interfiere con la intensidad de dosis administrada de otros medicamentos14,15 y, en segundo lugar, la necesidad de un monitoreo estricto de los niveles séricos de metotrexato que requiere de experiencia y tecnología que en muchos centros no está disponible16,17.
El análisis de los datos del protocolo OS II–INC muestran que el tratamiento del osteosarcoma con cisplatino, doxorrubicina, ifosfamida y etopósido sin el uso de altas dosis de metotrexato (12 gramos/m2sc) produce supervivencia global y libre de evento similares a la lograda en países con mayores recursos económicos que han utilizado regímenes de tratamiento que no incluyen metotrexato como terapia estándar de osteosarcoma de las extremidades y sin metástasis. Como fue informado por Whelan JS et al. en tres ensayos clínicos del Intergrupo Europeo de Osteosarcoma donde en los estudios BO02/80831, BO03/80861 y BO06/80931 compararon el tratamiento con y sin metotrexato en 1067 pacientes con osteosarcoma no metastásico encontrando que el brazo tratado con el régimen estándar de cisplatino y doxorrubicina tenía una supervivencia general del 56% contra el 52% en el grupo tratado con poliquimioterapia y dosis altas de metotrexato sin probar diferencia estadísticamente significativas18,19.
Tunn PU et al20. logran una supervivencia del 67% con un tratamiento que incluyó cisplatino, adriamicina, vincristina y ciclofosfamida. El grupo de tratamiento de osteosarcoma del Brasil (BTOG sigla en inglés) en los estudios IV y V no utilizó methotrexate como parte de sus tratamientos y lograron supervivencia a 5 años para niños menores de 12 años y con osteosarcoma no metastásico de 57,4% y para adolescentes entre 12 a 18 años de 67%21,22. Finalmente, Xu M et al23. publicó los resultados de 36 pacientes tratados entre 2004 y 2008 en la República Popular China con un protocolo basado en cisplatino, doxorrubicina (adriamicina) e ifosfamida (DAI) donde expuso que la buena respuesta histológica y la supervivencia libre de evento (54,8%) y general (61,5%) son resultados comparables con los tratamientos donde se utiliza methotrexate a dosis altas y concluye que el régimen DAI es bien tolerado y puede ser efectivo.
Los datos de este estudio demuestran que la cohorte estudiada de pacientes no metastásicos al diagnóstico y tratados sin metotrexato lograron una supervivencia con una mediana de seguimiento de 25,4 meses similar de 55,3%.
La respuesta histológica a la quimioterapia neoadyuvante reveló en el análisis bivariado y multivariado ser un factor pronóstico de supervivencia altamente significativo. Como lo han demostrado otros estudios, la supervivencia a 5 años en buenos respondedores es de 73% contra 47% en malos respondedores23. El estudio presentado muestra que la supervivencia global fue mayor en los buenos respondedores (p<0,05). En forma similar el análisis multivariado muestra un mayor riesgo de morir en los pacientes malos respondedores a quimioterapia. (HR: 4,33; IC 95%: 1,77–10,58).
La cirugía de salvamento de la extremidad se pudo realizar en el 52% de los pacientes, aunque solo un número pequeño de los adolescentes se beneficiaron de esta mediante prótesis y la mayoría recibieron aloinjerto osteocondral. Si bien los salvamentos de extremidades en osteosarcoma se han incrementado en el mundo logrando pasar de un 20% hasta un 90% en la cohorte de pacientes reportada por Bacci G et al24. La tasa lograda en esta serie es un avance importante en nuestro medio y representa una alternativa a la amputación para el control local de la enfermedad que es comparable a lo informado en estudios multi-institucionales realizados por Goordin et al., 50% 25 y por el Children Cancer Group 43%26.
La frecuencia de recaídas locales de un 10% es elevada comparada con el 5% reportado por otros autores27,28; a diferencia del Intergrupo Europeo de Osteosarcoma que tuvo una recurrencia local del 6%, y se observaron que las recaídas locales fueron más frecuentes en pacientes con cirugía de salvamento de extremidad que en pacientes amputados (8% contra 2% respectivamente29), nosotros no encontramos una diferencia estadísticamente significativa (p= 0,229) entre las recaídas locales en el grupo que recibió salvamento de la extremidad, 14% (9/63 pacientes), y los pacientes sometidos a amputación 6,4% (3/47 pacientes), lo cual puede ser explicado por el pequeño tamaño de la cohorte y el número reducido de eventos. Consideramos que en este punto tenemos un reto para mejorar en el futuro inmediato y que implica una identificación más estricta de los pacientes que cumplan con los criterios definidos de resecabilidad tumoral para preservación de la extremidad para así evitar el incluir a pacientes con indicaciones limítrofes.
El presente estudio tiene como fortaleza que todos los pacientes fueron tratados en la misma institución por un mismo equipo de oncólogos pediatras y ortopedistas oncológicos; además nosotros reportamos, como pocos estudios en la literatura, tanto los resultados de los pacientes tratados con enfermedad localizada como la supervivencia de toda la cohorte incluyendo a la enfermedad metastásica. Asimismo, reconocemos como debilidad que no es un estudio aleatorizado controlado y que tiene los riesgos propios de no tener un grupo de comparación, y cuyos resultados son de una sola institución por lo cual las inferencias tienen como limitante la extrapolación a otras instituciones.
Para finalizar, concluimos que el análisis de los datos de 10 años de experiencia de tratamiento sin altas dosis de metotrexato demuestra que esta puede ser una alternativa para regiones donde no existe la posibilidad del manejo con este medicamento, pues con esta se logra una supervivencia en los pacientes con osteosarcoma localizado superior al 50%, por lo que es necesaria la búsqueda de estrategias terapéuticas que apunten a mejorar las tasas de supervivencia.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEstudio financiado por el Instituto Nacional de Cancerología.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.