Evaluar en un contexto de práctica clínica la ventaja de supervivencia para pacientes con cáncer de próstata resistente a castración (CPRC) tratado activamente con diversos tratamientos que incluyen acetato de abiraterona (AA) y prednisona con o sin docetaxel.
Material y métodoSe analiza la supervivencia de pacientes con CPRC y se compara un grupo tratado con AA y prednisona (n=33) con un control histórico formado por pacientes consecutivos tratados una década antes en la misma institución exclusivamente con retirada de antiandrógeno y medidas paliativas (n=31). Se analizan variables clínico-patológicas predictivas de pronóstico en la población activamente tratada. Se evalúa la respuesta global a AA y el intervalo libre de progresión radiológica.
ResultadosLa supervivencia cáncer específica a 2 años fue 79% para pacientes tratados activamente y 17,2% para control (log-rank, p<0,0001). Cinco de 13 pacientes con AA post-docetaxel (38,5%) recibieron después de AA quimioterapia de segunda línea (4 cabazitaxel y 1 vinorelbina) y 1 (7,7%) hormonoterapia con enzalutamida. Tres de 20 pacientes tratados con AA sin quimioterapia (15%) recibieron enzalutamida y solo 1 (5%) fue tratado con docetaxel. Los pacientes de menor edad (<65años; p=0,02) y sin metástasis al diagnóstico (p=0,04) tuvieron mejor pronóstico. Aquellos de PSA más alto (>45ng/ml; p=0,09) y patrón de Gleason 5 en la biopsia se comportaron de manera más desfavorable. Globalmente el 75,8% tuvieron respuesta a AA (80% pre- y 69,2% post-quimioterapia; p=0,1) y el 52,4% estuvieron libre de progresión radiológica al año (47,9% pre y 49,8% post-quimioterapia; log-rank, p=0,3).
ConclusiónEl tratamiento de pacientes con CPRC prolonga la expectativa de supervivencia en un entorno de práctica clínica y es posible identificar factores predictivos de pronóstico en estos pacientes.
To assess, in a clinical practice context, the survival advantages of patients with castration-resistant prostate cancer (CRPC) actively treated with several treatments that include abiraterone acetate (AA) and prednisone, with or without docetaxel.
Material and MethodsAn analysis was performed on patient survival with CRPC, and was compared to a group treated with AA and prednisone (n=33), with a historical control treated exclusively with anti-androgen withdrawal and palliative measures (n=31). In the population actively treated, variables predictive of prognosis were analysed, as well as an evaluation of the overall response to AA and radiographic progression-free survival.
ResultsCancer-specific survival at 2 years was 79% for patients actively treated and 17.2% for control group (P<.0001). Five (38.5%) of 13 patients treated with AA post-docetaxel received second-line chemotherapy after AA (4 cabazitaxel, 1 vinorelbine), and one (7.7%) enzalutamide. Three (15%) of 20 patients treated with AA without chemotherapy received enzalutamide and 1(5%) docetaxel. The younger patients (<65yrs; P=.02) without metastases at diagnosis (P=.04) had better prognoses. Patients with higher PSA levels (>45ng/ml; P=.09) and a Gleason pattern 5 in the biopsy had less favourable outcomes. There was a 75.8% over response to AA (80% pre- and 69.2%post-chemotherapy; P=.1), and 52.4% were radiographic progression-free at 1 year of treatment (47.9% pre- and 49.8% post-chemotherapy; P=.3).
ConclusionTreatment of CRPC patients extends survival expectations in a clinical practice setting and prognostic predictors can be identified in these patients.
Desde que Huggins y Hodges describieron al principio de los años cuarenta los efectos de la castración en el cáncer de próstata metastático1, la deprivación androgénica ha resultado fundamental en el armamentario urológico para el tratamiento del cáncer de próstata. La terapia hormonal se empleó inicialmente de manera restringida en la enfermedad avanzada inoperable, pero en la era del antígeno prostático específico (PSA) la detección más precoz de la enfermedad ha supuesto una migración a estadios más prematuros y ha conllevado mayor diversidad de tratamientos. Por ello, los pacientes con esta enfermedad pueden recibir bloqueo hormonal de forma más temprana, generalmente asociada a otras terapias, aunque se asume que el valor de la deprivación androgénica es mayor en la enfermedad avanzada1,2.
Los pacientes con cáncer de próstata localmente avanzado o metastático que no pueden ser curados con tratamientos locales y reciben castración médica o quirúrgica a menudo presentan remisiones completas de su enfermedad por un periodo variable de en torno a 14-30 meses3. No obstante, de forma irremisible estos pacientes progresan y vuelven a expresar señalización activa del receptor de andrógenos (RA) a pesar de tener niveles muy bajos de andrógenos. El regreso de la señalización androgénica sucede debido a la confluencia de diferentes mecanismos, algunos dependientes del RA como es la producción local en el entorno tumoral de andrógenos o la amplificación de la proteína RA, y otros no dependientes entre los que destacan mecanismos coactivadores y transactivadores4. De hecho, durante la progresión independiente a andrógenos las células tumorales desarrollan diferentes mecanismos que les permiten sobrevivir y replicarse, como: mutaciones del gen RA; silenciamiento de genes promotores por metilación anómala; activación independiente de ligandos del RA, o incluso la intervención de células madre tumorales5–7. El resultado es el desarrollo de una enfermedad totalmente refractaria a la deprivación de andrógenos5, entidad a la que hoy denominamos cáncer de próstata resistente a la castración (CPRC).
El CPRC es una enfermedad fatal que sigue un curso agresivo, aunque con un ritmo de progresión variable, con pacientes que fallecen muy rápidamente y otros con menor potencial metastático que pueden convivir con la enfermedad por un periodo que muy rara vez supera los 40 meses8. Diferentes regímenes de quimioterapia sistémica empleados consiguieron muy escasa mejora en la supervivencia de estos pacientes hasta el descubrimiento del complejo microtúbulo-molécula Bcl2 como diana terapeútica. Docetaxel (75mg/m2 cada 3 semanas) asociado a prednisona ha conseguido en los últimos años un discreto beneficio en la supervivencia (18,9 meses vs. 16,4 meses para mitoxantrona y prednisona) y una mejora en el control analgésico en la fase final de la enfermedad9,10.
En la actualidad el tratamiento integral del CPRC se encuentra en constante evolución al incorporar nuevos elementos de terapia hormonal (acetato de abiraterona y enzalutamida) y de quimioterapia (cabazitaxel). El uso de acetato de abiraterona (AA), en ocasiones tras quimioterapia fallida y más recientemente en pacientes sin tratamiento quimioterápico, ha revolucionado el concepto de hormonoterapia de segunda línea y la expectativa de mejora integral de la supervivencia de estos pacientes y ha retrasado en muchos casos la quimioterapia y en los que ya la han recibido mejorando los cuidados en la fase final de la enfermedad11–14. Evaluamos en un contexto de práctica clínica la ventaja de supervivencia para pacientes con CPRC tratado activamente con hormonoterapia de segunda línea asociada o no a quimioterapia con taxanos y la magnitud de efecto en la mejora de la supervivencia libre de progresión debida a AA.
Material y métodoSe analizó retrospectivamente una serie de pacientes consecutivos con CPRC (n=33), definidos durante su seguimiento como enfermedad recurrente a pesar de castración apropiada (testosterona sérica <50mg/ml) y progresión bioquímica confirmada (3 elevaciones consecutivas de PSA, separadas al menos 1 semana, que producen dos aumentos del 50% sobre nadir, con PSA<2ng/mL) o progresión radiológica (aparición de 2 o más lesiones óseas en gammagrafía o una lesión de partes blandas empleando criterios RECIST)15 que recibieron AA con prednisona, con o sin quimioterapia sistémica, en nuestra institución entre noviembre de 2011 y noviembre de 2014. El diagnóstico primario de estos tipos de cáncer se estableció en el periodo 2000-2013. Este grupo se comparó con un control histórico equiparable de pacientes con CPRC tratados en el mismo centro (n=31) y analizados también de forma retrospectiva. Los pacientes del grupo control fueron diagnosticados en el periodo 1989-2003, antes del uso habitual de docetaxel y fueron tratados exclusivamente con retirada del antiandrógeno y medidas paliativas, que generalmente incluyeron en la fase final de la enfermedad control analgésico y prednisona oral (10mg).
La selección de los controles se basó en identificar pacientes consecutivos tratados en la misma institución y en número similar al de los casos a estudio, pero con una década de diferencia. Así se asegura que estos pacientes no fueron tratados activamente con antiandrógenos de segunda línea ni con quimioterapia sistémica. La proporción de controles y casos tratados activamente fue 1:1. En todos los casos el seguimiento del paciente se actualizó al momento del último seguimiento, tanto para casos como para controles. Se registró también el momento y la causa de fallecimiento. Los pacientes que fallecieron por causa diferente a cáncer de próstata aportaron seguimiento de supervivencia cáncer específico hasta el momento en el que fueron censurados. Con respecto al protocolo de imagen, al tratarse de un estudio retrospectivo, las pruebas radiológicas (TAC) y de medicina nuclear (gammagrafía) se llevaron a cabo cuando se consideró clínicamente necesario. Los pacientes tratados activamente con antiandrógenos de segunda línea fueron seguidos con imagen en un intervalo de 3-4 meses. En este grupo se evalúa la progresión radiológica.
El objetivo principal del estudio se centró en conocer la supervivencia cáncer-específica de los pacientes tratados activamente y compararla con la del grupo control. El tamaño de la muestra evaluada no permitió llevar a cabo un modelo multivariante de regresión de Cox. Se llevó a cabo análisis de Kaplan Meier y test log-rank, así como análisis de riesgo proporcional. El objetivo secundario fue establecer la tasa de respuesta global (clínica, bioquímica y radiológica) en los pacientes tratados con AA y la supervivencia libre de progresión radiológica desde el inicio de este tratamiento hasta que se registra de nuevo progresión de la enfermedad.
Se describió la práctica de uso clínico las diferentes modalidades de tratamiento complementario de rescate recibidas en los pacientes tratados con AA y se analizaron las variables clínico-patológicas predictivas de supervivencia en estos pacientes, tomando un nivel de significación estadística p<0,1 debido al tamaño y el seguimiento limitado de esta serie. Asimismo se analizó si existían diferencias en la progresión de la enfermedad entre pacientes tratados con AA tras quimioterapia (n=13) o de forma primaria (n=20); así como la tolerancia clínica al tratamiento con AA.
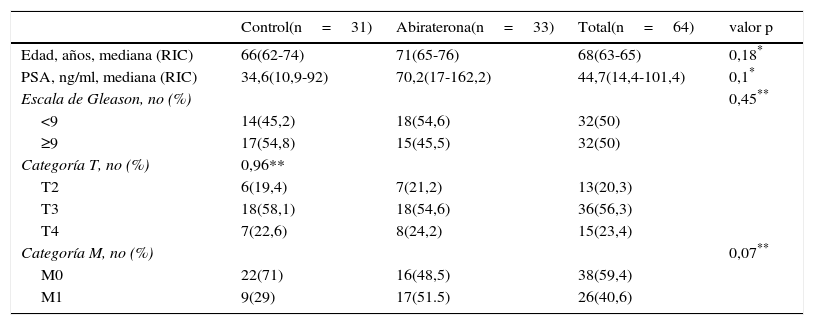
ResultadosNo se detectaron diferencias de significación estadística en edad, PSA al diagnóstico, escala de Gleason y categoría T o M al diagnóstico (p>0,05) entre el grupo tratado activamente y el grupo control (Tabla 1). No obstante, existe una tendencia a que los pacientes tratados con AA fuesen metastáticos; lógicamente esto fue condicionado por la indicación en ficha técnica del fármaco en este tipo de pacientes. Asimismo, también existe una tendencia a edad más avanzada y PSA más elevado en los pacientes del grupo AA, sesgos posiblemente debidos al momento histórico de cada serie.
Características clínico-patológicas de los pacientes con CPRC en el momento del diagnóstico
| Control(n=31) | Abiraterona(n=33) | Total(n=64) | valor p | |
|---|---|---|---|---|
| Edad, años, mediana (RIC) | 66(62-74) | 71(65-76) | 68(63-65) | 0,18* |
| PSA, ng/ml, mediana (RIC) | 34,6(10,9-92) | 70,2(17-162,2) | 44,7(14,4-101,4) | 0,1* |
| Escala de Gleason, no (%) | 0,45** | |||
| <9 | 14(45,2) | 18(54,6) | 32(50) | |
| ≥9 | 17(54,8) | 15(45,5) | 32(50) | |
| Categoría T, no (%) | 0,96** | |||
| T2 | 6(19,4) | 7(21,2) | 13(20,3) | |
| T3 | 18(58,1) | 18(54,6) | 36(56,3) | |
| T4 | 7(22,6) | 8(24,2) | 15(23,4) | |
| Categoría M, no (%) | 0,07** | |||
| M0 | 22(71) | 16(48,5) | 38(59,4) | |
| M1 | 9(29) | 17(51.5) | 26(40,6) |
Control vs Abiraterona: U-Mann Whitney (*), Chi-X2 (**)
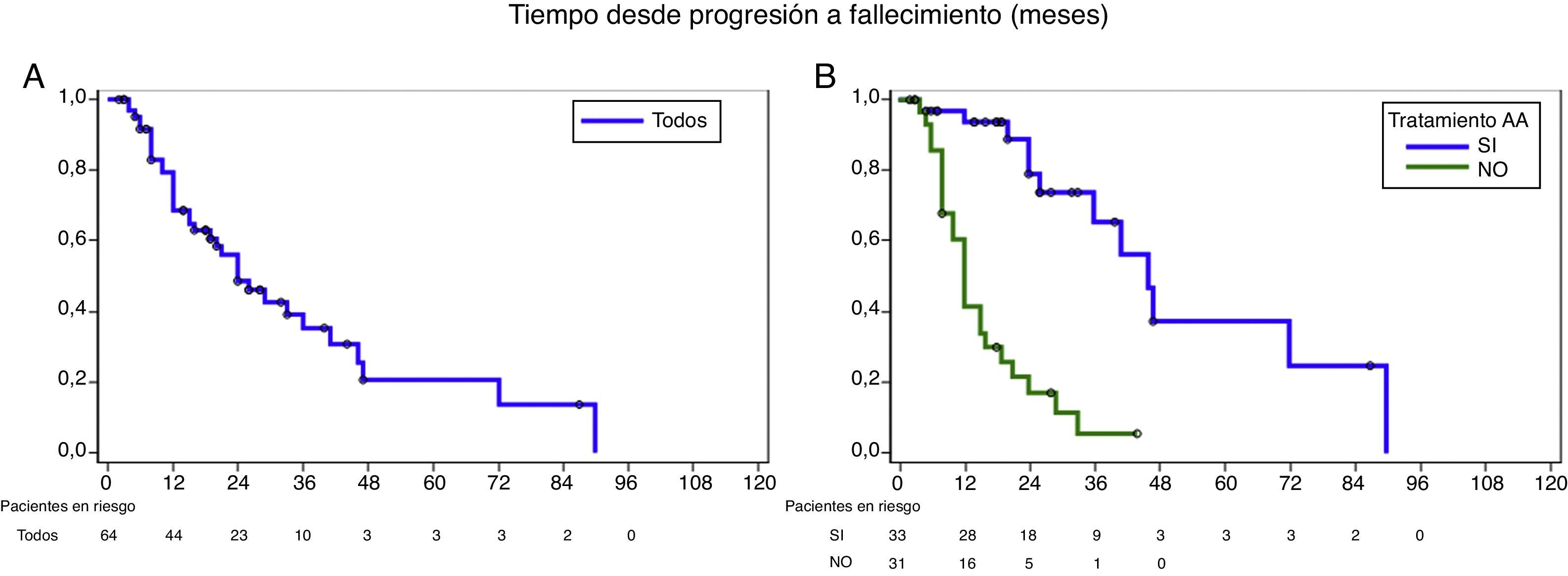
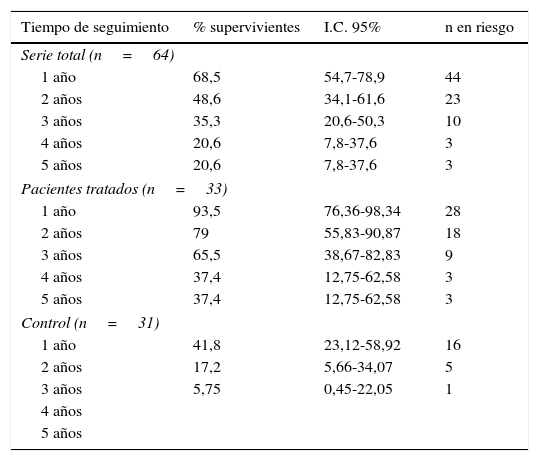
La supervivencia de la serie completa de pacientes con CPRC fue 68,5%, 48,6%, 35,5% y 20,6% a 1, 2, 3 y 4 años, respectivamente (tabla 2, fig. 1). El tiempo de supervivencia cáncer-específica desde la definición de CPRC fue significativamente mayor en los pacientes tratados con AA que en el grupo control (log-rank, p<0,0001) (fig. 1). En este grupo la supervivencia cáncer-específica al año fue 93,5% para pacientes tratados y 41,5% en el grupo control, y a 3 años 65,5% y 5,7%, respectivamente (Tabla 2).
Supervivencia cáncer-específica para pacientes con CPRC: serie total, tratados con abiraterona +/− quimioterapia sistémica y grupo control histórico
| Tiempo de seguimiento | % supervivientes | I.C. 95% | n en riesgo |
|---|---|---|---|
| Serie total (n=64) | |||
| 1 año | 68,5 | 54,7-78,9 | 44 |
| 2 años | 48,6 | 34,1-61,6 | 23 |
| 3 años | 35,3 | 20,6-50,3 | 10 |
| 4 años | 20,6 | 7,8-37,6 | 3 |
| 5 años | 20,6 | 7,8-37,6 | 3 |
| Pacientes tratados (n=33) | |||
| 1 año | 93,5 | 76,36-98,34 | 28 |
| 2 años | 79 | 55,83-90,87 | 18 |
| 3 años | 65,5 | 38,67-82,83 | 9 |
| 4 años | 37,4 | 12,75-62,58 | 3 |
| 5 años | 37,4 | 12,75-62,58 | 3 |
| Control (n=31) | |||
| 1 año | 41,8 | 23,12-58,92 | 16 |
| 2 años | 17,2 | 5,66-34,07 | 5 |
| 3 años | 5,75 | 0,45-22,05 | 1 |
| 4 años | |||
| 5 años | |||
Abiraterona vs. Control: test log-rank, p<0,0001
El seguimiento medio desde la definición de CPRC hasta fallecimiento o censura de los pacientes tratados con AA fue 28,7±21,3 meses (28,7±25 meses post-quimioterapia y 22,3±16,1 meses pre-quimioterapia). Los pacientes que recibieron AA después de quimioterapia habían recibido una mediana de 7±2 (rango 6-11) ciclos de docetaxel con dosis estándar de 75mg/m2 cada 3 semanas. De ellos, 10 (76,9%) recibieron también ácido zoledrónico. Un 38,5% de los pacientes con AA post-quimioterapia recibieron después de AA otros tratamientos complementarios; bien quimioterapia de 2ª línea, cabazitaxel (n=4) y vinorelbina (n=1), u hormonoterapia con enzalutamida y de nuevo AA (n=1). El 20% de los pacientes con AA pre-quimioterapia recibió otros tratamientos después de AA; enzalutamida (n=3) y docetaxel (n=1).
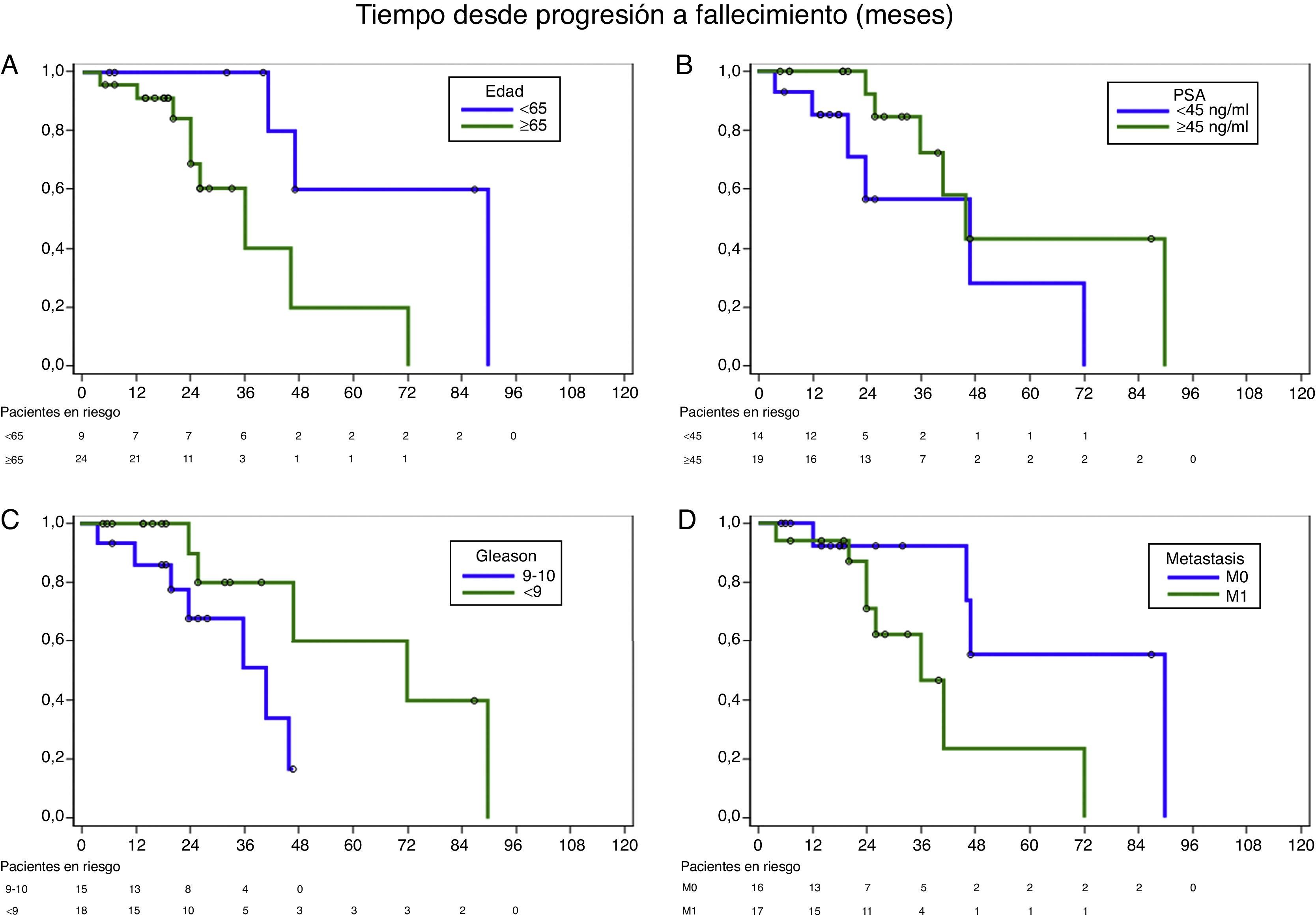
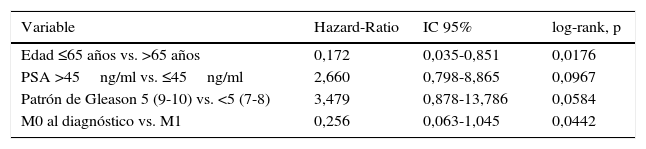
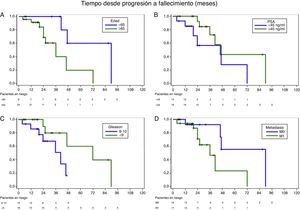
Las variables que definen el riesgo de muerte por cáncer en el grupo de pacientes con tratamiento activo son edad ≤65 años (HR 0,1; p=0,02), PSA ≤45ng/ml (HR 2,66; p=0,09), presencia de Gleason 5 en la biopsia (HR 3,48; p=0,06) y ausencia de metástasis (M0) al diagnóstico (HR 0,26; p=0,04) (tabla 3, fig. 2). No se aprecia diferente pronóstico para indicación pre- o post-quimioterapia en el momento de este análisis, ni para categoría T al diagnóstico.
Variables que influyen en la supervivencia cáncer-específica de pacientes con CPRC que reciben tratamiento con abiraterona (estudio univariado)
| Variable | Hazard-Ratio | IC 95% | log-rank, p |
|---|---|---|---|
| Edad ≤65 años vs. >65 años | 0,172 | 0,035-0,851 | 0,0176 |
| PSA >45ng/ml vs. ≤45ng/ml | 2,660 | 0,798-8,865 | 0,0967 |
| Patrón de Gleason 5 (9-10) vs. <5 (7-8) | 3,479 | 0,878-13,786 | 0,0584 |
| M0 al diagnóstico vs. M1 | 0,256 | 0,063-1,045 | 0,0442 |
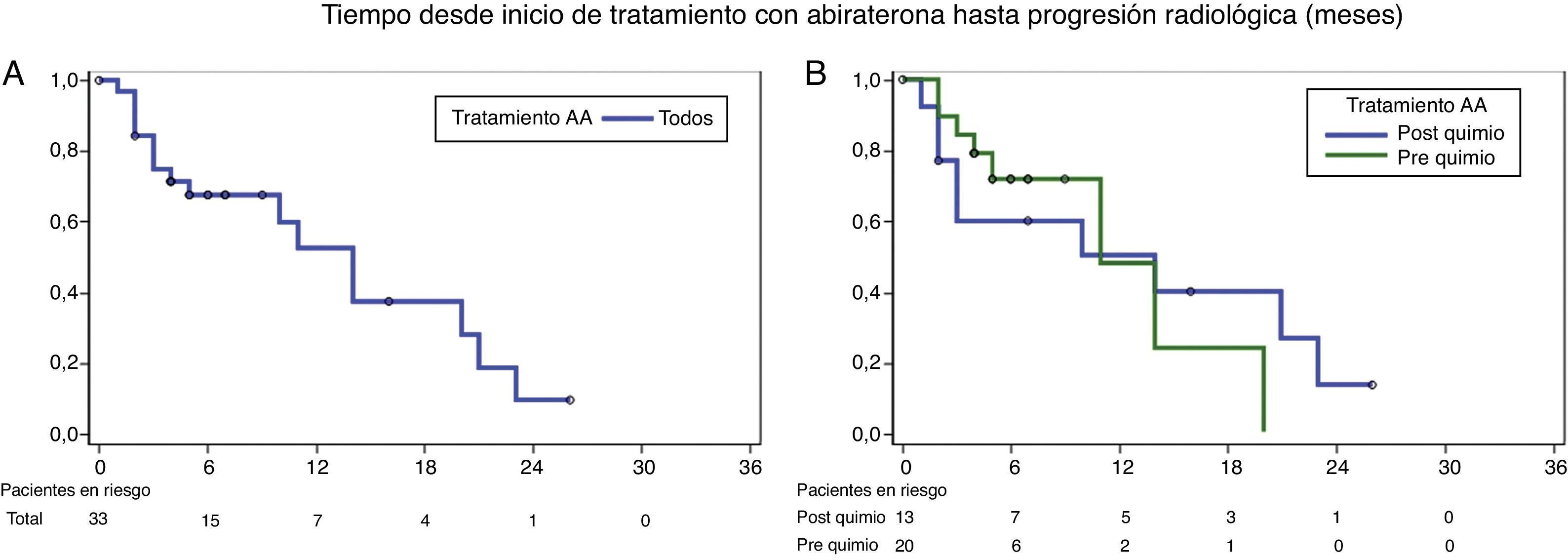
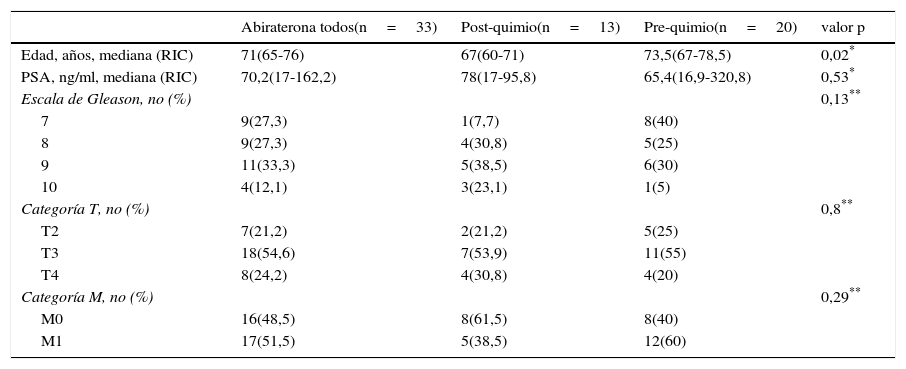
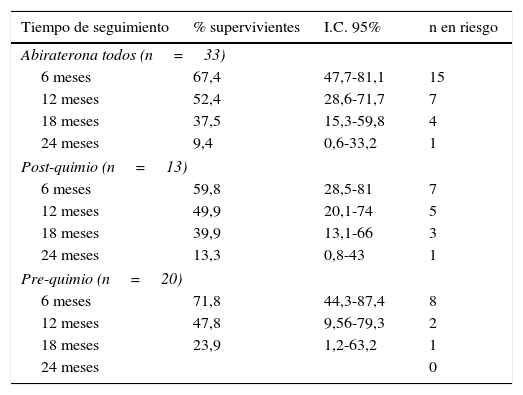
Según un criterio global que recoge mejoría clínica, analítica (descenso de PSA) y por métodos de imagen (respuesta radiológica), el 75,8% de los pacientes tuvieron respuesta al tratamiento con AA. Los pacientes con AA post-quimioterapia fueron más jóvenes que los pacientes con AA sin quimioterapia (p=0,02), pero no se detectaron diferencias en Gleason, categoría T o categoría M (Tabla 4). Estratificando por grupos la respuesta fue 80% para la indicación en pre-quimioterapia y 69,2% en post-quimioterapia (Chi-x2; p=0,1). El 52,4% estaba libre de progresión radiológica al año de tratamiento (47,9% pre y 49,8% post-quimioterapia; log-rank, p=0,3) (tabla 5, fig. 3). La indicación en pre-quimioterapia tiene menor seguimiento y las censuras se producen en la primera parte de la curva, por lo que resulta presumible que a mayor seguimiento aumente la supervivencia cáncer-específica de este tipo de pacientes y pudieran detectarse diferencias en el pronóstico.
Características al diagnóstico de los pacientes que reciben tratamiento con abiraterona y comparación entre pacientes con indicación post- o pre-quimioterapia
| Abiraterona todos(n=33) | Post-quimio(n=13) | Pre-quimio(n=20) | valor p | |
|---|---|---|---|---|
| Edad, años, mediana (RIC) | 71(65-76) | 67(60-71) | 73,5(67-78,5) | 0,02* |
| PSA, ng/ml, mediana (RIC) | 70,2(17-162,2) | 78(17-95,8) | 65,4(16,9-320,8) | 0,53* |
| Escala de Gleason, no (%) | 0,13** | |||
| 7 | 9(27,3) | 1(7,7) | 8(40) | |
| 8 | 9(27,3) | 4(30,8) | 5(25) | |
| 9 | 11(33,3) | 5(38,5) | 6(30) | |
| 10 | 4(12,1) | 3(23,1) | 1(5) | |
| Categoría T, no (%) | 0,8** | |||
| T2 | 7(21,2) | 2(21,2) | 5(25) | |
| T3 | 18(54,6) | 7(53,9) | 11(55) | |
| T4 | 8(24,2) | 4(30,8) | 4(20) | |
| Categoría M, no (%) | 0,29** | |||
| M0 | 16(48,5) | 8(61,5) | 8(40) | |
| M1 | 17(51,5) | 5(38,5) | 12(60) |
Post- vs pre-quimio: U-Mann Whitney (*), Test exacto de Fisher (**)
Supervivencia libre de progresión radiológica: todos los pacientes tratados con abiraterona, pacientes con abiraterona sin quimioterapia previa (pre-quimio) y pacientes que han recibido antes docetaxel (post-quimio)
| Tiempo de seguimiento | % supervivientes | I.C. 95% | n en riesgo |
|---|---|---|---|
| Abiraterona todos (n=33) | |||
| 6 meses | 67,4 | 47,7-81,1 | 15 |
| 12 meses | 52,4 | 28,6-71,7 | 7 |
| 18 meses | 37,5 | 15,3-59,8 | 4 |
| 24 meses | 9,4 | 0,6-33,2 | 1 |
| Post-quimio (n=13) | |||
| 6 meses | 59,8 | 28,5-81 | 7 |
| 12 meses | 49,9 | 20,1-74 | 5 |
| 18 meses | 39,9 | 13,1-66 | 3 |
| 24 meses | 13,3 | 0,8-43 | 1 |
| Pre-quimio (n=20) | |||
| 6 meses | 71,8 | 44,3-87,4 | 8 |
| 12 meses | 47,8 | 9,56-79,3 | 2 |
| 18 meses | 23,9 | 1,2-63,2 | 1 |
| 24 meses | 0 | ||
Post- vs pre-quimio: test log-rank, p=0,93
La mediana desde inicio de AA hasta progresión es 7,6±6,8 meses. Durante el seguimiento se observaron efectos adversos solo en 3 de los pacientes que recibieron AA (9,1%), aunque este dato puede estar afectado por la recogida retrospectiva del mismo. Todos fueron efectos adversos leves que no llevaron a discontinuar el tratamiento. Se trató de hipertensión moderada controlada con antihipertensivos habituales, edemas en piernas relativamente bien tolerados, y elevación de transaminasas (<200%).
DiscusiónEl AA con prednisona se emplea como terapia hormonal de segunda línea en pacientes con cáncer de próstata resistente a la castración (CPRC), bien tras quimioterapia fallida o en pacientes que no han recibido docetaxel con intención de evitar la quimioterapia o demorar su empleo. En casos seleccionados la quimioterapia intermitente con administración repetida de docetaxel y las combinaciones de carboplatino y docetaxel ha demostrado eficacia en pacientes que progresan16, pero muy raramente se emplea por la severidad de la toxicidad acumulativa y escaso beneficio desde que disponemos de cabazitaxel, abiraterona o enzalutamida11,17,18. De hecho, existe un beneficio en la supervivencia reconocido, tanto con hormonoterapia como con quimioterapia de segunda línea para pacientes con fallo de docetaxel; aunque no se han realizado estudios comparativos entre las opciones terapéuticas 19. Habitualmente la reserva de médula ósea, la presencia de neuropatía periférica, la comorbilidad médica y el grado de exposición previa a antiandrógenos son los elementos empleados para tomar la decisión a favor de una u otra decisión.
Desde la aprobación de indicación de AA y prednisona para tratar pacientes con CPRC que no han recibido quimioterapia sistémica la indicación pre-quimioterapia de abiraterona se está convirtiendo en predominante y está desplazando o retrasando el empleo de taxanos en pacientes asintomáticos u oligosintomáticos y sin afectación visceral, debido a la mejor tolerancia del tratamiento hormonal de segunda línea, su cómoda administración y el hecho de que muchos pacientes tienen edad avanzada y no son aptos para quimioterapia20. La disponibilidad actual de diferentes opciones terapéuticas activas está suponiendo una mejora importante en el manejo médico multidisciplinar de esta fase de la enfermedad21. A pesar de ello, el curso de la enfermedad continúa siendo ampliamente heterogéneo y en ocasiones el beneficio del tratamiento es transitorio. Además, desconocemos la forma más efectiva de secuenciar los diferentes tratamientos, por lo que la práctica clínica supone un entorno de estudio realmente atractivo.
Con este trabajo pretendemos evaluar la magnitud del beneficio terapéutico activo para nuestros pacientes en un contexto de práctica habitual, que a menudo difiere de la extrapolación de los resultados derivados de ensayos clínicos. Sabemos de la escasa supervivencia de pacientes con CPRC en bases de datos y registros antes del empleo de docetaxel y prednisona22, equiparable a la del grupo control histórico de nuestra institución. Tradicionalmente las variables que definían el pronóstico en estos pacientes fueron: edad, hemoglobina sérica, tiempo hasta el desarrollo de enfermedad refractaria y carga de afectación metastásica22–24. Por otro lado, algunos grupos nacionales están describiendo los resultados en expectativa de vida de pacientes tratados activamente con AA y prednisona, después o en lugar de docetaxel25, con experiencias también similares a la nuestra.
A pesar del escaso tamaño de la serie que analizamos, la heterogeneidad de la misma y su seguimiento por un tiempo limitado hemos obtenido algunas conclusiones sobre la predicción de pronóstico en pacientes con CPRC tratados con AA y prednisona como parte de un tratamiento integral. Confirmamos que AA más prednisona retrasa la progresión de la enfermedad, tanto en pacientes con CPRC metastásico que han recibido quimioterapia y han progresado a pesar de docetaxel, como en aquellos que nunca recibieron quimioterapia 12,14. En nuestra modesta experiencia los pacientes de edad más avanzada y con metástasis desde el momento del diagnóstico de la enfermedad, y por lo tanto que han recibido durante más tiempo bloqueo hormonal, tienen definitivamente peor pronóstico. Ahora bien, este último punto puede ser objeto de controversia, porque un análisis post-hoc del ensayo COU-AA-302ha mostrado que una mayor exposición a tratamiento hormonal antes del inicio de AA y prednisona se asocia a supervivencia libre de progresión radiológica más prolongada, tanto en pacientes tratados con AA y prednisona como con prednisona solamente26. Los pacientes que en esta serie han recibido enzalutamida o incluso de nuevo AA y prednisona después de progresión con abiraterona han tenido una respuesta muy transitoria a este tratamiento, observación también señalada en otro estudio post-hoc de COU-AA-30227.
Los pacientes con patrón de Gleason 5 en la biopsia y aquellos que tienen un valor de PSA más bajo también conllevan peor supervivencia. Tal vez algunos de estos pacientes pudieran beneficiarse de un enfoque activo y precoz con quimioterapia sistémica28, pero evidentemente se necesita reconocer y validar marcadores predictivos de respuesta para poder conseguir la deseada personalización del tratamiento y poder anticipar mejor su eficacia. El análisis combinado de los ensayos en fase III con AA indica que la escala de Gleason realmente no parece predecir eficacia a este tratamiento, porque tanto pacientes con score ≥8 como los <8 se benefician de recibir AA y prednisona29. En espera de nuevos marcadores, el nivel de PSA y la mera evaluación del estado metastásico son herramientas insuficientes para poder monitorizar adecuadamente esta enfermedad. No obstante, en pacientes que no han recibido quimioterapia la elevación de PSA y fosfatasa alcalina podría tener valor pronóstico30. En nuestra experiencia se reproduce el hecho de que los pacientes con PSA más elevado tienen peor supervivencia cuando son tratados con abiraterona, pero carecemos del dato de fosfatasa alcalina para poder validar esta observación.
El tratamiento integral de pacientes con CPRC a base de abiraterona y prednisona con taxanos o sin estos prolonga marcadamente la expectativa de supervivencia. Este beneficio no se debe solamente al papel de abiraterona, sino más bien a la combinación de abiraterona con quimioterapia (docetaxel, cabazitaxel, vinorelbina), y en ocasiones con enzalutamida.
La magnitud de efecto de abiraterona en la mejora de la supervivencia libre de progresión es muy notable (7,6+/-6,8 meses), con mínimos efectos adversos. Las principales limitaciones de este estudio son el carácter retrospectivo de la serie control y el escaso número y seguimiento de la serie de pacientes que reciben tratamiento activo. Otra limitación es el hecho de que debido al carácter restrospectivo del estudio no ha sido posible evaluar oportunamente la toxicidad del tratamiento en esta muestra. Por el contrario, la principal fortaleza del mismo supone el que se trata de una experiencia basada en la práctica clínica y el que se ajusta a la pauta de tratamiento multimodal más recomendado y actual en este tipo de pacientes. Según nuestra experiencia el triste pronóstico del CPRC está mejorando con respecto a los resultados que hace décadas se obtenían en el manejo de esta entidad, lo que únicamente puede lograrse con la colaboración de los distintos profesionales implicados en el tratamiento de estos pacientes. Es importante que los decisores de la salud tengan en cuenta este tipo de resultados para poder calcular de forma realista la eficiencia de las nuevas terapias.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónNinguna.
Conflicto de interésLos autores no presentan conflicto de intereses alguno con la publicación del manuscrito.