En la radioterapia de cabeza y cuello las glándulas salivales suelen recibir una dosis elevada de radiación, lo que provoca una disminución progresiva y, a partir de determinada dosis, irreversible de la secreción salival, entre otros efectos. La xerostomía o sensación de boca seca es el efecto secundario más frecuente tras la radioterapia de cabeza y cuello, el cual disminuye la calidad de vida de los pacientes al dificultar funciones como la fonación y la deglución. Dada la complejidad y la temprana aparición de este síntoma, su prevención es la solución más eficaz. Los avances de las últimas décadas tienen un papel imprescindible: la radioterapia de intensidad modulada, la administración de sustancias citoprotectoras y el autotransplante de glándula submandibular parecen limitar en cierta medida el efecto de la radiación y disminuir así la sensación de sequedad bucal.
Radiation therapy is a key component in the multidisciplinary treatment of head-and-neck malignancies. In these cases, salivary glands are irradiated with high-level doses, which, among other side effects, results in a progressive and irreversible decrease in the salivary output. Radiation-induced xerostomia is the most common side effect of the head and neck region after radiotherapy treatment, and highly impairs the patients’ long-term quality of life, threatening physiological functions, essentially speaking and swallowing. Given the complexity and early appearance of this symptom, its prevention is the most effective solution. In the past decades, the development of new radiation delivery techniques, such as intensity-modulated radiotherapy (IMRT), along with the administration of radioprotective drugs and autologous submandibular gland transplantation, seem to reduce the dose reaching the salivary glands, which in turn improves the patients’ perception of dry mouth.
El objetivo de la radioterapia en el cáncer de cabeza y cuello es obtener un control locorregional del tumor (evitando la diseminación o, en caso de que se haya producido, evitando las metástasis a distancia) limitando la toxicidad a los tejidos circundantes. Sin embargo, la íntima relación entre la neoplasia y las diversas estructuras anatómicas limita la capacidad de la radioterapia convencional de disminuir la dosis a los órganos adyacentes considerados de riesgo1.
En la radioterapia de cabeza y cuello, las glándulas salivales suelen recibir una dosis elevada de radiación, lo que provoca una disminución progresiva y, a partir de determinada dosis, irreversible, de la secreción salival, entre otros efectos. La capacidad humectante de la saliva se ve disminuida debido a cambios tanto cuantitativos como cualitativos, y todo ello contribuye a la aparición de xerostomía2. La xerostomía es el efecto secundario más frecuente tras la radioterapia de cabeza y cuello seguido de la mucositis3, y ambos disminuyen la calidad de vida de los pacientes al dificultar funciones como la fonación, la masticación y la deglución4, por lo que la prevención de su aparición resulta primordial.
El objetivo del presente trabajo es revisar la literatura de los últimos diez años respecto a la relación entre radioterapia y xerostomía.
Evolución histórica de la radioterapiaBernier et al.5 nos citan que el médico Emil Grubbe empleó las radiaciones ionizantes con intención terapéutica con el objetivo de controlar un carcinoma de mama en 1896, un año después del descubrimiento de los rayos X. En 1903, Albers-Schönberg demostró que las radiaciones podían provocar cambios subyacentes al lugar donde aparentemente se recibía el tratamiento. Aun así, no fue hasta el año 1911 que Bergonie describió por primera vez el daño radioinducido a las glándulas salivales6.
El tratamiento en radioterapia externa se planificaba inicialmente mediante radiografías, y el cálculo de la dosis se llevaba a cabo manualmente, de forma que esta no se repartía de manera uniforme. En la década de 1950, la introducción de la bomba de Co60 y los aceleradores lineales permitieron mejorar la distribución de la dosis5. La evolución de las tecnologías dio paso, a partir de 1970, al uso de técnicas tridimensionales (RT 3D), en las cuales las imágenes son obtenidas mediante tomografía computarizada (TC) y se incorporan complejos algoritmos informáticos para el cálculo de dosis que permiten una adaptación del campo a la forma del tumor1. Gracias a los avances de las últimas décadas, se desarrolló en 1990 la radioterapia de intensidad modulada (IMRT, del inglés Intensity-Modulated Radiotherapy), una forma avanzada de RT 3D que, mediante técnicas de optimización de dosis y el uso de colimadores multilámina, origina una distribución no uniforme de la intensidad del haz. Esta modalidad de radiación permite someter al tumor a una dosis mayor mientras que disminuye la exposición de los tejidos no afectados, reduciendo los efectos secundarios1,5. No obstante, la IMRT no tiene en cuenta las variaciones en forma y volumen que sufre el tumor a lo largo del tratamiento, por lo que se ha desarrollado la radioterapia adaptativa, la cual planifica la distribución de dosis durante el curso del tratamiento7.
Fisiopatología del daño radioinducidoPese a que las células acinares de las glándulas salivales tienen un recambio lento y están altamente diferenciadas, responden de manera aguda a la irradiación, tras solo una semana8. Su comportamiento, por tanto, sugiere un mecanismo de acción distinto al habitual, y la literatura disponible es extensa y no concluyente debido a la inexistencia de estudios en humanos. Inicialmente se creía que la radiación destruía las membranas de los gránulos de secreción de las células acinares, ocasionando salida de enzimas proteolíticas al citoplasma y desencadenando lisis celular9. Posteriormente se observó que los cambios degenerativos a nivel morfológico se producían en menos del 20% de las áreas examinadas, por lo que la anterior hipótesis quedó descartada. Con base en esto, los estudios posteriores intentan determinar cuál es el mecanismo responsable de la temprana reducción del flujo salival2,10.
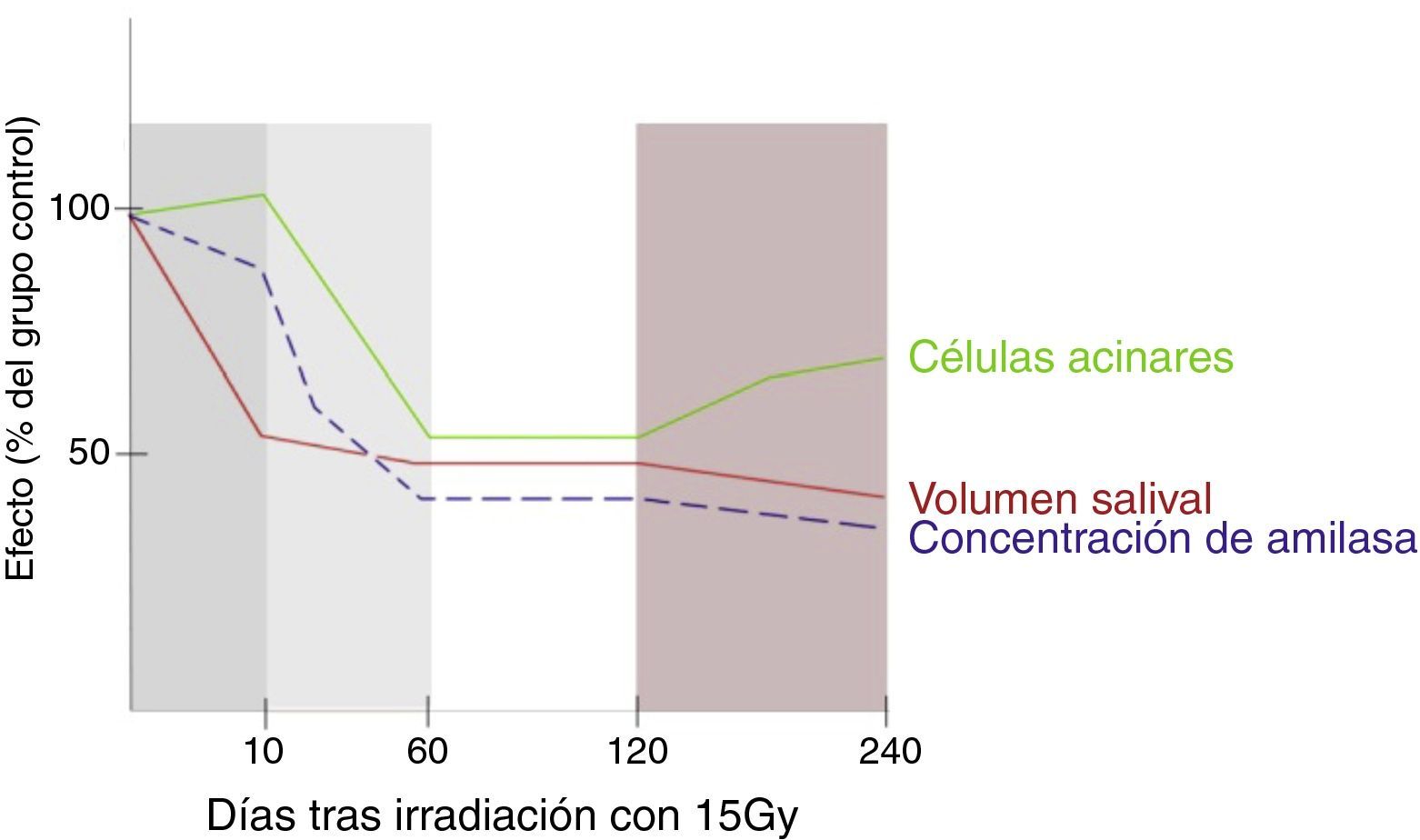
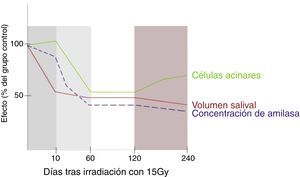
En 2001, Coppes et al.2 analizaron el volumen salival secretado por parótidas irradiadas, la concentración de amilasa y la morfología acinar (mediante microscopía óptica) en periodos comprendidos entre los 10 y 240 días tras la irradiación. Los cambios evolutivos observados fueron descritos en cuatro fases (fig. 1):
- 1.
Daño agudo (los 10 primeros días) donde se reduce la secreción salival sin verse afectada la concentración de amilasa o la morfología celular.
- 2.
Daño temprano (entre 10-60 días), en el cual disminuyen los niveles de amilasa salival y aparece edema intersticial interacinar.
- 3.
Daño intermedio (60-120 días) caracterizado por un inicio de fibrosis.
- 4.
Daño tardío (120-240 días), con un progresivo aumento de la fibrosis y también del número de células (hasta 30 células/acino, comparado con las 10 células en condiciones normales). Sin embargo, estas son más pequeñas y desorganizadas.
Fases del daño radioinducido. Adaptación de: Coppes et al.2.
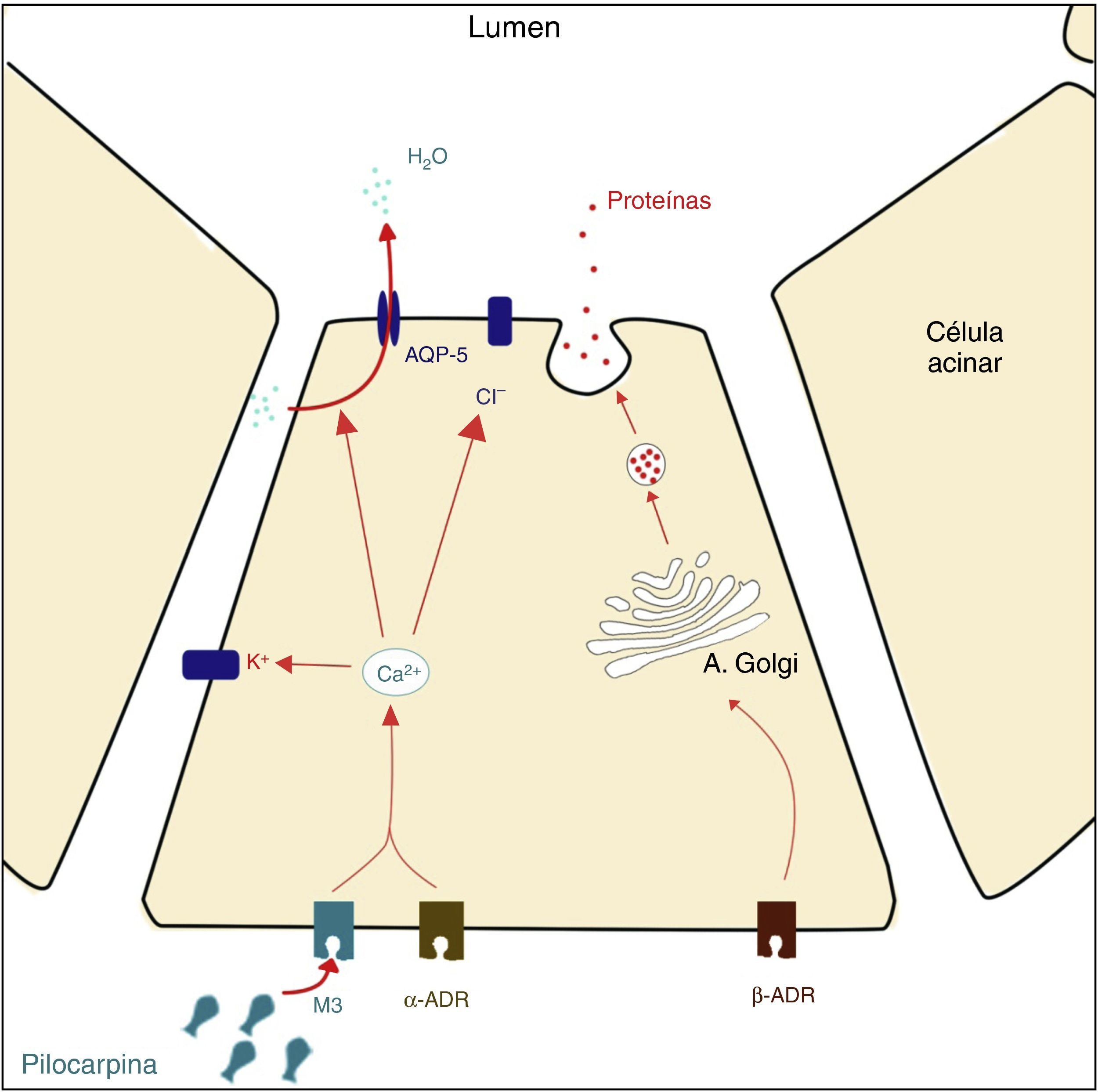
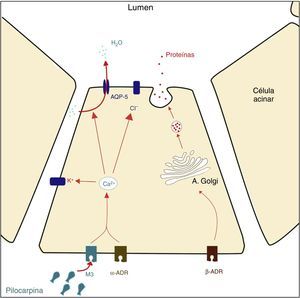
En condiciones normales, la secreción de agua y electrolitos de todas las glándulas salivales (ya sean mucosas, serosas o mixtas) es mediada por la unión de acetilcolina a los receptores muscarínicos M3 (y, en menor parte, por la unión de norepinefrina a los receptores α-adrenérgicos) de las células acinares. La cascada de reacciones provoca un aumento de la concentración intracelular de Ca2+, activando así el transporte activo de Cl− y Na+ al lumen, y la traslocación de acuaporina-5 (proteína transmembrana que permite el paso de agua a través de la célula) desde la membrana intercelular a la apical. El gradiente osmótico resultante estimula el transporte de agua del espacio basolateral hacia el lumen, gracias a la acción de esta proteína11.
El efecto temprano de la radioterapia parece provocar algún error en el proceso normal de señalización2,10–13. El número de receptores M3 de la membrana celular y la afinidad de sus ligandos no difieren significativamente de aquellos presentes en células normales13, pero se ha observado una disminución en la traslocación de acuaporina-5 a la membrana apical, pese a que el mecanismo por el cual esto sucede se desconoce y no es debido a un déficit en la liberación de Ca2+10,12.
La aplicación de factor de necrosis tumoral α (TNF α) a células epiteliales pulmonares in vitro parece reducir la expresión de AQP-5. Dado que el efecto de la irradiación aumenta la concentración de este factor en suero y tejidos, Asari et al.11 sugirieron que podría explicar la disminución en la translocación de AQP-5 en las glándulas salivales tras la radioterapia de cabeza y cuello, aunque esto no ha sido estudiado.
No obstante, la magnitud del daño producido en las glándulas se ve influenciada por diversos factores, no todos ellos dependientes de la dosis. Se ha visto que el uso concomitante de quimioterapia no parece influir en la aparición de xerostomía, pero la ingestión de medicamentos xerostomizantes podría agravar los síntomas8. Los fármacos más comúnmente asociados son: los antidepresivos tricíclicos, antipsicóticos, β bloqueantes y antihistamínicos14. Por otra parte, la respuesta a la irradiación podría no ser uniforme en toda la superficie de la glándula, existiendo zonas más radiosensibles dentro de la misma. En trabajos realizados en ratas, la irradiación de la zona craneal de la parótida supone un efecto más perjudicial, ya que la saliva producida en la parte caudal es finalmente excretada en la mitad craneal, recorriendo toda la glándula8 y, pese a que la anatomía humana es más compleja, podría ocurrir un fenómeno similar8. Además, existe un reciente estudio que sugiere un riesgo mayor de presentar xerostomía tras la radioterapia en pacientes con polimorfismos en el gen XRCC3, que está implicado en la reparación celular15.
Medición clínicaEl grado de xerostomía producida por la radioterapia puede determinarse mediante cuestionarios que valoran la sintomatología, o bien por criterios objetivos, ya sean mediciones de la secreción salival (en reposo o estimulada) o técnicas de imagen (escintigrafía).
La calidad de vida son aquellos valores subjetivos de los efectos emocionales, sociales y funcionales que una enfermedad y su tratamiento tienen para el paciente16. El cuestionario sobre calidad de vida más extendido en pacientes con cáncer es el QLQ-30, desarrollado por los grupos RTOG/EORTC (Radiation Therapy Oncology group/European Organization for Research and Treatment of Cancer) e incorpora gran variedad de referencias sobre la funcionalidad y sintomatología en una escala categórica sobre calidad de vida general, la cual es transformada en puntuaciones del 1 al 100 para su análisis. Para los pacientes con cáncer de cabeza y cuello se diseñó el módulo QLQ-H&N35, que consiste en 35 preguntas que evalúan los síntomas y efectos secundarios del tratamiento, y analiza la presencia de sintomatología asociada a los dientes, apertura bucal, xerostomía, saliva espesa y tos17.
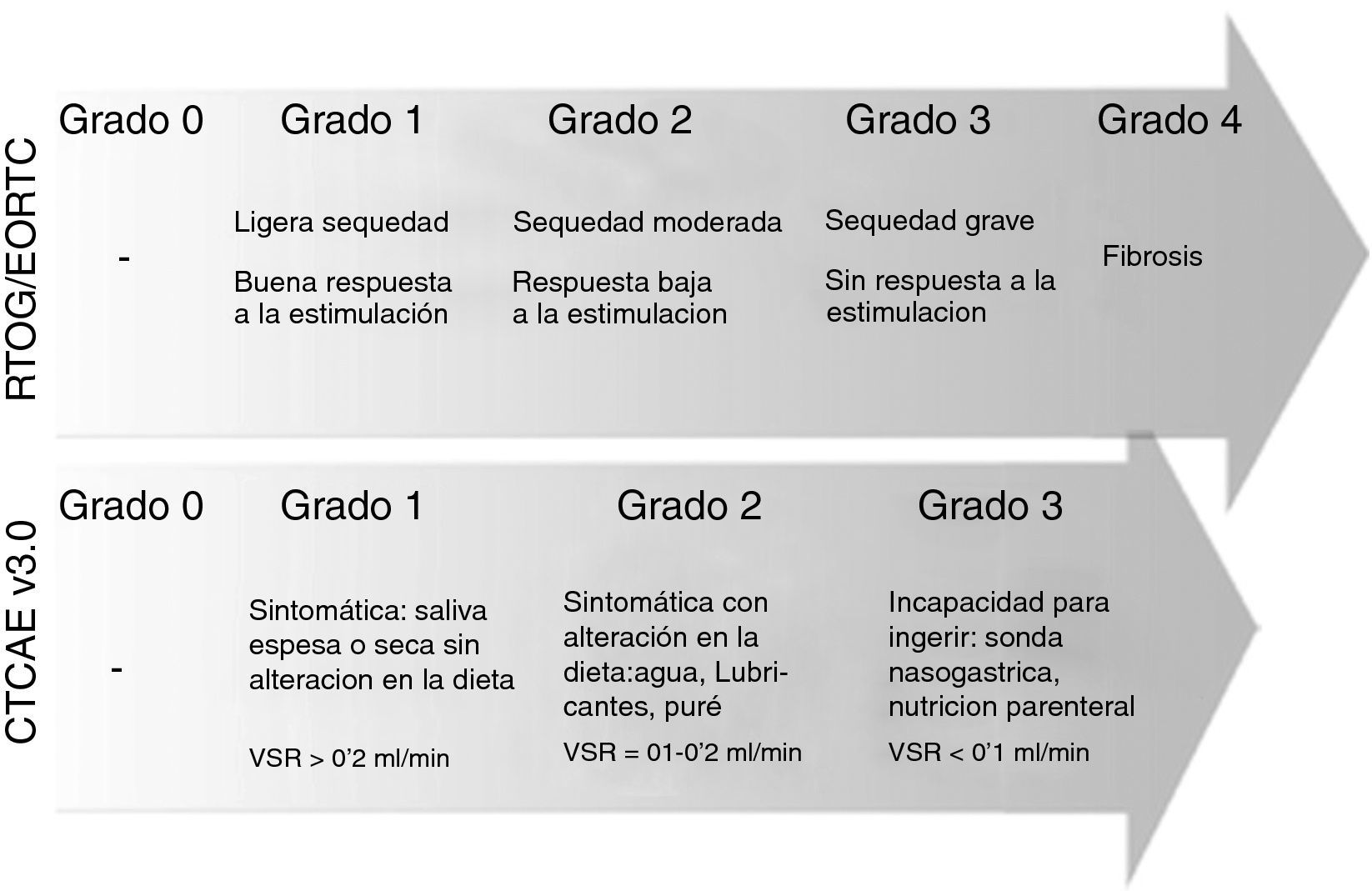
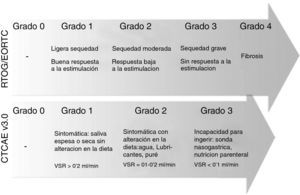
También cabe la posibilidad de utilizar escalas de toxicidad validadas por parte del profesional. La escala RTOG/EORTC, desarrollada por este grupo, publicó su primera versión en 1984, mientras que la escala CTCAE v3.0 (Common Terminology Criteria for Adverse Events, desarrollada por el National Cancer Institute) fue publicada en 2003 y modificada en su versión 4.0 en 2009, aunque la mayoría de estudios publicados utilizan la versión 3.0. (fig. 2). Ambas pueden ser consultadas en internet18,19.
Gravedad de la xerostomía según las escalas RTOG/EORTC y CTCAE v3.0. VSR=Volumen salival en reposo. Adaptación de https://www.rtog.org y http://ctep.cancer.gov.41,42
Los criterios objetivos para la medición de la función glandular incluyen sialometrías (en reposo o tras estimulación) o técnicas de imagen. La escintigrafía como técnica de imagen es un buen indicador de la función glandular y permite detectar valores muy bajos de reserva salival, aunque representa una técnica más invasiva que el TC o la resonancia magnética20. Su aplicación en pacientes con cáncer de cabeza y cuello con el fin de objetivar la función glandular ha sido utilizada en diversas ocasiones20,21, y consiste en la inyección de tecnecio-99 (Tc-99), tras lo cual se capturan imágenes mediante una gammacámara para registrar la actividad glandular. Si bien ambos métodos permiten registrar la actividad de la glándula parótida por separado y bajo distintas condiciones (estimulación o reposo), la escintigrafía es considerada un método más reproducible y exacto que la sialometría, ya que es capaz de detectar cambios en la función parenquimal de tan solo el 5-10%22. A través de las sialometrías también podemos detectar disminuciones en el flujo salival de manera más práctica. Hablamos de hiposialia o hiposecreción salival cuando el flujo salival total es menor de 0,1-0,2ml/min en reposo, o bien menor de 0,4-0,7ml/min en saliva total estimulada23.
No obstante, todavía no se ha definido el mejor método para registrar la sequedad bucal tras el tratamiento con radioterapia, y parece que mediante el uso de escalas subjetivas los profesionales tienden a subestimar la severidad de la xerostomía, por lo que existe una pobre correlación entre estos instrumentos clínicos de medida y la sensación real de sequedad que presenta el paciente24–26.
Prevención de la xerostomíaPreservar la función salival en pacientes sometidos a radioterapia constituye actualmente un reto pese a los avances tecnológicos y farmacológicos de los que disponemos. Gracias a las ventajas dosimétricas que ofrece la IMRT, es posible disminuir la dosis recibida por estas glándulas, lo que preserva su función, a menos que la extensión tumoral haga inevitable su exposición a la irradiación24. En el estudio de Pow et al.27, esta técnica no mostró ser superior a la radioterapia convencional en casos donde la parótida ipsilateral al tumor y las glándulas submandibulares recibían altas dosis de irradiación, lo cual refleja la importancia de la dosis sobre el efecto. En dosis no superiores a 25-30Gy, ocurre una recuperación de la salivación estimulada gradual28 y, en ocasiones, completa tras dos años29. No obstante, cuando esta glándula recibe una dosis media de 40Gy existe una probabilidad del 50% de reducir su función por debajo del 25% de los valores previos al tratamiento20. Por encima de esta dosis, la recuperación es casi inexistente, incluso transcurridos más de dos años del tratamiento29. Recientemente se ha sugerido una guía práctica clínica con el fin de reducir el riesgo de toxicidad, basada en la restricción de la dosis recibida por las glándulas parótidas. Se asume que la xerostomía grave puede reducirse si la dosis media a una glándula parótida no supera los 20Gy o si ambas glándulas reciben una dosis<25Gy30.
Sin embargo, una función parotídea normal no tiene por qué acompañarse de una disminución en la sensación de sequedad bucal (como se menciona en el apartado anterior). En este sentido, Dijkema et al.31 realizaron un seguimiento durante un año tras acabar el tratamiento y resaltaron la persistencia de xerostomía durante la noche pese a haber reducido significativamente la dosis a las glándulas parótidas, resultados similares a los obtenidos en los cuestionarios de dos estudios retrospectivos32,33. Esto es debido a que la dosis recibida por las glándulas submandibulares, sublinguales y menores es también un predictor de la xerostomía34 y, en el cáncer de cabeza y cuello, suele ser inevitable. Es por este motivo que, más allá de los avances técnicos en radioterapia, han sido estudiadas la amifostina y pilocarpina como fármacos con efecto radioprotector35–43, o el empleo de técnicas quirúrgicas (autotransplante de la glándula submandibular) para proteger las glándulas submandibulares6,44,45.
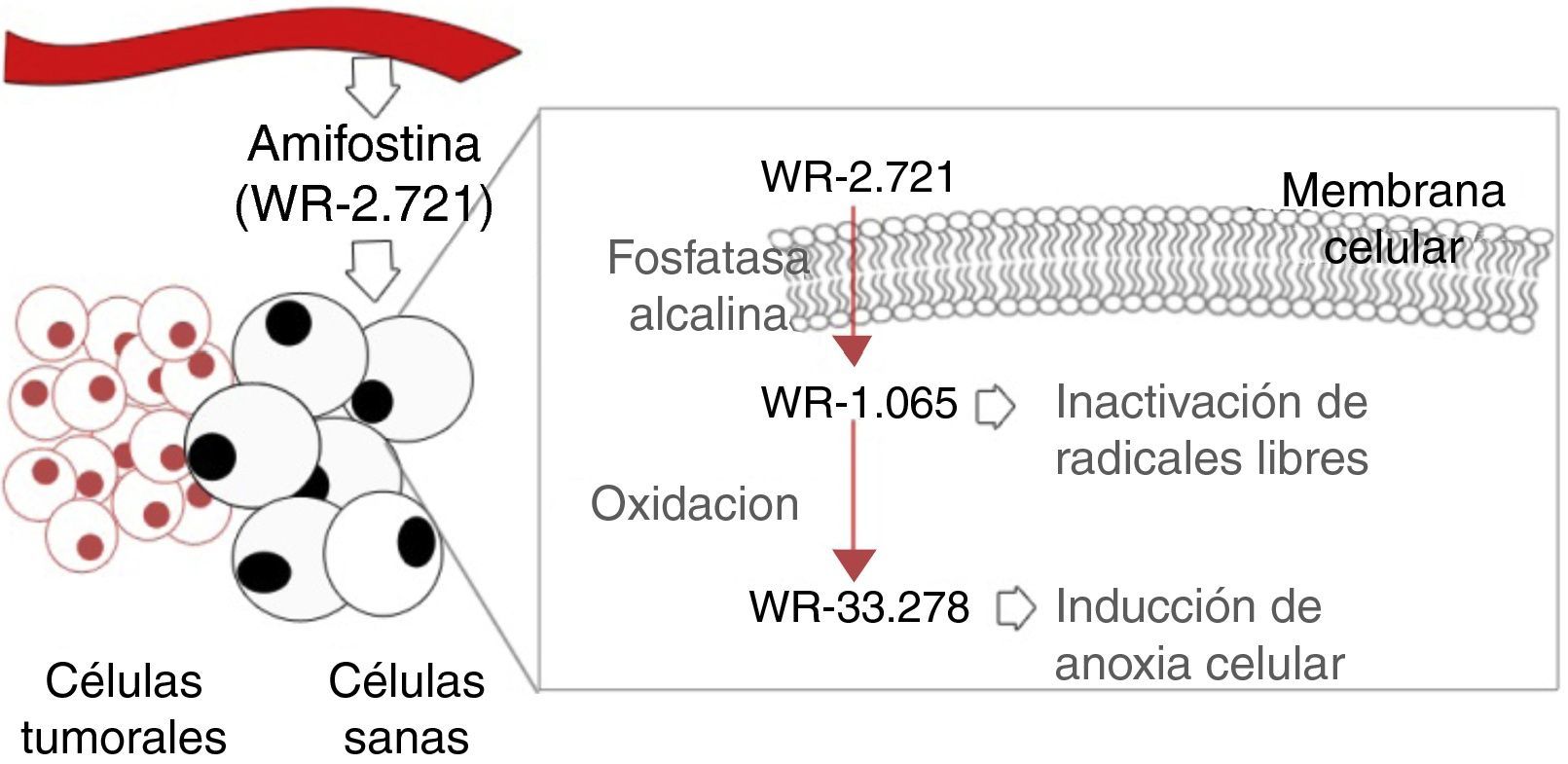
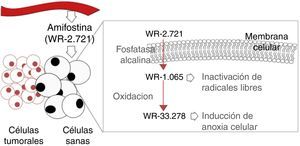
La amifostina (WR-2721) es un compuesto orgánico formado por un grupo aminotiol, conocido por su amplio efecto citoprotector. Este compuesto no puede actuar hasta que no es defosforilado y transformado a su metabolito activo (WR-1065) por medio de la fosfatasa alcalina. Tras su activación, se acumula en células sanas y ejerce su acción protectora inactivando los radicales libres e induciendo anoxia celular (evitando así el efecto fijador de lesiones moleculares provocado por el O2) (fig. 3)35,36. Su acumulación en células sanas es 100 veces mayor que en las tumorales, al presentar las últimas menos fosfatasa alcalina en la membrana celular, y un espacio intersticial ácido35. La administración endovenosa de 200mg/m2 de amifostina previa a cada sesión de irradiación parece ser efectiva en la conservación de la función parotídea según observaron Rudat et al.37 mediante escintigrafías en un estudio retrospectivo, y como también se menciona en la revisión de Kouvaris et al.36 Por otro lado, también parece efectiva en la reducción de otras toxicidades como la mucositis y la disfagia, aunque aquellos pacientes que realizan quimioterapia concomitante no parecen beneficiarse de este efecto protector38. Sin embargo, presenta un alto potencial de toxicidad, lo que genera efectos adversos graves como hipotensión, náuseas y reacciones alérgicas. En el estudio de Rades et al.39 tuvo que detenerse el tratamiento en el 41% de pacientes de una muestra de 39. Por el contrario, los pacientes parecen presentar menos efectos secundarios mediante la administración subcutánea junto con corticoides y premedicación antiemética, y siguiendo medidas de hidratación35.
A diferencia de la amifostina, la pilocarpina es un alcaloide natural que actúa generando un efecto parasimpaticomimético, al ser un agonista no selectivo de los receptores muscarínicos (fig. 4). El efecto, por tanto, es de estimulación de la función glandular, de forma que no bloquea el efecto de la irradiación, aunque su uso simultáneo a la radioterapia podría disminuir la aparición y gravedad de la xerostomía40. Su administración es por vía oral de tres a cuatro veces al día a una dosis de entre 5-10mg23, y la aparición de los efectos adversos es dosis-dependiente41, siendo estos los derivados del efecto colinérgico: náuseas, escalofríos, sudoración y dolor abdominal. En un estudio realizado en Japón por Nakamura et al.42, el 64% de pacientes presentaron sudoración tras el tratamiento con 5mg de pilocarpina, y solo el 47% de los pacientes de su estudio toleraron la administración, por lo que su uso sigue siendo controvertido. Los beneficios de este fármaco dependen de la dosis recibida por las glándulas irradiadas. En este sentido, Burlage et al.41 publicaron un ensayo clínico aleatorizado controlado con grupo placebo, y observaron una menor percepción de boca seca un año después del tratamiento en aquellos pacientes tratados con pilocarpina y cuya dosis sobre la glándula parótida era>40Gy. Por el contrario, si la dosis no excedía los 40Gy, no se observaba un efecto beneficioso de la pilocarpina en comparación con el grupo placebo. Además, la pilocarpina parece ser más efectiva si se da desde el inicio del tratamiento con radioterapia, y no tras haberlo finalizado, por lo que podría tener un efecto preventivo43.
Esquema sobre la acción de la pilocarpina sobre la secreción de agua y electrolitos en las células acinares. A. Golgi=aparato de Golgi. M3=receptor muscarínico M3. α-ADR=receptor α-adrenérgico. β -ADR=receptor β-adrenérgico. Adaptación de Konings et al.35
Como última medida de protección, Seikaly et al.44 publicaron en 2001 una nueva técnica quirúrgica consistente en autotransplantar la glándula submandibular contralateral al tumor, al espacio submental, en pacientes sin metástasis ganglionares (N0). En esta cirugía, se transfiere la glándula mediante suturas reabsorbibles y es marcada en su borde posterior e inferior mediante un alambre del calibre 25 (aproximadamente 0,5mm de diámetro) con tal de ser identificada radiográficamente. Si bien la seguridad de este método frente a la aparición de recurrencias locorregionales ha sido discutida, un reciente metaanálisis6 concluyó que no existe un mayor riesgo de recurrencia y que podría reducir hasta un 69% el riesgo de xerostomía a corto plazo y un 81% a largo plazo. Durante esta cirugía, puede resultar dañada la glándula submandibular, con lo que no se consigue conservar su función intacta. Aun así, parece ser más efectivo que la administración oral de pilocarpina45.
La xerostomía (como síntoma) y la hiposialia (como signo) son los efectos secundarios más frecuentes de la radioterapia de cabeza y cuello. Como consecuencia de la hiposialia, los pacientes deben modificar su dieta con tal de mantener una nutrición e hidratación adecuadas. Esto, junto con las limitaciones funcionales postquirúrgicas y otros efectos secundarios derivados de la radioterapia y quimioterapia (entre ellos fibrosis muscular y mucositis), limita la calidad de vida de estos pacientes.
Pese a los avances de las últimas décadas, que han permitido reducir las dosis recibidas por las glándulas salivales y cavidad oral (en mayor medida gracias a la IMRT), la respuesta de estas a la irradiación es compleja y posiblemente multifactorial, por lo que no existe un tratamiento curativo completamente eficaz y los esfuerzos van enfocados a la prevención, siempre que sea posible por la localización y estadio del tumor.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.