La terapia antiplaquetaria dual (DAPT) con ácido acetilsalicílico más un inhibidor del receptor plaquetario para ADP, el P2Y12, es fundamental para evitar la trombosis posterior a una angioplastia balón o a la angioplastia con implantación de un stent. El principal riesgo de la DAPT es el sangrado. La duración de la terapia DAPT depende de la evaluación integral entre el riesgo de las complicaciones trombóticas isquémicas y el de sangrado del paciente. Las guías de manejo de las diferentes sociedades recomiendan, según la condición clínica, una duración de tratamiento dual de mínimo seis meses, idealmente un año en el paciente con síndrome coronario agudo.
Dual antiplatelet therapy (DAPT) with acetylsalicylic acid plus a platelet ADP P2Y12 receptor inhibitor is key in avoiding thrombosis following balloon angioplasty, or angioplasty with stent implantation. The main risk of DAPT is bleeding. The length of DAPT treatment depends on the comprehensive assessment of the patient's risk of thrombotic-ischemic complications and risk of bleeding. Depending on the clinical condition, treatment guidelines from the various societies recommend at least six months of dual treatment (and ideally one year), in patients with acute coronary syndrome.
Desarrollar un consenso de aproximación en el uso de la terapéutica de los antiagregantes plaquetarios en la enfermedad coronaria en sujetos adultos, con el objetivo de unificar criterios diagnósticos y manejo en los servicios de Cardiología intervencionista de Colombia, a fin de cumplir metas de calidad y reunir lo recomendado por la literatura actual.
AlcanceLos servicios de Hemodinamia y Cardiología intervencionista son parte de las instituciones de salud públicas y privadas con alto nivel de complejidad. En estos se realizan procedimientos diagnósticos invasivos en sujetos sintomáticos de enfermedad coronaria, y se ofrece el respectivo manejo intervencionista como parte integral del tratamiento de la enfermedad coronaria. Por consiguiente, se requiere que los procedimientos estén estandarizados con el fin de aplicarlos con parámetros de calidad en Colombia.
Definiciones- •
Agregación plaquetaria: proceso fisiológico compuesto por tres fases: adhesión, activación y agregación de las plaquetas en respuesta a una lesión de pared vascular y con la formación de un trombo como resultado final.
- •
Antiagregante plaquetario: medicamentos que interrumpen este proceso fisiológico en alguna de sus fases.
Profesionales de Salud Médicos con formación en Hemodinamia y Cardiología intervencionista, cardiólogos clínicos debidamente certificados para ejecutar su ejercicio en el territorio colombiano.
DesarrolloPoblación objetoPacientes con edad igual o mayor a 18 años que tengan enfermedad coronaria conocida, que hayan sido receptores de stent coronario y en quienes se deba administrar terapia antiplaquetaria de acuerdo con lo definido en este documento.
MetodologíaSe realizó una revisión bibliográfica teniendo en cuenta las guías presentadas por European Heart Society – European APCI, American Heart Association, American College of Cardiology, Society SCAI, Sociedad Latinoamericana de Cardiología Intervencionista, y portales como TCTmd y PCR online, de los que se toman elementos para adaptarlos al entorno del país.
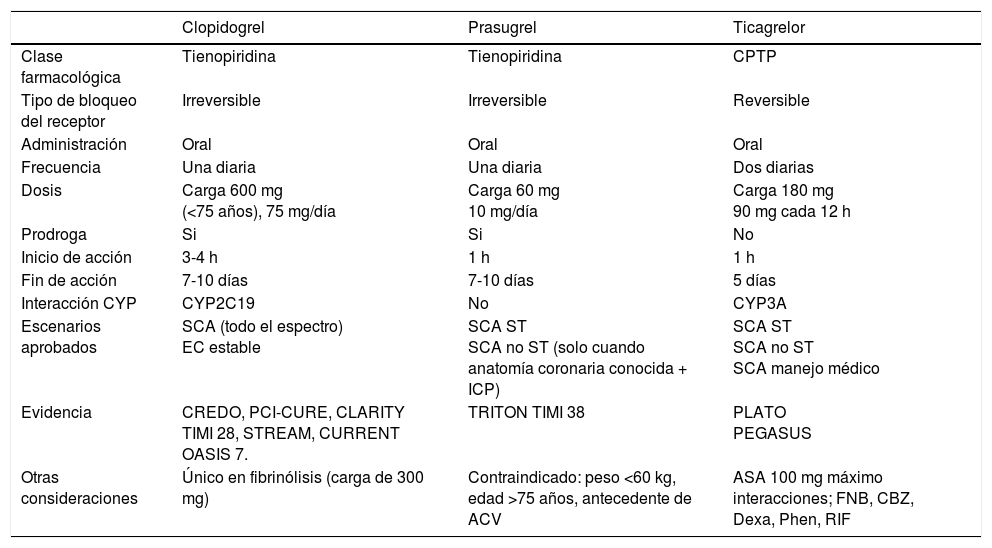
Medicamentos antiplaquetariosLa terapia antiplaquetaria dual (DAPT) con ácido acetilsalicílico (ASA) más un inhibidor del receptor plaquetario para el adenosin difosfato (ADP) denominado P2Y12, es fundamental para evitar la trombosis que se puede generar posterior a la realización de una angioplastia balón o a la angioplastia con implantación de un stent. Hoy en día se cuenta en Colombia con tres moléculas que inhiben el receptor P2Y12; dos son del tipo de fármacos denominados tienopiridinas, que lo inhiben de forma irreversible (clopidogrel y prasugrel) y una que lo bloquea de forma reversible (ticagrelor), cada una con diferentes características de farmacocinética, farmacodinamia e intensidad (tabla 1).
Características y evidencia clínica de los tres principales inhibidores P2Y12
| Clopidogrel | Prasugrel | Ticagrelor | |
|---|---|---|---|
| Clase farmacológica | Tienopiridina | Tienopiridina | CPTP |
| Tipo de bloqueo del receptor | Irreversible | Irreversible | Reversible |
| Administración | Oral | Oral | Oral |
| Frecuencia | Una diaria | Una diaria | Dos diarias |
| Dosis | Carga 600 mg (<75 años), 75 mg/día | Carga 60 mg 10 mg/día | Carga 180 mg 90 mg cada 12 h |
| Prodroga | Si | Si | No |
| Inicio de acción | 3-4 h | 1 h | 1 h |
| Fin de acción | 7-10 días | 7-10 días | 5 días |
| Interacción CYP | CYP2C19 | No | CYP3A |
| Escenarios aprobados | SCA (todo el espectro) EC estable | SCA ST SCA no ST (solo cuando anatomía coronaria conocida + ICP) | SCA ST SCA no ST SCA manejo médico |
| Evidencia | CREDO, PCI-CURE, CLARITY TIMI 28, STREAM, CURRENT OASIS 7. | TRITON TIMI 38 | PLATO PEGASUS |
| Otras consideraciones | Único en fibrinólisis (carga de 300 mg) | Contraindicado: peso <60 kg, edad >75 años, antecedente de ACV | ASA 100 mg máximo interacciones; FNB, CBZ, Dexa, Phen, RIF |
CPTP: ciclopentil–tiazolo-pirimidina, ATP: adenosina trifosfato. SCA ST: síndrome coronario agudo con elevación del ST, SCA no ST: síndrome coronario agudo sin elevación del ST, EC: enfermedad coronaria estable, ICP: intervención coronaria percutánea, ACV: ataque cerebrovascular, FNB: fenobarbital, CBZ: carbamazepina, Phen: fenitoína, RIF: rifampicina.
El principal riesgo de la terapia dual antiplaquetaria (DAPT) es el sangrado, el cual está en función de variables como enfermedad renal, hepática, hematológica, o la anticoagulación. Las guías de manejo de las diferentes sociedades recomiendan, según la condición clínica, que el tratamiento dual debe mantenerse mínimo por seis meses, idealmente un año. Sin embargo, la duración de la terapia DAPT, dependerá del balance entre la disminución de complicaciones trombóticas isquémicas y el riesgo de sangrado derivado de la intervención.
Existe otro inhibidor P2Y12 que ha sido evaluado en ensayos clínicos, el cangrelor, es una molécula que se comporta como análogo no tienopiridínico de la adenosina trifosfato (ATP), bloqueando de forma reversible el receptor P2Y12. Se administra por vía endovenosa mediante la aplicación de un bolo de 30 mcg/kg seguido de una infusión de 4 mcg/kg/min durante la duración del procedimiento. Debido a que es un metabolito activo de administración endovenosa, su inicio de acción es a los dos minutos, con vida media corta de tres a seis minutos. La función plaquetaria se normaliza 30 a 60 minutos posterior a su suspensión.
La efectividad y seguridad del cangrelor fue evaluada en el estudio CHAMPION PHOENIX1, en el que se demostró reducción de eventos isquémicos (incluyendo trombosis de stent) durante la ICP sin incremento de sangrado mayor. El análisis conjunto de los estudios CHAMPION (PCI)2, PLATFORM3, PHOENIX1 demostró reducción de complicaciones trombóticas durante la intervención percutánea a expensas de aumento en las tasas de sangrado.
La utilidad del cangrelor está dada por los casos en que se requiera inhibición plaquetaria rápida, predecible, profunda pero reversible; por ejemplo, en síndrome coronario agudo que llegan a la sala de cateterismo y que aún no reciben inhibidor P2Y12. Es de anotar que durante el procedimiento, según la anatomía coronaria documentada y la estrategia de revascularización a realizar, se deberá seleccionar el inhibidor P2Y12 con el que se continuará una vez finalice la infusión de cangrelor.
Recomendación para seleccionar un inhibidor P2Y12Con base en la evidencia disponible y las guías de manejo internacionales, en el contexto del síndrome coronario agudo con y sin elevación del ST, se recomienda la combinación de ASA junto con ticagrelor, o ASA junto con prasugrel por encima de la combinación ASA más clopidogrel. La selección del inhibidor P2Y12 se debe hacer de forma individualizada teniendo en cuenta las características de la población que fue analizada en los estudios PLATO4 y TRITON TIMI 385 y una vez se hayan descartado contraindicaciones o condiciones de alto riesgo de sangrado.
Si en la fase aguda no se dispone de ticagrelor ni de prasugrel entonces se administrará la dosis de carga de clopidogrel de 600mg seguido de una dosis de mantenimiento de 75mg día, excepto en los mayores de 75 años en quienes no está recomendado dar el bolo. Si posteriormente, durante la fase aguda de la hospitalización, se logra la consecución de ticagrelor, es posible reemplazar el clopidogrel por esta molécula siguiendo las recomendaciones que se mencionan más adelante4.
Con relación a la selección de prasugrel se debe tener en cuenta que, en el estudio TRITON TIMI 385, en los sujetos con peso menor a 60kg y en aquellos con edad mayor a 75 años, o con antecedente de evento cerebrovascular se documentó un riesgo mayor de sangrado que supera el beneficio antitrombótico.
En el contexto de síndrome coronario agudo sin elevación del ST es necesario conocer la anatomía coronaria y definir la susceptibilidad de manejo percutáneo antes de la administración del prasugrel6.
Por su parte, en el contexto de enfermedad coronaria estable, la evidencia está a favor de una terapia antiplaquetaria dual con ASA más clopidogrel. Ningún ensayo clínico evaluó la eficacia de ticagrelor o prasugrel en pacientes con enfermedad coronaria estable llevados a intervención percutánea; estos pudieran ser útiles en pacientes cuidadosamente seleccionados con un perfil isquémico alto que supere al riesgo de sangrado.
Indicaciones para el inicio o cambio del inhibidor P2Y12La población y el momento adecuado para iniciar la administración del inhibidor P2Y12 debe ser tal y como fue diseñada en el ensayo clínico que llevó a su aprobación; el empleo de clopidogrel y ticagrelor es una indicación de uso inmediato en el servicio de urgencias; por el contrario, el prasugrel depende de la documentación previa de la anatomía coronaria y de que se decida la necesidad de intervención percutánea.
El único escenario de cambio de P2Y12 que ha sido evaluado en un estudio clínico con suficiente poder estadístico es el de clopidogrel por ticagrelor. Si bien es cierto que el estudio PLATO4 no tenía por objetivo analizar la eficacia y seguridad de esta transición, es necesario reconocer que el 50% de los pacientes que fueron aleatorizados a recibir ticagrelor ya habían sido tratados previamente con una carga de 300 a 600mg de clopidogrel. Los resultados demostraron que este diseño no afectó la eficacia ni la seguridad del ticagrelor.
Respecto al prasugrel es necesario recordar que por el diseño del TRITON TIMI 38 el pretratamiento con clopidogrel era un criterio de exclusión. Sin embargo, existen registros con resultados que demuestran que el cambio de clopidogrel por prasugrel es seguro7–9.
A la fecha no existen ensayos clínicos que evalúen otros escenarios de intercambio de uso entre inhibidores P2Y12 (clopidogrel por prasugrel, prasugrel por ticagrelor, ticagrelor por prasugrel o de los más nuevos hacia el clopidogrel). Al no disponer de evidencia clínica con suficiente poder estadístico que demuestre la seguridad y eficacia de estas transiciones, no se puede generar una recomendación y estimular su uso en la práctica rutinaria, sin embargo, debido a los distintos escenarios clínicos que pueden obligar a un cambio de P2Y12 (reacciones adversas, efectos secundarios, necesidad de anticoagulación oral), se han sugerido unas recomendaciones con base en el perfil de farmacodinamia de estos medicamentos:
- •
En la fase aguda del síndrome coronario agudo (hospitalización), si se desea reemplazar el clopidogrel, se recomienda suspender el medicamento y administrar, independiente de la última dosis, la dosis de carga del nuevo P2Y12 (180mg de ticagrelor o 60mg de prasugrel) para luego continuar con la dosis de mantenimiento establecida (90mg cada 12 horas de ticagrelor o 10mg día de prasugrel).
Si el objetivo es reemplazar el ticagrelor o el prasugrel por clopidogrel se recomienda suspender estos medicamentos y a las 24 horas administrar la dosis de carga de 600mg de clopidogrel, para luego continuar la dosis de mantenimiento establecida (75mg día de clopidogrel).
- •
Si el objetivo es reemplazar el ticagrelor por el prasugrel (o viceversa), se recomienda suspender el medicamento y 24 horas después administrar la dosis de carga del nuevo P2Y12 a utilizar, para luego continuar con la dosis de mantenimiento establecida.
- •
En la fase posterior al egreso hospitalario, cualquier cambio que se realice entre los distintos inhibidores P2Y12 requiere de la suspensión del primer medicamento 24 horas antes del inicio del nuevo a la dosis de mantenimiento establecida, sin necesidad de dosis de carga.
El cambio de clopidogrel por ticagrelor tiene una recomendación clase I con nivel de evidencia B en la última versión del consenso europeo de terapia antiplaquetaria dual en enfermedad coronaria. Cualquier otro cambio entre P2Y12 por las razones anteriormente expuestas, tiene una recomendación menor (IIB con nivel de evidencia C).
Utilidad de las escalas de riesgo en terapia dualEn un paciente que reciba DAPT es importante reconocer el perfil de riesgo de isquemia y sangrado.
Las variables que identifican un perfil de riesgo isquémico alto son10: edad avanzada, antecedente de infartos previos, recurrencia de síndrome coronario agudo en presencia de DAPT, enfermedad arterial obstructiva periférica, insuficiencia renal crónica, diabetes mellitus, enfermedad coronaria multivaso, stent con mala aposición, presencia de múltiples stent, stent de longitud considerable, stent en vasos de pequeño calibre, reestenosis intrastent, presencia de dos stent en bifurcación, presencia de stent medicados liberadores de paclitaxel y armazones bioabsorbibles.
Como perfil isquémico bajo están: enfermedad coronaria estable, síndrome coronario con troponina negativa, enfermedad coronaria de un vaso o presencia de stent de corta longitud en vaso con gran calibre, stent metálico convencional y stent medicado libre de polímero.
Igualmente se reconocen las variables que constituyen un perfil de riesgo de sangrado alto: diátesis hemorrágica, sangrado previo en presencia de DAPT, disfunción hepática, disfunción renal, edad avanzada, bajo peso, género femenino, diabetes, anemia, trombocitopenia, anticoagulación crónica con antagonista de la vitamina K o anticoagulantes directos, uso crónico de antiinflamatorios no esteroides o esteroides.
A todos los pacientes se les debe establecer el riesgo de sangrado con DAPT11 para lo cual se han propuesto algunas escalas como DAPT y PRECISE-DAPT; se reconoce que su implementación facilita la decisión al momento de establecer la duración del tratamiento.
La escala DAPT se desarrolló a partir de los 11.648 pacientes incluidos en el estudio DAPT y posteriormente validado en los 8.136 pacientes enrolados en el estudio PROTECT12. Esta escala analiza nueve variables (edad, función ventricular izquierda reducida, stent en injerto venoso, infarto de miocardio, -IM-, antecedente de infarto de miocardio o de intervención percutánea, diabetes, stent con diámetro menor a 3mm, tabaquismo, stent liberador de paclitaxel). Es de anotar que esta escala aplica para pacientes con los criterios de inclusión del estudio DAPT, quienes hayan recibido stents medicados de segunda generación.
La escala DAPT establece un puntaje entre -2 a+10, un puntaje de alto riesgo para eventos isquémicos corresponde a un valor>2, en quienes una prolongación de la DAPT por 30 meses ofreció una reducción del desenlace compuesto de infarto de miocardio/trombosis de stent/eventos cardiovasculares con un número necesario para tratar de 34, con un incremento discreto en el riesgo de sangrado y un número necesario para causar daño de 272. Por otro lado, un puntaje de riesgo bajo corresponde a un valor<2 y en estos casos se demostró que la prolongación de la terapia DAPT no ofreció ningún beneficio en términos de reducción de riesgo para eventos isquémicos, mientras que sí aumentó de forma significativa la presencia de sangrado mayor con un número necesario para causar daño de 64.
La escala PRECISE-DAPT (PREdicting bleeding Complications In patients undergoing Stent implantation and subsEquent Dual Anti Platelet Therapy)13 se desarrolló a partir del análisis de 14.963 pacientes con enfermedad coronaria sometidos a ICP de forma electiva o urgente. Incluye cinco variables (edad, depuración de creatinina, hemoglobina, conteo de leucocitos, antecedente de sangrado espontáneo), que establecen un puntaje entre 0 y 100 permitiendo determinar el riesgo de sangrado con la terapia DAPT posterior al egreso hospitalario.
El rendimiento de la escala PRECISE-DAPT se validó en una cohorte de los pacientes incluidos en el estudio PLATO (8.595 pacientes) y en el registro BernPCI (6.172 pacientes). Un puntaje mayor a 25 demostró que la DAPT prolongada no ofrece reducción en el riesgo de nuevos eventos isquémicos sino por el contrario, aumenta el riesgo de sangrado con un número necesario para causar daño de 38, mientras que un puntaje<25 no incrementa el riesgo de sangrado, por el contrario, se asocia con reducción significativa del compuesto de infarto de miocardio, trombosis de stent, evento cerebrovascular y reintervención del vaso tratado (TLR) con un número necesario a tratar de 65. Con base en lo anterior, un paciente con un puntaje<25 sería candidato a DAPT de duración estándar (12 meses) o extendida (24 meses), mientras que en un paciente con un puntaje>25 se recomienda una DAPT de duración corta (tres a seis meses).
Duración de la DAPT¿Cuánto es lo mínimo?El definir un tiempo mínimo de uso de la DAPT dependerá no solo del perfil de riesgo del paciente sino del tipo de dispositivo que haya recibido para el manejo de su patología cardiovascular. La utilización de stents liberadores de medicamento, especialmente los de segunda generación, ha demostrado reducción de la tasa de reintervenciones de lesiones anteriormente tratadas gracias a la disminución del fenómeno de reestenosis intrastent14,15.
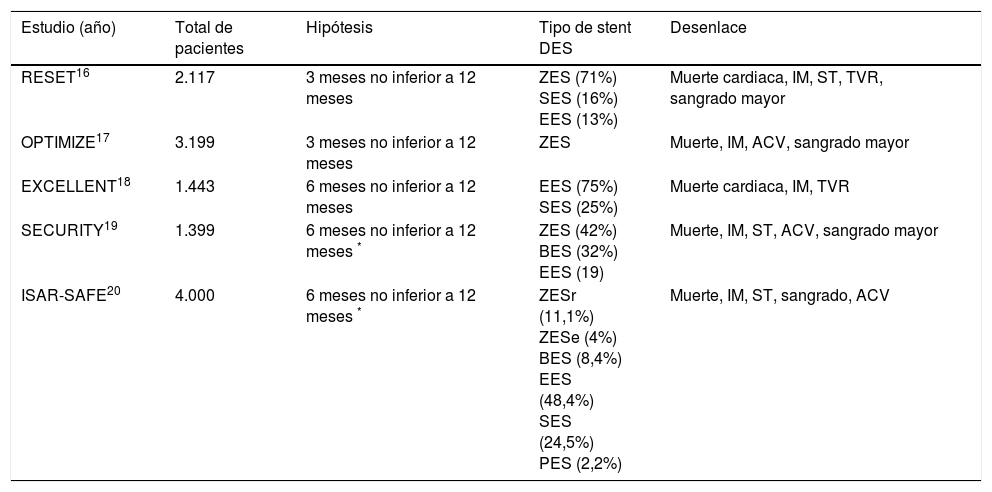
Con los estudios referenciados en la tabla 2, se determinó que la suspensión de la DAPT a los tres o seis meses fue no inferior a un tratamiento de doce meses en términos de desenlace de eficacia (compuesto de eventos isquémicos más sangrado mayor).
Estudios que evalúan duración de la terapia DAPT; duración corta (tres a seis meses), duración intermedia (doce meses), duración larga o extendida (más de 18 a 48 meses)
| Estudio (año) | Total de pacientes | Hipótesis | Tipo de stent DES | Desenlace |
|---|---|---|---|---|
| RESET16 | 2.117 | 3 meses no inferior a 12 meses | ZES (71%) SES (16%) EES (13%) | Muerte cardiaca, IM, ST, TVR, sangrado mayor |
| OPTIMIZE17 | 3.199 | 3 meses no inferior a 12 meses | ZES | Muerte, IM, ACV, sangrado mayor |
| EXCELLENT18 | 1.443 | 6 meses no inferior a 12 meses | EES (75%) SES (25%) | Muerte cardiaca, IM, TVR |
| SECURITY19 | 1.399 | 6 meses no inferior a 12 meses * | ZES (42%) BES (32%) EES (19) | Muerte, IM, ST, ACV, sangrado mayor |
| ISAR-SAFE20 | 4.000 | 6 meses no inferior a 12 meses * | ZESr (11,1%) ZESe (4%) BES (8,4%) EES (48,4%) SES (24,5%) PES (2,2%) | Muerte, IM, ST, sangrado, ACV |
ZES: stent medicado liberador de zotarolimus, ZESr: stent medicado liberador de zotarolimus plataforma resolute, ZESe: stent medicado liberador de zotarolimus plataforma endevour, SES: stent medicado liberador de sirolimus, EES: stent medicado liberador de everolimus, BES: stent medicado liberador de biolimus.
PES: Stent liberador de paclitaxel, DES 1ª.: stent medicado de primera generación, DES 2ª.: stent medicado de segunda generación, IM: infarto de miocardio, ST: trombosis del stent, TVR: reintervención del vaso tratado, ACV: ataque cerebrovascular.
Sin embargo, en cada uno de estos estudios se documentó menor tasa de eventos de lo esperado, lo cual reduce el poder estadístico de cada uno y el desenlace principal es un compuesto de eventos isquémicos y hemorrágicos que enmascaran el riesgo versus el beneficio de la intervención. Se debe tener en cuenta la condición clínica al momento de la intervención (enfermedad coronaria estable versus síndrome coronario agudo, el tipo de stent medicado (primera versus segunda generación) e individualizar el perfil de riesgo de cada paciente.
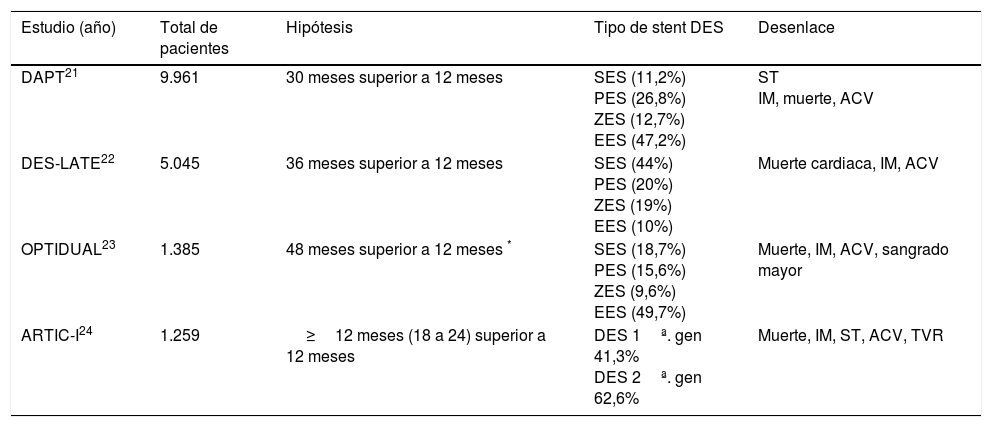
¿Cuánto es lo máximo?Con la premisa de que una DAPT extendida ofrecería protección contra la trombosis de stent tardía y muy tardía, además de prevenir nuevos eventos isquémicos secundarios a progresión de la enfermedad aterosclerótica sistémica, se planteó la necesidad de evaluar objetivamente la conveniencia de extender esta terapia (tabla 3).
Estudios que evalúan duración de la terapia DAPT; duración corta (tres a seis meses), duración intermedia (doce meses), duración larga o extendida (más de 18 a 48 meses)
| Estudio (año) | Total de pacientes | Hipótesis | Tipo de stent DES | Desenlace |
|---|---|---|---|---|
| DAPT21 | 9.961 | 30 meses superior a 12 meses | SES (11,2%) PES (26,8%) ZES (12,7%) EES (47,2%) | ST IM, muerte, ACV |
| DES-LATE22 | 5.045 | 36 meses superior a 12 meses | SES (44%) PES (20%) ZES (19%) EES (10%) | Muerte cardiaca, IM, ACV |
| OPTIDUAL23 | 1.385 | 48 meses superior a 12 meses * | SES (18,7%) PES (15,6%) ZES (9,6%) EES (49,7%) | Muerte, IM, ACV, sangrado mayor |
| ARTIC-I24 | 1.259 | ≥12 meses (18 a 24) superior a 12 meses | DES 1ª. gen 41,3% DES 2ª. gen 62,6% | Muerte, IM, ST, ACV, TVR |
ZES: stent medicado liberador de zotarolimus, ZESr: stent medicado liberador de zotarolimus plataforma resolute, ZESe: Stent medicado liberador de zotarolimus plataforma endevour, SES: Stent medicado liberador de sirolimus, EES: stent medicado liberador de everolimus, BES: stent medicado liberador de biolimus.
PES: stent liberador de paclitaxel, DES 1ª.: stent medicado de primera generación, DES 2ª.: stent medicado de segunda generación, IM: infarto de miocardio, ST: trombosis del stent, TVR: reintervención del vaso tratado, ACV: ataque cerebrovascular.
El estudio DAPT es el ensayo clínico con el mayor tamaño de muestra que evaluó la duración de la terapia DAPT; incluyó 9.961 sujetos con síndrome coronario o enfermedad coronaria estable que al cabo de 12 meses de DAPT estándar y en ausencia de eventos isquémicos o de sangrado fueron aleatorizados a recibir ASA+placebo vs. DAPT por 18 meses más (30 meses en total).
La prolongación de la DAPT se asoció con una reducción de la trombosis del stent (0,4% versus 1,4%; HR 0,29, IC 95%: 0,17-0,48, p<0,001), eventos cardiovasculares mayores (4,3% versus 5,9%; HR 0,71, IC 95%: 0,59-0,85, p<0,001) e infarto de miocardio (2,1% versus 4,1%, HR 0,47, p<0,001) pero con un incremento en el riesgo de muerte por cualquier causa (2,0% versus 1,5%, HR 1,36, IC 95%: 1,00 - 1,85, p=0,05) y de sangrado moderado a severo (2,5% versus 1,6%, p=0,001).
Los estudios DES –LATE, ARTIC-I y OPTIDUAL no demostraron superioridad en continuar la DAPT por un periodo de tiempo mayor a 12 meses.
Respecto a la DAPT extendida con inhibidores P2Y12 diferentes a clopidogrel solo un estudio, el PEGASUS TIMI 5425, evaluó la eficacia y la seguridad del ticagrelor hasta 33 meses después en 21.162 sujetos con enfermedad coronaria estable con antecedente de infarto de miocardio presentado 1 a 3 años antes de la aleatorización. Se implementó un diseño de no inferioridad con tres brazos en los que se comparó ticagrelor 90mg cada 12 horas, 60mg cada 12 horas y placebo a fin de evaluar un desenlace compuesto de muerte cardiovascular, infarto e ictus. Tanto la dosis de 90mg como la de 60mg redujeron el riesgo de presentar el desenlace primario (90mg; HR 0,85. 60mg; HR 0,84). Sin embargo y de forma concomitante, la intervención genera aumento en el riesgo de sangrado mayor TIMI no fatal, no intracraneal (2,6% para la dosis de 90mg y 2,3% para la dosis de 60mg). El análisis mostró finalmente beneficio en grupos de alto riesgo como diabéticos y en sujetos que tuvieran enfermedad arterial periférica concomitante.
Duración en enfermedad coronaria estableEn pacientes con enfermedad coronaria estable tratados mediante intervención coronaria percutánea con inserción de stent se recomienda mantener la DAPT por seis meses así como la administración de ASA más clopidogrel independiente del tipo de stent utilizado18,20,26. En pacientes con enfermedad coronaria estable tratados mediante angioplastia con balón liberador de medicamento se recomienda seis meses de DAPT27. En pacientes con enfermedad coronaria estable tratados con plataformas bioabsorbibles, se recomienda mantener la DAPT por mínimo 12 meses.
Sin embargo, si el paciente se clasifica en riesgo de sangrado alto (PRECISE-DAPT>25) la DAPT podría reducirse a tres meses16,17.
En contraste, si el paciente con enfermedad coronaria estable completa los seis meses de DAPT sin ningún tipo de complicación, pero presenta alto riesgo de nuevos eventos isquémicos y bajo riesgo de sangrado, se podría considerar extender la duración de la terapia DAPT hasta 30 meses28,29.
Duración en síndrome coronario agudoEn pacientes con síndrome coronario agudo tratados de forma percutánea, la duración de la terapia dual con ASA más inhibidor P2Y12 debe ser de 12 meses independiente del tipo de stent utilizado. Sin embargo, si el paciente está en riesgo alto de sangrado (PRECISE-DAPT>25), la duración de la terapia dual se puede reducir a seis meses.
En los casos en que se realizó angioplastia con armazón bioabsorbible se recomienda una duración no menor a 12 meses.
En quienes no fue posible realizar angioplastia percutánea ni cirugía de revascularización por la severidad de la enfermedad coronaria (manejo médico) se recomienda mantener la DAPT con ASA más clopidogrel o ticagrelor durante 12 meses. El prasugrel no demostró beneficio en este escenario30.
Si el paciente que presentó un síndrome coronario toleró de forma exitosa la DAPT durante los primeros 12 meses, se podría considerar extender la duración del tratamiento por más tiempo. Existe evidencia que pacientes con antecedente de infarto de miocardio, con alto riesgo de nuevos eventos isquémicos y que no hayan presentado sangrado al cabo de 12 meses de DAPT con ASA más ticagrelor 90mg cada 12 horas, podrían tener un beneficio adicional con prolongar la terapia antiplaquetaria con ASA más ticagrelor 60mg cada 12 horas hasta por 30 meses25,31.
DAPT en situaciones especialesFibrinólisis y DAPTEn el contexto de un infarto con elevación del segmento ST en el que se opte por la estrategia de reperfusión farmacológica (fibrinólisis), el único P2Y12 recomendado es el clopidogrel, a una dosis de carga de 300mg y posterior mantenimiento por un año a dosis de 75mg al día32,33.
Diabetes mellitus y DAPTEsta población de pacientes está expuesta a un mayor riesgo de eventos isquémicos fatales y no fatales, tanto en la enfermedad coronaria estable como en el síndrome coronario agudo. El fundamento fisiopatológico radica en que esta enfermedad tiene presente un estado de hiperreactividad plaquetaria aumentado. Desde el estudio CURE34 se demostró que se benefician de la DAPT tanto como los no diabéticos. En los estudios TRITON TIMI 38 y PLATO se demostró igualmente beneficio en este subgrupo, aunque sin un impacto superior al demostrado en los pacientes sin esta comorbilidad. Finalmente, la presencia de diabetes mellitus no debe influir en la selección del inhibidor P2Y12, ni tampoco en la duración de la terapia.
DAPT e inhibidores de la bomba de protonesEl clopidogrel es una prodroga que requiere del metabolismo hepático para su transformación en metabolito activo. La isoenzima CYP219 es la encargada de este proceso. Los inhibidores de la bomba de protones (IBP) también son metabolizados por las isoenzimas CYP. Esto conllevaría a que, en teoría, la administración simultánea de ambos grupos de medicamentos predispondría a una potencial inhibición de la CYP219 y en consecuencia una reducción en la efectividad del clopidogrel. Los estudios de farmacodinamia han demostrado que dentro de la familia de los IBP el omeprazol y el esomeprazol tendrían mayor interacción mientras que el lanzoprazol y el pantoprazol la menor. Desde el punto de vista de farmacodinamia nunca se han encontrado interacciones con ticagrelor ni con prasugrel.
En el ámbito clínico solo un estudio observacional sugirió que podría existir incremento en el riesgo de eventos isquémicos cardiovasculares con el uso concomitante de clopidogrel más IBP35. Sin embargo, ningún ensayo clínico que haya utilizado escalas de propensión ha demostrado dicha interacción negativa.
El COGENT36 ha sido el único estudio aleatorizado diseñado para evaluar el impacto clínico del uso simultáneo de clopidogrel (75mg día) y omeprazol (20mg día). Con un diseño que aseguró doble enmascaramiento, este estudio fase III incluyó pacientes que fueron llevados a angioplastia con implantación de stent en presencia de síndrome coronario agudo o enfermedad estable y que presentaran bajo riesgo de sangrado para DAPT. A pesar de que fue interrumpido de forma prematura por razones de financiación, se logró recolectar el 75% de la muestra calculada. Este estudio demostró que el uso simultáneo de clopidogrel y omeprazol no aumentó el riesgo de eventos adversos cardiovasculares (4,9%, IC 95%, 3,4–6,4%, en el grupo de omeprazol y 5,7%, IC 95% 4,0–7,3%, en el grupo placebo; p=0,98).
Teniendo en cuenta que la DAPT con ASA más ticagrelor o prasugrel conlleva mayor riesgo de sangrado gastrointestinal y que el perfil de seguridad de los IBP ha sido cuidadosamente estudiado en enfermedad coronaria con resultados favorables36, se recomienda el uso de IBP de forma concomitante con la DAPT independiente del tipo de inhibidor P2Y12 que se utilice.
Anticoagulación oral y DAPTLa DAPT es una intervención ampliamente estudiada, que ha demostrado gran seguridad con un riesgo de sangrado. Este desenlace de seguridad ha sido evaluado con diferentes escalas o criterios como los diseñados en los estudios del grupo TIMI o el GUSTO. A su vez, algunos estudios han definido criterios propios de sangrado mayor/menor y han analizado otras variables en relación con el sangrado tales como sangrado que amenaza la vida, sangrado fatal, sangrado intracraneal, sangrado no intracraneal, sangrado relacionado con cirugía de revascularización, sangrado no relacionado con revascularización y sangrado espontáneo.
En el estudio PLATO4 se documentó una incidencia de sangrado mayor no relacionado con cirugía por criterios de TIMI de 7,9% para ticagrelor más ASA y 7,7% para el clopidogrel más ASA, sin diferencias estadísticamente significativas entre ambas intervenciones.
Por otra parte, el estudio TRITON TIMI 3835men pacientes menores de 75 años, con peso mayor a 60kg y sin antecedente de ACV/AIT, evidenció una incidencia de sangrado mayor no relacionado a cirugía por criterios TIMI del 2% para prasugrel más ASA y de 1,5% para clopidogrel más ASA, sin significancia estadística.
La terapia anticoagulante oral ha demostrado buenos resultados en desenlaces de seguridad como sangrado mayor, sangrado menor y sangrado intra- y extracraneal.
En el estudio RELY37 la incidencia de sangrado mayor fue de 2,71% por año para dabigatrán 110mg, 3,11% por año para dabigatrán 150mg y 3,36% por año para warfarina. La reducción relativa de sangrado mayor con la dosis de 110mg fue del 20%, siendo estadísticamente significativa.
En el estudio ARISTOTLE38 el sangrado mayor se analizó utilizando los criterios de la Sociedad Internacional de Trombosis y Hemostasia ISTH (2,1% por año para apixabán versus 3,09% año con warfarina), criterios GUSTO (0,52% por año para apixabán versus 1,13% por año para warfarina) y criterios TIMI (0,96% por año para apixabán versus 1,69% por año para warfarina).
En el ROCKET AF39 el desenlace de seguridad sangrado se definió como un compuesto de eventos mayores y menores clínicamente relevantes con una frecuencia de presentación de 14,9 eventos por cada 100 pacientes/año para rivaroxabán y 14,5 eventos por cada 100 pacientes/año para pacientes aleatorizados a warfarina, sin que se demostrara diferencia estadísticamente significativa entre las dos intervenciones.
En pacientes llevados a angioplastia coronaria hasta un 8% de los casos pueden tener condiciones clínicas con indicación de terapia anticoagulante oral (fibrilación auricular, prótesis valvular mecánica, trombos intracavitarios, trombosis venosa profunda). El uso concomitante de terapia DAPT más anticoagulantes orales, en comparación con la sola terapia de anticoagulación, aumenta hasta tres veces el riesgo de complicaciones hemorrágicas37,40–43.
Siempre que haya indicación de iniciar anticoagulación se debe realizar un balance individualizado entre el perfil de riesgo isquémico y el riesgo de sangrado. La implementación de escalas de riesgo cardioembólico (CHA2DS2VASc) y de sangrado (HASBLED, ABC) permiten una selección rigurosa de los pacientes con fibrilación auricular que más se benefician de la anticoagulación oral.
En los casos de fibrilación atrial de origen no valvular, al iniciar la anticoagulación las guías actuales recomiendan el uso de un anticoagulante directo en lugar de la warfarina. En caso de usar esta última, se debe buscar un INR en límite inferior del rango terapéutico propuesto. El único inhibidor P2Y12 evaluado y aprobado en este escenario es el clopidogrel.
La terapia triple (ASA, clopidogrel y warfarina) se considera en quienes el perfil de riesgo de nuevos eventos isquémicos es superior al riesgo de sangrado. La terapia dual (clopidogrel más anticoagulación oral) se considera en aquellos casos en los que el perfil de sangrado es superior al riesgo de nuevos eventos isquémicos. El esquema propuesto es el siguiente:
- •
Si se opta por la terapia triple, esta debe utilizarse mínimo por un mes independiente del tipo de stent implantado y hasta por seis meses en pacientes con bajo perfil de sangrado, pero con alto riesgo isquémico derivado del síndrome coronario agudo o de las características anatómicas o del procedimiento43.
- •
Posterior a los seis meses se recomienda suspender uno de los dos antiagregantes plaquetarios para continuar con warfarina hasta por 12 meses.
- •
En pacientes cuyo riesgo de sangrado sea alto se puede optar por terapia triple durante el primer mes para luego continuar con warfarina más un antiagregante plaquetario (ASA o clopidogrel) por los siguientes 11 meses.
- •
En ambos escenarios, una vez se complete un año de la intervención percutánea se suspende el antiagregante plaquetario y se continúa sólo con warfarina.
La terapia dual con clopidogrel 75mg al día más anticoagulante oral (rivaroxabán 15mg al día, dabigatrán 110mg dos veces al día, warfarina) deberá ser considerada como alternativa a la terapia triple como fue evaluado en estudios como PIONEER AF-PCI44, RE-DUAL PCI45 o WOEST46. Esta terapia doble se implementa desde la intervención percutánea y se continúa hasta completar el primer año.
Recomendación del Consenso del Colegio Colombiano de Hemodinamia- •
La duración de DAPT no difiere si se trata de síndrome coronario agudo con ST o no ST (mínimo 6 meses, idealmente 12 meses).
- •
La prolongación de la terapia DAPT (18 a 36 meses) se decidirá de forma individualizada con base en el perfil de riesgo de isquemia (alto) / riesgo de sangrado (bajo).
- •
La implementación de la escala de riesgo de sangrado, como la derivada del estudio PRECISE-DAPT, podría ayudar a la toma de esta decisión.
- •
La dosis diaria de ASA sigue siendo indefinida.
- •
Hasta el momento no existe evidencia científica que demuestre el beneficio en desenlaces con el uso rutinario de pruebas de función plaquetaria o exámenes genéticos como guía para el uso de P2Y12, por lo que su uso no se recomienda.
Ninguno.