encontrar una relación entre los niveles de proteína C reactiva (PCR) y fibrinógeno, y la extensión de la aterosclerosis en el síndrome coronario agudo.
Métodosestudio observacional prospectivo, en el que se incluyeron 873 pacientes con síndrome coronario atendidos en un hospital entre 2016 y 2018. Se analizaron niveles de PCR y fibrinógeno, marcadores metabólicos y extensión de la aterosclerosis coronaria.
Resultadosno se halló correlación positiva entre los niveles de PCR y fibrinógeno y los marcadores metabólicos, así como tampoco con enfermedad de uno, dos y tres vasos (p 0,829; p 0,810).
Conclusioneslos niveles sanguíneos de PCR y fibrinógeno se relacionan con la tasa de eventos cardiovasculares, pero no se ha podido demostrar que exista relación entre estos y la severidad de la aterosclerosis coronaria.
To determine whether there is a relationship between C - reactive protein and fibrinogen levels and the extent of atherosclerosis in acute coronary syndrome.
MethodsA prospective observational study was conducted that include 873 patients with coronary syndrome treated in a hospital between the years 2016 and 2018. An analysis was made that included C - reactive protein and fibrinogen levels, metabolic markers, extent of coronary atherosclerosis.
ResultsNo positive correlation was found between the C - reactive protein and fibrinogen levels and the metabolic markers, nor with one, two, or three vessel disease (P=.829; P=.810).
ConclusionsAlthough blood C-Reactive Protein and fibrinogen levels are associated with the rate of cardiovascular events, this study was unable to demonstrate whether there is a relationship between these and the severity of the coronary atherosclerosis.
Es una proteína codificada por el gen PCR, localizado en el locus 1q21-q23 del cromosoma 1. Pertenece al grupo de las pentraxinas y está constituida por cinco subunidades idénticas, que conforman una estructura pentamérica estable con un peso molecular de 105 KD. Su síntesis es inducida en el hepatocito de manera reactiva a infecciones, inflamación subaguda/crónica o neoplasias, gracias a la mediación de citoquinas como IL-1, IL-6 y TNF-α1.
Es, además, el biomarcador inflamatorio más estudiado en la enfermedad cardiovascular. Esta proteína, además de opsonizar las bacterias en el seno de una infección aguda o subaguda, opsoniza las lipoproteínas de baja densidad (LDL), facilitando su adquisición por parte de los macrófagos en la placa de ateroma2.
Esta proteína incrementa la expresión de moléculas de adhesión de las células endoteliales (selectina-E, VCAM-1, ICAM-1)3 e induce la liberación de otras citoquinas proinflamatorias, tales como IL-6 e IL-8, que perpetúan el estado inflamatorio, así como reactantes de fase aguda positivos, como proteína sérica A. Asimismo, algunos estudios han demostrado su capacidad provasoconstrictora, ya que inhibe la actividad de la óxido-nítrico sintasa a nivel local4, y procoagulante, pues incrementa los niveles sanguíneos de protrombina y D-dímero en las cuatro horas posteriores a la infusión de PCR recombinante5.
Muchos estudios observacionales han sugerido la asociación entre los niveles altos de esta proteína, la prevalencia de lesiones ateroscleróticas y el riesgo de primer evento cardiovascular, así como recurrencia de los mismos. Algunos, incluso, determinan que el hallazgo de una cifra superior a 2,4mg/l duplica el riesgo de sufrir un evento coronario que con un nivel inferior al 1mg/l. Sin embargo, debido a que una PCR elevada puede tener múltiples causas, no es una prueba específica6–9. Hingorani et al. definieron una tasa de falsos positivos de 20, 10 y 5% cuando el punto de corte para la PCR en el seno de enfermedad cardiovascular se tomaba en 3,80; 6,65 y 9,74mg/dl respectivamente10. Aunque los niveles plasmáticos de proteína C reactiva parecen actuar como un predictor independiente de eventos cardiovasculares, el mayor valor predictivo positivo parece agregarse en el contexto de pacientes con riesgo cardiovascular intermedio11. Kaptoge et al., por su parte, sugirieron que la concentración plasmática de PCR presentaba una asociación lineal con muchos factores de riesgo convencionales12.
La elevación de la proteína C reactiva es cuantitativamente superior en pacientes con un síndrome coronario agudo (SCA) que en aquellos con ángor estable, lo cual sugiere que la inflamación de la pared arterial coronaria desempeña un papel importante en la inestabilidad de la placa de ateroma13–15.
Existe cierta controversia en la literatura médica sobre la correlación entre los niveles de PCR y la extensión de la lesión aterosclerótica a nivel coronario. Redberg et al. no demostraron correlación positiva entre los niveles de PCR y el “score” de calcio medido en angio-tomografía de arterias coronarias en una cohorte de mujeres postmenopáusicas asintomáticas16. Hunt et al., por su parte, tampoco demostraron relación significativa en idéntica medición en varones de entre 40 a 45 años, pertenecientes a la armada de Estados Unidos17. Tataru et al., sin embargo, realizaron un estudio observacional de casos y controles prospectivos, en el que analizaron 1.411 pacientes con antecedente reciente de infarto agudo de miocardio, a quienes les realizaron una coronariografía durante su seguimiento posterior (sin especificarse exactamente en qué momento del mismo), y encontraron que los niveles más altos de la PCR circulante se relacionaban con el número de arterias coronarias afectadas, sin diferencias significativas en cuanto a la severidad de la estenosis por la clasificación de DeBakey18.
En un estudio de características similares, realizado por Madsen et al., pero en el contexto de 269 pacientes con dolor torácico a estudio, equivalente anginoso posible o ángor de esfuerzo a quienes se les realizó coronariografía, se evidenció que los sujetos con coronarias sin lesiones angiográficamente significativas tenían niveles de PCR menores que aquellos con enfermedad de uno, dos o tres vasos (p<0,001). Sin embargo, cuando se compararon entre los grupos no se detectaron diferencias estadísticamente significativas19.
FibrinógenoEl fibrinógeno (factor I de la coagulación) se codifica por los genes FGA, FGB y FGG, situados todos ellos en el brazo largo del cromosoma 4 (4q28) y cuya expresión induce la transcripción de las cadenas alfa, beta y gamma respectivamente, que se combinan para formar el fibrinógeno funcional. En conjunto, se trata de una glicoproteína de 46 nanómetros de longitud y elevado peso molecular (340 kilodalton), que tiene una vida media de unas 100 horas, durante las cuales se degrada en dímeros de fibrina por la acción de la trombina, cumpliendo un rol fundamental en la inflamación aguda y subaguda y, sobre todo, en la hemostasia secundaria.
En la placa de ateroma, al igual que ocurría con la PCR, el fibrinógeno facilita la adquisición de las lipoproteínas LDL por los macrófagos e induce la expresión de moléculas de adhesión endotelial, fundamentalmente ICAM-120,21, incrementándose la permeabilidad vascular. De igual forma, se une al receptor IIb/IIIa de la superficie plaquetaria, con la consiguiente activación y agregación plaquetaria22 y liberación de citoquinas proinflamatorias, que perpetúan el estado inflamatorio y facilitan la migración de leiomiocitos de la túnica media arteriolar23.
Levenson et al. realizaron un estudio observacional en 1995 en el que incluyeron a 652 hombres de entre 40 y 60 años, con factores de riesgo, y midieron los niveles basales de fibrinógeno, sometiéndolos a ecografía doppler de arteria carótida interna, aorta abdominal y femoral. El análisis de regresión lineal múltiple demostró que existía una asociación independiente entre los niveles de fibrinógeno y la presencia y extensión de aterosclerosis a estos niveles24.
El estudio Northwick Park Heart analizó la aparición de eventos cardiovasculares en 1.510 pacientes varones de entre 40 y 64 años, en función de parámetros analíticos tales como niveles de colesterol, factor VII, VIII y I (fibrinógeno), con un tiempo de seguimiento de 7 a 13 años. El fibrinógeno fue factor de riesgo mayor para enfermedad arterial coronaria y tuvo, independientemente de la edad, mayor valor predictivo positivo para infarto de miocardio que el colesterol25,26.
El estudio Gothenburg incluyó 792 hombres de 54 años de edad media, y analizó la morbimortalidad cardiovascular y global a corto-medio plazo (13 años y medio de seguimiento). Se detectaron 92 casos de infarto de miocardio y 37 de ictus, mientras que el fibrinógeno se decantó como el principal predictor independiente de riesgo para infarto a corto y medio plazo27,28.
Finalmente, el estudio PROCAM examinó individuos del sexo masculino sin antecedentes personales de cardiopatía isquémica, de tal forma que el tercil superior de sus niveles (375mg/dl) demostró sensibilidad y especificidad cercana al 70% para el desarrollo de eventos cardiovasculares29,30.
Arnau et al. realizaron un estudio observacional prospectivo en el que incluyeron 325 pacientes consecutivos ingresados en un servicio de cardiología con sospecha de síndrome coronario agudo, dividieron los valores de fibrinógeno en terciles y evaluaron la incidencia de eventos cardiovasculares en cada estrato. El tercil de niveles de fibrinógeno superiores a 375mg/dl demostró mayor tasa de infarto de miocardio y mortalidad cardiovascular, o ambas, a mediano plazo (15 meses de seguimiento) (p<0,0001). Estos resultados se mantuvieron cuando ajustaron por factores de riesgo clásicos, como edad, angina previa y descenso del segmento ST al ingreso. De esta manera concluyeron que los valores elevados de fibrinógeno parecen asociar un peor pronóstico a corto y largo plazo en pacientes ingresados con sospecha de ángor inestable31.
MétodosEstudio observacional retrospectivo en el que se incluyeron pacientes con cardiopatía isquémica a quienes se les realizó coronariografía por síndrome coronario agudo sin elevación del segmento ST (SCASEST), síndrome coronario agudo con elevación del segmento ST (SCACEST) o infarto de miocardio evolucionado (dolor típico de más de 12 horas de duración, con criterios clínicos, analíticos y electrocardiográficos de infarto).
En la base de datos de trabajo de la unidad de hemodinámica del Hospital de Ciudad Real (centro de tercer nivel), se encontraban registradas en formato Excell 1.643 coronariografías realizadas entre los meses de enero de 2016 y enero de 2018. Estas coronariografías correspondían a pacientes que pertenecían a las Áreas Sanitarias de Ciudad Real, La Mancha Centro y Puertollano (poblaciones de Ciudad Real, Daimiel, Valdepeñas, Tomelloso...) y en quienes se sospechaba cardiopatía isquémica. De los 1.643 iniciales se seleccionaron 873 procedimientos realizados por síndrome coronario agudo. Se llevó a cabo un cálculo del tamaño muestral, en el cual, considerando una desviación típica de 5mg/dl para la proteína C reactiva y de 150mg/dl para el fibrinógeno, siendo la potencia del 95% y el error tipo 1 del 5%, se precisarían 10 pacientes con coronarias normales, 20 con enfermedad de un vaso, 20 con enfermedad de dos vasos y 20 con enfermedad de tres vasos. Teniendo en cuenta unas posibles pérdidas del 10%, la muestra total se calculó en 70 pacientes (n=70).
Tras la selección de la muestra, debido a la accesibilidad de la que se dispone y por su correlación con el riesgo cardiovascular, se recogieron variables de evaluación clínicas (edad, sexo, tabaquismo, diabetes mellitus, dislipidemia, hipertensión arterial enfermedad renal crónica), analíticas (glucemia, hemoglobina glicosilada, triglicéridos, colesterol total, colesterol LDL, creatina fosfoquinasa, troponina.I, PCR y fibrinógeno), electrocardiográficas (SCASEST, SCAEST o infarto agudo de miocardio evolucionado), de imagen cardíaca (función sistólica del ventrículo izquierdo), angiográficas (número de arterias coronarias con lesión angiográfica significativa [>70%], flujo coronario epicárdico en vaso responsable, oclusión total versus oclusión total...), temporales (duración de los síntomas, retraso de reperfusión) y pronósticas y de mortalidad (complicaciones periprocedimiento, morbimortalidad intrahospitalaria y a medio plazo). Ninguno de los pacientes que fueron analizados en este estudio presentaba una infección activa en el momento del ingreso que justificase la elevación de los reactantes de fase aguda de origen no-cardiovascular. Respecto al fibrinógeno, se hizo un análisis de subgrupos para el sexo y los diferentes factores de riesgo cardiovascular, ya que sexo femenino y tabaquismo podrían modificar los niveles basales de fibrinógeno, tal que los resultados fueron similares al análisis global.
Los marcadores inflamatorios se solicitaron en la analítica de ingreso del paciente, ya fuese en urgencias de nuestro hospital o de su hospital de referencia. La PCR fue medida utilizando el método turbidimétrico. En la reacción se combina la PCR con un anticuerpo específico y forma complejos antígeno-anticuerpo insolubles, tal que se mide el cambio de absorbancia a 340nm, siendo este cambio directamente proporcional a la concentración de PCR de la muestra. En nuestro centro este análisis se realiza generalmente con el analizador UniCelDxC 880i (Beckman Coulter®), y los valores de referencia en el laboratorio son <1mg/dl. El fibrinógeno se mide mediante el método de la trombina-tiempo de Clauss, el cual calcula el índice de conversión del fibrinógeno en fibrina en una muestra de plasma diluido en presencia de exceso de trombina. Cuando ese plasma se coagula por el exceso de trombina, el nivel de fibrinógeno es inversamente proporcional al tiempo de coagulación. Se reconoce como el método más idóneo por su gran precisión, rapidez, reproducibilidad y sensibilidad en los resultados32,33. Las muestras para el estudio de coagulación generalmente son procesadas en autoanalizadores ACL-TOP 500 (Beckman Coulter®), y los valores de referencia de fibrinógeno de nuestro laboratorio son 200-500mg/dl.
Se exploró el ajuste a distribución normal de las variables cuantitativas mediante el test de Kolmogorov- Smirnov, y se usó el test de la X2 de Pearson y el test exacto de Fisher para el análisis inferencial entre variables cualitativas. Se empleó el test de la t de Student y ANOVA de un factor para comparar las variables cuantitativas (por ejemplo, niveles de PCR en fase aguda o subaguda postinfarto agudo de miocardio) con las cualitativas, y el coeficiente de correlación de Pearson para establecer si existe relación entre los niveles de biomarcadores inflamatorios, cardíacos y metabólicos en la fase aguda del evento cardiovascular. La U de Mann Whitney y el test de Kruskall Wallis sirvieron para analizar muestras que no se ajustaban a la distribución normal. Se consideró un grado de significación estadística (p) <0,05 como estadísticamente significativo, y se empleó el programa estadístico SPSS versión 18.0 (SPSS Inc., Chicago, Illinois) para ejecutar el análisis inferencial.
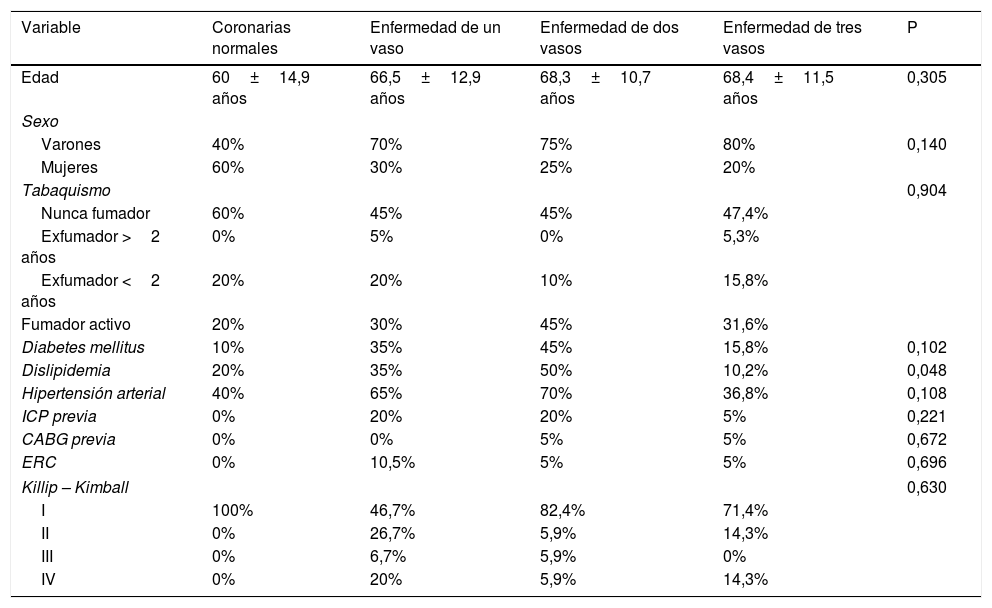
ResultadosDe los 70 pacientes incluidos en la muestra, 49 fueron varones (70%) y 21 (30%) mujeres. La edad media fue 66,6±12,3 años (rango 31-87). No hubo diferencias estadísticamente significativas en las variables de evaluación clínicas en función de la extensión de la aterosclerosis coronaria (tabla 1).
Análisis comparativo de variables de evaluación clínicas
| Variable | Coronarias normales | Enfermedad de un vaso | Enfermedad de dos vasos | Enfermedad de tres vasos | P |
|---|---|---|---|---|---|
| Edad | 60±14,9 años | 66,5±12,9 años | 68,3±10,7 años | 68,4±11,5 años | 0,305 |
| Sexo | |||||
| Varones | 40% | 70% | 75% | 80% | 0,140 |
| Mujeres | 60% | 30% | 25% | 20% | |
| Tabaquismo | 0,904 | ||||
| Nunca fumador | 60% | 45% | 45% | 47,4% | |
| Exfumador >2 años | 0% | 5% | 0% | 5,3% | |
| Exfumador <2 años | 20% | 20% | 10% | 15,8% | |
| Fumador activo | 20% | 30% | 45% | 31,6% | |
| Diabetes mellitus | 10% | 35% | 45% | 15,8% | 0,102 |
| Dislipidemia | 20% | 35% | 50% | 10,2% | 0,048 |
| Hipertensión arterial | 40% | 65% | 70% | 36,8% | 0,108 |
| ICP previa | 0% | 20% | 20% | 5% | 0,221 |
| CABG previa | 0% | 0% | 5% | 5% | 0,672 |
| ERC | 0% | 10,5% | 5% | 5% | 0,696 |
| Killip – Kimball | 0,630 | ||||
| I | 100% | 46,7% | 82,4% | 71,4% | |
| II | 0% | 26,7% | 5,9% | 14,3% | |
| III | 0% | 6,7% | 5,9% | 0% | |
| IV | 0% | 20% | 5,9% | 14,3% | |
Las variables de evaluación edad, hemoglobina glicosilada, triglicéridos, colesterol total y colesterol LDL siguieron una distribución normal según el test estadístico de normalidad de Shapiro-Wilk (p 0,797; p 0,214; p 0,263; p 0,364; y p 0,332 respectivamente), por lo que se usó la media y la desviación típica para su análisis descriptivo. Por su parte, leucocitos, glucemia, CPK, CK-MB, troponina-I, PCR, fibrinógeno y FEVI no se ajustaron a una distribución normal (p 0,030; p 0,031; p<0,001; p<0,001; p 0,001; p 0,009; p 0,033 y p<0,001 respectivamente), por tanto se empleó la mediana y el rango intercuartílico (amplitud intercuartílica).
Puesto que PCR y fibrinógeno no se ajustaban a distribución normal y además en todos los casos había menos de 30 individuos en alguno de los grupos, se utilizó el test de Kruskall-Wallis para la comparación entre estas variables cuantitativas con la variable anatomía coronaria. De esta forma, la mediana de niveles de PCR fue 1,06mg/dl, 0,5mg/dl, 1,6mg/dl y 1,14mg/dl en pacientes con coronarias normales y enfermedad de uno, dos y tres vasos respectivamente (p 0,829). Por otro lado, la mediana de niveles de fibrinógeno resultaron 410mg/dl, 396mg/dl, 435mg/dl y 437mg/dl en pacientes con coronarias normales y lesiones monovaso, de dos y tres vasos respectivamente (p 0,810) (tabla 2).
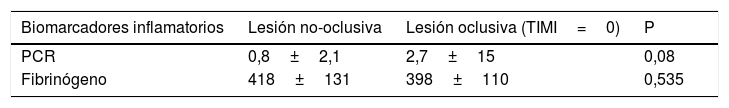
Los niveles de PCR fueron superiores en los pacientes que sufrieron un síndrome coronario agudo y presentaban una lesión oclusiva (TIMI=0) (mediana 2,7mg/dl) en comparación con aquellos en quienes existía perfusión distal en el momento del cateterismo urgente o emergente (TIMI=1, 2, 3) (mediana 0,8mg/dl), con tendencia a la significación estadística (p 0,08). Sin embargo, no se detectaron diferencias significativas en los niveles de fibrinógeno en sangre en función de si la arteria se encontraba ocluida o discretamente permeable (mediana 418mg/dl vs. 405mg/dl respectivamente; p 0,535) (tabla 3).
La mediana de los niveles de proteína C reactiva en fases subaguda postinfarto agudo de miocardio fue 2,7, 0,5 y 1,2mg/dl en coronariografías con flujo distal TIMI=0, 1 y 2 de la lesión responsable respectivamente (p=0,338). De igual manera, De la misma manera, no detectamos diferencia significativa en los niveles de fibrinógeno en función del grado de obstrucción coronaria medido mediante el flujo TIMI distal a la estenosis (398, 418, 460 y 418mg/dl en TIMI=0, 1, 2 y 3, respectivamente; p 0,662) (tabla 4).
Al aplicar el test de correlación de Pearson únicamente se detectó correlación positiva entre niveles de PCR y leucocitosis (p 0,037), con ausencia de correlación entre estos y glucemia (p 0,245), HBA1C (p 0,603), triglicéridos (p 0,402), colesterol total (p 0,276), colesterol LDL (p 0,486), CPK pico (p 0,911), CK-MB (p 0,579) y troponina.I (p 0,824). Los niveles de fibrinógeno, por su parte, se correlacionaban positivamente con la leucocitosis, al igual que lo hacía la PCR (p 0,034), sin ninguna otra correlación positiva (glucemia, p 0,221; HBA1C, p 0,085; triglicéridos, p 0,951; colesterol total, p 0,817; colesterol LDL, p 0,508; CPK pico, p 0,465; CK-MB pico, p 0,612; y troponina-I, p 0,380). Existió correlación positiva entre los niveles de PCR y fibrinógeno en fase aguda y subaguda postinfarto agudo de miocardio (p 0,002). En el análisis de subgrupos para el sexo y los diferentes factores de riesgo cardiovascular, los resultados fueron similares al análisis global.
No se detectó correlación positiva entre los niveles de PCR y fibrinógeno y la duración de los síntomas, tiempo desde el inicio de síntomas hasta urgencias ni tiempo desde urgencias hasta hemodinámica, así como tampoco con la tasa de complicaciones periprocedimiento. En esta muestra de 70 pacientes, únicamente falleció uno durante el periodo de seguimiento, por lo que no se considera relevante el análisis de la morbimortalidad a corto-medio plazo en estos pacientes.
DiscusiónLa PCR y el fibrinógeno son los marcadores inflamatorios cuya relación con la fisiopatología de la enfermedad cardiovascular ha sido más estudiada. Los niveles de PCR se han sugerido como factor predictor de evento cardiovascular en pacientes asintomáticos con factores de riesgo cardiovascular, y, de hecho, algunos estudios indican que niveles superiores a 2,4mg/l duplican el riesgo de sufrir un evento coronario5–8. Sin embargo, el valor predictivo positivo solamente es significativo en pacientes con un riesgo cardiovascular intermedio10. Estos niveles son significativamente mayores en pacientes con síndrome coronario agudo en comparación con cardiopatía isquémica estable, lo cual sugiere que la inflamación de la pared arterial coronaria desempeña un papel importante en la inestabilidad de la placa de ateroma12–14. Asimismo, la mayoría de estudios publicados sugieren la existencia de una asociación independiente entre los niveles de fibrinógeno y la presencia y extensión de aterosclerosis a diferentes niveles del cuerpo —coronaria, abdominal e iliobifemoral— 23–25. En nuestro estudio, sin embargo, no se halló ningún valor límite, tanto de PCR como de fibrinógeno, a partir del cual se pudiera establecer que existiese un riesgo aumentado de presentar una enfermedad arterial coronaria severa multivaso, ni lesión oclusiva responsable.
El estudio de Tataru et al. sugirió que los niveles más elevados de la PCR se relacionaban con el número de arterias coronarias afectadas en pacientes con antecedente reciente de infarto de miocardio (sin especificar la cronología del mismo, es decir el infarto podría haber sucedido hace una semana, hace un mes...)17. Por su parte, Madsen et al. realizaron un estudio similar que mostró una relación positiva entre PCR y anatomía coronaria en pacientes con dolor torácico a estudio, equivalente anginoso posible o ángor de esfuerzo18. No se encontró ningún estudio que analizase la anatomía coronaria en función de los niveles de fibrinógeno. En cualquier caso, lo que parece claro es que no existen estudios en los que se analice la relación cuantitativa entre los niveles sanguíneos de la proteína C reactiva y el fibrinógeno y la extensión de la enfermedad arterial coronaria severa específicamente en fase aguda o subaguda de un síndrome coronario. Es por esto por lo que se decidió realizar este estudio observacional, en el que únicamente se incluyeron pacientes con niveles de PCR y fibrinógeno medidos en la fase aguda (o subaguda) del síndrome coronario agudo, y se compararon con la anatomía coronaria de los mismos.
En este estudio, sin embargo, no se detectaron diferencias significativas entre los niveles de PCR y fibrinógeno y el número de arterias coronarias afectadas, así como tampoco entre niveles altos de estos biomarcadores en función del flujo sanguíneo distal a la lesión responsable (TIMI=0, 1, 2, 3). Las diferencias en cuanto a resultados podrían explicarse por un tamaño muestral reducido, especialmente de los pacientes a quienes conseguimos medirle la PCR, con la consiguiente poca potencia estadística del estudio. Al analizar las características basales de las muestras recogidas lo cierto es que son superponibles a la nuestra. No obstante, no se descarta que no exista relación entre los niveles de marcadores inflamatorios y la anatomía coronaria en el seno de un infarto agudo puesto que, como se ha dicho previamente, esto no se ha estudiado concretamente en ese momento de la cardiopatía isquémica. No se describieron procesos infecciosos o inflamatorios agudos en los pacientes, y los resultados se mantuvieron homogéneos al ajustar por sexo, tabaquismo activo, diabetes, hipercolesterolemia e hipertensión arterial, así como al evaluar de manera individual síndromes coronarios agudos sin elevación, con elevación e infartos evolucionados. De esta manera, no parece probable que otras causas de elevación de reactantes de fase aguda influyeran en los resultados del estudio tal y como se ha planteado.
Kaptoge et al. sugirieron que la PCR plasmática presentaba una asociación lineal con niveles de glucemia, triglicéridos y colesterol HDL entre otros11. No se encontraron estudios en la literatura que analizasen semejante comparación en torno a los niveles de fibrinógeno; tampoco algún estudio que analizase la correlación entre niveles de biomarcadores inflamatorios y cardíacos en el seno de un síndrome coronario agudo. Este estudio únicamente detectó correlación positiva entre niveles de PCR y fibrinógeno, así como PCR y leucocitosis. No existió correlación entre PCR y fibrinógeno con glucemia, HBA1C, triglicéridos, colesterol total, colesterol LDL, CPK pico, CK-MB y troponina I. La explicación más plausible a esta diferencia de hallazgos en este estudio respecto al de Kaptoge et al. es el tamaño muestral reducido ya que, al igual que ocurría en el caso anterior, las características basales eran similares a las de nuestro estudio.
Existen múltiples estudios que relacionan los niveles de proteína C reactiva y fibrinógeno con el riesgo de padecer un evento cardiovascular a medio-largo plazo5–8. Sin embargo, en esta muestra únicamente falleció un paciente durante el periodo de seguimiento, por lo que no se considera relevante el análisis de la morbimortalidad a corto-medio plazo en estos pacientes.
La principal limitación de este estudio consistió en que, dentro del tamaño muestral definido inicialmente (n=70), los niveles de proteína C reactiva únicamente fueron medidos en un total de 20 pacientes, y de ellos, en la mayoría de los casos fue medida durante la fase subaguda del síndrome coronario, y no en fase aguda propiamente dicha. Esto obliga a ser muy prudentes a la hora de establecer conclusiones, especialmente en lo que a la proteína C reactiva y su papel en la enfermedad cardiovascular se refiere. Así pues, con los datos de los que disponemos hasta ahora, incluyendo este estudio, es posible recomendar, por el momento, la medición de los niveles de PCR y fibrinógeno en los pacientes con síndrome coronario agudo para evaluar el riesgo de presentar nuevos eventos a largo plazo, pero no para utilizarlo como predictor de la extensión de la aterosclerosis coronaria.
ConclusionesEn este estudio no se halló una correlación positiva entre los niveles de PCR y fibrinógeno y el número de vasos afectados (coronarias normales, enfermedad de uno, dos y tres vasos) en pacientes ingresados con diagnóstico de certeza de síndrome coronario agudo. No se detectaron tampoco mayores niveles de estos biomarcadores inflamatorios en los casos que presentaban oclusión completa de la arteria responsable en comparación con aquellos con oclusión incompleta. No se objetivó correlación entre los niveles de estos biomarcadores inflamatorios y el grado de estenosis de la arteria responsable (TIMI=0, 1, 2, 3). Se demostró correlación positiva entre niveles de PCR y fibrinógeno con niveles de leucocitos en sangre de estos pacientes durante la fase aguda o subaguda del infarto. No existió correlación, sin embargo, entre PCR y fibrinógeno con glucemia, HBA1C, triglicéridos, colesterol total, colesterol LDL, CPK pico, CK-MB y troponina.I. La escasa casuística de eventos en el seguimiento impidió la valoración de la relación entre niveles de PCR o fibrinógeno y la probabilidad de eventos cardiovasculares y mortalidad a medio-largo plazo (un único paciente fallecido durante todo el estudio).
FinanciaciónNinguna.
Conflicto de interesesNinguno.