Las cardiopatías arritmogénicas son enfermedades genéticamente determinadas, que producen daño progresivo del miocardio, tienen una alta probabilidad de causar muerte súbita por arritmias cardiacas y se manifiestan por lo general antes de los 35 años. La forma de presentación mejor conocida afecta principalmente al ventrículo derecho y se denomina displasia arritmogénica del ventrículo derecho, aunque en algunas oportunidades puede ocasionar también compromiso del ventrículo izquierdo. Debe sospecharse en todos los pacientes jóvenes con un corazón aparentemente normal que sufran síncope asociado a taquicardia ventricular o muerte súbita arrítmica1.
Es una enfermedad de carácter autosómico dominante con penetración variable y expresión incompleta. Se observa con mayor frecuencia en el sexo masculino y pueden encontrarse antecedentes familiares en aproximadamente un 30 a 50% de los pacientes afectados. La edad al momento del diagnóstico es de 30 a 40 años. Su frecuencia varía ampliamente según las series y la región geográfica, pero se cree que representaría el 5% de las muertes súbitas en menores de 65 años y tendría una prevalencia que va de 1/2.000 a 1/10.0001.
Se caracteriza por una sustitución progresiva del miocardio por tejido adiposo o fibroadiposo. Esta infiltración constituye un sustrato para la inestabilidad eléctrica y lleva a arritmias auriculares y ventriculares; sin embargo, es la tendencia a producir arritmias ventriculares malignas y muerte súbita lo que explica la gravedad de esta enfermedad1.
Una de sus variedades, denominada queratodermia palmoplantar (enfermedad de Naxos), ha permitido estudiar en detalle su fisiopatología. Este tipo de displasia arritmogénica es causado por una mutación en el gen de la placoglobina, cuyo producto es un componente de los desmosomas y las uniones celulares. En otros casos con presentación familiar se han identificado alteraciones de la desmoplaquina y de la placofilina 2. Se han identificado también otras mutaciones presuntamente causantes de esta enfermedad en la placoglobina, así como en otros genes desmosómicos de la desmocolina 2 y la desmogleína 21. En la actualidad se considera que la disfunción desmosómica es la vía final común en la patogenia de casi todos los casos de displasia arritmogénica. La integridad estructural y funcional del tejido cardiaco se basa en los desmosomas, las uniones tipo adherens (uniones adherentes) y las uniones tipo gap (uniones estrechas) situadas en los discos intercalares. La integridad de los desmosomas es necesaria para mantener el acoplamiento eléctrico y los mecanismos de señalización en la regulación del crecimiento, la diferenciación y el desarrollo celulares1. Sin embargo, algunos genes no desmosómicos se han asociado también con casos de displasia arritmogénica, como mutaciones en el gen del factor de crecimiento transformador β-3 (TGFβ3), que modula la expresión de las proteínas de contacto celular y el gen del receptor de rianodina 2 (RyR2)1.
La mayoría de veces, el proceso de reemplazo fibroso afecta las áreas posterior e inferior del tracto de entrada del ventrículo derecho vecino a la válvula tricúspide, al infundíbulo anterior y al vértice cardiaco, formando lo que se conoce como triángulo de la displasia. La enfermedad puede causar anomalías de la contracción generales o regionales, alteraciones de la función sistólica y diastólica del ventrículo derecho, formación de aneurismas y dilatación e hipocinesia. El tabique interventricular suele estar preservado, por lo cual las biopsias endomiocárdicas que generalmente se obtienen del septum apical pueden no ser diagnósticas. La insuficiencia cardiaca sintomática puede ser una manifestación de la displasia arritmogénica y la mayoría de veces se produce en estadios avanzados de la enfermedad. Esto se debe a que la enfermedad es progresiva y termina por producir también compromiso del ventrículo izquierdo1.
El electrocardiograma puede ser anormal, observándose algunas veces ondas T invertidas y ondas épsilon en las derivaciones V1-V3. Las ayudas diagnósticas de mayor utilidad son la ecocardiografía y la resonancia magnética, para las cuales se han establecido algunos criterios diagnósticos precisos1.
En los pacientes con displasia arritmogénica, el implante de desfibrilador mejora el pronóstico y la supervivencia si se aplica a una población de alto riesgo y como prevención secundaria. Sin embargo, los criterios para la selección óptima de pacientes para el implante de desfibrilador como prevención primaria de la muerte súbita, todavía no son claros en esta patología. Es de suponer que los estudios genéticos tendrán gran importancia en este aspecto en el futuro cercano, y permitirán detectar con prontitud los casos de alto riesgo arrítmico.
Utilidad del mapeo tridimensionalLos métodos recientes que permiten el mapeo tridimensional computarizado de las cavidades cardiacas, han sido de gran valor para el estudio de la fisiopatología de esta enfermedad y para su tratamiento. Se ha observado que las cicatrices del ventrículo derecho identificadas mediante mapas electroanatómicos, corresponden a áreas de depleción miocárdica y están correlacionadas con los signos histopatológicos de atrofia miocárdica y sustitución fibroadiposa.
Corrado et al.2 demostraron que los mapas de voltaje pueden ser útiles en el diagnóstico diferencial con otras arritmias y las formas tempranas de la displasia arritmogénica. De hecho, en los pacientes con arritmias ventriculares originadas en el tracto de salida derecho y con ecocardiografías normales, la presencia de un área de regiones de bajo voltaje identificó un subgrupo con alto riesgo de recurrencia de taquicardia ventricular e incluso de muerte súbita durante el seguimiento clínico3.
Wijnmaalen et al.4 informaron que los pacientes con taquicardia ventricular derecha asociada a la presencia de cicatrices, con o sin un diagnóstico de displasia establecido según los criterios del Task Force, tenían una tasa de recurrencia de taquicardia superior a la de los pacientes sin cicatrices electroanatómicas. Todos estos datos confirman que los mapas de voltaje podrían ser un instrumento diagnóstico importante con implicaciones pronósticas y terapéuticas.
Otros autores recomiendan realizar biopsias endomiocárdicas guiadas por mapa tridimensional, debido a que esta herramienta permite delimitar las áreas enfermas de las sanas5,6.
La taquicardia ventricular en los casos de displasia arritmogénica, es el resultado de circuitos de reentrada relacionados con una cicatriz, de manera similar a lo que se observa en el contexto del paciente con infarto de miocardio. La ablación por catéter con mapas de voltaje del ventrículo derecho, mediante el empleo de técnicas de elaboración de mapas convencionales o electroanatómicos, puede aportar resultados favorables a corto plazo. Sin embargo, como consecuencia de la progresión de la enfermedad, las recurrencias de las arritmias a partir de nuevos sustratos arritmogénicos son frecuentes7.
En el plano endocárdico, las regiones con potenciales de bajo voltaje (< 1,5mV), con larga duración y fraccionados se correlacionan con pérdida de miocitos y reemplazo fibroadiposo, y confirman circuitos críticos para la taquicardia ventricular8. La distribución endocárdica de estas cicatrices se extiende desde la válvula tricúspide y/o pulmonar a la pared libre del ventrículo derecho, y aunque pueden encontrarse en los aspectos septales de las regiones perivalvulares, no incluyen comúnmente el ápex9. Los mapas tridimensionales del ventrículo izquierdo muestran que cuando hay compromiso se localiza frecuentemente en las regiones perivalvulares9.
El compromiso epicárdico es común en esta patología y en general es más extenso que el endocárdico10. En este sentido, se recomienda que el umbral de detección de cicatriz sea de 1mV para mejorar la distinción respecto a la grasa epicárdica11. Se ha sugerido que la determinación del voltaje unipolar endocárdico puede predecir cicatrices epicárdicas y el umbral de < 5,5mV se asocia con compromiso epicárdico12.
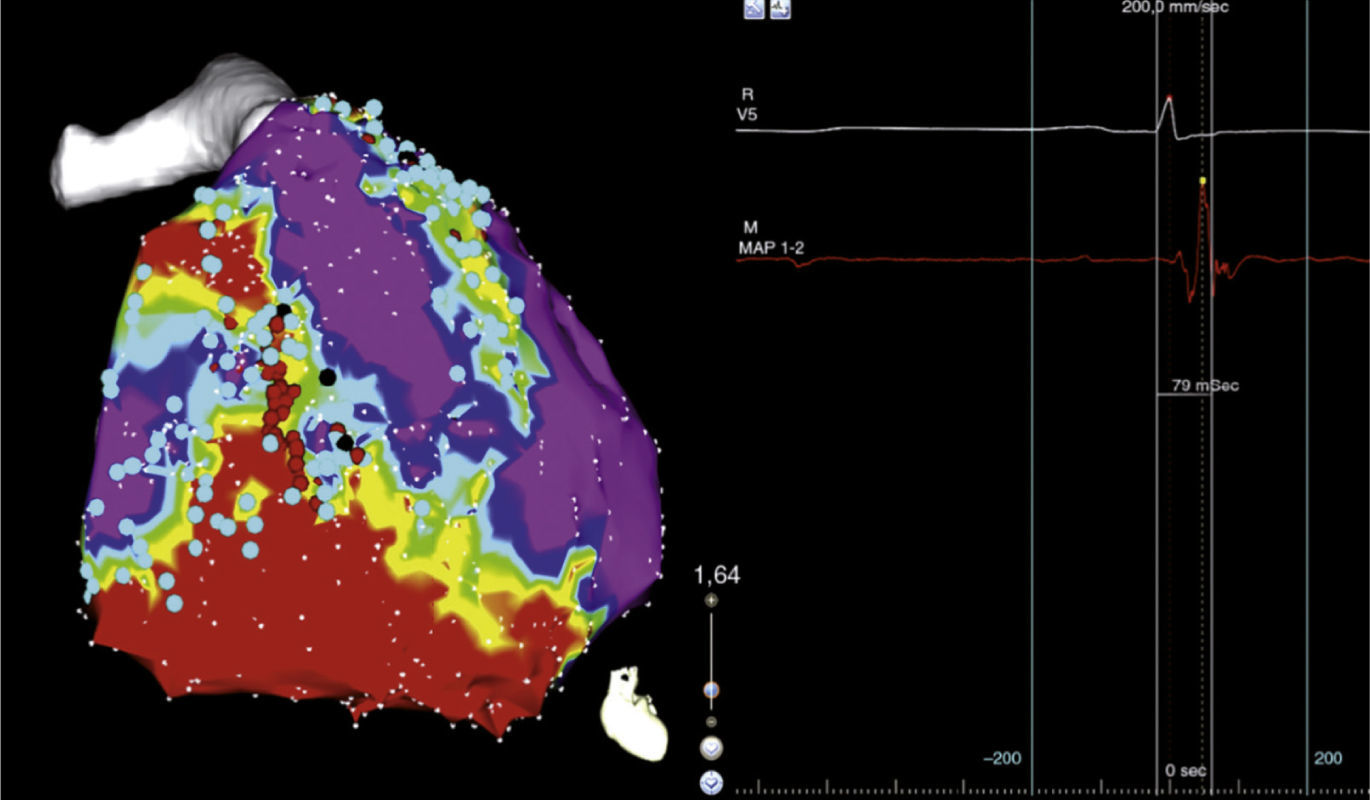
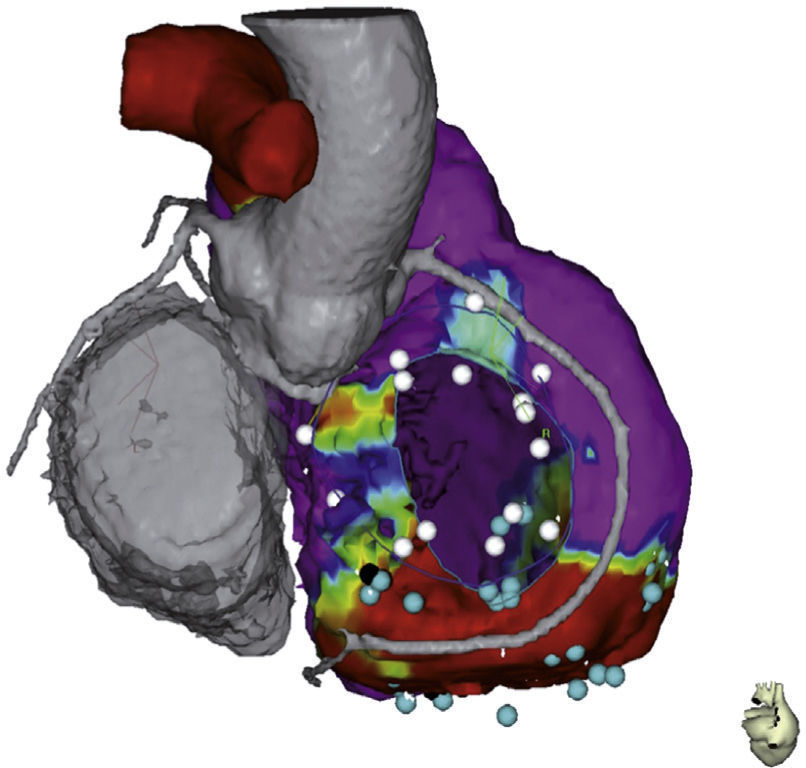
La técnica de ablación no está completamente establecida e incluye lesiones lineares que seccionan una cicatriz uniéndola a regiones eléctricamente inertes (anillos valvulares, otra cicatriz), lesiones dirigidas a potenciales tardíos con extensión de 2-3cm sobre esta zona o a la reciente técnica de descanalización10,13. En esta última se hace un mapeo de alta densidad en ritmo sinusal encontrando zonas de despolarización retardada que se hallan en el borde de la cicatriz y pueden ser objetivo de la ablación (figs. 1 y 2)14.
Se muestra una zona de bajo voltaje que corresponde a cicatriz (rojo), la zona que rodea la cicatriz o border (verde) y el tejido eléctricamente sano (violeta). Tomada con permiso de Díaz et al.14.
Imagen fusionada con tomografía computarizada en la que se muestra curso de otras estructuras cardiacas con la base del ventrículo derecho incluyendo las arterias coronarias. Tomada con permiso de Díaz et al.14.
Muchos autores consideran que las indicaciones actuales para la ablación por catéter en pacientes con displasia arritmogénica son la presencia de taquicardia ventricular monomórfica bien tolerada con formas localizadas de la enfermedad, siempre que no mejoren con la medicación, además de los casos de taquicardia ventricular de presentación frecuente, incesante o que se relaciona con descargas múltiples por parte de un desfibrilador implantado.
Kusano et al.15 reportan ablaciones exitosas mediante la aplicación de radiofrecuencia en istmos críticos. Por su parte, Nair et al.16 y Della Bella et al.17 realizaron ablaciones exitosas induciendo taquicardias inestables desde el punto de vista hemodinámico, que lograron ser mapeadas por técnica de no-contacto (Array, St. Jude Medical).
En términos generales, se podría afirmar que todas las técnicas de ablación usadas en la taquicardia ventricular relacionada con cardiopatía isquémica con infartos previos, son válidas para la ablación de la displasia arritmogénica, debido a las similitudes en su fisiopatología. En todo caso, estas técnicas requieren mapeo tridimensional para su realización9–11,13–22. Sin embargo, debido a la naturaleza progresiva de esta enfermedad, son comunes las recurrencias y la única terapia que puede aportar mejoría en la supervivencia de estos pacientes es el implante de un dispositivo desfibrilador.
RecomendacionesClase I- •
Se recomienda el procedimiento de ablación de arritmias mediante mapeo tridimensional en pacientes con displasia arritmogénica que deban ser llevados a ablación por taquicardia ventricular (nivel de evidencia C).