En los pacientes con trombosis arterial o venosa, in situ o por embolia, el uso de fibrinolíticos (como el rtPA) administrados directamente en el trombo a través de un catéter selectivo en el sitio de la oclusión, permite una resolución más rápida de la oclusión trombótica o embólica con menos dosis total del agente fibrinolítico y por ende con menos complicaciones hemorrágicas que con el uso sistémico.
Las indicaciones en las cuales se puede considerar la fibrinólisis selectiva con catéter son básicamente la isquemia aguda de una extremidad por oclusión arterial, la tromboembolia pulmonar, la trombosis venosa profunda iliofemoral (proximal), la trombosis venosa profunda proximal axilo-subclavia, la trombosis de los accesos venosos para diálisis y en los pacientes pediátricos en los casos de trombosis o embolia arterial con extremidad isquémica y en casos seleccionados de trombosis venosa profunda proximal de extremidades.
En este consenso describirá cada una de las indicaciones a través de un protocolo para el manejo con rtPA en cada situación, cómo monitorizar su uso y cómo tartar las complicaciones hemorrágicas.
In patients with arterial or venous thrombosis, in situ or due to an embolism, the use of fibrinolytics (such as recombinant tissue-type plasminogen activator, rtPA) administered directly into the clot through a selective catheter into the occlusion site. This can lead to a more rapid resolution of the thrombotic or embolic occlusion with a lower dose of the fibrinolytic agent, and therefore with less problems with haemorrhages than with systemic use.
The situations in which selective fibrinolysis with a catheter can be considered are mainly, acute ischaemia of a limb due to a blocked artery, pulmonary thromboembolism, proximal ileo-femoral deep venous thrombosis, proximal axillo-subclavian deep venous thrombosis, and in the thrombosis of the venous access for dialysis It is also indicated in paediatric patients in cases of arterial thrombosis or embolisms with an ischaemic limb, and in selective cases of proximal deep venous thrombosis of the limbs.
In this consensus, a description will be given of each one of the indications, with a protocol for the management with rtPA in each one of them, as well as monitoring its use and the management of haemorrhage complications.
El tratamiento de los pacientes con oclusión aguda arterial o venosa por trombosis in situ o embolia ha sido tradicionalmente la embolectomía quirúrgica (usualmente en oclusión arterial aguda y en algunos casos en trombosis venosa profunda proximal) o el uso sistémico de agentes fibrinolíticos como la estreptoquinasa, el activador del plasminógeno de origen tisular recombinante (rtPA) o la urokinasa. En años recientes los avances del intervencionismo cardiovascular y de sus aplicaciones en el segmento vascular periférico han permitido el desarrollo de técnicas menos invasivas y más selectivas que facilitan la administración supraselectiva del agente trombolítico dentro del trombo con el objetivo de disminuir la dosis total del fibrinolítico y las complicaciones asociadas. Las indicaciones para la fibrinólisis selectiva con catéter incluyen pacientes con isquemia aguda de una extremidad, tromboembolia pulmonar o trombosis venosa profunda proximal de las extremidades y la trombosis de los accesos venosos para diálisis y en algunos casos en pacientes pediátricos.
Sin embargo, estas indicaciones para la fibrinólisis selectiva con catéter no son ampliamente utilizadas, de una parte por la no disponibilidad del recurso altamente especializado que se necesita (salas de angiografía para intervencionismo cardiovascular) y de otra, por la falta de evidencia científica que indique su uso de manera sistemática.
A razón de lo anterior se reunieron tres sociedades científicas, la Asociación Colombiana de Radiología (ACR), la Asociación Colombiana de Cirugía Vascular y Angiología (ASOVASCULAR) y el Colegio Colombiano de Hemodinamia e Intervencionismo Cardiovascular (CCHICV), que tienen en común el tratamiento de estas enfermedades, y analizaron la información científica disponible con el fin de emitir recomendaciones de manejo del activador del plasminógeno tisular recombinante (rtPA) en los casos que requieran fibrinólisis selectiva con catéter, así como en la selección adecuada de los pacientes y la forma de usarla en cada indicación, de manera específica.
Se propone un protocolo para el manejo del rtPA como el agente fibrinolítico de elección en estas indicaciones pues es el que tiene la mayor evidencia en todas ellas. En este protocolo se explica la forma de usarlo, su monitorización, la terapia adjunta y el manejo de las complicaciones.
MetodologíaLa búsqueda sistemática de información se inició en los recursos sugeridos en la Guía metodológica para la elaboración de guías, actualización del 2014i, para identificar guía de práctica clínica (GPC), consensos, pronunciamientos o protocolos de utilidad. También se consultaron páginas web, repositorios y publicaciones de diferentes asociaciones y sociedades académicas y científicas de América Latina, ya que este tipo de documentos (GPC, consensos, entre otros), hacen parte de la literatura gris, que no siempre se indexa en recursos formales; entre estos últimos los consultados por los autores fueron las bases de datos bibliográficas Medline (a través del portal PubMed), Embase, Cochrane UpTodate y Lilacs. Por otra parte, se consultaron portales que agrupan las publicaciones de editores reconocidos como Sciencedirect y Clinicalkey de Elsevier, Ebscohost de editorial Ebsco,Springer, Wiley, a través de los descubridores con que cuentan las bibliotecas de universidades con programas en salud. Como parte del rastreo final se consultaron recursos de acceso abierto como Redalyc, SciELO y Google Académico. La búsqueda se realizó desde el año 2000 hasta el mes de abril de 2018, e incluyó población adulta mayor de 18 años y tipo de documentos, revisiones sistemáticas, metaanálisis, estudios clínicos en fase IV y cohortes de buen tamaño.
Trombólisis selectiva con catéter en enfermedad vascular tromboembólicaDefiniciónLa fibrinólisis selectiva con catéter es una terapia dirigida con imagen cineangiográfica, en la cual un agente fibrinolítico es administrado directamente dentro de un trombo a través de un catéter de infusión introducido dentro del mismo.
ObjetivosObtener una mayor concentración del fibrinolítico dentro del trombo con la administración de una dosis menor del mismo, a fin de mejorar la eficacia de la terapia fibrinolítica en comparación con la fibrinólisis sistémica.
IndicacionesLas entidades clínicas en las cuales se puede considerar la fibrinólisis selectiva con catéter son básicamente la isquemia aguda de una extremidad por oclusión arterial, la tromboembolia pulmonar, la trombosis venosa profunda iliofemoral (proximal), la trombosis venosa profunda proximal (axilo-subclavia) de una extremidad superior, la trombosis de los accesos venosos para diálisis y en los pacientes pediátricos hay 2 indicaciones que son la trombosis o embolia arterial con extremidad isquémica y en casos seleccionados de trombosis venosa proximal de extremidades inferiores. El primer paso para una fibrinólisis exitosa es la selección adecuada del paciente; en vista de que la evidencia disponible con frecuencia es limitada, la decisión de administrar fibrinólisis selectiva con catéter en estas entidades debe hacerse de manera individualizada, sopesando en cada paciente los beneficios potenciales contra los riesgos de la terapia fibrinolítica. La fibrinólisis no está indicada en embolia de colesterol aéreo o tumoral.
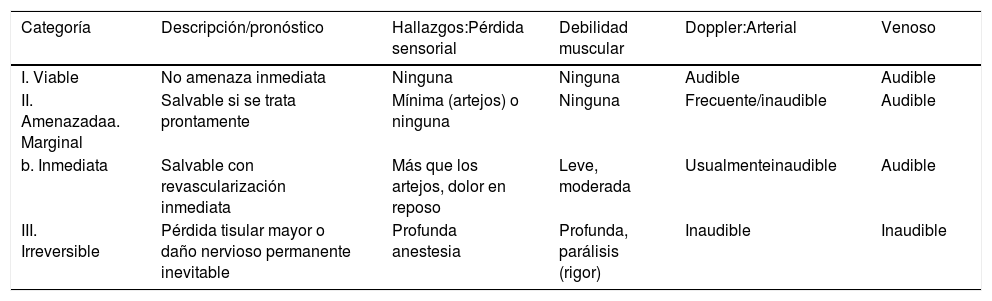
Isquemia aguda de una extremidadUsualmente es secundaria a oclusión arterial por embolia arterio-arterial, cardioembolia o trombosis “in situ”. La indicación de fibrinólisis con catéter dependerá de la presentación clínica, principalmente en lo que se refiere a la presencia de compromiso neurológico, que determina la urgencia de la revascularización, la duración y la localización de la isquemia, las comorbilidades, el tipo de vaso a tratar (nativo vs. injerto) y los riesgos de la terapia. Para definir esto es muy útil la clasificación de Rutherford et al. (tabla 1)1,2, que ayuda a determinar la viabilidad de la extremidad y la urgencia de la reperfusión. En las categorías I y IIa usualmente hay margen de tiempo suficiente para la reperfusión más gradual que se obtiene con la fibrinólisis selectiva con catéter, a menos que la misma esté contraindicada (tabla 2), por lo que la fibrinólisis en esta circunstancia es recomendación clase I, nivel de evidencia A. Los resultados de la fibrinólisis son mejores cuando la duración de la isquemia aguda es menor a catorce días.
Separación entre las extremidades viables y las amenazadas
| Categoría | Descripción/pronóstico | Hallazgos:Pérdida sensorial | Debilidad muscular | Doppler:Arterial | Venoso |
|---|---|---|---|---|---|
| I. Viable | No amenaza inmediata | Ninguna | Ninguna | Audible | Audible |
| II. Amenazadaa. Marginal | Salvable si se trata prontamente | Mínima (artejos) o ninguna | Ninguna | Frecuente/inaudible | Audible |
| b. Inmediata | Salvable con revascularización inmediata | Más que los artejos, dolor en reposo | Leve, moderada | Usualmenteinaudible | Audible |
| III. Irreversible | Pérdida tisular mayor o daño nervioso permanente inevitable | Profunda anestesia | Profunda, parálisis (rigor) | Inaudible | Inaudible |
Adaptada de: Norgren L, Hiatt WR, Dormandy JA, Nehler MR, Harris KA, et al. Inter-Society Consensus for the Management of Peripheral Arterial Disease (TASC II). Eur J Vasc Endovasc Surg. 2007;33 Suppl 1:S1-75.
Contraindicaciones y precauciones para la terapia fibrinolítica
| Absolutas• Ataque cerebrovascular hemorrágico o de origen desconocido en cualquier época• Ataque cerebrovascular isquémico en últimos 3 meses (excepto el agudo menor o igual a tres horas de evolución)• Neoplasia intracraneana maligna conocida (primaria o metastásica)• Lesión vascular cerebral estructural conocida: por ejemplo malformación arteriovenosa)• Trastorno convulsivo• Sangrado (interno) activo o diátesis hemorrágica, incluyendo coagulación intravascular diseminada (no incluye menstruación)• Sospecha de disección aórtica• Trauma cerrado significativo de cabeza o cara en últimos tres meses (trauma mayor/cirugía/trauma encéfalo-craneano en últimas tres semanas)• Sangrado gastrointestinal en el último mes• Punciones no compresibles (por ejemplo catéter subclavio, biopsia hepática, punción lumbar) en las últimas 24 horas |
| Relativas• Hipertensión arterial severa no controlada al ingreso (>180/110); posible contraindicación absoluta en ciertas circunstancias.• Historia de hipertensión arterial crónica severa pobremente controlada• Historia de ataque cerebrovascular isquémico previo mayor a tres meses, demencia o enfermedad intracerebral conocida no incluida en las contraindicaciones absolutas (accidente isquémico transitorio en últimos seis meses)• Uso actual de anticoagulantes orales (a mayor INR mayor riesgo de sangrado)• Trombocitopenia severa• Resucitación cardiopulmonar traumática o prolongada (mayor a 10 min) o cirugía mayor reciente (últimas tres semanas)• Punciones vasculares no compresibles• Sangrado interno reciente (últimas dos a cuatro semanas)• Para estreptoquinasa y anistreplase: exposición previa (especialmente cinco días a dos años) o reacción alérgica previa• Embarazo y primera semana del posparto; lactancia• Úlcera péptica activa• Endocarditis infecciosa• Enfermedad hepática avanzada• Retinopatía diabética hemorrágica• Reacciones alérgicas (o de otro tipo) serias a los fibrinolíticos, los anticoagulantes o los medios de contraste (no controladas por pretratamiento con esteroides/antihistamínicos)• Cortocircuito de derecha-a-izquierda cardíaco o pulmonar o trombo en corazón izquierdo conocidos• Sospecha de trombo venoso infectado• Falla renal (creatinina mayor a 2,0 mg/dl) |
| ¶ Visto como herramienta de consulta para la toma de decisiones. Puede no ser definitivo en todos los casos. |
Adaptada de: Antman EM, Anbe DT, Armstrong PW, Bates ER, Green LA, Hand M., et al. ACC/AHA guidelines for the management of patients with ST-elevation myocardial infarction: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee to Revise the 1999 Guidelines for the Management of Patients with Acute Myocardial Infarction). Circulation. 2004;110(9):e82-292.
Task Force on the management of ST-segment elevation acute myocardial infarction of the European Society of Cardiology (ESC), Steg PG, James SK, Atar D, Badano LP, Blömstrom-Lundqvist C, et al. ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J. 2012;33(20):2569-619.
Vedantham S, Thorpe PE, Cardella JF, Grassi CJ, Patel NH, Ferral H, et al. Quality improvement guidelines for the treatment of lower extremity deep vein thrombosis with use of endovascular thrombus removal. J Vasc Interv Radiol. 2009;20(7 Suppl):S227-39.
Las ventajas de la fibrinólisis selectiva comparada con la embolectomía quirúrgica incluyen la disminución del riesgo de trauma endotelial y la lisis de los coágulos que están en vasos demasiado pequeños para los balones de embolectomía. Adicionalmente, la reperfusión gradual de baja presión producida por la fibrinólisis puede tener ventajas sobre la reperfusión súbita y de alta presión producida por la embolectomía quirúrgica, principalmente en lo que respecta a disminución en el riesgo de lesión por reperfusión. Cuando la isquemia de la extremidad es más profunda (categoría IIb), de manera que la viabilidad de la extremidad está en riesgo en un plazo de tiempo más corto (por ejemplo horas) se requiere un método de revascularización más rápido que el brindado por la fibrinólisis con catéter, bien sea endovascular (trombectomía mecánica percutánea) o quirúrgico (embolectomía quirúrgica). El método seleccionado dependerá en este caso de varios factores, incluyendo la localización anatómica de la oclusión, la etiología de la isquemia aguda, las contraindicaciones para las diferentes técnicas de revascularización endovascular o quirúrgica y los protocolos, el nivel de experiencia y la disponibilidad de recursos locales.
Una revisión reciente de fibrinolíticos en enfermedad vascular periférica menciona que el rtPA intraarterial (selectivo en el trombo) es más efectivo que la administración intraarterial de estreptoquinasa o de rtPA intravenoso para obtener la permeabilidad arterial en oclusión aguda. Cuando se compara el rtPA con urokinasa no hay evidencia de que sea más efectivo, pero hay certeza de que la lisis inicial puede ser más rápida con el rtPA de acuerdo con el régimen utilizado24,25.
Las guías americanas recomiendan lo siguiente: 23
- –
Clase I: la fibrinólisis selectiva con catéter es efectiva y benéfica, y está indicada para pacientes con isquemia aguda de extremidades (Rutherford categorías I y IIa) menor a 14 días de duración (Nivel de evidencia A).
- –
Clase IIa: la trombectomía mecánica está indicada como terapia adjunta en isquemia aguda de las extremidades debida a oclusión arterial periférica (Nivel de evidencia B).
- –
Clase IIb: la fibrinólisis selectiva con catéter o la trombectomía mecánica pueden ser consideradas para pacientes con isquemia aguda de extremidades (Rutherford categoría IIb) de menos de 14 días de duración (Nivel de evidencia B).
En las siguientes indicaciones específicas la fibrinólisis es el procedimiento de elección:
- –
Oclusión de injertos arteriales de menos de catorce días de evolución.
- –
Fragmentación del trombo y embolia a vasos distales con oclusión de vasos de eflujo.
- –
Oclusión de aneurisma poplíteo con embolia a vasos de eflujo.
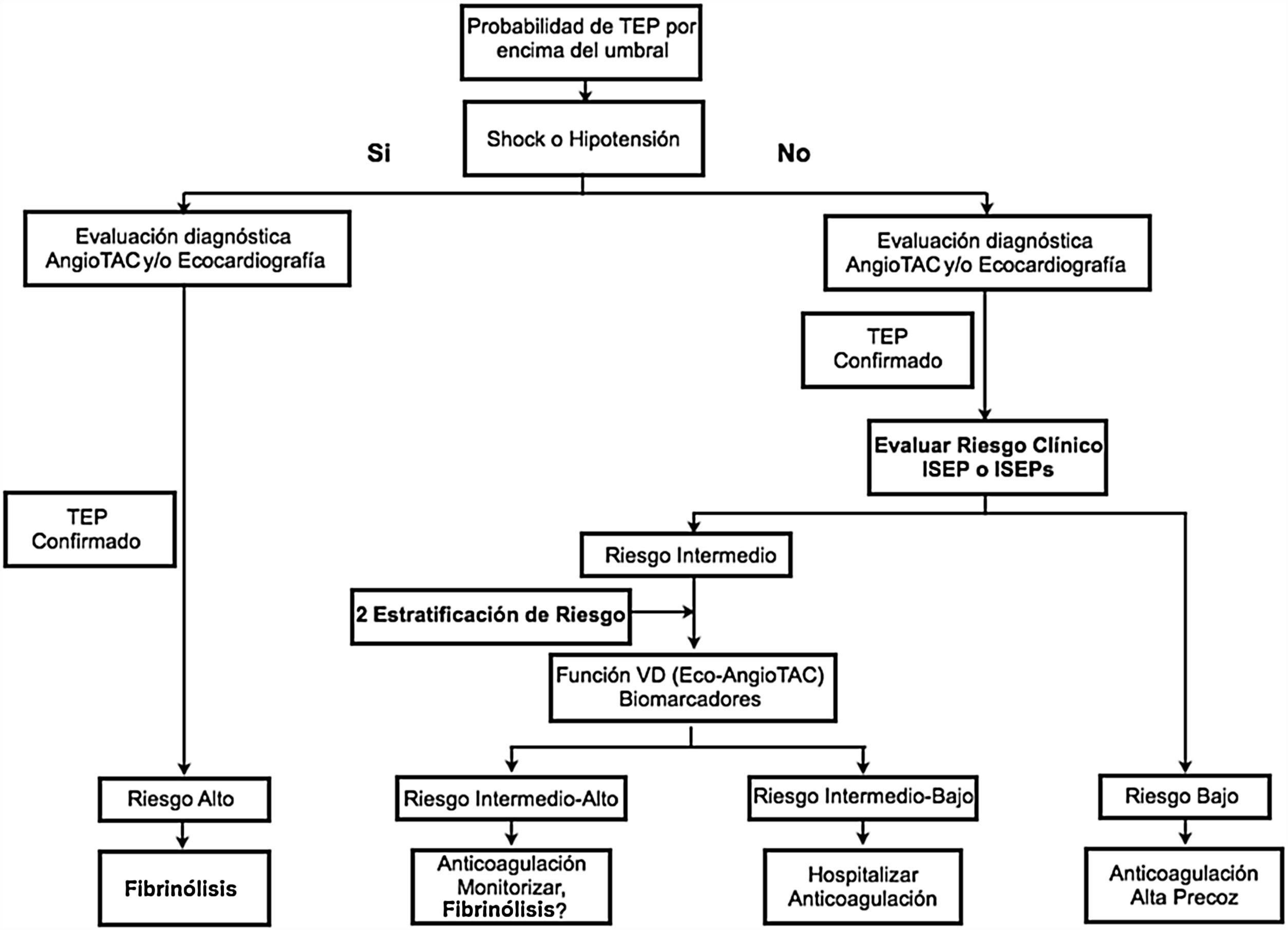
La fibrinólisis se considera razonable en los pacientes con tromboembolia pulmonar “masiva” (o “de alto riesgo”, mortalidad temprana menor al 15%)3,5 que tengan un riesgo aceptable de complicaciones hemorrágicas (recomendación I, nivel de evidencia B), y puede considerarse en aquellos con tromboembolia pulmonar “submasiva” (o “de riesgo intermedio-alto”, mortalidad de 3-15%) con evidencia clínica de pronóstico adverso (inestabilidad hemodinámica nueva, insuficiencia respiratoria que empeora, disfunción ventricular derecha severa o lesión miocárdica) y riesgo bajo de complicaciones hemorrágicas (recomendación IIa, nivel de evidencia B). La recomendación para fibrinólisis en tromboembolia pulmonar depende, entonces, del riesgo temprano de mortalidad asociado con la embolia, en cuyo caso la severidad de la tromboembolia pulmonar debe entenderse como un estimado del riesgo de mortalidad temprana asociado con el evento, más que como la simple carga anatómica y la distribución de los émbolos intrapulmonares. Lo anterior se debe a que lo “masivo” de la tromboembolia pulmonar en cuanto al compromiso clínico que produzca dependerá no solo de la “carga de émbolos” en el pulmón, sino también, en parte, de la reserva cardiopulmonar previa del paciente. La decisión requiere una estimación individualizada del balance entre los riesgos y los beneficios de la terapia. Los beneficios potenciales incluyen resolución pronta de los síntomas, estabilización más rápida de las funciones respiratoria y cardiovascular sin la necesidad de ventilación mecánica o soporte vasopresor, disminución del daño del ventrículo derecho, mejoría en la tolerancia al ejercicio, mayor prevención de recurrencia de tromboembolia pulmonar y principalmente, mayor probabilidad de sobrevida. Entre los riesgos potenciales están la hemorragia incapacitante o fatal, incluida la hemorragia intracerebral, y el riesgo mayor de hemorragia menor que prolongue la hospitalización o que conlleve la necesidad de transfusión de derivados sanguíneos3,5.
Los criterios para definir los grupos de riesgo en tromboembolia pulmonar y definir el manejo son los siguientes:
- –
Tromboembolia pulmonar de riesgo alto o “masiva”: tromboembolia pulmonar que se presenta con hipotensión arterial sostenida o inestabilidad hemodinámica (presión arterial sistólica<90mm Hg por al menos 15 minutos o que requiere soporte inotrópico, que no se debe a otra causa, como arritmia, hipovolemia, sepsis o disfunción ventricular izquierda), un índice de shock mayor a 1 persistente (frecuencia cardíaca en latidos/min dividida por la presión sistólica), ausencia de pulso o bradicardia profunda persistente (frecuencia cardiaca menor a 40/min con signos o síntomas de shock). Requiere terapia de reperfusión farmacológica (fibrinólisis) o, en su defecto, intervencionista o quirúrgica.
- –
Tromboembolia pulmonar de riesgo intermedio: en quienes no hay hipotensión o inestabilidad hemodinámica, una vez confirmado el diagnóstico se efectúa una reestratificación del riesgo mediante una puntación de pronóstico clínico validada, como el ISEP (índice de severidad de la embolia pulmonar o PESI su sigla en inglés por pulmonary embolism severity index) o su versión simplificada, para distinguir entre riesgo intermedio y bajo. Los pacientes normotensos con ISEP mayor o igual a 3 o ISEP mayor o igual a 1 constituyen un grupo de riesgo intermedio (tabla 3). Los pacientes de riesgo intermedio de acuerdo con ISEP o ISEPs se deben clasificar con base en el estado del ventrículo derecho (ventrículo derecho) en respuesta a la sobrecarga de presión aguda por el embolia pulmonar (evaluada en ecocardiografía o en tomografía computarizada) y al aumento de biomarcadores cardiacos (elevación de troponinas preferencialmente). La disfunción del ventrículo derecho determinada por dilatación del mismo (diámetro ventricular derecho en apical 4 cámaras/diámetro ventricular izquierdo mayor a 0,9 en ecocardiografía o tomografía computarizada) o disfunción ventricular derecha en la ecocardiografía (hipocinesia de la pared libre, menos excursión sistólica del plano del anillo tricúspide o mayor velocidad del chorro de insuficiencia tricúspide) y la elevación de troponinas identifica un grupo de pacientes con riesgo intermedio alto que requieren una estrecha monitorización para la detección oportuna de deterioro hemodinámico y la necesidad de terapia de reperfusión (fibrinólisis) de rescate. Los pacientes de riesgo intermedio con ventrículo derecho normal en la ecocardiografía o la tomografía computarizada y valores normales de biomarcadores cardíacos (troponinas) pertenecen al grupo de riesgo intermedio bajo.
Tabla 3.Índice de severidad de la embolia pulmonar (ISEP) original y simplificado
Parámetro Versión original Versión simplificada Edad Edad en años 1 punto si edad mayor a 80 años Sexo masculino +10 puntos -- Cáncer +30 puntos 1 punto Insuficiencia cardiaca congestiva +10 puntos 1 punto Enfermedad pulmonar obstructiva crónica +10 puntos Pulso ≥ 110 lpm +20 puntos 1 punto Presión arterial sistólica<100mm Hg +30 puntos 1 punto Frecuencia respiratoria>30 +20 puntos -- Temperatura<36°C +20 puntos -- Estado mental alterado +60 puntos -- Saturación arterial<90% +20 puntos 1 punto Estratos de riesgo Clase I: ≤ 65 puntos (0-1,6%)Clase II: 66 a 85 puntos (1,7 -3,5%)Clase III: 86 a 105 puntos (3,2 a 7,1%)Clase IV: 106 a 125 puntos (4 a 11,4%)Clase V:>125 (10 a 24,5%)Riesgo de muerte a 30 días 0 puntos: 1% (IC95% 0 a 2,1%)≥ 1 punto 10,9% (IC95% 8,5 a 13,2%)Riesgo de muerte a 30 días - –
Tromboembolia pulmonar de riesgo bajo: pacientes normotensos con ISEP menor a 3 o ISEP 0, con biomarcadores negativos (troponinas) y sin alteraciones en el ventrículo derecho en ecocardiografía o angiotomografía computarizada de tórax.
En resumen, de acuerdo con los datos disponibles se pueden beneficiar potencialmente de la fibrinólisis los pacientes que tengan evidencia de shock (presión arterial sistólica menor a 90mm Hg o índice de shock mayor a 1), evidencia de insuficiencia respiratoria (hipoxemia menor al 95% con oxígeno ambiente, score de disnea de Borg mayor a 8 o alteración del estado mental) o pacientes normotensos con ISEP mayor o igual a 3 o ISEPs mayor o igual a 1 de riesgo intermedio-alto con evidencia de estrés significativo del ventrículo derecho (dilatación o hipocinesia del ventrículo derecho, presión sistólica del ventrículo derecho mayor a 40mm Hg o elevación de biomarcadores, como las troponinas, y que no tengan contraindicación para la misma (fig. 1).
Algoritmo propuesto para definir el uso de fibrinolíticos en tromboembolia pulmonar. Biomarcadores: troponinas T o I y BNP=péptido natriurético cerebral. ISEP: índice de severidad de la embolia pulmonar o PESI por las siglas en inglés: Pulmonary Embolism Severity Index) o su versión simplificada: ISEPs. TAC: tomografía axial computadorizada.
Adaptada de: Konstantinides SV, Torbicki A, Agnelli G, Danchin N, Fitzmaurice D, Galiè N, et al. Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014;35(43):3033-69, 3069a-3069k.
Vale la pena anotar que los esquemas de fibrinólisis aprobados oficialmente en tromboembolia pulmonar son por vía venosa sistémica (tabla 4). La recomendación anterior se basa en un estudio de 1988 que documentó que la fibrinólisis “selectiva” (en la arteria pulmonar) no aceleraba la lisis del trombo y causaba sangrado más frecuente en el sitio de acceso de los catéteres; sin embargo, en ese estudio no se administró el fibrinolítico directamente dentro del trombo y tampoco se intentó la fragmentación mecánica del mismo6. Evidencia más reciente sugiere que la fibrinólisis con catéter tiene ventajas potenciales sobre la sistémica: combina los componentes diagnóstico y terapéutico, es posible monitorizar los efectos del tratamiento en tiempo real por angiografía y por medición directa de la presión pulmonar, y adicionalmente permite realizar fragmentación mecánica y aspiración de los trombos. Lo anterior aumentaría el área de superficie del trombo expuesta al trombolítico y permitiría disminuir la dosis del medicamento, lo que redundaría en una incidencia potencialmente menor de complicaciones. Para optimizar la ventaja de la administración selectiva del fibrinolítico es importante que el mismo se administre dentro del trombo y no proximal a este; de no ser así, el medicamento liberado proximalmente no entrará en contacto con el émbolo distal debido a que el vórtice del flujo producido por la obstrucción hará que el remolino produzca un lavado rápido del medicamento hacia las arterias pulmonares no obstruidas. Adicionalmente, algunos investigadores han sugerido que para disminuir el riesgo de complicaciones se termine el procedimiento tan pronto como se logre la estabilidad hemodinámica, sin importar el resultado angiográfico6,16.
Esquemas de fibrinólisis aprobados en tromboembolia pulmonar (sistémicos)
| Estreptoquinasa: bolo de 250 UI en 30 minutos, seguido por infusión de 100.000 UI/hora por 12-24 horasEsquema acelerado: 1.5 millones de UI en 2 horasUroquinasa: bolo de 4.400 UI en 10 minutos, seguido por infusión de 4,40 UI/kg/hora por 12-24 horasEsquema acelerado: 3 millones de UI en 2 horasrtPA: 100mg en 2 horas o 0,6 mg/kg en 15 minutos (máximo 50 mg) |
| rtPA=activador tisular del plasminógeno recombinante |
Adaptada de: Torbicki A, Perrier A, Konstantinides S, Agnelli G, Galiè N, Pruszczyk P., et al. Guidelines on the diagnosis and management of acute pulmonary embolism: the Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). Eur Heart J. 2008;29(18):2276-315.
Las recomendaciones actuales para uso de fibrinólisis selectiva con catéter en tromboembolia pulmonar son:
- –
Clase IIa: en pacientes con tromboembolia pulmonar masiva con shock o hipotensión (riesgo alto) como alternativa para aquellos con fibrinólisis sistémica de dosis completa contraindicada por alto riesgo de sangrado, fibrinólisis fallida o shock antes de que la fibrinólisis sistémica pueda tener efecto (nivel de evidencia C).
- –
Clase IIb: en pacientes de riesgo intermedio alto si el riesgo hemorrágico predicho para la fibrinólisis sistémica es alto (nivel de evidencia B)3,5,27.
La fibrinólisis con catéter debe considerarse en centros con experiencia en este tipo de procedimientos en pacientes con trombosis venosa profunda iliofemoral asociada con compromiso circulatorio que amenaza la extremidad (por ejemplo flegmasia cerúlea dolens) (recomendación clase I, nivel de evidencia C), y es razonable en pacientes con deterioro sintomático o extensión rápida de los trombos a pesar de anticoagulación adecuada (recomendación clase IIa, nivel de evidencia B), siempre que el riesgo de sangrado sea bajo. También es pertinente considerar la fibrinólisis con catéter en pacientes cuidadosamente seleccionados, con trombosis venosa profunda iliofemoral, para disminuir la incidencia del síndrome postrombótico y siempre y cuando el riesgo de sangrado sea bajo (recomendación clase IIb, nivel de evidencia B). La selección de los pacientes deberá basarse en una evaluación cuidadosa de la severidad de los síntomas, las comorbilidades, la capacidad basal para la ambulación, la expectativa de vida, las preferencias del paciente para un manejo agresivo y la experiencia y disponibilidad de recursos locales7–11.
En principio, la última indicación (prevención del síndrome postrombótico)12,13,15 es más razonable en los pacientes con buena clase funcional y buena expectativa de vida (usualmente pacientes relativamente jóvenes), pues aunque en la mayoría de casos el síndrome postrombótico se desarrolla en los primeros dos años luego del episodio de trombosis venosa profunda, la incidencia acumulativa del mismo sigue aumentando posteriormente, según algunos reportes, aún hasta 10 a 20 años luego de la trombosis venosa, y el riesgo de sangrado con la fibrinólisis suele ser menor en los pacientes más jóvenes, lo que mejora la relación riesgo/beneficio. Adicionalmente, el aumento acumulativo de la incidencia del síndrome postrombótico con el paso de los años le resta valor a los ensayos clínicos con seguimiento a relativamente corto plazo, como el recientemente publicado estudio ATTRACT17, cuyo seguimiento fue a solo dos años.
La trombosis venosa profunda iliofemoral se refiere concretamente a la oclusión parcial o completa de cualquier parte de la vena femoral común o de las venas ilíaca externa o ilíaca común, con o sin compromiso de otras venas de la extremidad inferior o de la vena cava inferior. En la trombosis de la vena femoral superficial, la ruta primaria de colaterales por la que se realiza el drenaje de la extremidad es la vena femoral profunda, la cual drena a su vez en la vena femoral común. La importancia de la trombosis iliofemoral como un subgrupo concreto de trombosis venosa profunda proximal radica en que las trombosis por encima de la desembocadura de la vena femoral profunda (trombosis en o por encima de la vena femoral común) causan una obstrucción más severa al drenaje venoso, con síntomas iniciales más dramáticos y mayor incidencia de secuelas tardías (TEV recurrente y síndrome postrombótico). Adicionalmente, en la trombosis venosa profunda femoropoplítea la recanalización endógena de las venas del segmento femoropoplíteo y el desarrollo de colaterales con frecuencia mejoran el drenaje venoso de la extremidad y limitan la severidad del síndrome postrombótico. En contraste, una vena ilíaca trombosada raramente recanaliza de manera endógena, y la obstrucción venosa persistente produce mayor incremento de la presión venosa ambulatoria y aumento subsecuente de la incidencia de trombosis venosa profunda recurrente y síndrome postrombótico.
La remoción temprana de los trombos puede eliminar eficazmente la obstrucción venosa, preservar la función valvular, mantener la permeabilidad venosa tardía y prevenir el síndrome postrombótico4,9. La fibrinólisis dirigida con catéter es más eficaz que la fibrinólisis sistémica y produce menos complicaciones hemorrágicas debido a que facilita la obtención de concentraciones más altas del medicamento dentro del trombo con la utilización de dosis menores del mismo. Adicionalmente, la fibrinólisis con catéter facilita el uso de angioplastia con balón y stents cuando persisten obstrucciones venosas que podrían predisponer a trombosis venosa profunda recurrente (por ejemplo síndrome de compresión de la vena ilíaca izquierda, también llamado síndrome de May-Thurner o de Cockett)14,18,26. Por todo lo anterior, se recomienda la fibrinólisis con catéter sobre la fibrinólisis sistémica. Su eficacia es mayor en los primeros 14 días del inicio de los síntomas, y usualmente no se recomienda en trombosis venosa profunda crónica (mayor a 21 días de evolución) o cuando hay riesgo alto de complicaciones hemorrágicas16.
Trombosis venosa profunda proximal de una extremidad superiorSe puede considerar la fibrinólisis con catéter en trombosis venosa profunda de inicio reciente de una extremidad superior cuando hay edema extenso y/o impotencia funcional de la extremidad, el trombo compromete la mayor parte de las venas subclavia y axilar (trombosis axilo-subclavia), los síntomas tienen menos de 14 días, la expectativa de vida es mayor o igual a un año, el paciente tiene buen estado funcional y el riesgo de sangrado es bajo19,20. Como ocurre con la anticoagulación, la evidencia para avalar la fibrinólisis en miembros superiores se deriva en su mayor parte de los datos disponibles en fibrinólisis de miembros inferiores. Aunque las tasas de recanalización parecen satisfactorias, no se sabe si la fibrinólisis comparada con la anticoagulación sola disminuye el riesgo de trombosis recurrente, tromboembolia pulmonar o síndrome postrombótico en los pacientes con trombosis venosa profunda de una extremidad superior, aunque con cualquier tratamiento (fibrinólisis o anticoagulación), el síndrome postrombótico parece ser una complicación menos frecuente en la trombosis venosa profunda de miembros superiores que en la de los miembros inferiores. Pese a ello, el síndrome postrombótico es más común en algunos tipos de trombosis axilo-subclavia primaria, como en el síndrome de Paget-Schroetter (o trombosis de esfuerzo) o en el síndrome del opérculo torácico venoso, y en estos casos la mayoría de autores recomiendan con mayor fuerza la fibrinólisis dirigida con catéter para restablecer la permeabilidad venosa de manera más expedita y completa. Aunque no hay consenso al respecto, muchos autores recomiendan en este caso descompresión quirúrgica del opérculo torácico luego de la fibrinólisis con catéter, con mayor controversia sobre el momento de la misma; algunos la recomiendan temprano durante la misma hospitalización y otros sugieren realizarla luego de un periodo de anticoagulación de usualmente un máximo de tres meses21,22.
Trombosis de accesos para diálisisLa enfermedad renal crónica es considerada en Colombia como una de las enfermedades de alto costo. La incidencia en estado 5 (necesita terapia de reemplazo renal) en la población general es de 8,1 por cada 100.000 habitantes, mientras que la prevalencia es de 74.1 pacientes/100.000 habitantes, según el documento del Fondo Colombiano de Enfermedades de Alto costo29, que corresponde al menos a 359.222 pacientes. En 2016 la forma que requiere reemplazo renal tenía una prevalencia en Colombia según el mismo documento, de 77 pacientes por cada 100.000 habitantes lo que correspondió en ese año a 37.484 pacientes (58% hombres=21.749). El 97,7% de todos los pacientes que necesitaron terapia de reemplazo renal estaban afiliados al régimen contributivo o subsidiado (36.628 pacientes). De ellos 19.388 están en hemodiálisis (14.094 pacientes con diálisis por fístula arteriovenosa [FAV] y 5.294 pacientes por catéter)
Uno de los factores que disminuye la eficiencia de la terapia de reemplazo renal es el acceso vascular con catéter según las guías DOQI30, de ahí que sea recomendable garantizar la permeabilidad de los accesos para reemplazo renal a largo plazo. Una técnica que permite reutilizar las fístulas cuando se ocluyen y utilizarlas de nuevo sin necesidad de colocar catéteres, es el manejo endovascular, una de cuyas herramientas técnicas es la fibrinólisis. La terapia endovascular consiste en eliminar farmacológica o mecánicamente el trombo, y luego corregir la lesión subyacente o causante de la trombosis, que puede ser una estrechez de una o varias venas que comunican la fístula con el corazón. Esto típicamente implica la infusión de un trombolítico, como el activador del plasminógeno tisular, solo o en conjunto con un dispositivo para trombectomía percutánea; posterior a ello puede realizarse una angioplastia para corregir cualquier estenosis o estrechez subyacente.
Este manejo se asocia con una tasa de éxito inicial del 73%, una tasa de permeabilidad primaria de 32% a un mes31 y una tasa de permeabilidad primaria del 34% al 50% a los doce meses32,33.
El tratamiento endovascular exitoso de accesos de hemodiálisis trombosados permite a los pacientes someterse a hemodiálisis inmediata sin la necesidad de colocar catéteres de diálisis temporales o el consumo quirúrgico de conductos venosos adicionales. La disponibilidad de estos enfoques en muchos centros médicos ha preservado una línea de vida y ha mejorado la calidad de vida de los pacientes en hemodiálisis35. Debe aclararse que los sitios para hacer las fístulas en el cuerpo humano son finitos (los dos brazos y las dos piernas) y que el tiempo de vida que el paciente tiene depende de la permeabilidad de estas fístulas. La trombosis de fístula debe tratarse lo antes posible, preferiblemente dentro de las 48 horas iniciales. La duración y el sitio de la trombosis de la fístula aurículo-ventricular, así como el tipo de acceso, son determinantes en el resultado del tratamiento36.
La fibrinólisis se puede realizar de forma mecánica o fármaco-mecánica37–39. Si bien la tasa de éxito inmediato es mayor en los injertos que en las fístulas aurículo-ventriculares autógenas (99 vs. 93% en las fístulas del antebrazo), la tasa de permeabilidad primaria de la fístula aurículo-ventricular del antebrazo al año es mucho mayor (49 frente a 14%). Las tasas de permeabilidad secundaria a un año son del 80% en el antebrazo y del 50% en las fístulas aurículo-ventriculares del brazo, respectivamente 40 En las FAV, la combinación de un agente trombolítico (uroquinasa o activador del plasminógeno tisular tPA) con angioplastia con balón dio como resultado una tasa de éxito inmediata del 94%; Andriani et al.41 informaron una tasa de éxito del 93% y una tasa de permeabilidad primaria en un año del 70%. Por su parte, Haage et al.42 realizaron 81 tratamientos percutáneos de fístulas aurículo-ventriculares trombosadas. La restauración de flujo se logró en el 88,9% de las FAV. La tasa de permeabilidad primaria a un año fue del 26%, mientras que la tasa de permeabilidad secundaria a un año del 51%.
En todos los casos y series descritas la utilidad del activador del plasminógeno rtPA es fundamental para el resultado final y por ende para el pronóstico de vida del paciente. El manejo y las dosis en casos de trombosis aguda de fístulas arteriovenosas para diálisis es igual al utilizado en trombosis venosa periférica32,33,41.
Recomendaciones generales para aumentar la eficacia y disminuir las complicaciones de la fibrinólisis selectiva con catéterNo existe un consenso en la literatura acerca de los protocolos utilizados para la fibrinólisis dirigida con catéter y el esquema puede variar de acuerdo con la enfermedad que se vaya a tratar y las características particulares del paciente. Sin embargo, con base en la evidencia disponible, frecuentemente muy limitada como se mencionó previamente, y de acuerdo con la experiencia reportada por los diferentes grupos que tratan estas entidades, se recomiendan las siguientes normas generales:
Seleccionar cuidadosamente el paciente, lo que implica definir que sí tenga una indicación clara para el procedimiento (ver antes: indicaciones) y que no tenga contraindicaciones para fibrinólisis (tabla 2).
Hospitalizar siempre en la UCE (o en la UCI si el estado clínico lo amerita), para monitorización, vigilancia estricta de la evolución y detección oportuna de las complicaciones hemorrágicas.
- •
Evitar al máximo punciones vasculares innecesarias, principalmente arteriales, incluso en sitios fácilmente compresibles (por ejemplo en la arteria radial), dado el riesgo que existe de sangrados severos en presencia de la terapia trombolítica. Uno de los errores más frecuentes en el cuidado de estos pacientes, principalmente en aquellos con tromboembolia pulmonar, es la toma repetida y rutinaria de muestras para gases arteriales, sin una indicación clara que vaya a cambiar realmente la conducta en el paciente. Si es necesario realizar una punción arterial, se recomienda dejar en el sitio un catéter pequeño (por ejemplo un jelco) y cuidar de manera diligente la hemostasia en el sitio de punción. También se deben evitar las punciones intramusculares.
- •
Utilizar una sedación y una analgesia suficientes que faciliten un reposo adecuado por parte del paciente, lo que disminuye el riesgo de sangrado por los sitios de acceso de los catéteres de fibrinólisis. Se utilizan diferentes esquemas que dependen de las características del paciente y del operador, pero que en general incluyen diferentes combinaciones de acetaminofén vía oral, bolos intravenosos de midazolam y fentanilo, y eventualmente benzodiacepina vía oral o un antihistamínico vía oral (tipo difenhidramina) para ayudar con la sedación.
No existe un consenso acerca de cuál es el fibrinolítico más adecuado ni la dosis óptima. La mayoría de la evidencia en este aspecto se deriva de estudios realizados en pacientes con enfermedad arterial periférica y estudios pequeños de dosificación, algunos de los cuales han incluido pacientes con trombosis venosa profunda. Los agentes fibrinolíticos estudiados incluyen agentes de primera generación, como la estreptoquinasa y la urokinasa, de segunda generación, como el activador del plasminógeno tisular (rtPA) y de tercera generación, como reteplase, tenecteplase y estafiloquinasa. Entre los fibrinolíticos disponibles en Colombia, existe alguna evidencia de que la estreptoquinasa produce más complicaciones hemorrágicas y adicionalmente es alergénica, de modo que no se recomienda. Adicionalmente y aunque no hay evidencia científica clara al respecto, la experiencia disponible sugiere que es menos eficaz que el alteplase (rtPA). Por otra parte, la experiencia con tenecteplase a una dosis de 0,25 a 0,5mg/hora o reteplase a una dosis de 0,25 a 0,75 IU/hora es más limitada en fibrinólisis selectiva con catéter. Por todo lo anterior, el fibrinolítico recomendado como de primera línea es el alteplase (rtPA), a una dosis usual de 0,01mg/kg/hora (0,5 a 1mg/hora). El fibrinolítico debe diluirse para permitir una infusión de un volumen mayor de la solución, lo cual maximiza la dispersión del medicamento dentro del trombo (ejemplo: 50mg de rtPA en un volumen total mínimo de 500ml, lo que da una concentración de 1mg/10ml). Generalmente, la dosis se debe ajustar en cada paciente con base en el juicio clínico y de acuerdo con las características del paciente, la severidad clínica y la extensión del proceso trombótico, la evolución de la lisis de los trombos en los controles angiográficos y el riesgo de sangrado. El catéter para la infusión de alteplase intraarterial debe estar embebido en el trombo, idealmente con un segmento de longitud adecuada con orificios laterales (pulse-spray) para facilitar la lisis del trombo.
No existe consenso en cuanto a la terapia anticoagulante concomitante. Con base en la poca evidencia disponible y para disminuir potencialmente la formación de nuevos trombos y a la vez el riesgo de complicaciones hemorrágicas se sugiere el uso concomitante de heparina no fraccionada en infusión a dosis bajas (200 a 500 U/hora), para mantener un TPT por debajo de 40 a 45 segundos.
Se sugiere obtener valores basales de fibrinógeno, TPTa y mediciones seriadas (cada 12 horas, según las circunstancias) hemoglobina (Hb) y hematocrito (Hto), recuento de plaquetas y TPTa. Esto permite detectar sangrados subclínicos y trombocitopenia inducida por heparin induced thrombocytopenia (HIT), y disminuye el riesgo de sobre anticoagulación (y por ende de complicaciones hemorrágicas). La fibrinólisis se considera activa cuando caen los valores de fibrinógeno, aumentan los productos de degradación de la fibrina y se prolongan un 50% los valores del TPTa. Aunque algunos monitorizan de manera seriada los niveles de fibrinógeno y recomiendan suspender la fibrinólisis si los mismos caen por debajo de 100mg/dl, la presencia o ausencia de depleción de este no se correlaciona de manera confiable con el riesgo de sangrado, y a este respecto pueden ser más útiles otros marcadores potenciales de sangrado inminente tales como sangrado en el sitio de acceso vascular, sangrados centinelas menores (ejemplo: epistaxis) o niveles elevados de TPTa. Cuando es necesario, también se monitorizan otros parámetros de laboratorio, como nitrógeno ureico en sangre (BUN) y creatinina en compromiso de la función renal, equilibrio ácido-base, ionograma y CPK total en reperfusión de isquemia aguda de una extremidad, y los exámenes adicionales que sean necesarios de acuerdo con la condición clínica del paciente.
Aunque no se recomiendan oficialmente se puede considerar el uso de antibióticos “profilácticos” mientras dure la fibrinólisis selectiva.
Se deben realizar angiografías de control cada 8-24 horas según la evolución clínica del paciente. En cada control se puede cambiar la posición del catéter de infusión para concentrar la administración del fibrinolítico en las zonas que tengan mayor carga de trombos residuales. Adicionalmente, en cada control se pueden utilizar dispositivos de trombectomía mecánica percutánea y maceración con balón de angioplastia o trombectomía de aspiración, todo lo cual puede aumentar el área de superficie del trombo residual y acelerar el proceso fibrinolítico. La infusión del medicamento debe ser por el período de tiempo más corto posible para disminuir el riesgo de complicaciones hemorrágicas y en general se desaconsejan infusiones mayores a 48 horas. En los pacientes con tromboembolia pulmonar se recomiendan infusiones por catéter no mayores de 24 a 36 horas.
FinanciaciónColegio Colombiano de Hemodinamia e Intervencionismo Cardiovascular.
Conflicto de interesesNinguno.
Grupo de actualización de la Guía Metodológica para el desarrollo de Guías de Práctica Clínica con Evaluación Económica en el Sistema General de Seguridad Social en Salud Colombiano. Guía Metodológica para la elaboración de Guías de Práctica Clínica con Evaluación Económica en el Sistema General de Seguridad Social en Salud Colombiano. Bogotá: Fundación Santa Fe de Bogotá, 2014. p. 98-102.