La enfermedad cerebrovascular tiene varias denominaciones; en la actualidad se habla globalmente de ataque cerebrovascular, términos en los que se abarcan tanto manifestaciones hemorrágicas como isquémicas. Las mujeres son una población especial, con un riesgo relevante y mayores implicaciones pronósticas. Comparado con los hombres, comorbilidades como la hipertensión y la fibrilación auricular tienen mayor impacto vital y funcional en las mujeres. En el manejo no hay consideraciones que las diferencien de manera contundente, excepto en las mujeres embarazadas que requieren un ajuste especial al tratamiento, y en algunos casos no hay suficiente información para emitir una recomendación.
Cerebrovascular disease has several names and it is currently referred to as stroke, which encompasses hemorrhagic and ischemic manifestations. Women are a special population, with a relevant risk and greater prognostic implications. Comorbidities such as hypertension and atrial fibrillation have a greater impact at a vital and functional level, compared to men. Regarding management, there are no considerations that differentiate them in a definitive way, except in pregnant women (who require a special adjustment to the treatment), and in some cases there is not enough data to issue a recommendation.
La enfermedad cerebrovascular tiene múltiples denominaciones en la literatura, pero hoy se conoce como “ataque” o “accidente cerebrovascular” (ACV). Recientemente, el Stroke Network avaló el uso del término “ataque cerebrovascular”, el cual puede ser secundario a isquemia o hemorragia intracerebral y se define como una disfunción cerebral aguda con desarrollo de signos y síntomas focales o globales, que duran más allá de 24 horas y pueden acarrear la muerte1,2.
Esta enfermedad es la segunda causa de muerte en el mundo, y es de gran importancia en el ámbito de la salud pública debido al gran impacto que tiene sobre la funcionalidad y el grado de dependencia que genera en los pacientes3–5.
Las mujeres representan un grupo especial, dado que existen múltiples factores que las predisponen a mayor riesgo de desarrollar un ACV. Entre estos se han descrito diferencias en los factores de coagulación, factores hormonales, genéticos, inmunes y también sociales que finalmente contribuyen a este riesgo aumentado6. Adicionalmente, la fibrilación auricular es una importante causa de ACV en este género, la cual se incluye en los puntajes de riesgo para desarrollar ACV, sobre todo en mujeres mayores de 65 años7.
EpidemiologíaVaría según los diferentes grupos poblacionales; en la actualidad es la segunda causa de muerte y la principal causa de discapacidad en el mundo1,3.
Aproximadamente 16 millones de personas en todo el mundo se ven afectadas por un ACV cada año, y la prevalencia anual estimada de sobrevivientes después de este evento es de más de 60 millones1,3,8.
Se ha descrito que la incidencia mundial de ACV isquémico es del 68%, mientras que la incidencia de ACV hemorrágico (hemorragia intracerebral y hemorragia subaracnoidea combinada) es de 32%. En Estados Unidos, la proporción de todos los ACV debido a isquemia, hemorragia intracerebral y hemorragia subaracnoidea es de 87, 10, y 3%, respectivamente9.
La incidencia del ACV está disminuyendo en los países de altos ingresos, incluyendo los Estados Unidos; sin embargo está aumentando en los países de bajos ingresos, y en consecuencia el número de personas en el mundo con discapacidad y dependencia secundaria es alta y creciente10,11.
En los Estados Unidos, la incidencia anual de ACV nuevo o recurrente es de aproximadamente 795.000, de los cuales unos 610.000 se presentan por primera vez, y 185.000 son recurrentes10.
Los datos epidemiológicos en Latinoamérica son limitados secundario a la falta de estudios epidemiológicos que abarquen toda la población; no obstante, se ha calculado que la incidencia de enfermedad cerebrovascular en Latinoamérica oscial entre 0,89-1,83/1.000 personas1,3.
En Colombia se han planteado diferentes estudios epidemiológicos para determinar la incidencia de esta enfermedad, entre los que está el estudio de prevalencia de factores de riesgo para enfermedad cerebrovascular isquémica en la población colombiana (FREC VI)12 y uno de los estudios más llamativos realizado en Sabaneta, Antioquia, el cual encontró una incidencia anual ajustada por edad y género de 0,89/1.000 personas, siendo más común en hombres que en mujeres (1,1/1.000 vs. 0,61/1.000 personas), cifra que se triplicó después de los 60 años1,3.
Respecto a la mortalidad, en Colombia se ha encontrado que es cercana al 15% a 30 días y se ha descrito que de cada 100 colombianos hospitalizados por un ACV, 37 tendrán algún grado de dependencia (Rankin <3) y 24 necesitarán asistencia para sus actividades de la vida diaria a los 30 días3.
El impacto sobre la calidad de vida, la productividad y el costo del cuidado de la salud es inmenso. Este se ha intentado evaluar con diferentes escalas en distintos estudios; sin embargo, no existe ninguna validada hasta ahora. Así mismo, se han descrito ciertos factores de riesgo que influyen en el pronóstico de estos pacientes, entre estos, la edad, la gravedad y el mecanismo del ACV, la localización, los hallazgos clínicos, las comorbilidades del paciente y las complicaciones relacionadas13,14.
En lo que respecta a los últimos años, se ha reportado una disminución de la incidencia de ACV en los estudios poblacionales de países desarrollados, la cual es más marcada en hombres que en mujeres (30,3 vs. 17,8%)14. No obstante, cabe resaltar que más mujeres son admitidas con ACV debido a la mayor expectativa de vida en este grupo15.
Mecanismos biológicos: estrógenos y progesteronaLas hormonas sexuales, incluidas la progesterona, los estrógenos y la testosterona, influyen en la fisiología vascular, la reactividad vascular, la barrera hematoencefálica y la aterosclerosis14. Los vasos sanguíneos y en particular la vasculatura cerebral, son blanco de acción de estas hormonas debido a la expresión de receptores específicos para las hormonas sexuales16.
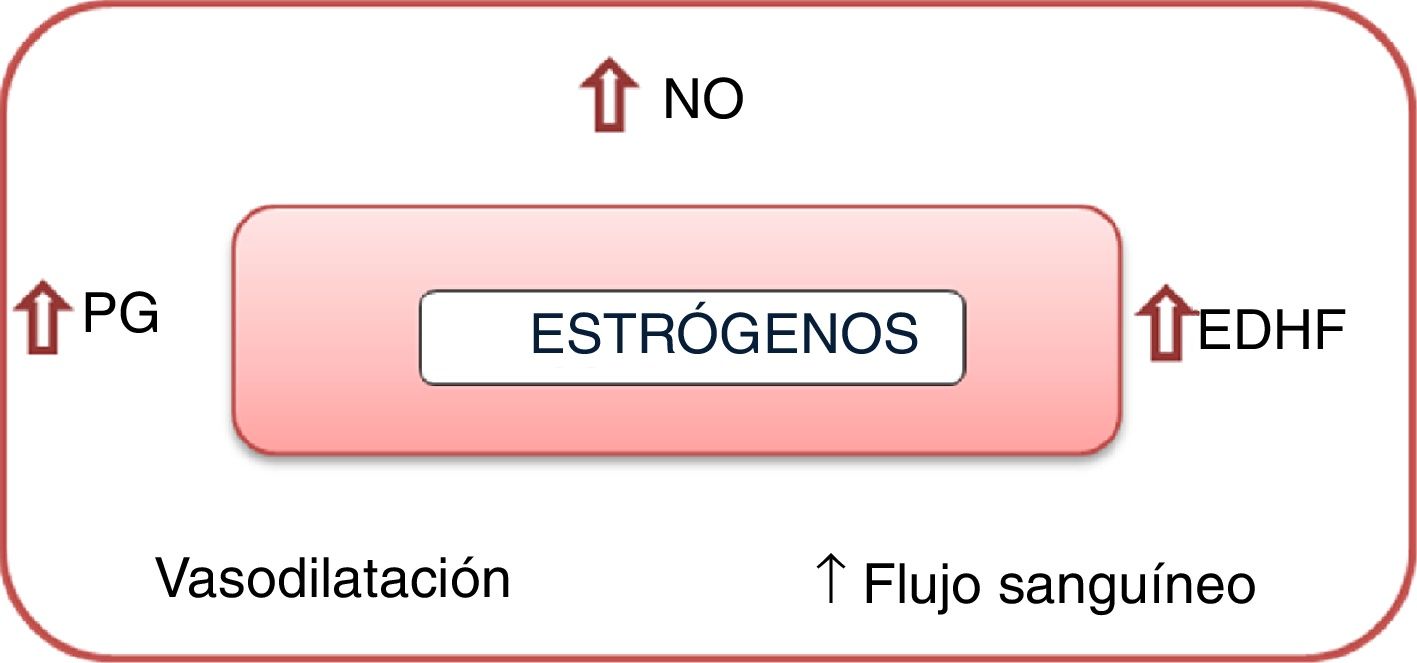
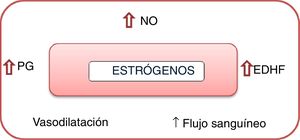
El estrógeno y la progesterona ejercen varios efectos sobre los vasos sanguíneos (fig. 1); entre estos está su efecto vasodilatador, que conlleva aumento en el flujo sanguíneo. Por otro lado, la testosterona tiene el efecto opuesto, pues lleva a la vasoconstricción de la vasculatura16.
Mecanismos de acción de los estrógenos sobre la vasculatura. PG: prostaglandinas; NO: óxido nítrico; EDHF: factor de hiperpolarización derivado del endotelio16.
Lo estrógenos mejoran la producción de óxido nítrico gracias al efecto sobre la óxido nítrico sintetasa endotelial. La reactividad vascular se ve afectada por aumento de la producción de óxido nítrico (NO), inducción de prostanoides vasodilatadores e influencia del factor de hiperpolarización derivado del endotelio (EDHF). Adicionalmente, al haber mayores niveles de NO circulante en las mujeres, hay mayores efectos sobre la barrera hematoencefálica y la autorregulación de la perfusión cerebral. En consecuencia, las arterias cerebrales masculinas tienden a tener un nivel más alto de vasoconstricción en respuesta a la presión arterial, comparado con las arterias cerebrales femeninas. Adicionalmente, el estrógeno mejora la sensibilidad de los vasos sanguíneos a sustancias vasodilatadoras e incluso puede llegar a contrarrestar los efectos vasoconstrictores de otras sustancias16.
El estrógeno y la progesterona reducen la formación de placas ateroscleróticas por sus efectos sobre las células del músculo liso, y es por esto que el primero ha sido considerado como posible tratamiento en la prevención de la enfermedad vascular en mujeres posmenopáusicas y se considera como agente protector en mujeres premenopaúsicas17.
Sin embargo, existe cierta controversia respecto al factor protector que se le atribuye a los estrógenos, ya que algunos investigadores sugieren que los niveles circulantes de andrógenos en hombres pueden tener efectos adversos sobre la vasculatura cerebral y por lo tanto explicar el mayor riesgo que tiene esta población, pero esto es un campo que requiere mayor investigación16.
Factores de riesgo específicos en mujeresExisten múltiples factores de riesgo para desarrollar un ACV, entre los que se han descrito algunos específicos del sexo femenino y otros que son más prevalentes en esta población (tabla 1)6. Más adelante se discutirá de manera detallada desde el punto de vista de la cardiología, algunos de los principales factores de riesgo descritos en mujeres.
Factores de riesgo de ACV en mujeres6
| Factores de riesgo específicos para el sexo femenino | Factores de riesgo más prevalentes en mujeres |
|---|---|
| • Embarazo | • Cambios en el estado hormonal |
| • Preeclampsia | • Migraña con aura |
| • Diabetes gestacional | • Fibrilación auricular |
| • Uso de anticonceptivos orales | • Diabetes mellitus |
| • Uso de hormonas en la postmenopausia | • Depresión |
| • Estrés psicosocial |
Dado que el riesgo de presentar eventos trombóticos aumenta durante el embarazo, se ha descrito una incidencia de ACV durante este período que oscila entre 9-34/100.000 partos en todo el mundo. Se postula que el aumento del riesgo de ACV durante el embarazo y el posparto, se debe a cambios hemostáticos que conducen a aumento de los factores de coagulación, disminución de factores anticoagulantes y factores fibrinolíticos. Adicionalmente, se ha descrito la resistencia a la proteína C, los niveles más bajos de proteína S y el aumento del fibrinógeno, que combinados conducen a un estado hipercoagulable que aumenta el riesgo de ACV17,19.
Los trastornos hipertensivos del embarazo conllevan riesgo adicional para el desarrollo de ACV isquémico y hemorrágico, por esto es de gran importancia su tamizaje y diagnóstico oportuno en las mujeres embarazadas. Al respecto, las guías de la American Heart Association (AHA) recomiendan el uso de Aspirina a bajas dosis desde las 12 semanas de gestación hasta el final del embarazo (clase I, nivel de evidencia A), así como el suplemento de calcio diario en mujeres embarazadas que padecen hipertensión arterial6.
En cuanto al manejo antihipertensivo se recomienda el uso de medicamentos seguros y eficaces tales como metildopa, labetalol y nifedipino, teniendo en cuenta los efectos secundarios maternos y fetales (clase I, nivel de evidencia A)6. Adicionalmente, se debe tener en cuenta que el atenolol, los bloqueadores de los receptores de angiotensina y los inhibidores directos de la renina están contraindicados durante el embarazo y no deben utilizarse por sus efectos teratogénicos6.
En lo concerniente a la vigilancia de las mujeres con hipertensión crónica, se recomienda continuar con sus regímenes antihipertensivos habituales con los ajustes de dosis y medicamentos necesarios, y adicionalmente ser monitorizadas de cerca por el riesgo de preeclampsia postparto6.
Trombosis de los senos venosos en el embarazoLa trombosis de los senos venosos (TSV) es otra de las presentaciones clínicas del ACV en mujeres y se describe con mayor frecuencia en el embarazo18. En una gran serie de pacientes con TSV el 75% eran mujeres, de las cuales el 17% estaban embarazadas o en período posparto19.
La sintomatología en el embarazo no difiere de las mujeres no embarazadas, reportándose con mayor frecuencia la aparición de una cefalea aislada intensa19.
Una revisión sistemática reciente encontró que el riesgo de TSV y otros tromboembolismos venosos durante el embarazo aumentan después de una TSV previa, encontrándose una recurrencia hasta en 9/1000 embarazos. Por consiguiente, el riesgo de TSV es lo suficientemente bajo para no aconsejar en contra de futuros embarazos en estas mujeres, pero se recomienda llevar un seguimiento cercano en caso de que se den, así como medidas para prevenir futuros eventos tromboembólicos20.
La anticoncepción oralEl consumo de anticonceptivos orales (ACO) en mujeres se ha asociado con un aumento del riesgo de ACV. Esto puede deberse a los efectos procoagulantes de los estrógenos y la progesterona, que conllevan aumento de la actividad de factores de coagulación como el fibrinógeno y a su vez, a la disminución de factores anticoagulantes21.
Un metaanálisis realizado por Gillum et al22., que analizó 16 diferentes estudios, encontró que las mujeres que consumían ACO tenían un riesgo relativo (RR) de 2,75 (intervalo de confianza -IC- 95% de 2,24-3,38) para desarrollo de ACV22. Adicionalmente, este estudio encontró que aquellas mujeres que tomaban dosis bajas de estrógenos (<0,5μg) tenían RR de 2,08 (IC 95% 1,55-2,8), menor comparado con aquellas que ingerían una dosis mayor (> 0,5μg) RR 4,53 (IC 95% 2,17-9,5)22.
Existen varios factores de riesgo modificables en la población femenina, los cuales incrementan el riesgo de desarrollar un ACV con el consumo concomitante de ACO. Entre estos se encuentran el tabaquismo, la hipertensión arterial, la cefalea y la historia de tromboembolia pulmonar o de miembros inferiores. En el estudio de Ryan et al23., se encontró que las mujeres con más de un factor de riesgo de los mencionados, eran más susceptibles a un ACV con el uso de ACO, con un OR 3,12 (IC 95% 1,62–6,00). Adicionalmente, encontraron que la combinación de factores más riesgosa era para aquellas mujeres con tabaquismo y cefalea23.
Sin embargo, el riesgo adicional de ACV que conlleva el consumo de anticonceptivos en la población femenina, no supera su beneficio en el manejo adecuado de la anticoncepción y los embarazos no deseados.
Visión desde la Cardiología clínica del problema del ataque cerebrovascular en mujeresLa enfermedad cerebrovascular debe ser una entidad que se aborde de manera integral, no solo por Neurología; por tanto, especialistas como cardiólogos e internistas, deben intervenir en el enfoque y manejo óptimo de esta entidad. Existen varios factores de riesgo, muchos ya mencionados previamente6. Pero tal vez la principal preocupación y el motivo principal de interconsulta de Neurología para los cardiólogos es el contexto de un ACV de fuente indeterminada, y ante la alta sospecha de cardioembolia, como causa más prevalente del evento isquémico, se promueve una búsqueda eficaz y completa24.
Se reporta que la fibrilación auricular (FA) es la arritmia más común en el mundo, la cual se asocia con morbimortalidad, y es una causal de cardioembolia, produciendo los ACV descritos como más graves y discapacitantes si se comparan con otras etiologías de ACV15,25.
El riesgo de desarrollar esta arritmia es 1,2-2,0 veces mayor en hombres, pero tiende a ser más prevalente en mujeres, dado que estas tienen una expectativa de vida más larga y representan una mayor proporción en la población25.
El riesgo atribuible de ACV por FA aumenta con la edad, y llega a ser hasta 4 a 5 veces más probable; por esto se calcula que habrá un número creciente de mujeres de edad avanzada con diagnóstico de FA26.
En la publicación “Get with the guidelines stroke”, un tercio de los ingresos hospitalarios por ACV fueron pacientes ≥ 80 años de edad, entre los que identificó FA en el 15,6 y 20,4% de los hombres y las mujeres, respectivamente (p <0,0001)27.
Las mujeres con FA reciben en menor proporción tratamiento anticoagulante en comparación con los hombres (88% contra 89,7%, OR ajustado, 0,93, IC del 95%, 0,88-0,98) por razones que no son claras hoy en día28.
Para definir quienes se benefician de manera objetiva del tratamiento anticoagulante, se han elaborado herramientas de estratificación del riesgo, como el puntaje CHA2DS2-VASc, que es útil para guiar la toma de decisiones para la instauración de terapia anticoagulante y la prevención de ACV isquémico cardioembólico29.
En esta escala se tiene en cuenta la historia de falla cardiaca (1 punto), hipertensión arterial (1 punto), edad entre 65 y 74 años (1 punto), 75 años o más (mayor riesgo, 2 puntos), antecedente de ACV previo (2 puntos), enfermedad vascular previa (1 punto) y sexo femenino (1 punto si se adiciona a otro factor de riesgo)7,29.
La clasificación de CHA2DS2-VASc se recomienda ampliamente incluso por la Sociedad Europea de Cardiología y por la AHA para la clasificación de riesgo de ACV30,31.
El sexo femenino es, por tanto, un predictor independiente del ACV en pacientes con FA y se ha comprobado con diferentes estudios, con grandes cohortes de pacientes la interacción edad-sexo en aquellos con FA, encontrándose mayor riesgo de ataque cerebrovascular en mujeres de 75 años o más, en comparación con los hombres26,32.
En guías actuales, tanto americanas como europeas, se coincide en anticoagular con un puntaje de CHA2DS2-VASc mayor o igual a 2 con indicación IA30. Sin embargo, los últimos consensos dejan la posibilidad abierta para anticoagular a criterio clínico aquellos pacientes con CHA2DS2-VASc de 1 en hombres y 2 en mujeres31.
Sin embargo, se deben tener en cuenta varias consideraciones. Primero, no todos los factores de riesgo en el CHA2DS2-VASc tienen igual peso, y la tendencia probablemente deba ser plantear anticoagulación oral para pacientes con fibrilación auricular y al menos un factor de riesgo para ACV, balanceando el riesgo de sangrado y decidiéndolo en conjunto con el paciente31.
Segundo, se debe tener en cuenta que de acuerdo con el puntaje, el riesgo anual se incrementa; por ejemplo, se describe que con CHA2DS2-VASc de 1 el riesgo es de 1,3%, y el máximo puntaje que es 9da un riesgo de 15,2%29.
Por tanto, es importante considerar la anticoagulación con puntaje de 1, pues el riesgo no equivale a cero y hay estudios con gran cantidad de pacientes en los que se ha descrito un riesgo aumentado de ACV incluso en aquellos con CHA2DS2-VASc=1 (y eran de sexo masculino), de ahí a que las más recientes guías europeas, pongan a consideración anticoagular estos pacientes7.
Sin embargo, conviene aclarar que si el único factor de riesgo es ser mujer, para poder sumar esta condición se debe tener al menos un factor de riesgo adicional, como edad mayor o igual a 65 años. En las guías europeas más recientes, si se es mujer se tiene un factor de riesgo adicional (puntuaría 2) y se plantearía anticoagulación, pero si solo se es mujer sin otro factor de riesgo puntuaría 1 y no se anticoagularía ni se antiagregaría (la antiagregación sola no previene eventos en pacientes con FA y sí aumenta el riesgo de sangrado). Adicionalmente, en los hombres que puntúen 1, se da la opción de anticoagular (recomendación IIaB)31.
Respecto al diagnóstico, cardiólogos y neurólogos deben estar encaminados a descartar etiología embólica, y como ya se mencionó previamente la fibrilación auricular es una causa líder y se debe precisar su diagnóstico mediante diferentes métodos, inicialmente electrocardiograma (ECG); es común que se inicie con la solicitud de un Holter electrocardiográfico. Sin embargo, el rendimiento diagnóstico del Holter electrocardiograma (ECG) de 24 horas, suele ser bajo para diagnosticar FA y depende de la frecuencia en que se presenten los síntomas (palpitaciones principalmente)33.
Es por esto que cada vez hay mayor evidencia de la monitorización de eventos con registros electrocardiográficos más extensos que van desde semanas a meses con monitores externos o implantables, y se ha encontrado que aquellos ACV criptogénicos o de fuente indeterminada son explicados por una FA no diagnosticada por métodos convencionales34,35.
Por otro lado, las modalidades diagnósticas imagenológicas como el ecocardiograma, aportan al diagnóstico y abordaje integral en el estudio etiológico del ACV, para descartar trombos intracavitarios, evaluar la función ventricular y el tamaño de las aurículas, así como tamizar defectos septales. De acuerdo con las necesidades diagnósticas y las características del paciente se recomendará abordaje transtorácico o transesofágico. En este contexto cada vez se describen más pacientes con tamaño aumentado de la aurícula izquierda (volumen>34ml/m2, o> 40mm en 2D) y su relación con ACV recurrente o de causa indeterminada, y a su vez este hallazgo se relaciona con aparición de fibrilación auricular e incapacidad de mantener ritmo sinusal con antiarrítmicos, y por consiguiente mayor riesgo de ACV36,37.
Otras causas menos frecuentes son el foramen oval persistente del cual hay controversia entre cerrar y no cerrar el defecto. En caso de no haber encontrado otra causa de ACV y en pacientes con historia de ACV o ataque isquémico cerebral transitorio (AIT) previo, podría indicarse el cierre percutáneo del defecto; sin embargo es una recomendación que no es fuerte y no es la causa más frecuente en mujeres, pero se ha descrito incluso en el embarazo38–40.
En cuanto al tratamiento y la prevención de ACV tanto por guías y sobre todo por la evidencia actual, los anticoagulantes directos (DOAC)- rivaroxabán, apixabán, dabigatrán y edoxabán- estarían indicados con un nivel de evidencia y recomendación IA, al igual que los antagonistas de la vitamina K (AVK); no obstante, se recomienda el uso de los primeros, por encima de los segundos, dado su menor riesgo de sangrado, y por tanto mejor balance clínico neto, así como menor interacción con medicamentos o alimentos y adicionalmente seguridad sin necesidad de monitorización como sí es imprescindible en el caso de los AVK31,41.
Otras comorbilidades y/o factores de riesgo para ACV en mujeres en las que los cardiólogos deben intervenir, es en el control adecuado de la hipertensión arterial y de la dislipidemia6.
El control óptimo de la presión arterial en pacientes con ACV incluye el uso de inhibidores de la enzima convertidora de angiotensina (IECA) o antagonistas del receptor de angiotensina II (ARA II) en combinación con calcio-antagonistas y/o diuréticos tiazídicos, de acuerdo con las cifras de presión arterial y metas que se quieran lograr con base en la edad (menos de 140/90mm Hg y en mayores de 60 años menos de 150/90mm Hg)6,42.
Los pacientes con enfermedad cerebrocardiovascular deberán recibir estatinas de alta intensidad (atorvastatina 40-80mg día y rosuvastatina 20 – 40mg día), y buscar mantener un colesterol de baja densidad (LDL), idealmente menor a 70mg/dl en prevención secundaria, así como promover estilos de vida saludable, dieta balanceada, prevención y tratamiento de la obesidad6,43.
Severidad del ataque cerebrovascular en mujeres y hallazgos neurológicos particularesLas mujeres se manifiestan clínicamente con ataques cerebrovasculares más graves que los hombres. Se estima que la tasa de pacientes que presentan un puntaje del National institute of Health Stroke Scale (NIHSS)> 7 (por tanto mayor severidad), corresponde en un 44% de mujeres y a un 36% de hombres15.
Las mujeres con mayor frecuencia presentan síntomas inusuales, y con menor periodicidad se describen síntomas como disartria, ataxia y parestesia. Por ejemplo, en las mujeres se observa mayor pérdida de sueño e inconsciencia (26,7%) que en hombres (19,7%), basándose en los datos del International Stroke Trial44.
En resumen, las mujeres pueden tener un perfil ligeramente diferente en la presentación clínica que los hombres, hecho que infortunadamente causa un diagnóstico tardío y a su vez, puede conducir a la demora de su tratamiento, reduciendo así la oportunidad de un pronóstico favorable45.
En consecuencia, esto se traduce en una estancia hospitalaria más larga y morbilidad y mortalidad elevadas. Por ende, es fundamental emprender más investigaciones y estudios para abordar esta problemática y alertar a los médicos clínicos a estar más alerta a identificar banderas rojas y signos de alarma tempranos46.
Particularidades del tratamiento en mujeresEn la actualidad, el tratamiento del ACV en hombres y mujeres se hace con base en guías y no diferencia un sexo del otro, a menos que se trate de contextos como el embarazo o de estrategias preventivas, como se mencionó, cuando hay relación FA y ACV2.
Sin embargo, en cuanto a la evidencia aportada por la literatura, las mujeres están generalmente subrepresentadas en los estudios clínicos aleatorizados y esto limita la extrapolarización de los hallazgos a esta población. En la mayoría de los estudios los hombres representan al menos dos tercios de la muestra y la edad media permanece por debajo de los 70 años25.
Una de las terapias de mayor impacto tanto en sobrevida como en pronóstico funcional evaluada por la escala de RANKIN, es una trombólisis oportuna en el tiempo de ventana establecido por guías, es decir 4,5 horas para trombólisis endovenosa y hasta 6 horas para manejo intraarterial y endovascular47–50. En cuanto a la terapia trombolítica, no hay indicaciones de diferencias de género en cuanto a beneficio y riesgo51.
Respecto al tratamiento endovascular, un metaanálisis de cinco ensayos no encontró diferencias de género acerca del efecto del tratamiento ajustado en la escala de Rankin modificada a los 90 días. En lo concerniente a esta terapia se ha visto una tendencia a una menor estancia hospitalaria en hombres comparado con mujeres, lo cual puede deberse a que los hombres tienden a presentar esta condición a una edad menor que las mujeres y usualmente con cuadros clínicos menos severos47.
En las intervenciones de arteria carótida, se han reportado diferencias significativas de género. El sexo femenino se considera un riesgo quirúrgico con endarterectomía, que conduce a una frecuencia más alta de ACV y muerte perioperatoria.
El manejo endovascular con stents carotídeos también parece tener una incidencia más alta de eventos adversos en mujeres52.
En cuanto a fibrilación auricular, un metaanálisis sobre las diferencias de género, evaluó la seguridad y eficacia de antagonistas de la vitamina K (AVK) y anticoagulantes orales directos (DOAC), reportándose una tendencia hacia una mayor protección contra la tromboembolia en mujeres junto con un menor riesgo de hemorragia con la administración de DOAC; sin embargo, el tiempo en rango terapéutico (TRT) para AVK no se incluyó en el análisis, lo cual deja cierta incertidumbre sobre la influencia en los resultados53.
Hay varias consideraciones en cuanto a las particularidades que pueden influir en la respuesta a las diferentes terapias del ACV en mujeres, y se requieren más estudios para esclarecerlo; sin embargo se han descrito algunas como por ejemplo: mayor edad de presentación, que hace más probables las complicaciones, mayor número de comorbilidades y mayor probabilidad de polifarmacia (más interacciones farmacológicas)54.
ConclusionesLa enfermedad cerebrovascular en la mujer tiene varias particularidades, que van desde su etiología hasta su pronóstico. Los factores hormonales propios del sexo, el uso de anticonceptivos orales y situaciones como el embarazo influyen de manera importante en su presentación. Infortunadamente en las mujeres, el ACV se presenta a edades más avanzadas lo cual se asocia con peor pronóstico funcional y vital. En condiciones especiales como el embarazo se debe hacer control óptimo de los factores de riesgo debido a la ausencia de terapias eficaces con evidencia concreta.
La enfermedad cerebrovascular requiere manejo multidisciplinario para lograr la prevención y el control de los factores de riesgo, como también en el tratamiento de comorbilidades como la fibrilación auricular, la hipertensión arterial, las dislipidemias y la obesidad.
Es clave que en los próximos años se desarrollen estudios que incluyan específicamente una muestra significativa de mujeres, que permitan entender mejor la etiología, el diagnóstico y el tratamiento del ACV en mujeres.
Conflicto de interesesNinguno.