El sangrado es la principal complicación no cardiaca relacionada con la intervención coronaria percutánea y se asocia a un aumento en el riesgo de eventos adversos. Actualmente existen varias escalas para definir riesgo de sangrado y varias definiciones de sangrado. El objetivo es determinar los factores asociados con la presencia de sangrado en pacientes con síndrome coronario agudo sometidos a intervención coronaria percutánea, utilizando la escala de Bleeding Academic Research Consortium y posteriormente ofrecer recomendaciones.
Materiales y Métodosestudio observacional analítico tipo casos y controles en pacientes con síndrome coronario agudo sometidos a intervención coronaria percutánea a quienes se aplicó la escala de Bleeding Academic Research Consortium. Los casos fueron definidos por pacientes que presentaron sangrado posterior al procedimiento (Bleeding Academic Research Consortium tipo 1-5) y los controles por pacientes que no presentaron sangrado (Bleeding Academic Research Consortium tipo 0).
ResultadosSe seleccionaron 366 pacientes (121 casos, 245 controles). El 33% de pacientes presentaron algún tipo de sangrado distribuidos así: tipo 1: 12%, tipo 2: 13,4%, tipo 3: 7,3% y tipo 5: 0,3%. En el análisis multivariado los predictores más importantes de sangrado estadísticamente significativos fueron: sexo femenino, tratamiento con warfarina y uso de tirofiban durante la intervención coronaria percutánea.
ConclusionesEl sangrado es un evento frecuente en la intervención coronaria percutánea, encontrando que utilizando la clasificación de Bleeding Academic Research Consortium la mayoría de los sangrados fueron tipo 1 y 2. Los factores de riesgo para sangrado descritos a nivel mundial, son parecidos a los del estudio. El sexo femenino, el uso de warfarina y uso de tirofibán fueron estadísticamente significativos.
Consideramos que un buen instrumento para definir tipo de sangrado es la escala de Bleeding Academic Research Consortium.
Bleeding is the main non-cardiac complication related to percutaneous coronary intervention and it is associated to an increase of the risk of adverse events. Nowadays there are multiple scales to define risk of bleeding and several definitions for bleeding. The goal is to determine factors associated to the presence of bleeding in patients with acute coronary syndrome undergoing percutaneus coronary intervention, using the the Bleeding Academic Research Consortium scale to then issue recommendations.
Material and methodsCase-control analytical observational study in patients with acute coronary syndrome undergoing percutaneous coronary intervention applying the Bleeding Academic Research Consortium scale. Cases were defined by patients who presented bleeding following the surgery (Bleeding Academic Research Consortium type 1-5) and controls by patients who did not show bleeding (Bleeding Academic Research Consortium type 0).
Results366 were selected (121 cases, 245 controls). 33% of the patients showed some type of bleeding, divided into: type 1: 12%; type 2: 13.4%; type 3: 7.3% and type 5: 0.3%. Multivariate analysis of most important predictive factors for bleeding that were statistically significant were: female gender, warfarin treatment and use of Tirobifan during percutaneus coronary intervention.
ConclusionsBleeding is a frequent event during percutaneus coronary intervention. According to the Bleeding Academic Research Consortium classification, most bleedings were of types 1 and 2. Risk factors for bleeding described worldwide are similar to those of this study. Female gender, warfarin treatment and use of Tirobifan were statistically significant. Bleeding Academic Research Consortium scale is considered a good indicator to define bleeding types.
El sangrado es la principal complicación no cardiaca relacionada con la intervención coronaria percutánea y se encuentra asociado a un aumento en el riesgo de desenlaces adversos como: la muerte, el infarto agudo de miocardio, el ataque cerebrovascular, la trombosis del stent y de manera adicional, el aumento en los tiempos de estancia hospitalaria y los costos en la atención1–3.
Las complicaciones hemorrágicas ocurren entre 1 a 15% durante el tratamiento del síndrome coronario agudo (SCA) y después de la intervención coronaria percutánea; este porcentaje varía, dependiendo de muchos factores como: la situación clínica, la complejidad de la población tratada, la experiencia del centro y la definición empleada para clasificar el sangrado.
Actualmente, existen varias escalas para definir el riesgo de sangrado como los que se describen en los siguientes estudios: GRACE (Global Registry of Acute Coronary Events), REPLACE (Randomized Evaluation in Percutaneous Coronary Intervention Linking Angiomax to Reduced Clinical Events), STEEPLE (Safety and Efficacy of Enoxaparin in PCI Patients, an International Randomized Evaluation), ACUITY (Acute Catheterization and Urgent Intervention Triage strategY), HORIZONS–AMI (Harmonizing Outcomes with Revascularization and Stents in Acute Myocardial Infarction) y el puntaje del registro CRUSADE (Can Rapid risk stratification of Unstable angina patients Suppress Adverse outcomes with Early implementation of the ACC/AHA guidelines) Bleeding Score; estos estudios han establecido puntajes para estratificar a los pacientes entre: bajo, moderado y alto riesgo de sangrado intrahospitalario, y esto se correlaciona con la morbimortalidad3–8. De manera adicional las definiciones de sangrado varían de acuerdo a los diferentes autores e investigaciones. Las definiciones más utilizadas en las diferentes publicaciones son: TIMI, GUSTO, NCDR, CURE, ACUITY, HORIZONS, CURRENT–OASIS 7, STEEPLE, PLATO, GRACE, REPLACE–2, ISAR–REACT 3, ESSENCE; todas muy útiles, pero tienen muchas limitaciones, dentro de estas se encuentran, por ejemplo: haber sido realizadas en la era fibrinolítica, los niveles utilizados de hemoglobina y hematocrito son diferentes, las indicaciones de transfusión cambian de acuerdo a las regiones geográficas, como conclusión no hay uniformidad de criterios y definiciones.
En respuesta a la necesidad de desarrollar y estandarizar las definiciones de sangrado para los pacientes que reciben tratamiento antitrombótico, y que puedan ser utilizados en estudios y registros, en el año 2010 se realizó un consenso donde participaron: los académicos, la FDA (Food and Drug Administration), the National Institutes of Health, organizaciones de estudios clínicos, la industria de medicamentos y dispositivos, presentando un reporte de consenso llamado Consorcio de Investigación Académica del Sangrado “Bleeding Academic Research Consortium” (BARC), ellos establecieron las definiciones de sangrado para estudios clínicos cardiovasculares en cinco grupos: tipo: 0 no sangrado; tipo 1: es un sangrado que no amerita atención médica; tipo 2: es un sangrado que requiere estudios diagnósticos, hospitalización o tratamiento por un profesional de la salud; tipo 3: con sus subtipos 3a (sangrado con descenso de la hemoglobina ≥ 3 a<5 gr/dl, que amerita transfusión), 3b (sangrado con descenso de la hemoglobina ≥ 5 gr/dl, que requiere intervención quirúrgica para controlar el sangrado, requiere medicamentos vasoactivos intravenosos y/o taponamiento cardiaco), 3c (incluye hemorragia intracerebral y sangrado intraocular que compromete la visión); tipo 4: incluye sangrado relacionado con la cirugía de puentes; hasta el tipo 5: sangrado fatal que lleva a la muerte. Esta clasificación aporta: una combinación de parámetros clínicos, de laboratorio, la causa del sangrado, el sitio, la severidad, el pronóstico, el diagnóstico y el tratamiento; además, de un sistema jerárquico detallado para la cuantificación de la gravedad de los episodios hemorrágicos1,2,4. (tabla 1).
Escala de sangrado “Bleeding Academic Research Consortium” (BARC)
| Tipo 0: sin sangrado. |
| Tipo 1: sangrado no significativo, no requiere estudios o consulta a un servicio médico, hospitalización o manejo por un profesional de salud. Puede incluir la suspensión voluntaria de la medicación antitrombótica por parte del paciente. Ejemplo: sangrado nasal, moretones, sangrado hemorroidal, en general, no se busca atención médica. |
| Tipo 2: Cualquier signo de hemorragia (cualquier sangrado que sea más de lo esperado, incluyendo sangrado solo identificado por un estudio de imagen), que no cumpla criterios para tipo 3, 4 o 5 pero que requiera al menos uno de los siguientes puntos: • Intervención médica no quirúrgica por parte de un profesional de salud (ejemplos suspender la medicación antiplaquetaria, antitrombótica, compresión en el sitio de sangrado, uso de medicamentos para revertir el efecto como: la protamina y la vitamina k). • Requiere hospitalización o aumento del nivel de cuidado. • Requiere evaluación pronta con exámenes como: el hemograma, el uroanálisis, las pruebas de coagulación, la endoscopia y la tomografía. |
| Tipo 3 • Tipo 3a: • Sangrado con descenso de la hemoglobina de ≥ 3 a<5g/dl (relacionado con el sangrado). • Cualquier necesidad de transfusión por sangrado evidente. Tipo 3b: • Descenso en la hemoglobina ≥ 5g/dl (relacionado con el sangrado). • Taponamiento cardiaco. • Sangrado que requiera intervención quirúrgica para su control (excluyendo nasal, dental, piel, hemorroides). • Sangrado que requiera el uso de agentes vasoactivos. • Tipo 3c: • Hemorragia intracraneal (no incluye microhemorragias o transformación hemorrágica. Incluye sangrado intraespinal). • Subcategorías confirmadas por autopsias o imágenes o punción lumbar. • Sangrado intraocular con compromiso de la visión. |
| Tipo 4: sangrado asociado a revascularización miocárdica. • Sangrado intracraneal perioperatorio dentro de las 48 horas. • Reoperación luego de cierre de esternotomía con propósito de controlar sangrado. • Transfusión de ≥ 5 unidades de glóbulos rojos, dentro de un período de 48 horas. • Gasto de tubo a tórax ≥ 2 litros en 24 horas. |
| Tipo 5: sangrado fatal • Tipo 5a: Sangrado fatal probable: con sospecha clínica pero no comprobado por autopsia o imagen. • Tipo 5b: Sangrado fatal definitivo: confirmado por imagen o autopsia. El sangrado se especifica como: intracraneal, gastrointestinal, pulmonar, pericárdico, genitourinario u otro. |
A pesar de las variaciones en incidencia y definiciones de sangrado en los estudios, hay unas variables consistentes como: la edad, el sexo femenino, el bajo peso, el uso de procedimientos invasivos y la insuficiencia renal.
Por todo lo anterior, es necesario conocer y evaluar los factores de riesgo asociados a la presencia de sangrado en pacientes con síndrome coronario agudo sometidos a intervención coronaria percutánea y utilizar la escala de sangrado BARC, para clasificar los tipos de sangrado.
MetodologíaObjetivo generalDeterminar los factores asociados con la presencia de sangrado y clasificar el sangrado de acuerdo a la escala BARC en pacientes con síndrome coronario agudo con y sin elevación del ST, a quienes se les realizó angioplastia coronaria en la Fundación Clínica Shaio.
Objetivos secundarios- •
Describir las características demográficas de los pacientes con síndrome coronario agudo que fueron a intervención coronaria percutánea.
- •
Determinar los factores asociados a la presencia de sangrado entre los casos y los controles según la escala BARC.
Estudio observacional analítico tipo casos y controles en pacientes con síndrome coronario agudo sometidos a intervención coronaria percutánea.
Población de estudioPacientes que consultaron al servicio de urgencias de la Fundación Clínica Shaio por síndrome coronario agudo con y sin elevación del ST y con indicación de intervención coronaria percutánea durante la hospitalización.
- •
Definición del caso: pacientes con síndrome coronario agudo con y sin elevación del ST, sometidos a intervención coronaria percutánea entre abril de 2012 a abril de 2013 que presentaron sangrado posprocedimiento dentro de su estancia hospitalaria, según la escala de BARC (Tipo 1-5).
- •
Definición de control: pacientes con síndrome coronario agudo con y sin elevación del ST, sometidos a intervención coronaria percutánea entre abril de 2012 a abril de 2013 que no presentaron sangrado posprocedimiento dentro de su estancia hospitalaria, según la escala de BARC (Tipo 0).
Pacientes mayores de 18 años que ingresaron a la Fundación Clínica Shaio con diagnóstico de síndrome coronario agudo con y sin elevación del ST, entre abril de 2012 a abril de 2013 sometidos a angioplastia coronaria percutánea.
Análisis estadísticoSe realizó un análisis descriptivo de las variables con el fin de caracterizar a la población de casos y controles; en las variables continuas se utilizaron medidas de tendencia central y de dispersión así: medias con su desviación estándar en el caso de distribución normal, en caso contrario medianas y su respectivo rango intercuartil. Las variables cualitativas se expresaron como frecuencias relativas y absolutas. Se consideró como variable desenlace el sangrado medido por la escala de BARC, esta se describió teniendo en cuenta que es una variable cualitativa como porcentajes, según la categoría que clasifica el tipo de sangrado; para la evaluación de asociación la variable se analizó como dicotómica si es igual a 0 o mayor igual a 1.
Se compararon los factores asociados a sangrado modificables, parcialmente modificables y no modificables entre los casos y los controles, se consideró una diferencia significativa entre los grupos si resultara un valor de p<0,05 estimado con la prueba de chi2 para variables cualitativas y la prueba de t de Student o Mann Whitney para variables continuas.
Para determinar la asociación de los factores descritos anteriormente con la presencia de sangrado, se realizó un análisis univariado, las variables que obtuvieron una asociación con un valor p menor a 0,2 fueron incluidas en un modelo de regresión logística, que permitió determinar el tipo y la magnitud de la asociación de las variables con el desenlace.
Para la construcción del modelo exploratorio se utilizó el método Backward de eliminación de variables previa verificación de la interacción y confusión. Una vez definido el modelo final se realizaron las pruebas de bondad de ajuste del modelo para verificar su consistencia.
Todos los análisis se realizaron a 2 colas, para todas las pruebas se aceptó un valor de 0,05 o menor como significativo, excepto en el análisis univariado para ampliar el número de variables a incluir en el modelo. La asociación de las variables se expresó con OR, sus respectivos intervalos de confianza y los resultados del test de Wald. Las pruebas y la construcción del modelo se realizaron en STATA 10,0.
Se aplicó la estrategia Backward, iniciando con el modelo completo, se retiraron una a una las variables con menor significancia estadística según el test de Wald, el modelo resultante se comparó con el modelo anterior mediante el logaritmo del cociente de verosimilitudes de los modelos, si el resultado de esta prueba no era significativo la variable fue eliminada del modelo.
Se evaluaron las interacciones comparando el modelo completo con los términos de interacción y el nuevo modelo sin los términos de interacción obteniendo un resultado de la prueba de hipótesis del likelihood-ratio test de 0,92, si este no era significativo, se eliminarían las interacciones y sus términos de primer orden no significativos en relación a la descripción del modelo. Después de comprobar las interacciones se evaluó la confusión con cada una de las variables de la siguiente forma: se incluyeron y excluyeron una por una las variables extraídas en el paso anterior y las que fueron seleccionadas en el plan de análisis y se observó el cambio en el OR resultante en cada uno de los nuevos modelos resultantes. Los valores extremos fueron determinados mediante el resultado del variance inflation factor (VIF) para cada una de las variables sin obtener observaciones extremas. Se evaluó la desviación y los residuales para determinar la presencia de valores influyentes, sin encontrar observaciones significativas.
Para la selección del modelo final se evaluó el cambio en los criterios de Akaike y Bayesiano buscando que siempre el siguiente modelo con menores términos reflejara una disminución en estos criterios, el R2 fue de 0,80, lo que sumado a las otras pruebas aseguró la coherencia del modelo. Se evaluó la colinealidad en las variables del modelo final resultante sin obtener valores mayores a 1,3. Al modelo final se realizaron las pruebas de bondad de ajuste de Hosmer y Lemeshow que obtuvo un valor p de 0,49 y la determinación de la curva de características operativas del receptor obteniendo un valor de 0,63 lo que permite asegurar que el modelo se ajustó adecuadamente para explicar el sangrado.
La relación 1:2 (121 casos y 245 controles), no fue al alzar, se buscó con el objetivo de aumentar el poder del estudio.
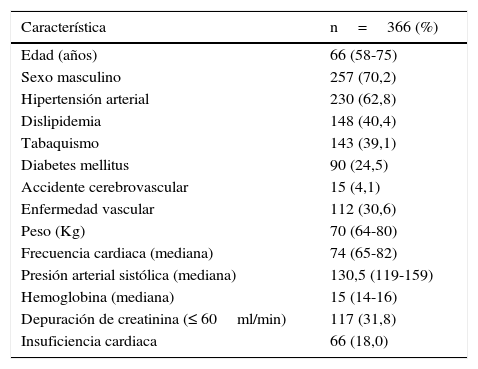
ResultadosSe seleccionó un total de 366 pacientes (121 casos y 245 controles) que cumplieron los criterios establecidos para el estudio. En la tabla 2 se presenta la descripción general de los pacientes. El sexo masculino fue el más frecuente (70,2%), con una mediana de edad de 66 años. El factor de riesgo cardiovascular predominante fue la hipertensión arterial sistémica, seguido de la dislipidemia, el tabaquismo, la enfermedad vascular y la diabetes, respectivamente, ver tabla 2.
Características basales pacientes con síndrome coronario agudo, grupo total
| Característica | n=366 (%) |
|---|---|
| Edad (años) | 66 (58-75) |
| Sexo masculino | 257 (70,2) |
| Hipertensión arterial | 230 (62,8) |
| Dislipidemia | 148 (40,4) |
| Tabaquismo | 143 (39,1) |
| Diabetes mellitus | 90 (24,5) |
| Accidente cerebrovascular | 15 (4,1) |
| Enfermedad vascular | 112 (30,6) |
| Peso (Kg) | 70 (64-80) |
| Frecuencia cardiaca (mediana) | 74 (65-82) |
| Presión arterial sistólica (mediana) | 130,5 (119-159) |
| Hemoglobina (mediana) | 15 (14-16) |
| Depuración de creatinina (≤ 60ml/min) | 117 (31,8) |
| Insuficiencia cardiaca | 66 (18,0) |
Con respecto a la función renal, el 68,2% de los pacientes presentó depuración de creatinina mayor a 60ml/minuto y el 31,8% ≤ 60ml/min., ver tabla 2.
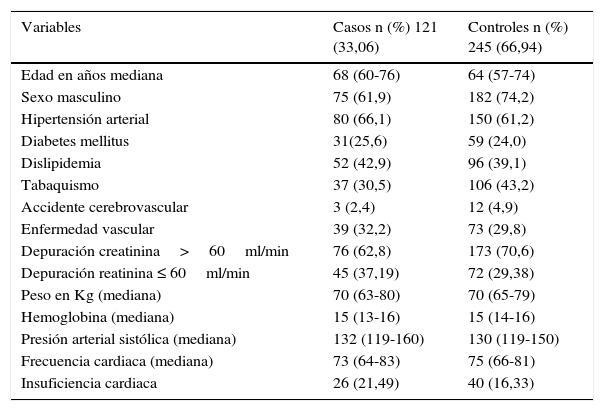
En la tabla 3 se describen los grupos por separado con las características generales.
Características basales pacientes con síndrome coronario agudo, casos y controles
| Variables | Casos n (%) 121 (33,06) | Controles n (%) 245 (66,94) |
|---|---|---|
| Edad en años mediana | 68 (60-76) | 64 (57-74) |
| Sexo masculino | 75 (61,9) | 182 (74,2) |
| Hipertensión arterial | 80 (66,1) | 150 (61,2) |
| Diabetes mellitus | 31(25,6) | 59 (24,0) |
| Dislipidemia | 52 (42,9) | 96 (39,1) |
| Tabaquismo | 37 (30,5) | 106 (43,2) |
| Accidente cerebrovascular | 3 (2,4) | 12 (4,9) |
| Enfermedad vascular | 39 (32,2) | 73 (29,8) |
| Depuración creatinina>60ml/min | 76 (62,8) | 173 (70,6) |
| Depuración reatinina ≤ 60ml/min | 45 (37,19) | 72 (29,38) |
| Peso en Kg (mediana) | 70 (63-80) | 70 (65-79) |
| Hemoglobina (mediana) | 15 (13-16) | 15 (14-16) |
| Presión arterial sistólica (mediana) | 132 (119-160) | 130 (119-150) |
| Frecuencia cardiaca (mediana) | 73 (64-83) | 75 (66-81) |
| Insuficiencia cardiaca | 26 (21,49) | 40 (16,33) |
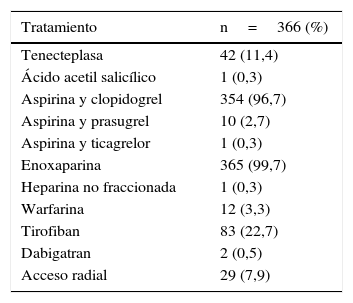
El tratamiento farmacológico se suministró de acuerdo a las guías de práctica clínica para intervención coronaria percutánea (doble terapia antiplaquetaria y anticoagulación). Dentro del análisis hubo un número de pacientes que inicialmente fueron trombolizados por infarto agudo de miocardio con elevación del ST (11,4%), el trombolítico utilizado fue tenecteplasa. El 22,7% de los pacientes recibió un inhibidor de glicoproteína IIb/IIIa (tirofiban), ver tabla 4.
Tratamiento y abordaje utilizado en el grupo total de pacientes
| Tratamiento | n=366 (%) |
|---|---|
| Tenecteplasa | 42 (11,4) |
| Ácido acetil salicílico | 1 (0,3) |
| Aspirina y clopidogrel | 354 (96,7) |
| Aspirina y prasugrel | 10 (2,7) |
| Aspirina y ticagrelor | 1 (0,3) |
| Enoxaparina | 365 (99,7) |
| Heparina no fraccionada | 1 (0,3) |
| Warfarina | 12 (3,3) |
| Tirofiban | 83 (22,7) |
| Dabigatran | 2 (0,5) |
| Acceso radial | 29 (7,9) |
La combinación de la aspirina y el clopidogrel se utilizó en el 96,7% de los pacientes, la enoxaparina en el 99,7% y el abordaje radial en 29 pacientes (7,9%), de estos cuatro en los casos y 25 en los controles, ver tabla 4.
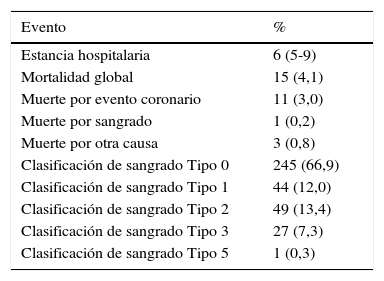
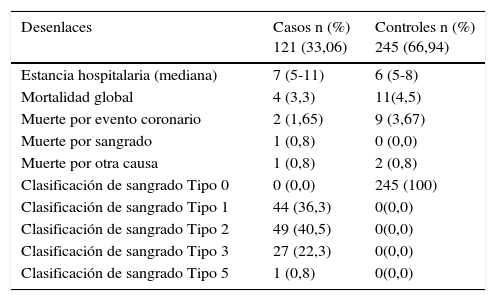
La estancia hospitalaria promedio de los pacientes fue de 6 días, la mortalidad global del 4,1% y la mortalidad por sangrado de 0,3%. El 67% de los pacientes no presentaron sangrado de acuerdo a la clasificación de la escala de BARC. El 33% de los pacientes presentaron sangrado de acuerdo a esta clasificación, entre ellos el 12% de los pacientes presentó sangrado tipo 1, el 13,4% presentó sangrado tipo 2, el 73% presentaron sangrado tipo 3, y en el tipo 5 un paciente (0,3%), ver tabla 5.
Desenlaces presentados y tipo de sangrado según la clasificación BARC (grupo total n=366)
| Evento | % |
|---|---|
| Estancia hospitalaria | 6 (5-9) |
| Mortalidad global | 15 (4,1) |
| Muerte por evento coronario | 11 (3,0) |
| Muerte por sangrado | 1 (0,2) |
| Muerte por otra causa | 3 (0,8) |
| Clasificación de sangrado Tipo 0 | 245 (66,9) |
| Clasificación de sangrado Tipo 1 | 44 (12,0) |
| Clasificación de sangrado Tipo 2 | 49 (13,4) |
| Clasificación de sangrado Tipo 3 | 27 (7,3) |
| Clasificación de sangrado Tipo 5 | 1 (0,3) |
Cuando se analizan los desenlaces por separado hubo 15 muertes de estas cuatro fueron en el grupo de casos, de estas dos por eventos coronarios y una por sangrado cerebral; en el grupo control 11 muertes, de estas nueve por eventos coronarios, ver tabla 6.
Desenlaces presentados y tipo de sangrado según la clasificación BARC (casos y controles
| Desenlaces | Casos n (%) 121 (33,06) | Controles n (%) 245 (66,94) |
|---|---|---|
| Estancia hospitalaria (mediana) | 7 (5-11) | 6 (5-8) |
| Mortalidad global | 4 (3,3) | 11(4,5) |
| Muerte por evento coronario | 2 (1,65) | 9 (3,67) |
| Muerte por sangrado | 1 (0,8) | 0 (0,0) |
| Muerte por otra causa | 1 (0,8) | 2 (0,8) |
| Clasificación de sangrado Tipo 0 | 0 (0,0) | 245 (100) |
| Clasificación de sangrado Tipo 1 | 44 (36,3) | 0(0,0) |
| Clasificación de sangrado Tipo 2 | 49 (40,5) | 0(0,0) |
| Clasificación de sangrado Tipo 3 | 27 (22,3) | 0(0,0) |
| Clasificación de sangrado Tipo 5 | 1 (0,8) | 0(0,0) |
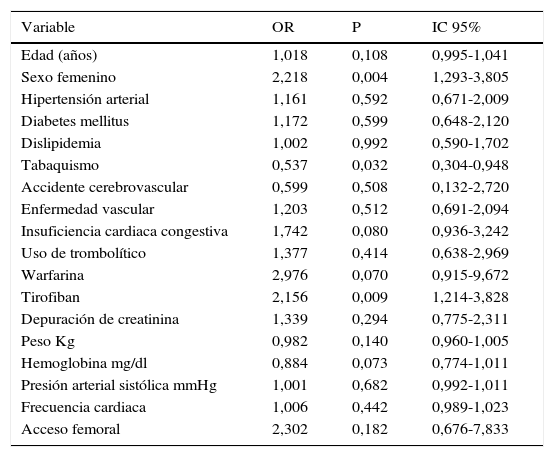
En el análisis univariado, las variables identificadas como importantes fueron: el sexo femenino, la presencia de insuficiencia cardiaca, el uso previo de la warfarina, el uso del tirofiban y el acceso femoral, ver tabla 7.
Análisis univariado en pacientes con síndrome coronario agudo
| Variable | OR | P | IC 95% |
|---|---|---|---|
| Edad (años) | 1,018 | 0,108 | 0,995-1,041 |
| Sexo femenino | 2,218 | 0,004 | 1,293-3,805 |
| Hipertensión arterial | 1,161 | 0,592 | 0,671-2,009 |
| Diabetes mellitus | 1,172 | 0,599 | 0,648-2,120 |
| Dislipidemia | 1,002 | 0,992 | 0,590-1,702 |
| Tabaquismo | 0,537 | 0,032 | 0,304-0,948 |
| Accidente cerebrovascular | 0,599 | 0,508 | 0,132-2,720 |
| Enfermedad vascular | 1,203 | 0,512 | 0,691-2,094 |
| Insuficiencia cardiaca congestiva | 1,742 | 0,080 | 0,936-3,242 |
| Uso de trombolítico | 1,377 | 0,414 | 0,638-2,969 |
| Warfarina | 2,976 | 0,070 | 0,915-9,672 |
| Tirofiban | 2,156 | 0,009 | 1,214-3,828 |
| Depuración de creatinina | 1,339 | 0,294 | 0,775-2,311 |
| Peso Kg | 0,982 | 0,140 | 0,960-1,005 |
| Hemoglobina mg/dl | 0,884 | 0,073 | 0,774-1,011 |
| Presión arterial sistólica mmHg | 1,001 | 0,682 | 0,992-1,011 |
| Frecuencia cardiaca | 1,006 | 0,442 | 0,989-1,023 |
| Acceso femoral | 2,302 | 0,182 | 0,676-7,833 |
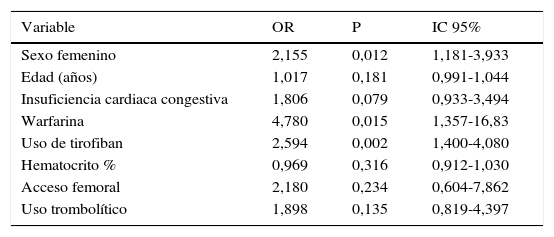
En el análisis del modelo final las variables importantes y relacionadas con sangrado fueron:
Sexo femenino (OR 2,155, IC 95% 1,181–3,933, p=0,012); uso de la warfarina (OR 4,780, IC 95% 1,357–16,83, p=0,015) y uso del tirofibán (OR 2,594 IC 95% 1,4–4,08, p=0,002); ver tabla 8.
Modelo final pacientes del estudio
| Variable | OR | P | IC 95% |
|---|---|---|---|
| Sexo femenino | 2,155 | 0,012 | 1,181-3,933 |
| Edad (años) | 1,017 | 0,181 | 0,991-1,044 |
| Insuficiencia cardiaca congestiva | 1,806 | 0,079 | 0,933-3,494 |
| Warfarina | 4,780 | 0,015 | 1,357-16,83 |
| Uso de tirofiban | 2,594 | 0,002 | 1,400-4,080 |
| Hematocrito % | 0,969 | 0,316 | 0,912-1,030 |
| Acceso femoral | 2,180 | 0,234 | 0,604-7,862 |
| Uso trombolítico | 1,898 | 0,135 | 0,819-4,397 |
El sangrado es la principal complicación no cardiaca asociada a la intervención coronaria percutánea y se encuentra relacionado con un incremento en el riesgo de muerte, infarto de miocardio y ataque cerebrovascular, como también en los tiempos de estancia hospitalaria y costos de atención1–3.
Los avances en terapia antitrombótica, antiplaquetaria y la realización de intervencionismo en forma temprana, han disminuido la incidencia de eventos isquémicos y la muerte en pacientes con síndrome coronario agudo (angina inestable, infarto agudo de miocardio con y sin elevación del segmento ST); pero por otra parte se han incrementado los episodios de sangrado3–6.
Existen varias escalas para estimar el riesgo de sangrado y se han identificado varios factores relacionados con el sangrado como: la edad, el sexo femenino, el bajo peso, la insuficiencia renal y el uso de procedimientos invasivos. Hay una manera de organizar estos factores de riesgo, durante la realización de intervencionismo en: factores modificables, parcialmente modificables y no modificables4,7–10. (tabla 9).
Factores asociados a sangrado post ICP
| • Modificables • Combinación antitrombóticos/antiplaquetarios. • Uso de introductores y tamaño. • Procedimientos invasivos (ICP, BCIA). • Duración del procedimiento. • Acceso radial/femoral. • Intercambio de heparinas periprocedimiento. • Terapia puente con heparina. • Uso de inhibidores de la glicoproteína IIb/IIIa. • Duración del tratamiento anticoagulante. • INR ≥ 2.5. |
| • Potencialmente modificables • Fondaparinux vs. Enoxaparina. • Monoterapia con bivalirudina. |
| • No modificables • Edad avanzada. • Género femenino. • Enfermedad renal crónica. • Anemia. • Accidente cerebrovascular previo. • Bajo peso corporal. • Diabetes. • Hipertensión arterial crónica. • Cambio en el segmento ST. |
ICP: Intervención coronaria percutánea; BCIA: Balón de contrapulsación intraaórtico.
Según las escalas de riesgo descritas en la literatura (CRUSADE, GRACE, TIMI, ACUITY, GUSTO, entre otras) las tasas de frecuencia de eventos hemorrágicos oscilan entre el 4 y 15%; se estima que una hemorragia grave tiene lugar entre un 3 a 5% de los pacientes con un SCA, siendo las hemorragias leves las más frecuentes, entre un 5 a 10%. En cuanto a la localización, algunos estudios reportan que el sangrado más frecuente es el gastrointestinal, seguido del sangrado en la zona de acceso vascular, sangrado nasal, sangrado genitourinario, retroperitoneal y craneal9–11.
Existen diferentes definiciones de sangrado como: NCDR (National Cardiovascular Data Registry), GUSTO (Global Utilization of Streptokinase and Tissue Plasminogen Activator), TIMI (Thrombolysis In Myocardial Infarction), todas ellas con limitaciones; por tanto, en respuesta a la necesidad de desarrollar y estandarizar las definiciones, se realizó un consenso donde participaron: los académicos, la FDA, the National Institutes of Health, las organizaciones de estudios clínicos, la industria de medicamentos y dispositivos, presentando un reporte de consenso llamado Consorcio de Investigación Académica del Sangrado (“Bleeding Academic Research Consortium”) (BARC), donde se establecieron las definiciones de sangrado para estudios clínicos cardiovasculares en cinco grupos (0 a 5)1,4, ver tabla 1.
Cada vez existen más estudios, donde la clasificación de sangrado y tipo de sangrado se realiza utilizando la definición BARC4,11–13. La frecuencia de sangrado en el presente trabajo utilizando la clasificación BARC fue del 33%, siendo el mayor porcentaje los tipos 1 y 2 (25,4%), relacionados la mayoría con el sitio de la punción arterial. Solo se presentó un evento de sangrado fatal tipo 5 (0,3%) que correspondió a un sangrado del tallo cerebral.
El porcentaje es más alto que el reportado en la literatura, pero la mayoría no fueron sangrados significativos solo moretones en el sitio de punción, estos normalmente no se reportan y con las clasificaciones de sangrado tradicionales pudiera estar subregistrado. Otras explicaciones pueden estar relacionadas a que hubo pacientes con infarto agudo con elevación del ST que fueron trombolizados y luego intervenidos, en otros se utilizó un inhibidor de la glicoproteína IIb/IIIa, hubo pacientes con depuración de creatinina ≤ 60ml/min., en otros pudo haber sobredosificación y mayor tiempo de anticoagulantes a pesar del cuidado que se tiene en la institución y finalmente el acceso vascular más utilizado fue el femoral; ya se ha descrito en varios estudios que el acceso radial se asocia con menos complicaciones. Todo lo anterior resalta la importancia de la estratificación de riesgo de sangrado y una clasificación unificada para disminuir estas complicaciones.
En el trabajo de los doctores Mendoza et al., se resalta la importancia del puntaje “CRUSADE”, para identificar el riesgo de sangrado en los pacientes con SCA; ellos encontraron que el porcentaje de sangrado mayor fue del 18,18% utilizando la definición GUSTO3.
Analizando los pacientes que son llevados a intervencionismo, aproximadamente la mitad de los episodios de sangrado ocurren en el sitio del acceso arterial como: las equimosis, los hematomas y en raros casos puede llegar hasta un sangrado fatal retroperitoneal. La mortalidad está más relacionada con sangrados en otros sitios diferentes a los de la punción, como: el sangrado cerebral, el digestivo y estos están asociados con el tratamiento anticoagulante o antiplaquetario.
El aumento en la mortalidad causado por un sangrado mayor en un síndrome coronario agudo es importante, está en el orden del 11% (95% IC 8–14)4,11–13. El impacto del sangrado sobre el pronóstico está también descrito, en el registro GRACE (Global Registry of Acute Coronary Events) donde se presentó una asociación significativa con la muerte intrahospitalaria (OR ajustada de 1,64). En los registros y estudios de más de 30.000 pacientes, el sangrado mayor se asoció con tres veces el riesgo de ataque cerebrovascular (ACV), cuatro veces el riesgo de muerte y cinco veces el riesgo de infarto durante el primer mes7.
Con la utilización del acceso radial para la angiografía las complicaciones de sangrado están casi abolidas, aunque algunas persisten como hematoma local en menos del 5% de los casos, síndrome compartimental<0,01%. Un metaanálisis actualizado que incluyó el estudio MATRIX, mostró una disminución significativa de las hemorragias mayores, el infarto, el ataque cerebrovascular y la muerte, en los pacientes en los cuales se utilizó el acceso radial, comparado con el acceso femoral14. En el presente trabajo el uso del acceso radial fue tan solo del 7,9%; para esa época del trabajo, la institución estaba iniciando la transición a la vía radial en la mayoría de las intervenciones, tanto agudas como electivas.
Los factores de riesgo descritos en la literatura asociados a sangrado son: el sexo femenino, la diabetes mellitus, la enfermedad vascular periférica, el evento cerebrovascular, la taquicardia al momento de la hospitalización, la presión arterial sistólica mayor de 180mmHg, los signos clínicos de insuficiencia cardiaca congestiva, el hematocrito de base menor de 36% y la depuración de creatinina disminuida, muchos de los anteriores factores son las variables analizadas en el registro CRUSADE3,5. El modelo de riesgo “CRUSADE” fue mejor para los pacientes que fueron intervenidos (estadísticoC: 0,73). El puntaje de sangrado ACUITY (The Acute Catheterization and Urgent Intervention Triage strategY) evaluó variables independientes como: el sexo femenino, la edad avanzada, los niveles de creatinina, la anemia, el número de leucocitos, el tipo de SCA con y sin elevación del ST y el tratamiento (uso de heparina no fraccionada, bivalirudina e inhibidores de la glicoproteína IIb/IIIa); este no ha sido validado en una cohorte independiente para intervención3,5,10,11.
En el trabajo publicado por los doctores Mendoza et al., se estableció la utilidad del puntaje “CRUSADE”, encontrando como punto de corte ≥ 35 para identificar a la población de mayor riesgo de sangrado3, y los doctores García y Cols., en su trabajo de validación de la escala CRUSADE, encontraron buena calibración pero poca capacidad de discriminación15.
Cambios en la práctica diaria, como mayor uso del acceso radial, reducción de las dosis de la heparina, menor utilización de inhibidores de la glicoproteína IIb/IIIa y uso de más potentes y mejores antiplaquetarios pueden hacer que se modifiquen estos modelos de riesgo. Además, en pacientes tratados con anticoagulantes orales, el valor predictivo de estos puntajes no está bien establecido en esta población10,11. En el presente trabajo hubo utilización de inhibidores de glicoproteína IIb/IIIa en un 22,7% y de warfarina en un 3,3%.
Algunos registros, diseñados específicamente para pacientes llevados a intervención coronaria percutánea, mostraron que los principales factores de riesgo identificados fueron: el choque cardiogénico, la insuficiencia cardiaca, la enfermedad vascular periférica, la tasa de filtración glomerular disminuida, el uso de agentes trombolíticos, la dosis del clopidogrel mayores a 300mg y el uso de un inhibidor de glicoproteína IIb/IIIa10–13.
En varios trabajos se han encontrado los siguientes factores durante la intervención: el uso de trombolíticos (OR: 2,68, IC: 1,27-5,67), el uso de inhibidores de glicoproteína IIb/IIIa (OR: 2,37, IC: 1,04-5,41) y la depuración de creatinina menor de 30ml/minuto (OR: 2,44, IC: 0,87-6,83)12,13. En el presente estudio, los factores de riesgo estadísticamente significativos fueron: el sexo femenino (OR: 2,15, IC: 1,18-3,93), el uso de warfarina luego del procedimiento (OR: 4,78, IC: 1,35-16,83) y recibir un inhibidor de glicoproteína IIb/IIIa durante el procedimiento (OR: 2,59, IC: 1,40-4,08). La presencia de insuficiencia cardiaca congestiva mostró un OR importante sin ser estadísticamente significativo (OR: 1,80, IC: 0,93-3,49). Lo anterior está muy acorde con lo descrito en la literatura.
La edad es un factor de riesgo mayor, en el registro GRACE luego de realizar los ajustes se encontró un aumento del 30% por cada década de edad (OR 1,28, 95%; IC 1,21 - 1,37), lo anterior puede estar explicado por la acumulación de amiloide y de colágeno en la pared arterial, causando fragilidad y riesgo de sangrado4, en este trabajo no se encontró relación con la edad, pero hay que tener en cuenta que la mediana de edad en el grupo de casos fue de 68 años y en el grupo de controles fue de 64 años. Las mujeres con SCA tienen tendencia a mayor riesgo de sangrado que los hombres, en el registro GRACE, las mujeres tuvieron un 43% más de probabilidad de sangrado mayor intrahospitalario (OR 1,43, 95%; IC 1,23 - 1,66). De manera adicional la función renal juega un papel muy importante en el riesgo de sangrado con un 50% más de probabilidad (OR 1,48, 95%; IC 1,19 - 1,84). Otras variables incluyen: la sobredosificación, el tiempo de uso de los antitrombóticos, la anticoagulación oral crónica, la intervención coronaria percutánea, los cambios en los anticoagulantes y el sitio de punción4,6–8.
Si se presenta un sangrado durante un síndrome coronario agudo tiene un gran impacto sobre el pronóstico. El sangrado mayor en el registro GRACE se asoció con un mayor riesgo de muerte hospitalaria, además, el riesgo de muerte se prolonga al escenario extrahospitalario. Es importante conocer que muchos predictores de sangrado se superponen con predictores de eventos isquémicos3,4,7.
Varios factores contribuyen al peor pronóstico asociado con sangrado dentro de los que se incluyen: la insuficiencia renal, la anemia, la hipotensión, el choque, las transfusiones, el retiro de los medicamentos antiplaquetarios. El suspender un tratamiento antiplaquetario aumenta el riesgo de trombosis del stent sea convencional o medicado, aumentando el riesgo de eventos isquémicos que pueden llevar a la muerte16–18.
En algunos casos de sangrado es necesaria la transfusión de glóbulos rojos, esta se ha asociado con: un mayor riesgo de muerte, el infarto e isquemia recurrente; los mecanismos relacionados con la transfusión son: la activación y agregación plaquetaria, la activación de la cascada inflamatoria, la alteración de la capacidad de aporte de oxígeno y de óxido nítrico por los glóbulos rojos almacenados, y todo lo anterior lleva a: la vasoconstricción, la isquemia tisular y la trombosis3,16–18.
Durante la práctica clínica, se ha descrito que los médicos pueden utilizar dosis alta de anticoagulantes, hecho que lleva a un riesgo mayor de sangrado. En reportes del registro “CRUSADE”, al menos un error en la dosis de heparina no fraccionada o de heparina de bajo peso molecular o de los inhibidores de la glicoproteína IIb/IIIa, usadas para el manejo de los síndromes coronarios agudos sin elevación del ST, fueron reportadas en el 45% de los pacientes y 15% de los eventos de sangrado se atribuyeron a los errores en las dosis. De manera adicional está descrito aumento del sangrado cuando hay cambio en el uso de los anticoagulantes (ejemplo de heparina no fraccionada a enoxaparina o lo contrario)3,4,16–18.
Por tanto, luego de identificar los pacientes con alto riesgo de sangrado se deben establecer estrategias para disminuir este riesgo, dentro de estas se mencionan las siguientes:
- 1.
Evitar la sobredosificación: esta es una situación frecuentemente relacionada con el aumento del sangrado y la muerte intrahospitalaria. Por lo que se deben ajustar las dosis por: el peso, la edad y la función renal. La mayoría de los anticoagulantes como: el fondaparinux, las heparinas de bajo peso molecular (HBPM), los inhibidores de la glicoproteína IIb/IIa, son depurados por el riñón, por tanto, no deben ser utilizados o su dosis reajustada si la depuración de creatinina es<30ml/min. Para pacientes con diálisis o con depuración de creatinina<15ml/min, la heparina no fraccionada es la que mejor seguridad ofrece. De manera adicional si no hay otra indicación para la anticoagulación, esta se debe suspender o utilizar el menor tiempo posible3,4,16,18–20.
- 2.
No se recomienda realizar cambios de los anticoagulantes, ejemplo de enoxaparina a heparina no fraccionada o viceversa.
- 3.
Elección de la vía de acceso: si la experiencia del operador y la situación hemodinámica lo permite, se debe escoger la vía de acceso radial, ya que se asocia a una reducción de los episodios de sangrado relacionados con el acceso vascular16,18–20.
- 4.
Pacientes con anticoagulación oral crónica: en los diferentes estudios se ha encontrado que entre un 5–7% de los pacientes sometidos a ICP y hasta un 10% de los pacientes con SCA tienen indicación de anticoagulación oral a largo plazo por diferentes causas (principalmente: fibrilación auricular, enfermedad tromboembólica venosa, válvulas mecánicas). Las guías para este grupo de pacientes que deben utilizar terapia antiplaquetaria dual y anticoagulación recomiendan: en pacientes con fibrilación auricular y bajo riesgo de sangrado (HAS-BLED ≤ 2), la terapia triple con anticoagulación: (la warfarina), la aspirina (75–100mg/día) y el clopidogrel (75mg/día), debe ser considerada por tres a seis meses, seguido del clopidogrel (75mg) o la aspirina (75–100mg) y anticoagulación (warfarina) hasta doce meses; en caso de pacientes con fibrilación auricular y alto riesgo de sangrado (HAS-BLED ≥ 3), la terapia triple con anticoagulación (la warfarina), la aspirina (75–100mg/día) y el clopidogrel (75mg/día), debe ser considerada por un mes, seguido del clopidogrel (75mg) o la aspirina (75–100mg) y anticoagulación (la warfarina) hasta doce meses, independiente del tipo de stent convencional o medicado. De manera adicional otras recomendaciones son: utilizar el acceso radial sobre el femoral, utilizar los stents medicados de última generación, no utilizar prasugrel ni ticagrelor como parte de la terapia triple; se esperan estudios con los nuevos anticoagulantes orales directos16,18.
- 5.
Protección para el sangrado gastrointestinal: durante la fase inicial de un SCA, se pueden presentar hemorragias gastrointestinales, por lo que un inhibidor de bomba de protones en combinación con la terapia antiplaquetaria dual es recomendada en pacientes con alto riesgo de sangrado gastrointestinal como, por ejemplo: los pacientes con historia de úlcera o hemorragia gastrointestinal, el uso crónico de antiinflamatorios no esteroideos, el uso de corticoides, la necesidad de tratamiento anticoagulante; o si los pacientes presentan dos o más de los siguientes factores de riesgo: (edad ≥ 65 años, dispepsia, reflujo gastroesofágico, alcohol e infección por Helicobacter pylori)16,8–20.
- 6.
Medicamentos: en el SCA sin elevación del ST, el fondaparinux se prefiere sobre la enoxaparina o la heparina no fraccionada, por el mejor perfil de eficacia y seguridad. El uso de inhibidores de la GP IIb/IIIa, está actualmente restringido al ámbito de la angioplastia, en pacientes de alto riesgo trombótico y con bajo riesgo de sangrado. Actualmente no se recomienda su administración sistemática antes de la angiografía en una estrategia invasiva. En el estudio PLATO medicamentos como el ticagrelor reportaron disminución de la mortalidad, sin aumentar el riesgo de sangrado. Resultados favorables en relación al sangrado han sido reportados con el cangrelor3,16,18,21,22.
- 7.
Duración del tratamiento: un inhibidor P2Y12 (ticagrelor, prasugrel, clopidogrel), en adición a la aspirina es recomendado generalmente por doce meses luego de un síndrome coronario agudo. La terapia antiplaquetaria dual puede ser acortada de tres a seis meses en pacientes con episodios de sangrado o si se encuentran en un grupo de alto riesgo de sangrado (tanto para los stents convencionales como los medicados de última generación). Utilizar la terapia dual más de un año puede ser considerada evaluando el riesgo isquémico vs. el riesgo de sangrado16,18,23.
- 8.
En caso de sangrado este deberá ser controlado en lo posible, con medidas hemostáticas específicas, para retirar el tratamiento antiplaquetario el menor tiempo posible. Las hemorragias menores y sin riesgo para la vida del paciente deben ser manejadas preferiblemente sin interrumpir los medicamentos antiplaquetarios en pacientes con ICP e implante reciente de un stent.
- 9.
La transfusión de sangre solo se recomienda en casos de deterioro hemodinámico o hematocrito menor al 25% o concentración de la hemoglobina menor a 7 gr/dl.
Las relacionadas con los estudios de casos y controles, como los factores de confusión y sesgos de selección y medición.
ConclusionesEl sangrado es un evento frecuente en los pacientes con síndrome coronario agudo, que son llevados a ICP; encontrando que utilizando la clasificación de BARC, la mayoría de los sangrados fueron tipo 1 y 2.
Los factores de riesgo para sangrado descritos a nivel mundial, en pacientes con síndrome coronario agudo, a quienes se les realiza una intervención coronaria percutánea son parecidos a los del estudio. El sexo femenino, el uso de la warfarina y el uso del tirofiben fueron estadísticamente significativos.
El grupo tratante debe siempre realizar una estratificación de riesgo isquémico y de sangrado en los pacientes que consultan por un síndrome coronario agudo. El puntaje “CRUSADE” se recomienda para pacientes tratados médicamente y para los pacientes que son llevados a ICP. Posteriormente, se deben establecer todas las estrategias para disminuir este riesgo de sangrado. Recomendamos con el fin de unificar definiciones, utilizar la definición de sangrado BARC para establecer los tipos de sangrado que presentan los pacientes intervenidos, esta definición es amplia, no solo define la causa (relacionada o no con el procedimiento), sino que además, incluye la severidad, el sitio y las implicaciones pronósticas.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.