La miocardiopatía hipertrófica afecta cerca del 0,2% de la población general y es una de las principales causas de muerte súbita cardíaca. La fibrilación auricular ocurre en una frecuencia cuatro a seis veces mayor en los pacientes con miocardiopatía hipertrófica que en la población general, con una incidencia anual cercana al 2% y prevalencias entre el 18 al 28%1. En pacientes con miocardiopatía hipertrófica y dispositivos de estimulación cardíaca, la incidencia de fibrilación auricular de novo es del 53%2.
FisiopatologíaLa dilatación y remodelación atriales son hallazgos frecuentes en la miocardiopatía hipertrófica. La disfunción diastólica, el incremento en las presiones de llenado, los fenómenos relacionados con la miopatía atrial, la obstrucción del tracto de salida del ventrículo izquierdo, la insuficiencia mitral y la coexistencia de factores como la hipertensión arterial son circunstancias que pueden explicar la coexistencia frecuente de las entidades1.
ImplicacionesLa fibrilación auricular en los pacientes con miocardiopatía hipertrófica se asocia con aumento de la mortalidad total o aquella relacionada con falla cardíaca, aumento del riesgo de ataque cerebrovascular y discapacidad funcional3. De manera independiente, constituye un predictor de mortalidad3,4. La incidencia de ataque cerebrovascular en pacientes con fibrilación auricular y miocardiopatía hipertrófica puede ser del 1% anual5 y es ocho veces más común en pacientes con fibrilación auricular comparados con aquellos en ritmo sinusal (21 vs. 2,6%)3. Un metaanálisis reciente revela una incidencia de embolia de 3,75% por 100 pacientes año6.
Conducta terapéutica1Una revisión reciente plantea respuestas a interrogantes comunes en pacientes con fibrilación auricular y miocardiopatía hipertrófica. Se resumen a continuación:
Tamización en pacientes asintomáticos: dada la incidencia y prevalencia elevadas de la entidad, las guías americanas7 y europeas8 recomiendan monitorización Holter en pacientes asintomáticos.
- •
AHA/ACC 2011: Holter 24h (recomendación IIb).
- •
ESC 2014: Holter 48h cada 6 a 12 meses si el diámetro de la aurícula izquierda es ≥ 45mm (recomendación IIa).
Evaluación de pacientes con palpitaciones: las palpitaciones o taquicardia no documentadas en pacientes con miocardiopatía hipertrófica debe llevar prontamente a la realización de pruebas diagnósticas que permitan demostrar la presencia de arritmias.
- •
AHA/ACC 2011: Holter 24h (recomendación I).
- •
ESC 2014: Holter 48h (recomendación I); en pacientes con palpitaciones frecuentes podría considerarse el implante de un monitor de eventos (recomendación IIb).
Anticoagulación en pacientes con fibrilación auricular y miocardiopatía hipertrófica: dado el alto riesgo de cardioembolia así como la comorbilidad y mortalidad relacionadas con el mismo, ambas guías coinciden en sugerir la anticoagulación para estos pacientes. En vista de que los puntajes para evaluación del riesgo no han sido validados en pacientes con miocardiopatía hipertrófica, la decisión de anticoagulación no debe basarse en un puntaje de riesgo sino en la documentación de la arritmia. Análisis retrospectivos de pacientes con miocardiopatía hipertrófica en quienes se evaluó el desempeño del CHA2DS2-VASc mostraron que no provee una estratificación adecuada del riesgo, con tasas de embolia cercanas al 10% en pacientes con puntajes de 09. Modelos predictivos han encontrado relación con factores como el diámetro de la aurícula izquierda, la edad, la clase funcional de la NYHA, la presencia de enfermedad vascular y el grosor máximo de la pared del ventrículo izquierdo9.
- •
AHA/ACC 2011: Anticoagulación en todos los pacientes (recomendación IC).
- •
ESC 2014: Anticoagulación en todos los pacientes (recomendación IB).
- -
Selección del anticoagulante: la evidencia que avala el uso de anticoagulación en fibrilación auricular y miocardiopatía hipertrófica es escasa, pero muestra una disminución del riesgo de cardioembolia (RRR 54,8%) en los pacientes que utilizan warfarina6,9. Dado que no existe evidencia con el uso de los nuevos anticoagulantes, la sugerencia de ambas guías es utilizar warfarina. Plantean la alternativa de anticoagulantes directos en caso de imposibilidad del uso de antagonistas de la vitamina K o rechazo del paciente.
- -
- •
AHA/ACC 2011: warfarina con INR 2,0 y 3,0 (recomendación IC).
- •
ESC 2014: warfarina con INR 2,0 y 3,0 (recomendación IB).
- -
Selección del antiarrítmico: la evidencia que fundamenta el uso de antiarrítmicos es escasa6,10. Si se plantea una estrategia para el control de la frecuencia cardíaca los bloqueadores beta, el verapamilo o el diltiazem ((recomendación IC) son las alternativas iniciales, seguidas de la ablación del His y el implante de marcapaso en caso de respuesta insuficiente (recomendación IIa). Si se decide una estrategia para el control del ritmo, la amiodarona constituye la alternativa predilecta seguida por la disopiramida (recomendación IIaB). Como opciones adicionales están sotalol, dofetilida o dronedarona (recomendación IIbC).
- -
Papel de la ablación percutánea de la fibrilación auricular en miocardiopatía hipertrófica: la ablación de venas pulmonares en pacientes con miocardiopatía hipertrófica ha mostrado resultados satisfactorios y superiores al tratamiento farmacológico, aunque con tasas de recurrencia mayores que en la población general. Dos revisiones sistemáticas recientes concluyen que la tasa de recurrencia, así como la necesidad de procedimientos adicionales y de antiarrítmicos es mayor respecto a la población convencional11,12. En pacientes con miocardiopatía hipertrófica apical la eficacia es ligeramente menor en comparación con la miocardiopatía hipertrófica septal13.
- •
AHA/ACC 2011: considerar ablación en pacientes sintomáticos, sin dilatación atrial y refractarios al tratamiento farmacológico (recomendación IIa).
- •
ESC 2014: considerar ablación en pacientes sintomáticos y refractarios al tratamiento farmacológico (recomendación IIa).
La fibrilación auricular paroxística puede presentarse hasta en un tercio de pacientes con síndrome de Wolff-Parkinson-White (WPW)14. La forma de presentación varía desde episodios de taquicardia autolimitada hasta eventos de muerte súbita. Es importante resaltar que a pesar de la distinción entre pacientes sintomáticos y asintomáticos para definir el manejo, algunos autores sugieren que el pronóstico depende de propiedades electrofisiológicas intrínsecas de la vía accesoria más allá de los síntomas15.
FisiopatologíaSe han planteado varios mecanismos para explicar la aparición de fibrilación auricular paroxística en pacientes con WPW: vulnerabilidad atrial, degeneración espontánea de la taquicardia reciprocante en fibrilación auricular, las propiedades eléctricas de la vía accesoria, los efectos de la vía accesoria sobre la estructura atrial, entre otros14,16. El aumento en los períodos refractarios y la disminución de la dispersión de la refractariedad en el tejido auricular posterior a la ablación de la vía accesoria avalan un papel determinante de la denominada vulnerabilidad atrial17.
ImplicacionesLas vías accesorias carecen, en términos generales, de las propiedades de conducción decremental del nodo aurículo-ventricular. La conducción anterógrada de la fibrilación auricular por una vía accesoria puede llevar a una respuesta ventricular rápida y degenera en fibrilación ventricular. La preexcitación intermitente y la pérdida abrupta de esta durante una prueba de esfuerzo son considerados marcadores de bajo riesgo. Por el contrario, la fibrilación auricular maligna (aquella con un intervalo RR más corto<250ms) es un predictor desfavorable y se ha observado hasta entre el 0 y el 9% de los pacientes; hasta en un 2% de los mismos se ha presentado fibrilación ventricular8. El riesgo de muerte súbita cardíaca en 10 años oscila entre 0,15-0,24%18,19. La ablación de la vía accesoria tiene una eficacia mayor al 95% y una tasa de complicaciones menor del 1%; a largo plazo se asocia con disminución significativa del riesgo de muerte súbita arrítmica, aunque también con una incidencia de fibrilación auricular similar o ligeramente mayor respecto a la población general20,21.
Conducta terapéuticaManejo arritmia- -
Farmacológico:
- 1.
En pacientes con WPW y fibrilación auricular que no desean o no son candidatos para la ablación, la propafenona o la flecainida serían las alternativas de elección si no existe cardiopatía estructural o isquemia (recomendación IIa, nivel de evidencia B). Dofetilida o sotalol podrían ser alternativas adicionales (recomendación IIb, nivel de evidencia B). La amiodarona no es la alternativa más adecuada (recomendación IIb, nivel de evidencia C)19.
- 2.
En pacientes con WPW y fibrilación auricular sin compromiso hemodinámico, la terapia de elección sería procainamida o ibutilide pero no están disponibles en nuestro medio de manera rutinaria. Los demás antiarrítmicos en general tienen un riesgo potencial de enlentecer la conducción por el nodo aurículo-ventricular y favorecer la conducción por la vía accesoria, de modo que no se sugiere su uso (recomendación I, nivel de evidencia C)19.
- 3.
No se recomienda el uso de amiodarona intravenosa (IV), digoxina IV, beta-bloqueadores IV o beta-bloqueadores, verapamilo y diltiazem por vía oral dado que pueden ser potencialmente peligrosos (recomendación III, nivel de evidencia C)19.
- 1.
- -
No farmacológico
- 1.
En pacientes con fibrilación auricular y WPW con inestabilidad hemodinámica debe realizarse una cardioversión eléctrica (recomendación I, nivel de evidencia B19.
- 2.
En pacientes con una vía accesoria anterógrada con un evento previo de muerte súbita o síncope con/sin fibrilación auricular documentada la ablación de la vía accesoria es la terapia más apropiada (recomendación I, nivel de evidencia B19.
- 3.
En pacientes con una vía accesoria anterógrada con fibrilación auricular documentada la ablación de la vía accesoria es la terapia más apropiada (recomendación I, nivel de evidencia B)19.
- 4.
En pacientes sintomáticos, con una vía accesoria anterógrada sin fibrilación auricular documentada, se recomienda hacer un estudio electrofisiológico para estratificar el riesgo y realizar la ablación (recomendación I, nivel de evidencia B19.
- 5.
En pacientes asintomáticos, con hallazgo incidental de WPW, es razonable hacer estudio electrofisiológico para estratificar el riesgo y realizar la ablación (recomendación IIa, nivel de evidencia B)19.
- 1.
- 1.
El riesgo de cardioembolia en pacientes con WPW y fibrilación auricular no se ha estudiado de manera sistemática. Dado que usualmente es una población joven y sin comorbilidades, el riesgo es bajo y no requieren anticoagulación a largo plazo. Las escalas de riesgo de embolia no han sido validadas en esta población. El juicio clínico debe primar para definir las conductas terapéuticas de manera individual.
La fibrilación auricular en el postoperatorio de cirugía cardíaca es un evento frecuente que conlleva implicaciones pronósticas significativas. La incidencia varía entre el 15 al 60% de acuerdo con el tipo de intervención: entre el 11 y 24% en trasplante, 15 al 40% en cirugía de revascularización, 37 al 50% en cirugía valvular y hasta el 60% en pacientes con cirugía combinada de revascularización y valvular22–24. Existe una variación de la incidencia de la fibrilación auricular en el postoperatorio de cirugía cardiaca de acuerdo con la región geográfica evaluada, con valores cercanos al 33% en Estados Unidos o Europa y del 17% en Suramérica24,25.
FisiopatologíaLa fibrilación auricular en el postoperatorio de cirugía cardiaca se explica por un mecanismo multicausal, con factores transitorios facilitadores y estructurales proarrítmicos: la inflamación ocupa un papel preponderante y el pico de incidencia de la fibrilación auricular en el postoperatorio de cirugía cardiaca al segundo día de la cirugía coincide con el aumento de la proteína C reactiva24. La activación simpática y el estrés oxidativo tienen papeles preponderantes. Las alteraciones electrolíticas, el trauma quirúrgico, la pericarditis, la activación del sistema renina-angiotensina-aldosterona y los cambios hemodinámicos, entre otros, contribuyen al proceso. Pero también existen factores que predisponen, como cardiopatía estructural, enfermedad valvular mitral, disfunción ventricular, fenómenos de remodelación, cambios en los canales iónicos y composición de la matriz extracelular. Entre los factores clínicos que influyen para la aparición de la fibrilación auricular en el postoperatorio de cirugía cardiaca están la edad, la hipertensión arterial, la falla cardíaca, la enfermedad pulmonar obstructiva crónica e incluso los puntajes elevados en el CHADS2 o el CHA2DS2-VASc26.
ImplicacionesLa fibrilación auricular en el postoperatorio de cirugía cardiaca se asocia con aumento en el riesgo de accidente cerebrovascular, tanto temprano (30 días; 2 a 4 veces) como tardío (un año; HR 1,3 con IC95% 1,1-1,6)27. Se ha relacionado con aumento en el riesgo de falla cardíaca, disfunción renal, infección, necesidad de reintervención o de vasopresores, readmisión a UCI, entre otros. Sin embargo, varios de los desenlaces podrían explicarse por el perfil de comorbilidad de la población y pueden constituirse en factores de confusión perdiendo peso en la asociación con los análisis multivariados22.
Varios estudios reportan un aumento de la mortalidad temprana entre el 2 al 7%22,28–30 e incluso aumento en la mortalidad a un año31. Adicionalmente, se ha encontrado asociación con aumento de la estancia hospitalaria y costos en la atención22.
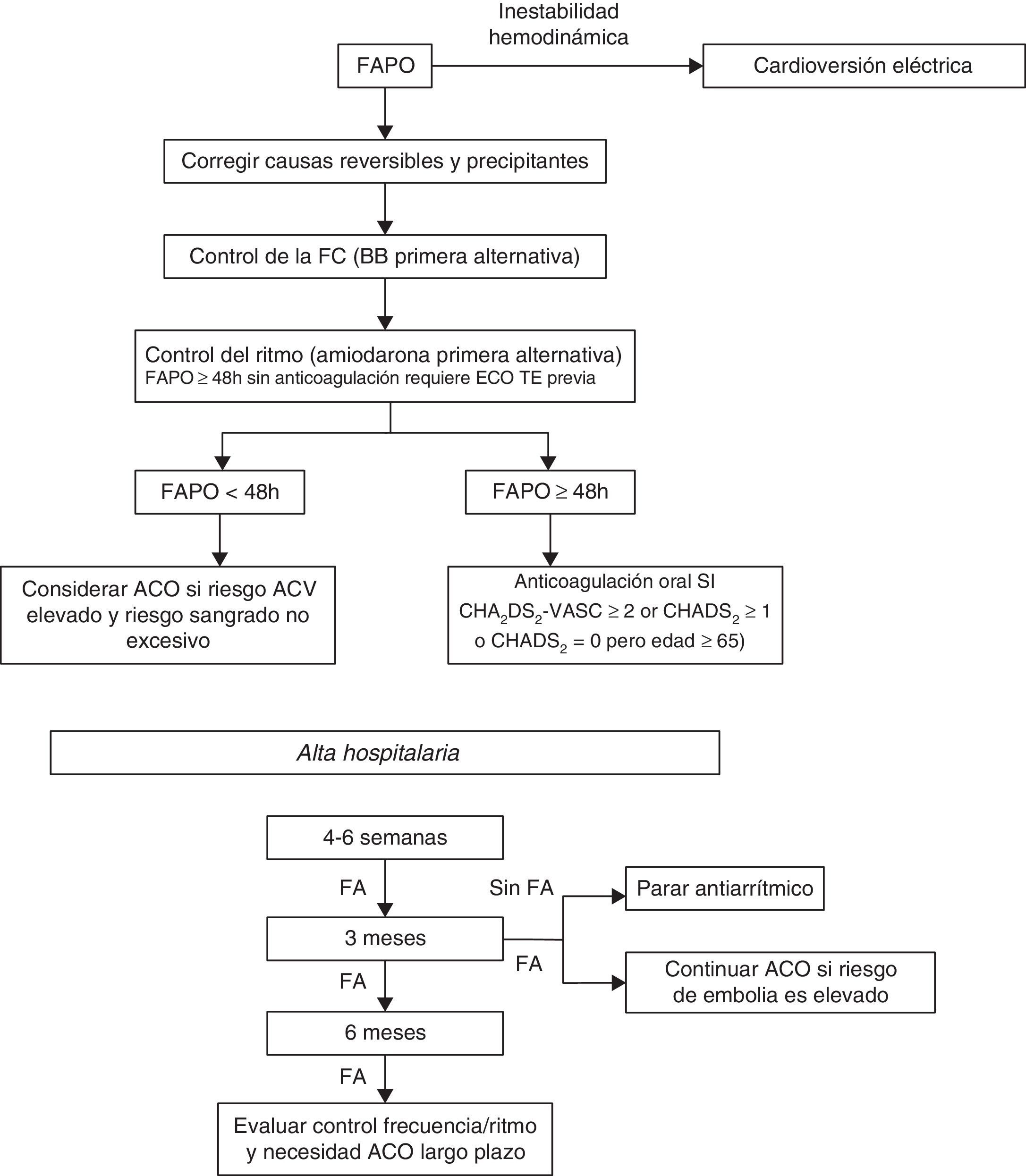
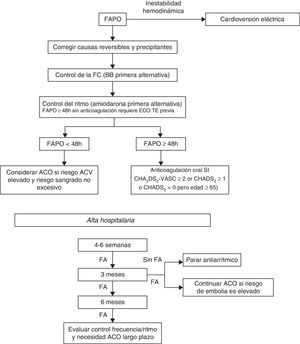
Conducta terapéuticaLos objetivos que rigen la terapia para el paciente con fibrilación auricular en el postoperatorio de cirugía cardiaca debe centrarse en cuatro situaciones fundamentales32 (fig. 1).
- •
Modificar factores desencadenantes y perpetuadores
- •
Controlar la respuesta ventricular y/o el ritmo
- •
Definir el riesgo de embolia y sangrado e iniciar la anticoagulación
- •
Establecer necesidades de seguimiento y duración de terapia antiarrítmica y anticoagulación
Algoritmo propuesto para el manejo de la fibrilación auricular en el posoperatorio de cirugía cardíaca. Modificado de: Ha et al32. FAPO: fibrilación auricular en el postoperatorio de cirugía cardiaca; BB: bloqueadores beta; ACO: anticoagulación oral; ACV: ataque cerebro-vascular; FA: fibrilación auricular.
- -
Estatinas: múltiples estudios han evaluado el uso de estatinas para modificar los desenlaces en el postoperatorio de cirugía cardíaca; una revisión reciente de Cochrane (la mayoría de pacientes en cirugía de revascularización) demuestra que la terapia previa con estatinas disminuye hasta un 46% el riesgo de fibrilación auricular en el postoperatorio de cirugía cardiaca (OR 0,54, IC95% 0,43; 0,67)33 además de disminuir la estancia en UCI y la estancia hospitalaria.
Recomendación: la evidencia actual no avala el uso rutinario de la intervención para la disminución de la fibrilación auricular en el postoperatorio de cirugía cardiaca.
- -
Ácidos grasos: el estudio OPERA34 y un meta análisis35 posterior, concuerdan en afirmar que no existe evidencia consistente entre la administración de ácidos grasos omega 3 y la reducción en la fibrilación auricular en el postoperatorio de cirugía cardiaca.
Recomendación: la evidencia actual no apoya el uso rutinario de la intervención para la disminución de la fibrilación auricular en el postoperatorio de cirugía cardiaca.
- -
Colchicina: el estudio COPPS evalúo la colchicina como alternativa para modular la inflamación y la pericarditis. La administración de colchicina 1,0mg VO cada 12 horas al tercer día postoperatorio seguida por dosis de 0,5mg cada 12 horas por un mes (≥ 70kg), se asoció con una reducción del riesgo relativo de 45% en la incidencia de fibrilación auricular en el postoperatorio de cirugía cardiaca a los 30 días del postoperatorio, con disminución de la estancia hospitalaria36. Sin embargo el COPPS-2 no demostró el beneficio de la colchicina en la reducción de la fibrilación auricular en el postoperatorio de cirugía cardiaca37.
Recomendación: la evidencia actual no avala el uso rutinario de la intervención para la disminución de la fibrilación auricular en el postoperatorio de cirugía cardiaca.
- -
Esteroides: múltiples estudios han evaluado el papel de los esteroides en la fibrilación auricular en el postoperatorio de cirugía cardiaca. Varios trabajos demostraron la reducción en la incidencia de la arritmia, pero no encontraron una modificación significativa en desenlaces como mortalidad. Halonen et al. demostraron la disminución de fibrilación auricular en el postoperatorio de cirugía cardiaca con la administración de hidrocortisona. Por su parte, Whitlock et al. evaluaron la evidencia en el 2008 con un metanálisis que suma más de 3.000 pacientes y concluyeron que los esteroides disminuyen la fibrilación auricular en el postoperatorio de cirugía cardiaca (RR 0,71, IC95% 0,59-0,87) con una tendencia a la reducción en la mortalidad. Un metaanálisis posterior de Cochrane en el 2011 en pacientes sometidos a cirugía de revascularización, muestra una disminución en la fibrilación auricular en el postoperatorio de cirugía cardiaca pero no evidencia impacto en otros desenlaces importantes38. El estudio DECS evalúo el efecto de la administración de dexametasona en casi 4.500 pacientes sometidos a cirugía cardíaca y no encontró impacto favorable en eventos adversos mayores39. Al evaluar específicamente la presencia de fibrilación auricular, concluyeron que la dexametasona no disminuye la incidencia de esta en el postoperatorio de cirugía cardiaca (RR 0,94, IC95% 0,87-1,02, p=0,14)40. Vale resaltar que los autores llaman la atención dado el aumento del riesgo de reintervención (toracotomía) en pacientes a quienes se les administró dexametasona41.
Recomendación: la evidencia actual no apoya el uso rutinario de la intervención para la disminución de la fibrilación auricular en el postoperatorio de cirugía cardiaca.
AHA/ACC/HRS 201442: NR.
ESC 201043: recomendación IIb B.
- -
Amiodarona: múltiples estudios han evaluado el impacto de la administración de la amiodarona por diferentes vías (oral o endovenosa), en diversos momentos (antes y en el postoperatorio) y con dosis diferentes (dosis de carga, dosis acumulada) para la disminución de la fibrilación auricular en el postoperatorio de cirugía cardiaca. La mayoría de estudios coinciden en el efecto benéfico de la medicación. La revisión más reciente de Cochrane corrobora estos datos al demostrar una reducción del 57% en la aparición de la fibrilación auricular en el postoperatorio de cirugía cardiaca (OR 0,43; IC95% 0,34-0,54)44. Chatterjee et al. en un análisis muy interesante demuestran la eficacia de la amiodarona en la disminución de la fibrilación auricular en el postoperatorio de cirugía cardiaca independiente de la ruta (oral o IV) y el tiempo de administración (un día preoperatorio respecto a la administración en el posoperatorio inmediato) e incluso de la duración de la terapia cuando se administran el menos 300mg IV como dosis de carga y una dosis total de al menos un gramo45. Los mismos autores en el paciente sometido a cirugía de revascularización más cambio valvular sugieren la administración desde el preoperatorio. Un estudio clínico controlado publicado recientemente por los miembros del Cardiothoracic Surgical Trials Network (CTSN) que compara la estrategia de control de la frecuencia cardíaca (frecuencia menor de 100 latidos por minuto) vs. el control del ritmo con amiodarona y en caso de persistencia después de 48h con cardioversión (dosis amiodarona equivalente a 3g antes del alta y 200mg/día o menos como dosis de mantenimiento después de la cardioversión). Los resultados del estudio no encuentran diferencias entre las estrategias en los días de estancia hospitalaria, tasa de complicaciones y la persistencia en fibrilación auricular a los 60 días después del inicio de la misma. Dados los resultados, el editorial que acompaña el artículo llama la atención acerca de la verdadera utilidad de esfuerzos importantes por mantener el ritmo sinusal como la cardioversión temprana, dado que los desenlaces evaluados a corto y mediano plazo resultan similares46.
Recomendación: la evidencia actual sustenta la administración de amiodarona para la disminución de la fibrilación auricular en el postoperatorio de cirugía cardiaca. Sin embargo, evidencia reciente puede dar un viraje en las recomendaciones.
AHA/ACC/HRS 2014: recomendación IIa A.
ESC 2010: recomendación IIa A
- -
Bloqueadores beta (BB): hay evidencia suficiente para avalar el uso de BB en la reducción del riesgo de fibrilación auricular en el postoperatorio de cirugía cardiaca. El inicio de la terapia en el preoperatorio parece tener mejores resultados22. Aunque no existen grandes diferencias de acuerdo con el tipo de BB47, algunos reportes sugieren un posible mayor efecto cuando se utiliza carvedilol respecto a metoprolol48. No se ha demostrado de manera significativa la reducción en el ataque cerebrovascular perioperatorio. El análisis de Cochrane demuestra una reducción significativa en la fibrilación auricular en el postoperatorio de cirugía cardiaca (OR 0,33; IC95% 0,26-0,43)44.
Recomendación: la evidencia actual sustenta la administración de BB para la disminución de la fibrilación auricular en el postoperatorio de cirugía cardiaca.
AHA/ACC/HRS 2014: recomendación I A.
ESC 2010: recomendación I A.
- -
Magnesio: un metaanálisis reciente evalúa el papel del magnesio asociado con bloqueadores beta para la disminución de las arritmias atriales en el postoperatorio de cirugía cardíaca (cirugía de revascularización) y demuestra cómo esa combinación no minimiza la incidencia de arritmias (OR 1,12, IC95% 0,86-1,47, p=0,40)49. Sin embargo, en un metaanálisis de Cochrane en el que específicamente se evalúa el papel del magnesio en relación con la aparición de fibrilación auricular, demostró una reducción del 45% en pacientes tratados (OR 0,55; IC95% 0,41–0,73)44.
Recomendación: dado el bajo costo y seguridad de la intervención, se recomienda la suplementación de magnesio previo a la cirugía para mantener niveles séricos normales.
AHA/ACC/HRS 2014: NR.
ESC 2010: NR.
- -
Sotalol: un metaanálisis del 2011 demuestra una reducción en el riesgo de fibrilación auricular en el postoperatorio de cirugía cardiaca, incluso mayor que la de bloqueadores beta, independiente del inicio previo o posterior a la cirugía (RR 0,329 con IC95%0,236-0,459] p<.001)50. De manera más reciente, una revisión de Cochrane confirma que el sotalol está relacionado con una disminución significativa en la fibrilación auricular en el postoperatorio de cirugía cardiaca (OR 0,34; IC95% 0,26-0,43)44.
Recomendación: la evidencia actual soporta la administración de sotalol en la disminución de la fibrilación auricular en el postoperatorio de cirugía cardiaca como una alternativa secundaria al bloqueador beta y a la amiodarona.
AHA/ACC/HRS 2014: recomendación IIb B.
ESC 2010: recomendación IIa A.
- -
Estimulación atrial: con fundamento en la disminución de la extrasistolia atrial y la modificación de la dispersión de la refractariedad atrial, se han evaluado diversas estrategias de estimulación transitoria: estimulación biatrial, atrial derecha, izquierda, Bachman y triple estimulación. Fundamentalmente con la estimulación atrial derecha y la biatrial, se demuestra una reducción significativa en la aparición de fibrilación auricular en el postoperatorio de cirugía cardiaca (OR 0,47; IC95% 0,36-0,61)44.
Recomendación: la evidencia actual soporta la estimulación atrial para disminución de la fibrilación auricular en el postoperatorio de cirugía cardiaca como una alternativa secundaria al bloqueador beta y la amiodarona en pacientes de alto riesgo. La selección del sitio de estimulación, la frecuencia programada y la duración de la intervención no están bien definidas (usualmente 3 a 5 días).
AHA/ACC/HRS 2014: NR.
ESC 2010: recomendación IIb A.
- -
Pericardiotomía posterior: esta intervención se ha relacionado con una disminución en la incidencia de fibrilación auricular en el postoperatorio de cirugía cardiaca (OR 0,35; IC95% 0,18-0,67)44. No es posible generalizar una recomendación y esta intervención es inherente al acto quirúrgico, no definida por el clínico.
- -
Anticoagulación: no existen estudios suficientes que respondan cuál es el mejor momento para el inicio de la anticoagulación en pacientes con fibrilación auricular en el postoperatorio de cirugía cardiaca y cuál debe ser la duración de la misma. Las guías para el manejo de la fibrilación auricular sugieren iniciar warfarina con un INR objetivo entre 2,0 y 3,0 para pacientes con CHADS2 ≥ 1 o el CHA2DS2-VASc ≥ 2 si la fibrilación auricular en el postoperatorio de cirugía cardiaca persiste por más de 48h, pero no especifica el uso de heparina no fraccionada o heparina de bajo peso como alternativas o terapia puente mientras se obtiene el efecto terapéutico del anticoagulante oral51. En el estudio del CTSN, se utilizó warfarina en fibrilación auricular en el postoperatorio de cirugía cardiaca cuya duración fue de al menos 48h con heparinas de bajo peso molecular como puente. A pesar de esto se presentó una tasa relativamente alta de accidente cerebrovascular o isquemia cerebral transitoria (1,1% a los 60 días)46.
Las guías del American College of Chest Physicians de 2005 recomiendan continuar la anticoagulación hasta 30 días después del retorno a ritmo sinusal52.
Recomendación: la evidencia actual valida la administración de warfarina para la disminución del riesgo de cardioembolia en pacientes con fibrilación auricular en el postoperatorio de cirugía cardiaca con duración ≥ 48h. Se sugiere terapia puente con heparina o heparinas de bajo peso molecular. La duración sugerida de la anticoagulación es hasta 30 días después del retorno a sinusal.
AHA/ACC/HRS 2014: recomendación IIa B.
ESC 2010: recomendación IIa A.
- -
Seguimiento: se sugiere una estrategia de seguimiento con visitas al mes, tres y seis meses de acuerdo con la condición clínica de los pacientes en donde se evalúe: persistencia de la arritmia, eficacia de la estrategia de control de la frecuencia cardíaca y/o el ritmo así como la necesidad de la continuidad de la terapia de anticoagulación.
Los autores declaran no tener conflicto de intereses.