La fibrosis endomiocárdica o endocarditis de Löffler es una patología de causa todavía desconocida, esta puede presentarse durante la evolución de diversas enfermedades de causa infecciosa, tumoral, autoinmune, medicamentos, etc. En muchos casos el presentar eosinofilia moderada (más de 1500 eosinófilos/microlitro) por largos períodos de tiempo puede producir toxicidad en diferentes órganos, entre ellos el corazón, produciendo disfunción del mismo por infiltración directa lo cual daña el tejido y también por las proteínas encontradas en los gránulos, principalmente la proteína catiónica eosinofílica y la proteína básica mayor que tienen predilección por el tejido endocárdico, llevando a su destrucción celular, lo que se traducirá en engrosamiento y fibrosis del subendocardio. Estas alteraciones conllevan a la cardiomiopatía restrictiva, siendo la fibrosis endomiocárdica su principal causa. Se presenta el caso de un paciente masculino de 30 años de edad, que ingresa al hospital por un cuadro de falla cardiaca aguda con evidencia en el ecocardiograma de ingreso de un componente restrictivo biventricular, el cual en diferentes series se presenta hasta en el 51% de los casos. El paciente presentaba una enfermedad hematológica de base, donde la eosinofilia era persistente durante más de 6 meses.
Endomyocardial fibrosis or Löffler endocarditis is a condition whose cause still remains unknown. It can develop during the progress of multiple infectious or tumour diseases, medication, etc. In many cases, showing moderate eosinophilia (more than 1500 eosinophils/microliter) for long periods of time can cause organ toxicity, among them the heart. This produces a dysfunction of the heart due to direct infiltration, which damages the tissue, and also due to the proteins found in the granules, mostly eosinophil cationic protein and major basic protein, which have a predilection for endocardial tissue, leading to their cell destruction, which will translate into a subcardial enlargement and fibrosis. These alterations result in restrictive cardiomyopathy, endomyocardial fibrosis being their main cause. We present the case of a 30 year-old male patient who is admitted at the hospital due to acute heart failure with an admission echocardiogram that evidenced a restrictive biventricular component, present in up to 51% of the cases in different series. The patient had a base hematological disorder, where eosinophilia had been persistent for more than 6 months.
La fibrosis endomiocárdica (enfermedad endomiocárdica, endocarditis parietalis fibroplástica o endocarditis de Löffler) es una patología de causa aún desconocida, descrita por primera vez en el África por Bedford y Konstam en el año de 1946, en soldados de la segunda guerra mundial, no obstante, Arthur Williams en el año de 1938, realizó una descripción temprana de esta patología. En Uganda en el año de 1948, Jack Davies, fue el primero en acuñar el término fibrosis endomiocárdica1,2. La patología se caracteriza por ser la primera causa de la cardiomiopatía restrictiva a nivel mundial. La mayor prevalencia de esta patología se presenta en ciertas regiones de África Subsahariana, donde se registran hasta el 20 - 25% de los casos de falla cardiaca; por razones aún no claras, se presenta una notable variación de la distribución en los diferentes continentes donde ha sido reportada.
Afecta principalmente a niños, adolescentes y adultos jóvenes, es más evidente en los estratos socioeconómicos bajos. En el África, donde se ve la forma endémica de esta patología, se observa un pico bimodal en cuanto a su presentación, a los 10 y 30 años, respectivamente. Las diferencias en cuanto al sexo es muy variable. La patología puede ser idiopática o asociada a otras patologías tales como: procesos infecciosos, medicamentos, enfermedad autoinmune, deficiencia de magnesio y cerio, atopia3, o neoplasias hematológicas, donde predomina el aumento de los eosinófilos por tiempo prolongado (dado que, en las patologías como síndrome hipereosinofílico y leucemia eosinofílica se presentan las mismas características histológicas), por tal razón puede ser primario o secundario a procesos infiltrativos (tabla 1).
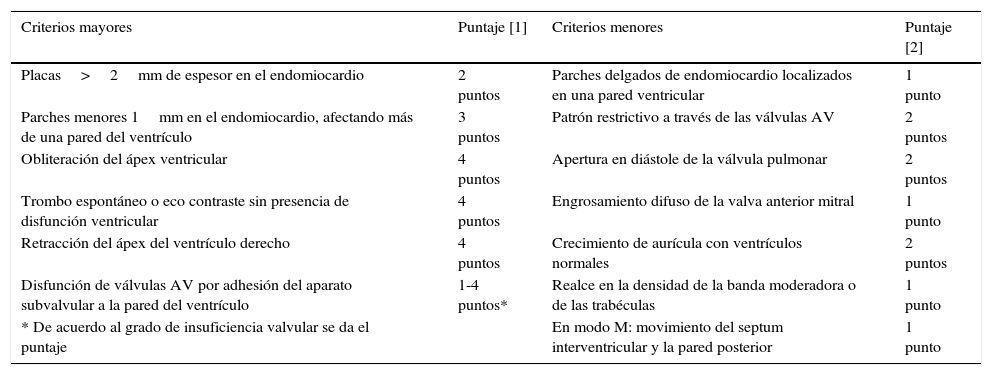
Criterios para el diagnóstico y evaluación de la severidad de la fibrosis endomiocárdica16
| Criterios mayores | Puntaje [1] | Criterios menores | Puntaje [2] |
|---|---|---|---|
| Placas>2mm de espesor en el endomiocardio | 2 puntos | Parches delgados de endomiocardio localizados en una pared ventricular | 1 punto |
| Parches menores 1mm en el endomiocardio, afectando más de una pared del ventrículo | 3 puntos | Patrón restrictivo a través de las válvulas AV | 2 puntos |
| Obliteración del ápex ventricular | 4 puntos | Apertura en diástole de la válvula pulmonar | 2 puntos |
| Trombo espontáneo o eco contraste sin presencia de disfunción ventricular | 4 puntos | Engrosamiento difuso de la valva anterior mitral | 1 punto |
| Retracción del ápex del ventrículo derecho | 4 puntos | Crecimiento de aurícula con ventrículos normales | 2 puntos |
| Disfunción de válvulas AV por adhesión del aparato subvalvular a la pared del ventrículo | 1-4 puntos* | Realce en la densidad de la banda moderadora o de las trabéculas | 1 punto |
| * De acuerdo al grado de insuficiencia valvular se da el puntaje | En modo M: movimiento del septum interventricular y la pared posterior | 1 punto |
Paciente masculino de 30 años de edad, con antecedentes de enfermedad mieloproliferativa en estudio extrainstitucional, fue valorado en marzo de 2014 por hematología, y se le práctica una biopsia de médula ósea. En los resultados se pueden observar cortes de la médula ósea cortical con celularidad del 100%, con marcado predominio de las formas maduras e intermedias. La relación mieloeritroide es de 10:1. Los megacariocitos se encuentran aumentados y agrupados con atipia ligera. No hay aumento de la población de blastos. Los estudios de inmunohistoquímica muestran reactividad en la población mieloide para HLA-DR, MPO, CD43 y CD45, negatividad para CD34, CD117, TDT y CD20. Los hallazgos morfológicos plantean una neoplasia mieloproliferativa crónica (figs. 1 y 2).
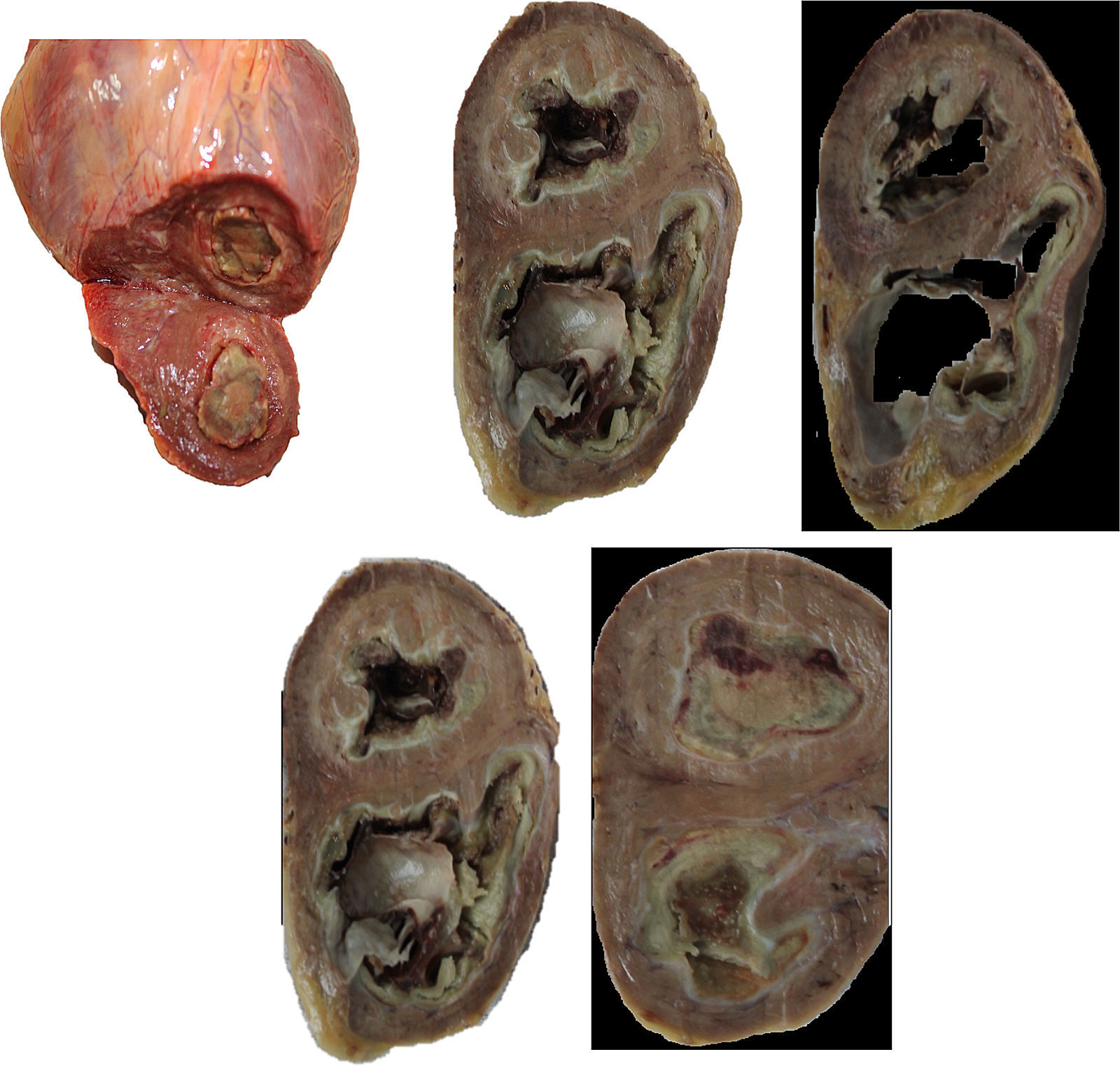
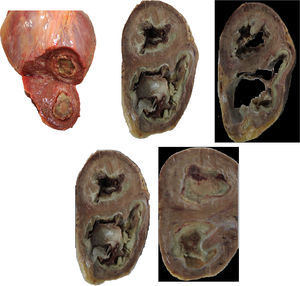
Material de autopsia. En la imagen superior izquierda se evidencia un corte compatible con un estadio 2 de la enfermedad donde se aprecian trombos. En las imágenes restantes se observa podemos observar un corazón en estadio 3 con una extensa área de fibrosis (Cortesia: Departamento de Patología del Hospital San José).
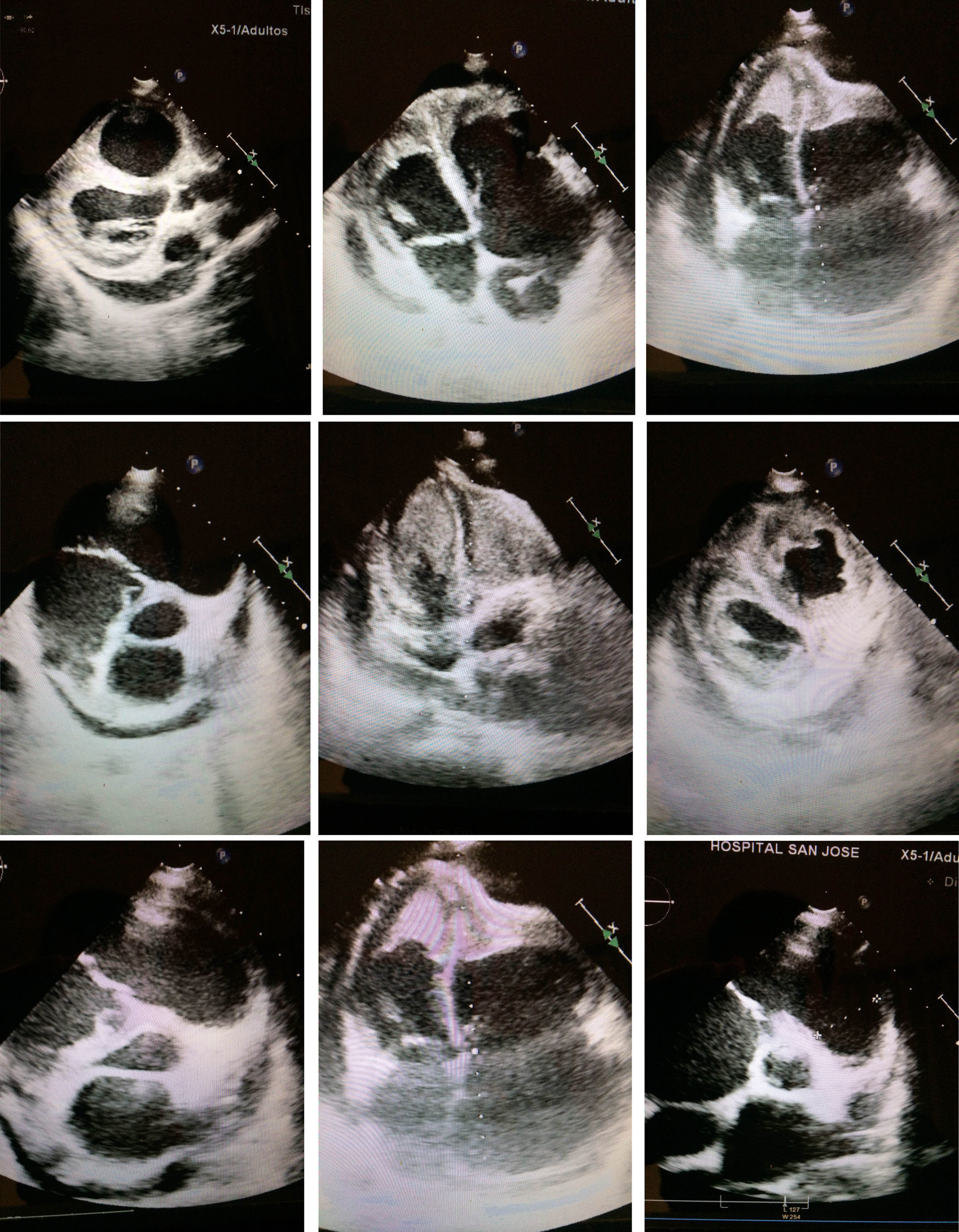
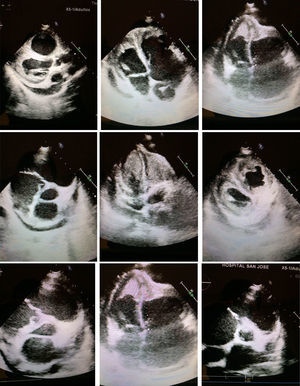
Ventrículo izquierdo: se observa la presencia de infiltración apical con una imagen ecorrefringente de tipo homogéneo que oblitera el ápex del ventrículo. Ventrículo derecho: se encuentra dilatado con hipertrofia de sus paredes y con presencia de obliteración por imagen ecorefringente de tipo homogéneo que oblitera el ápex del ventrículo derecho.
El 23 de abril de 2014 el paciente ingresa al servicio de urgencias por cuadro clínico de 4 meses de evolución que empeoró en los últimos tres días, caracterizado por deterioro de su clase funcional, ortopnea, disnea paroxística nocturna. Actualmente, con un diagnostico de falla cardiaca descompensada (insuficiencia mitral y tricuspídea severa), disnea clasificación NYHA III/IV en estadio C, asociado a edema progresivo de miembros inferiores. El paciente niega un estado febril, no obstante, refiere presentar un cuadro de dolor torácico de características atípicas, tipo punzada de predominio en el hemitórax derecho, el cual se incrementa con la inspiración profunda.
En el examen de la ecocardiografía institucional se evidenció imágenes de tipo infiltrante con obliteración de los ápex de ambos ventrículos que pueden corresponder a infiltración de tipo masa tumoral versus enfermedades de tipo infiltrativo o enfermedades de tipo fibrosis endomiocárdica. Hipertensión pulmonar severa con dilatación de las cavidades derechas y signos de aumento de las presiones de fin de diástole. Derrame pericárdico en cantidad aproximada de 200 cm2, sin signos actuales de aumento en la presión intrapericárdica. Se observa, además, una imagen ecorefringente sobre el pericardio parietal apical.
El paciente presenta antecedentes del síndrome mieloproliferativo en estudio (leucemia granulocítica crónica extrainstitucional hace 18 meses), valvulopatía mitral y tricuspídea severa. Fracción de eyección del ventrículo izquierdo: 67% (documentada en febrero de 2014 extrainstitucional) de etiología no establecida. Farmacológicos: la hidroxiurea 500mg cada 12 horas (inicio extrainstitucional) más la furosemida 40mg día. Otros antecedentes negativos.
Al paciente se le inicia manejo con restricción hídrica, diurético de asa, IECA a dosis bajas, betabloqueador, y tromboprofilaxis con heparinas de bajo peso molecular, gastroprotección. Posteriormente, el paciente presenta deterioro de su estado general, cifras tensionales con tendencia a la hipotensión, empeoramiento de la anasarca y se torna oligúrico (GU: 0,3 cc/kg/h), con empeoramiento de la función renal con patrón prerrenal. Fue necesario el traslado a la unidad de cuidados intensivos por requerimiento de soporte vasopresor e inodilatador. Llamó la atención que en los hemogramas extrainstitucionales e institucionales siempre persistía con eosinofilia; presenta una evolución tórpida con: falla renal, falla ventilatoria, choque mixto (cardiogénico y séptico) con alto soporte vasopresor, inodilatador y ventilatorio, evolución tórpida; el paciente finalmente fallece.
DiscusiónEn poblaciones del África (Uganda y Mozambique) sitios donde más se ha estudiado esta patología, se ha observado cierta asociación entre los factores ambientales y susceptibilidad genética, sugiriendo que el complejo HLA puede contribuir con ésta4. En estas mismas regiones del África Subsahariana, se han encontrado familias con la patología, lo que sugiere que hay factores ambientales y genéticos, sin embargo, esto aún no ha sido clarificado y se evidencia la necesidad de realizar más estudios.
Desde los años setenta se ha sugerido que, tanto la presentación tropical como la esporádica podían ser causadas por hipereosinofilia. La característica cardinal es la fibrosis y el engrosamiento del endocardio, lo cual es más prominente en los ventrículos5. Macroscópicamente son corazones hipertróficos, pudiéndose encontrar la cavidad ventricular dilatada o reducida en su medida, la característica más llamativa es el aumento en el espesor del endocardio, a menudo varios milímetros en su dimensión, las fibras del tejido endocárdico, usualmente se extienden hacia el miocardio subyacente, no obstante, no siempre limita con el tercio interno de la pared del miocardio; puede estar involucrado el ventrículo izquierdo, derecho o ambos.
Cuando el compromiso es derecho se afecta el ápex y se va extendiendo hacia la válvula tricúspide, la cual también puede verse afectada por este proceso, así, progresivamente, la cavidad se va obliterando. Puede haber compromiso de las cuerdas tendinosas y los músculos papilares, cuando el compromiso es izquierdo, el tracto de entrada, parte del tracto de salida es usualmente afectado, las valvas de la mitral, las cuerdas tendinosas y los músculos papilares pueden también comprometerse6. Lo anterior lleva a que estos pacientes puedan presentar insuficiencia mitral y tricúspide, tal como se presentó con nuestro paciente y en otros reportes del caso como en el de Uenishi7. Cuando hay compromiso de las aurículas, generalmente, es dilatación de las mismas, la función sistólica es normal o mínimamente deprimida mientras que la disfunción diastólica es la que conlleva a la falla cardiaca8, como se demostró en el estudio de Melgarejo y Cols., en la clínica Shaio, en el cual la ecocardiografía Doppler fue de gran ayuda dado que vamos a encontrar parámetros restrictivos, anormalidades en la distensibilidad ventricular, muestra un tiempo de relajación isovolumétrica disminuido, onda E altas y tiempos cortos de desaceleracion, toda esta diastología nos ayuda a diferenciar esta patología de la pericarditis constrictiva9.
Histológicamente, se evidencian tres estadios: el primero es una fase de necrosis aguda de difícil diagnóstico y que, generalmente, pasa desapercibida; la siguiente fase, es la formación de los trombos adyacentes al endocardio comprometido, lo cual puede llegar a producir eventos tromboembólicos, y la última fase, es la fibrosis, la cual se caracteriza por las progresivas cicatrices del endocardio, resultando en un patrón restrictivo con disfunción atrioventricular y disfunción valvular10, desafortunadamente, es en esta última fase, donde se aumenta la sospecha diagnóstica.
El endocardio anormal se encuentra organizado en capas; debajo del trombo se va a encontrar una zona de tejido colágeno, ocasionalmente, separado en dos capas; la capa más profunda llamada capa de granulación, está formada por el tejido conectivo libremente organizado en los cuales está rodeado por los vasos sanguíneos, se van a encontrar diferentes células inflamatorias, incluyendo, ocasionalmente, eosinófilos.
La fase necrótica consiste en una intensa miocarditis rica en eosinófilos, asociado a arteritis. El estadio trombótico, se presenta cuando la enfermedad ha durado mínimo 10 meses, el proceso miocárdico tiende a retroceder y algunos cambios no específicos de la hipertrofia del endocardio ya se presentan, varios grados de trombos, a menudo extensos, se encuentran superpuestos; en este estadio la arteritis tiende también a retroceder y frecuentemente, se encuentran los trombos ocluyendo los pequeños vasos intramiocárdicos.
La fase fibrótica se alcanza después de un tiempo promedio de 24,5 meses y se asemeja a la fibrosis endomiocárdica en cada detalle. La fibrosis es debida a una estimulación anormal del fibroblasto cardiaco que lo lleva a aumentar su producción de colágeno, representando un cambio reactivo estromal.
La característica clínica de estos pacientes depende del ventrículo afectado, la duración de la enfermedad, la presencia de la enfermedad activa o no. Aunque los signos clínicos de la fibrosis endomiocárdica se pueden desarrollar a los tres meses de iniciada la hipereosinofilia, la mayoría de los pacientes que cursan con el síndrome hipereosinofílico toman varios años para que la enfermedad cardiaca progrese a un estadio fibrótico. Grandes trombos intracavitarios pueden desarrollarse en el ventrículo izquierdo en estadios tempranos y comprometer el llenado ventricular o permitiendo la embolia sistémica. Dado que esta es una entidad en la cual los eosinófilos, se ha demostrado que tienen una gran participación, son sus principales propiedades las que predisponen a causar injuria miocárdica dada su capacidad para secretar proteína catiónica eosinofílica y proteína básica mayor en las áreas de inflamación, produciendo radicales libres y mediadores de peroxidación lipídica que conllevan a la injuria cardiaca. Clínicamente se puede dividir en los estadios histológicos en los cuales en la fase necrótica se evidencia: fiebre, malestar general, dolor torácico, esplenomegalia, linfadenopatias, anorexia, pérdida de peso, tos, insuficiencia de válvulas atrioventriculares y falla biventricular; en el estadio trombótico se observan las áreas de infarto: el esplénico, el cerebral y el coronario; en el estadio fibrótico se observa: la insuficiencia atrioventricular, la falla cardiaca derecha y/o izquierda11.
En los pacientes con hipereosinofília, estas células tienen una morfología inusual, dado que son metabólica y funcionalmente más efectivas que lo normal. Son multilobulados y por medio de la degranulación de sus proteínas, los gránulos median la cardiotoxicidad, a través de la activación de los mastocitos en el corazón, son capaces de secretar mediadores profibróticos incluyendo PAI 2, el cual tiene un papel en la destrucción y remodelación del tejido, es por tal razón que se pueden encontrar eosinófilos en los depósitos de fibrina en el tejido cardiaco12. La eosinofilia puede ser clasificada en: secundaria, clonal e idiopática.
En los pacientes de Uganda, Davies describió la enfermedad en tres estadios clínicos. El primer estadio corresponde a la fase temprana, en la cual se presenta una carditis aguda, y se evidenciará fiebre, dolor abdominal, edema facial, edema periorbitario, picazón en el cuerpo, en casos severos se podrá observar falla cardiaca y/o shock cardiogénico. Los pacientes que sobrevivieron esta fase pasaron a la siguiente, la cual consiste en una fase subaguda y crónica, consistente en falla cardiaca izquierda, derecha o ambas; la forma mixta es la más común de las presentaciones, predominando la clínica de falla derecha y finalmente la fase tres, donde se forman trombos, generalmente, en las aurículas, los cuales pasan a los ventrículos y pueden producir eventos tromboembólicos.
En cuanto la fisiopatología de la fibrosis endomiocárdica, ésta se caracteriza por un deterioro en el llenado ventricular y reducción del volumen diastólico de ambos ventrículos o de uno, según sea el compromiso; por lo cual como se mencionó anteriormente, el compromiso es en la función diastólica y no en la sistólica; el sello distintivo de la fibrosis endomiocárdica es la presencia de engrosamiento, fibrosis y recubrimiento de la superficie endocárdica de los ventrículos13.
El curso clínico varía dependiendo de la patología subyacente y el tratamiento. El trasplante cardiaco permanece como una opción terapéutica viable para pacientes seleccionados con falla cardiaca terminal y síntomas limitantes. El pronóstico es pobre, con una sobrevida a 10 años menor al 50%. Las causas del fallecimiento, generalmente, son: por falla cardiaca, muerte súbita o eventos tromboembólicos14. El tratamiento médico en general, es poco satisfactorio y la cirugía para pacientes en clase funcional III-IV (resección del endocardio con reemplazo de las válvulas auriculoventriculares afectadas, es el tratamiento de elección), en el estudio de Schneider se demuestra una sobrevida después de la cirugía a 10 años del 70%, con buena calidad de vida15.
La resonancia magnética (cardioresonancia) es el examen ideal (gold estándar) para realizar un diagnóstico (información detallada de morfología y función ventricular) seguimiento clínico y posterior a la cirugía. Dada su alta precisión en la anatomía y la hemodinamia, es muy útil en los pacientes con anormalidades estructurales severas que lleva a la distorsión del ventrículo, comprometiendo así que se logre realizar una buena evaluación ecocardiográfica; igualmente, este examen permite confirmar la presencia de trombos o calcificaciones, de igual forma, se pueden definir los bordes exactos de las áreas hipoperfundidas que van a corresponder a fibrosis. Tiene una excelente visualización del ápex, cuando utilizamos el gadolinio permite la evaluación de las áreas inflamatorias, la injuria y la fibrosis, el unico problema es su costo y que no se encuentra en muchas partes.
El cateterismo permite confirmar las anormalidades hemodinámicas, pero puede pasar por alto cuando la afección es leve o localizada, no es de elección en estadios avanzados. En tanto, el electrocardiograma permite evidenciar signos de crecimiento auricular, signos de hipertrofia del ventrículo comprometido al igual que cambios de sobrecarga, en los pacientes que presentan derrame pericárdico, se observará bajo voltaje del QRS, los pacientes pueden presentar taquiarritmias del tipo de la fibrilación auricular, las cuales podrán ser vistas en el electrocardiograma de 12 derivaciones.
La biopsia endomiocárdica tiene un papel controversial para el diagnóstico de fibrosis endomiocárdica. Se puede observar una extensa capa de fibrosis en el endocardio, que son fibras de colágeno con alteraciones en la estructura donde predomina el colágeno tipo I sobre el III, pequeña proliferación de vasos, leve a moderado proceso inflamatorio, predomino de macrófagos y linfocitos T, a veces se pueden encontrar eosinófilos y la degranulación de sus gránulos produce todos los cambios previamente mencionados. Podría ser de ayuda en los casos en que se encuentra proceso inflamatorio activo, puesto que estos pacientes pueden beneficiarse de esteroides e inmunosupresores16.
Mocumbi elaboró los criterios ecocardiográficos (mayores y menores) en la población de Uganda para realizar screning y determinar el grado de severidad de la patología.
El diagnóstico se realiza con dos criterios mayores o uno mayor y dos menores; menos de 8 puntos indican un compromiso leve, de 8-15 moderado y más de 15 es un compromiso severo. Estos criterios son de utilidad en pacientes asintomáticos en los primeros estadios, dado que hacer un diagnóstico rápido mejora el pronóstico.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.