Describir una causa poco común de síndrome de falla cardiaca aguda como lo es el linfoma primario del corazón.
MétodosPresentación de un caso con antecedentes y cuadro clínico de ingreso, manejo instaurado y desenlace.
Resultados y conclusionesLos tumores cardiacos malignos son bastante infrecuentes, más aún el linfoma cardiaco, por lo que no se considera en el diagnóstico diferencial del médico. Se presenta un nuevo caso en la literatura del linfoma cardiaco manifestado como síndrome de falla cardiaca aguda.
To describe an uncommon cause of acute cardiac failure such as primary cardiac lymphoma.
MethodsPresentation of a case with medical history and clinical records of admission, established management and outcomes.
Results and conclusionsMalignant cardiac tumours are quite infrequent, even more so with cardiac lymphoma, which is why they usually are not taken into consideration by physicians when making a differential diagnosis. A new case of cardiac lymphoma manifesting as acute cardiac failure syndrome is presented in the literature.
Los tumores cardiacos primarios fueron descritos por primera vez por Realdus Columbus en el año 1559 en el texto De Re Anatomica. Son de 10 a 100 veces más infrecuentes que los tumores secundarios metastásicos. La incidencia reportada oscila entre 2.1 casos por millón de personas por año en España y 1.38 casos por cada 100.000 personas por año en Italia1,2. Pueden encontrarse entre 0.002 a 3.3 por cada 1.000 autopsias, en 1.5 de cada 1.000 ecocardiografías transtorácicas y de 3 a 7 por cada 1.000 cirugías de corazón abierto2. Presentamos un paciente de 80 años de edad con síndrome de falla cardiaca aguda como manifestación del linfoma primario cardiaco.
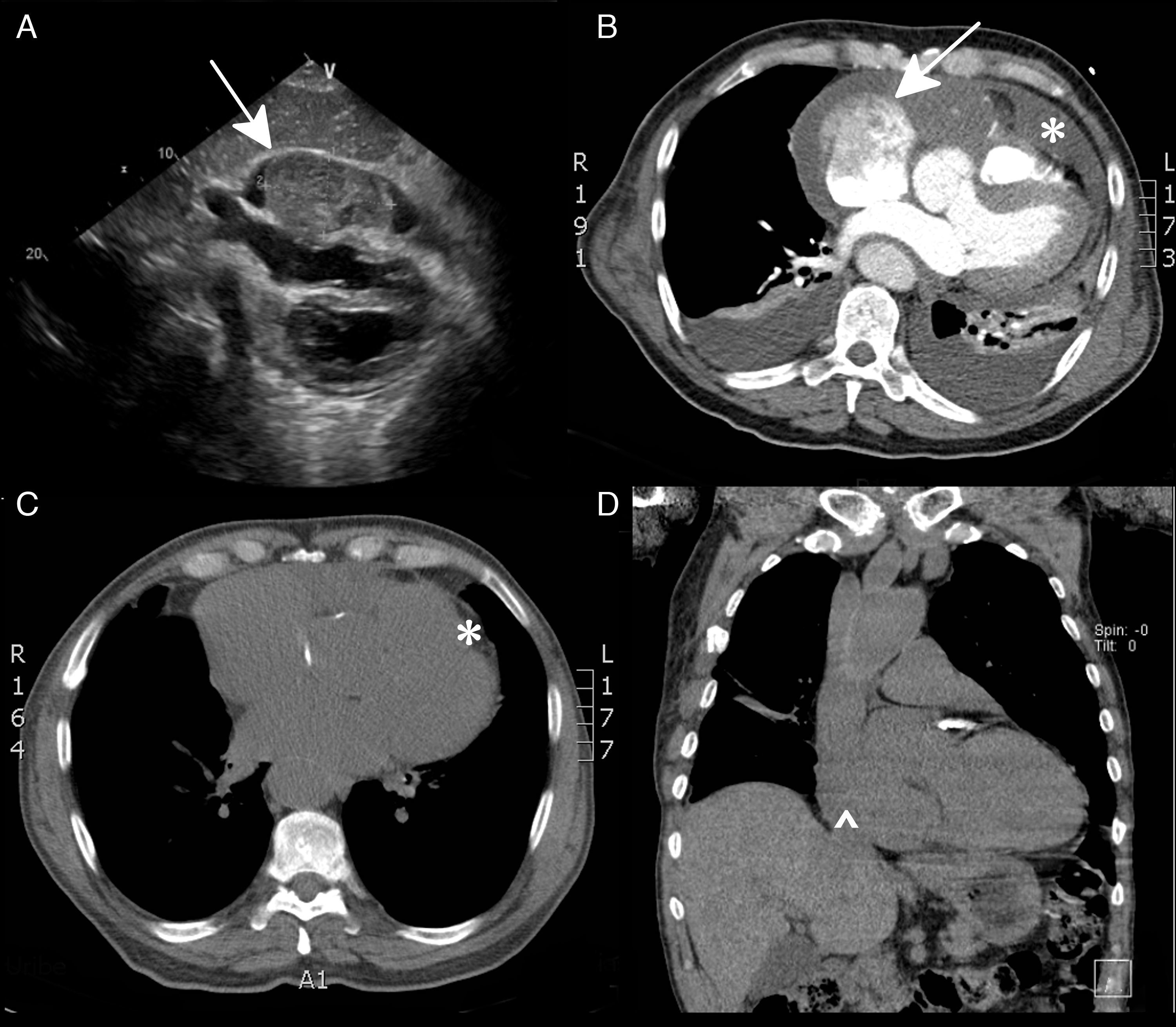
Presentación del casoUn hombre de 80 años de edad ingresó al servicio de urgencias por 3 semanas de evolución de disnea. El paciente presentó disnea progresiva hasta llegar al reposo, asociado a: ortopnea, disnea paroxistica nocturna y edema de miembros inferiores que dejaba fóvea hasta la rodilla. El día previo al ingreso al servicio de urgencias presentó cuadro sincopal. No presentaba dolor torácico. El paciente negaba antecedentes de importancia y durante la última semana estaba tomando medicación para conciliar el sueño. No había antecedentes de consumo de tabaco, sí, de licor ocasional. Al examen físico se encontró al paciente en regulares condiciones generales, con signos de: dificultad respiratoria, frecuencia cardiaca 134 lpm, frecuencia respiratoria 28 rpm, presión arterial 128/70mm Hg y saturación de oxígeno 91% a aire ambiente. Llamaba la atención, adicionalmente, la presencia de: ingurgitación yugular, ruidos cardiacos arrítmicos sin soplos, crépitos en ambas bases pulmonares, ascitis y edema de miembros inferiores que llegaba hasta las rodillas. Su química sanguínea y hemoleucograma llamaban la atención por: anemia leve (Hb 11.9 gr/dL), linfopenia, discreta elevación de aminotransferasas, sin presentar variaciones significativas durante toda su evolución. Se realizó un electrocardiograma (ECG), que reportó ritmo de fibrilación atrial con respuesta ventricular rápida, la troponina cuantitativa fue positiva (TnI 0.955ng/mL). El paciente ingresó a la unidad de cuidados especiales con diagnósticos de: falla cardiaca de novo de etiología a esclarecer y fibrilación atrial con respuesta ventricular no controlada. Se ordenó ecocardiograma transtorácico donde se observan: derrame pericárdico moderado y la presencia de dos masas en pericardio con compromiso de la aurícula y el ventrículo derecho de 42×23mm cada una (fig. 1, Panel A). El estudio tomográfico toracoabdominal mostró una masa cardiaca sin compromiso en otros órganos (fig. 1, Panel B). Se realizó ventana pericárdica y citología de líquido sin hallazgos concluyentes por lo que se decide llevar a biopsia por minitoracotomía donde se evidenció un tumor adherido a la aurícula derecha y en contacto con la aorta. La biopsia demostró linfoma B de alto grado, CD20(+), Ki67>90%, BCL2 y 6 (+), MUM-1(+), HHV8(-), LMP-1(-)1. Se realizó estudio de citogenética molecular por hibridación in situ fluorescente (FISH) en el tejido para rearreglos del locus (8q24) y para la translocación t (18;14), los cuales fueron negativos. No obstante, se identificaron señales extra de la sonda dirigida al locus (8q24) lo cual sugiere aumento en el número de copias del gen MYC. Se inició manejo con quimioterapia R-CHOP. El paciente presentaba resolución de edemas y mejoría de la disnea hasta el tercer ciclo de quimioterapia momento en el cual presentaba infección respiratoria que requiere internarse nuevamente al hospital. Ante la sospecha de neumonía no clara en Rx se realiza tomografía computarizada de tórax donde aún hay evidencia de cardiomegalia (fig. 1, Panel C y D), se considera que se ha logrado una respuesta parcial a la quimioterapia, motivo por el cual se continúa igual esquema de manejo. Tras el quinto ciclo de quimioterapia el paciente presenta: empeoramiento de los edemas, taquicardia y disnea paroxística nocturna; se inicia manejo con furosemida y espironolactona sin mejoría, presenta rápido deterioro clínico y muerte súbita a los 6 meses del diagnóstico.
Ecocardiograma TT, ventana 4 cámaras: masa intracavitaria que compromete casi toda la auricular derecha [flecha] (panel A). TC de tórax contrastado. Masas lobuladas con amplia base en el pericardio a nivel de la auricular derecha [flecha], derrame pericárdico [*] (panel B y C). TC simple de tórax. Persistencia de masa cardiaca en la auricular derecha (punta de flecha), líquido versus engrosamiento epicárdico derecho [^] (panel D).
Clásicamente, se afirma que los tumores primarios cardiacos son benignos en el 75% y malignos en el 25% de los casos. De los benignos el mixoma auricular es el más frecuente. Por su parte los sarcomas representan dos tercios de los casos de neoplasias malignas cardiacas primarias; mientras que las metástasis cardiacas más comunes provienen de primarios en: el pulmón, la mama, el esófago y el melanoma3.
La afección cardiaca por el linfoma diseminado es común, con incidencia entre el 9 al 24% en series de autopsias. El linfoma cardiaco primario (LCP) por su parte, definido como aquel que involucra solo al corazón o cuya masa principal se encuentra rodeada por el saco pericárdico, representa apenas un 0.5% de los linfomas extranodales y el 1 a 2% de todos los tumores cardiacos primarios4,5. Si bien, parece ser más frecuente en pacientes con infección por el VIH, da cuenta por menos de un 5% de todos los linfomas que se presentan en esta población. En total se han reportado poco más de 200 casos en la literatura mundial5. En una serie que recogió el total de los tumores cardiacos en un período de 12 años manejados en el MD Anderson Cancer Center solo se registró un caso de afección cardiaca por linfoma diseminado y ningún caso de linfoma cardiaco primario6. La mediana de edad de presentación es 64 años; prevalece en el sexo masculino con una razón hombre mujer de 3:1, el predomino en varones está mucho más acentuado en los pacientes con SIDA. A pesar de su rareza la incidencia ha venido aumentando con el incremento en el número de pacientes inmunosuprimidos y el envejecimiento de la población3,6.
La afección cardiaca por LCP, al igual que los demás tumores malignos, ocurre predominantemente en las cavidades derechas; por su parte los mixomas están en las cavidades izquierdas en el 78% de las veces. Están comprometidos en orden descendente: la aurícula derecha, el ventrículo derecho, el ventrículo izquierdo y finalmente el septo interatrial. La afección del ventrículo izquierdo es un marcador pronóstico adverso. Es característica la extensión a lo largo de la superficie epicárdica pero se afectan las 3 capas del corazón. La extensión se genera hacia grandes estructuras venosas como: la cava o la yugular interna mientras que el compromiso en la médula ósea o el sistema nervioso central es raro7.
Las manifestaciones clínicas están en relación con las zonas del corazón afectadas por lo que no hay un cuadro patognomónico. La presentación incluye muerte súbita por defectos de conducción aurículo-ventricular o por obstrucción aguda del tracto de salida ventricular; no obstante, lo más frecuente es encontrar: el síndrome de falla cardiaca, el síncope, el derrame pericárdico y el taponamiento cardiaco. También se incluyen: el síndrome de la vena cava superior, la embolia sistémica, las arritmias cardiacas, la cardiomiopatía hipertrófica, la cardiomiopatía restrictiva y la pericarditis constrictiva. Los síntomas de: sudoración nocturna, fiebre y pérdida de peso se presentan alrededor de un 5%8. La presencia de: adenopatías, hepatomegalia o esplenomegalia al examen físico sugieren que se trata de un linfoma cardiaco secundario. Los principales hallazgos de laboratorio son: la elevación de la velocidad de sedimentación globular, de la deshidrogenasa láctica y de la concentración del receptor soluble de interleucina 2. Los hallazgos del electrocardiograma incluyen: el flutter atrial, la fibrilación auricular, los bloqueos de rama y el bajo voltaje9. Debido a lo inespecífico y variable de las manifestaciones clínicas, el diagnóstico suele ser tardío comprometiendo el pronóstico.
Cuando se sospecha un tumor cardiaco, el primer paso del algoritmo diagnóstico es realizar una ecocardiografía transesofágica y una resonancia magnética cardiaca; con ello se logran reconocer con alta especificidad masas cardiacas no quirúrgicas como: pseudotumores, lipomas, trombos e hipertrofia lipomatosa10. La sensibilidad de la ecocardiografía transtorácica no es suficiente por lo que siempre está indicado el abordaje transesofágico; lo que se aprecia en esta técnica es una masa hipoecoica que infiltra el corazón derecho asociada con derrame pericárdico6,8,11. En la resonancia magnética cardiaca los LCP son variablemente hipointensos o isointensos con respecto al miocardio en las secuencias T1 y tienen una intensidad de señal relativamente alta en las secuencias de T2 con realce heterogéneo luego del contraste4. Otros datos en la resonancia sugestivos de LCP son: la localización en aurícula derecha, la ausencia de necrosis tumoral, la presencia concomitante de derrame pericárdico, el respeto relativo por el aparato valvular, la extensión a lo largo del epicardio con encapsulamiento de la raíz de la aorta y las arterias coronarias12. Estos hallazgos imagenológicos no son suficientes para hacer el diagnóstico por lo que es imperativo realizar la biopsia, para tener certeza sobre la etiología de la lesión; puede optarse por la biopsia endomiocárdica o la biopsia por toracotomía13,14. Se reporta que la pericardiocentesis tiene una sensibilidad del 67%; por su parte la biopsia intracardiaca transvenosa guiada por la ecocardiografía transefosfágica tiene un rendimiento del 100% al igual que la biopsia cardiaca por toracotomía7. Se prefiere iniciar por la alternativa menos invasiva.
En vista de las dificultades técnicas para la obtención de la muestra el estudio de inmunohistoquímica es esencial. En estudios de inmunofenotipo los linfomas cardiacos se distinguen de otras neoplasias con base en su reactividad para el antígeno común leucocitario y por la presencia de marcadores de célula B (CD20) o célula T (CD3). Independiente de la presencia de inmunodeficiencia, el tipo histológico más frecuente es el linfoma B difuso de célula grande; dando cuenta por el 80% de los casos. También se han reportado linfomas de células T, linfoma linfocítico pequeño, entre otros4,5. Hay poca información sobre la citogenética y las alteraciones moleculares asociadas con los LCP. La translocación t(18;14), la sobreexpresión de BCL-2 y el incremento en la expresión de BCL-6 han sido descritas basadas en el análisis de casos individuales. El único factor de riesgo claramente asociado con la enfermedad es la inmunosupresión15.
El pronóstico del LCP en general es pobre. En caso de que no medie ningún tratamiento los pacientes fallecen usualmente al cabo de un mes. Se estima que el 50% mueren sin haber logrado recibir ningún tipo de tratamiento13.
Sobre la terapéutica, todos los datos están derivados de series y reportes de casos, los cuales incluyen principalmente pacientes con linfoma B difuso de célula grande. En la más completa revisión de LCP a la fecha que incluye el análisis de 197 casos individuales, Petrich, et al5, reportan que el 89% de los pacientes recibieron quimioterapia y tan solo el 20% radioterapia a dosis variables (15-59Gy), lo que hace imposible una comparación sustantiva entre las dos estrategias de tratamiento. El pilar del tratamiento entonces es la quimioterapia con esquemas basados en antracíclicos: CHOP y R-CHOP desde el año 2001; este último es el estándar del manejo actual. Los pacientes que reciben cualquier tipo de terapia tienen tasas de respuesta completa entre el 39 y el 59%. La supervivencia global tiene una mediana de 12 meses. El pronóstico está ensombrecido en casos de: inmunodeficiencia, compromiso del ventrículo izquierdo y afección extracardiaca; en ausencia de estos factores de riesgo el guarismo de supervivencia global asciende a 22 meses. El 40% de las muertes obedecen a la falla cardiaca, el 26% a los procesos infecciosos y el 23% a la progresión de la neoplasia. La administración concomitante de la quimioterapia con la radioterapia no parece mejorar el pronóstico. Durante la quimioterapia los pacientes están en riesgo de muerte por necrosis tisular, especialmente, en caso de: haber infiltración miocárdica, síndrome de lisis tumoral con ruptura cardiaca, arritmias fatales y falla cardiaca congestiva. El hecho de evitar la administración de la doxorrubicina durante el primer ciclo de quimioterapia no es suficiente para obviar los potenciales efectos adversos, pero la reducción de la dosis del antracíclico y de la ciclofosfamida en un 50% sí parece menguar el riesgo de muerte súbita. La sustitución de la doxorrubicina por el etopósido se ha asociado con incremento en el riesgo de recaída de la enfermedad. Anecdóticamente, se ha realizado trasplante autólogo de médula ósea4.
Recientemente, se ha preconizado otra estrategia para reducir el riesgo de complicaciones cardiacas derivadas de la quimioterapia. Consiste en la introducción gradual de los fármacos. En primer lugar se ofrece una prefase de tratamiento con: prednisolona 40mg día por 10 días y rituximab 375mg/m2; luego de comprobar la tolerancia se siguen 2 ciclos cada 3 semanas con dosis bajas de R-CHOP (ciclofosfamida 400mg/m2, doxorrubicina 25mg/m2, vincristina 1mg, prednisolona 60mg y rituximab 375mg/m2) y finalmente se escala a dosis plenas de R-CHOP por 4 ciclos más11,16. Idealmente, los pacientes deben estar monitorizados en la Unidad de Cuidado Crítico para la vigilancia estrecha de las posibles complicaciones.
La cirugía oncológica no tiene cabida como tratamiento único; su papel se reserva para el diagnóstico de la enfermedad, para paliación de los síntomas (pericardiostomía subxifoidea) o como tratamiento experimental (trasplante cardiaco ortotópico)17. En los casos donde se ha necesitado cirugía el inicio de la quimioterapia debería retrasarse por 2 semanas para reducir el riesgo de ruptura ventricular18.
La presentación de este caso tiene varios puntos interesantes. Se trata de un paciente previamente asintomático quien cursa con sindrome de falla cardiaca aguda, dada su edad las etiologías hipertensiva e isquémica cobraban importancia; sin embargo, se identifica la masa cardiaca como posible etiología. Aunque la mayor parte de estas neoplasias son: malignas y metastásicas, luego de un rastreo tomográfico toracoabdominal y de pelvis no se encontró otro primario por lo que se decide llevar a la biopsia endomiocárdica. El hallazgo histológico del linfoma da un mejor pronóstico al paciente siendo una enfermedad potencialmente curable aunque este no haya sido el caso. Se trata de un linfoma primario del corazón ya que no se identificó compromiso en la ganglionar ni en la médula ósea de acuerdo a las recomendaciones actuales en construcción de las guías colombianas de leucemias y linfomas19. Se debe propender entonces, siempre que las condiciones clínicas del paciente lo permitan y no se encuentre otro sitio de toma de muestras, la realización de la biopsia endomiocárdica para aclarar la histología y pronóstico del paciente.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Fuente de financiaciónNinguna.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.




![Ecocardiograma TT, ventana 4 cámaras: masa intracavitaria que compromete casi toda la auricular derecha [flecha] (panel A). TC de tórax contrastado. Masas lobuladas con amplia base en el pericardio a nivel de la auricular derecha [flecha], derrame pericárdico [*] (panel B y C). TC simple de tórax. Persistencia de masa cardiaca en la auricular derecha (punta de flecha), líquido versus engrosamiento epicárdico derecho [^] (panel D). Ecocardiograma TT, ventana 4 cámaras: masa intracavitaria que compromete casi toda la auricular derecha [flecha] (panel A). TC de tórax contrastado. Masas lobuladas con amplia base en el pericardio a nivel de la auricular derecha [flecha], derrame pericárdico [*] (panel B y C). TC simple de tórax. Persistencia de masa cardiaca en la auricular derecha (punta de flecha), líquido versus engrosamiento epicárdico derecho [^] (panel D).](https://static.elsevier.es/multimedia/01205633/0000002300000005/v1_201610020025/S0120563315002338/v1_201610020025/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)