La resonancia magnética cardiaca desempeña un papel fundamental en el diagnóstico, la definición y la evaluación de las masas cardiacas debido a su amplio campo de visión, resolución de contraste, versatilidad en planos de imagen y capacidad única para facilitar la discriminación de diferentes características tisulares. Debido a ello, varias declaraciones de consenso han posicionado a la resonancia magnética cardiaca como una técnica de imagen de primera línea en el estudio de las masas cardiacas.
Cardiac magnetic resonance plays a fundamental role in the diagnosis, definition, and assessment of cardiac masses, due to its wide field of vision, contrast resolution, versatility in image planes, and the unique capacity to help in the discrimination of different tissue characteristics. Due to all this, several consensus statements have positioned cardiac magnetic resonance as first line imaging technique in the study of cardiac masses.
La resonancia magnética cardicardiaca ejerce un papel fundamental en el diagnóstico, la definición y la evaluación de las masas cardicardiacas. Como modalidad de imágenes, ofrece un gran valor debido a su campo de visión más amplio, contraste de tejido superior, versatilidad en planos de imagen y capacidad única para permitir la discriminación de diferentes características tisulares.
Los tumores cardicardiacos, benignos y malignos, tienen una prevalencia estimada de 0,002 a 0,3% en autopsias1,2. El 75% de los tumores cardicardiacos primarios son benignos, y los más comunes en adultos son mixomas (50%), fibroelastomas papilares (20%), lipomas (15% -20%) y hemangiomas (5%)3,4. El 25% restante son malignos: el 95% corresponde a sarcomas y el 5% a linfomas3,5. El tipo más común de masa cardicardiaca son los “pseudotumores”, como trombos intracardicardiacos o variantes anatómicas normales mal interpretadas6.
La mayoría de las masas cardiacas se detecta inicialmente con ecocardiografía, ya que es una técnica de imagen no invasiva inocua y de gran disponibilidad. La tomografía computarizada cardicardiaca es una modalidad de diagnóstico de segunda línea utilizada para evaluar las masas cardicardiacas7,8, seguida por la tomografía por emisión de positrones (PET)9.
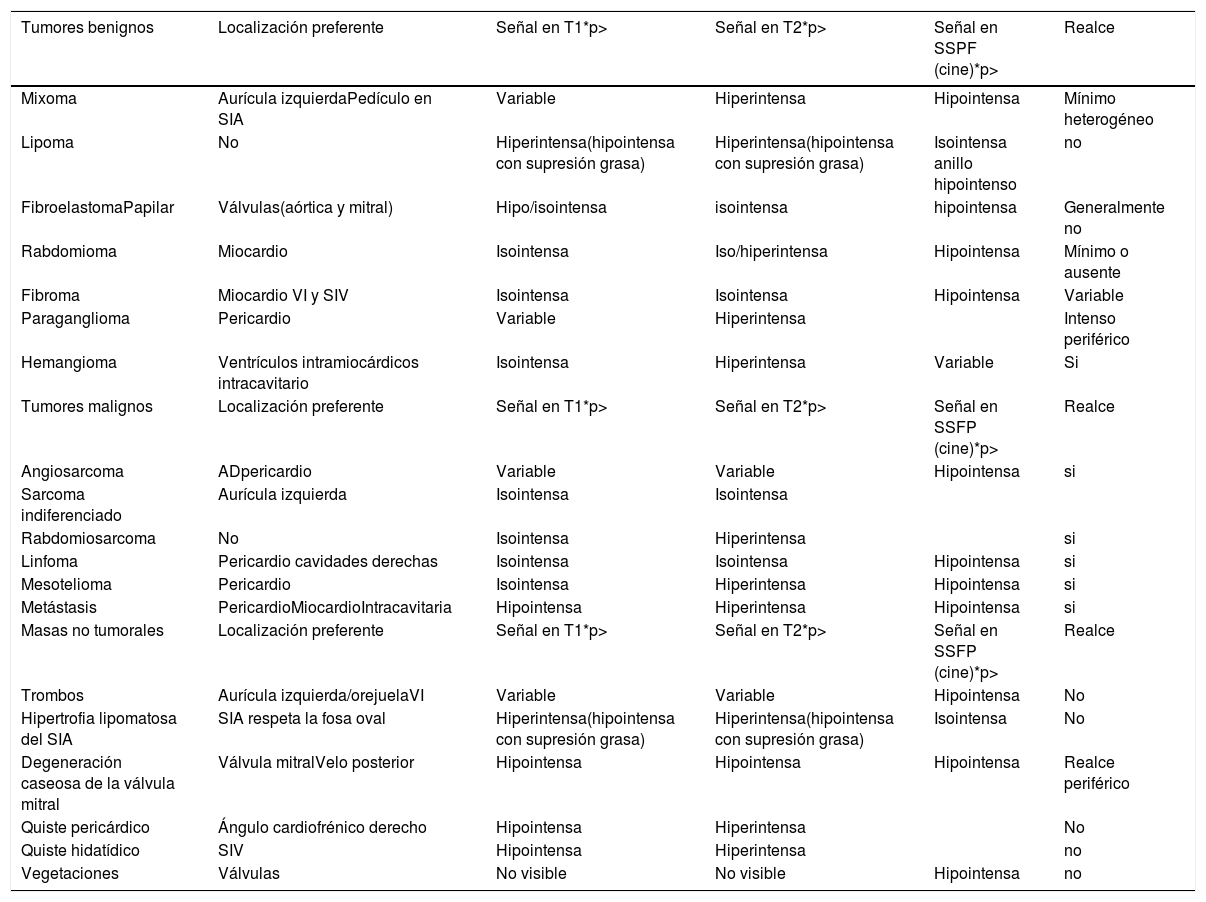
Las características de la imagen obtenida mediante la resonancia magnética cardiaca se pueden utilizar para predecir la probabilidad de malignidad de una masa cardicardiaca10-12 (tablas 1 y 2). Hoffman et al.10 utilizaron un protocolo de imágenes de resonancia magnética multiparamétricas para evaluar las propiedades de la señal, las características morfológicas (localización, tamaño, naturaleza infiltrante, presencia de derrames pleurales/pericárdicos) y la resolución elevada del contraste en los tumores cardicardiacos de 55 pacientes. Se encontró que una interpretación global de las características de la resonancia magnética cardiaca tenía una precisión diagnóstica de 0,92 (área debajo de la curva) para determinar que una masa cardicardiaca es maligna (confirmada en la evaluación histológica).
Caracterización tisular mediante resonancia magnética cardiaca de las masas cardiacas más frecuentes:
| Tumores benignos | Localización preferente | Señal en T1*p> | Señal en T2*p> | Señal en SSPF (cine)*p> | Realce |
|---|---|---|---|---|---|
| Mixoma | Aurícula izquierdaPedículo en SIA | Variable | Hiperintensa | Hipointensa | Mínimo heterogéneo |
| Lipoma | No | Hiperintensa(hipointensa con supresión grasa) | Hiperintensa(hipointensa con supresión grasa) | Isointensa anillo hipointenso | no |
| FibroelastomaPapilar | Válvulas(aórtica y mitral) | Hipo/isointensa | isointensa | hipointensa | Generalmente no |
| Rabdomioma | Miocardio | Isointensa | Iso/hiperintensa | Hipointensa | Mínimo o ausente |
| Fibroma | Miocardio VI y SIV | Isointensa | Isointensa | Hipointensa | Variable |
| Paraganglioma | Pericardio | Variable | Hiperintensa | Intenso periférico | |
| Hemangioma | Ventrículos intramiocárdicos intracavitario | Isointensa | Hiperintensa | Variable | Si |
| Tumores malignos | Localización preferente | Señal en T1*p> | Señal en T2*p> | Señal en SSFP (cine)*p> | Realce |
| Angiosarcoma | ADpericardio | Variable | Variable | Hipointensa | si |
| Sarcoma indiferenciado | Aurícula izquierda | Isointensa | Isointensa | ||
| Rabdomiosarcoma | No | Isointensa | Hiperintensa | si | |
| Linfoma | Pericardio cavidades derechas | Isointensa | Isointensa | Hipointensa | si |
| Mesotelioma | Pericardio | Isointensa | Hiperintensa | Hipointensa | si |
| Metástasis | PericardioMiocardioIntracavitaria | Hipointensa | Hiperintensa | Hipointensa | si |
| Masas no tumorales | Localización preferente | Señal en T1*p> | Señal en T2*p> | Señal en SSFP (cine)*p> | Realce |
| Trombos | Aurícula izquierda/orejuelaVI | Variable | Variable | Hipointensa | No |
| Hipertrofia lipomatosa del SIA | SIA respeta la fosa oval | Hiperintensa(hipointensa con supresión grasa) | Hiperintensa(hipointensa con supresión grasa) | Isointensa | No |
| Degeneración caseosa de la válvula mitral | Válvula mitralVelo posterior | Hipointensa | Hipointensa | Hipointensa | Realce periférico |
| Quiste pericárdico | Ángulo cardiofrénico derecho | Hipointensa | Hiperintensa | No | |
| Quiste hidatídico | SIV | Hipointensa | Hiperintensa | no | |
| Vegetaciones | Válvulas | No visible | No visible | Hipointensa | no |
La intensidad de señal de las masas cardiacas en las secuencias espín-eco (T1 y T2) se compara con la intensidad de señal del miocardio. En la tabla se refleja el comportamiento más habitual.
En las secuencias cine (SSFP) la señal de las masas cardiacas se compara con la intensidad de señal de la sangre.
Diagnóstico diferencial por imagen de masas cardiacas: hallazgos estructurales
| Trombo | Tumores benignos | Tumores malignos | |
|---|---|---|---|
| Presencia derrame asociado | No | No | Derrame pericárdico/pleural |
| Tamaño | <4 cm | Variable | Mayor tamaño> 4 cm |
| Base de implantación | Variable | Pedículo, movilidad | Amplia, no móvil |
| Irregularidad bordes | No | Bordes lisos | Bordes irregulares |
| Infiltración estructuras adyacentes | No | No | Invasión de estructuras sin adherencia a planos tisulares |
| Movilidad | No habitual Ocasional | Frecuente | Posible |
| Ocupación ≥ 2 cámaras cardiacas | No | No habitual | Frecuente |
| Señal | Homogénea | Inhomogénea | Inhomogénea |
| Localización | VI/aurícula izquierda | Variable | Cámaras derechas |
| Afectación extracardiaca | No | No | Si |
En los últimos años se han incorporado al arsenal diagnóstico de la resonancia magnética cardiaca nuevas secuencias de mapeo de tejidos (T1 y T2 mapping) que se pueden aplicar tanto al miocardio como a las masas. Así, en un reciente artículo13, en el que se caracterizó mediante T1 y T2 mapping las masas intracardiacas de 41 pacientes (22 trombos y 19 tumores), se concluyó que los trombos presentan unos valores de T1 mapping similares al miocardio, y significativamente mayores al miocardio en las secuencias de mapeo en T2. Otro hallazgo de interés fue que los trombos más recientes diferían en valor (T1 más corto) que los trombos de mayor tiempo de evolución. Por otro lado, tumores como los lipomas o las metástasis del melanoma mostraron valores de T1 nativo más cortos. Estas secuencias representan un nuevo enfoque para el estudio y caracterización tisular de las masas cardiacas mediante resonancia magnética cardiaca.
En reconocimiento de sus capacidades de diagnóstico, varias declaraciones de consenso ahora posicionan la resonancia magnética cardiaca como una técnica de imagen de primera línea en el estudio de los tumores cardicardiacos7,14. De forma realista, aunque el acceso a la resonancia magnética cardiaca está aumentando, sigue estando menos disponible que la ecocardiografía o la tomografía computarizada cardiaca; el uso conjunto de la ecocardiografía y la resonancia magnética cardiaca se utilizará para el diagnóstico y la monitorización de masas y tumores cardicardiacos.
Protocolo con resonancia magnéticaAspectos generalesLa resonancia magnética cardiaca es una técnica objetiva, reproducible e inocua que ofrece una resolución temporal más alta que la tomografía computarizada cardiaca y una caracterización adicional del tejido para analizar el corazón y el resto de las estructuras torácicas4,14. Los estudios de resonancia magnética cardiaca se realizarán preferiblemente en equipos de 1,5 o 3,0 tesla (T), con antenas de superficie acopladas en fase y sincronización electrocardiográfica.
Adquisición del estudioEl protocolo de estudio habitual consiste en lo siguiente:
- 1.
Localizador multiplano con sincronización electrocardiográfica y en apnea espiratoria.
- 2.
Secuencias funcionales, cine-resonancia magnética cardiaca, de «sangre blanca» basada en eco de gradiente (EG) (fast imaging with steady-state precession, SSFP). Son secuencias con gran diferenciación en la intensidad de señal de la sangre y el miocardio que facilitan la detección de lesiones intracavitarias.
- 3.
Secuencias morfológicas y de caracterización tisular, de «sangre negra» basadas en eco de espín (SE) rápido (turbo o fast spin echo) (TSE), generalmente con doble o triple pulso de inversión para mejorar la anulación del flujo intracavitario. Se obtendrán secuencias potenciadas en T1 y T2, y opcionalmente secuencias de supresión grasa.
- 4.
Perfusión de primer paso durante la administración intravenosa de gadolinio. Secuencias en EG ultrarrápidas potenciadas en T1 con alta resolución temporal para analizar la llegada del bolo de contraste, y valorar la perfusión miocárdica5,14.
- 5.
Secuencias de realce tardío (miocardio negro). Secuencias potenciadas en T1 con un pulso de inversión de 180∘ que se aplica en un tiempo seleccionado (tiempo de inversión) para anular la señal del miocardio sano. Las secuencias de realce tardío permiten delimitar más claramente el tumor y son esenciales para detectar y caracterizar los trombos5,14.
Pueden ser de localización intracavitaria y estar adheridos al endocardio o al miocardio, o bien pueden ser intramiocárdicos.
MixomaEs el tumor cardiaco primario más frecuente (25-50%). La mayoría son esporádicos y afectan a mujeres entre la cuarta y séptima década. Suelen ser asintomáticos o presentarse con insuficiencia cardiaca, embolia, síncope o muerte súbita cuando prolapsan a través de la válvula mitral3,4. Un 7% forma parte del complejo de Carney, síndrome autosómico dominante caracterizado por mixomas, hiperpigmentación y tumores extracardiacos15.
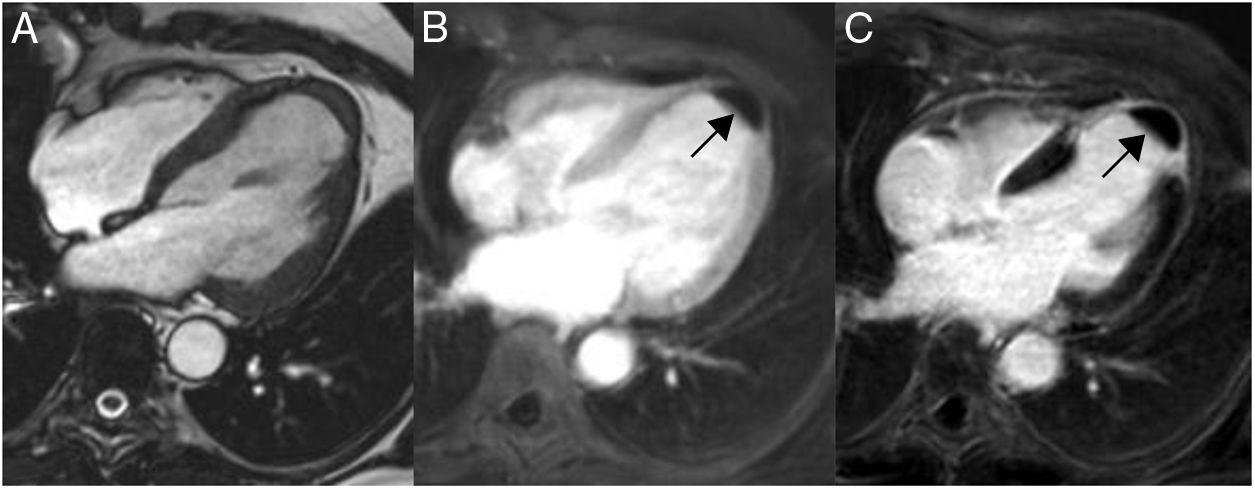
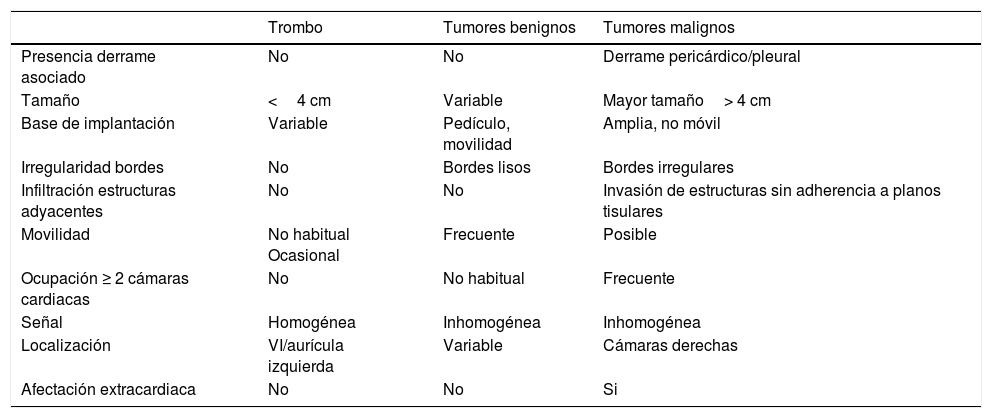
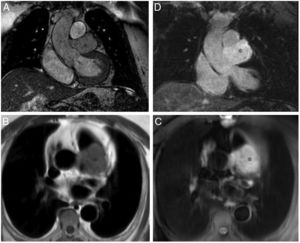
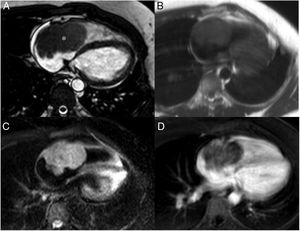
Son más frecuentes en la aurícula izquierda (75%), suelen estar adheridos por un pedículo al septo interauricular y pueden prolapsar a través de las válvulas auriculoventriculares (fig. 1). Se presentan como masas ovales intracavitarias de tamaño variable (1-15cm) y heterogéneas, debido a necrosis, calcificaciones, sangrado, formaciones quísticas o fibrosis16.
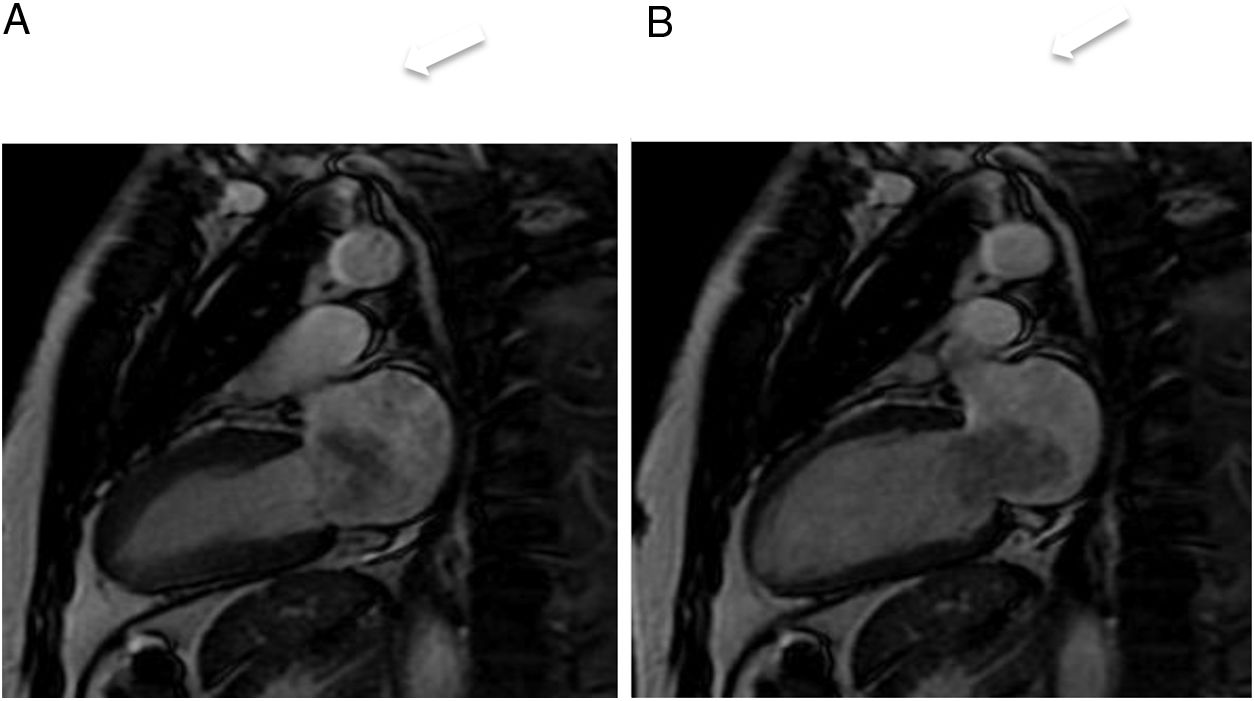
Mixoma en un varón de 47 años asintomático. Las imágenes de cine-resonancia magnética cardiaca (SSFP) en plano de dos cámaras, en sístole (A) y diástole (B), muestran una masa intracavitaria bien delimitada y polilobulada (flechas) en la aurícula izquierda, que en la diástole (B) se prolapsa (puntas de flechas) a través de la válvula mitral.
En la resonancia magnética cardiaca son de señal iso-/hipointensa o hiperintensa respecto al miocardio en las secuencias potenciadas en T1 e hiperintensa en las potenciadas en T2. El realce tras la administración de contraste suele ser escaso y heterogéneo16. La ausencia de realce con contraste intravenoso es el signo más útil para diferenciar un trombo intracavitario de un mixoma16.
Fibroelastoma papilarRepresentan el 10% de los tumores cardiacos primarios, suelen ser asintomáticos17 y se pueden localizar en la superficie endocárdica valvular aórtica (29%) o mitral (25%)15,17.
Son lesiones pequeñas (<1cm), delimitadas, de señal hipointensa o intermedia en secuencias potenciadas en T1, intermedia en las potenciadas en T2, e hipointensa en secuencias cine-resonancia magnética cardiaca SSFP. No realzan tras la administración de contraste intravenoso17.
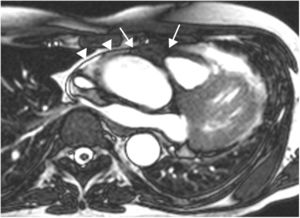
LipomaCorresponden al 8% de los tumores cardiacos; pueden detectarse a cualquier edad. Generalmente son solitarios, aunque se han descrito casos múltiples asociados a esclerosis tuberosa y cardiopatías congénitas18. La localización más habitual es endocavitaria en la aurícula derecha y en el ventrículo izquierdo; otras localizaciones son intramiocárdica (25%) y pericárdica (25%) y menos frecuente en válvulas cardiacas.
En la resonancia magnética cardiaca, los lipomas endocavitarios se observan como masas sésiles pequeñas, homogéneas, adheridas al septo interauricular o al techo de la aurícula; mientras que los intramiocárdicos, se aprecian como masas ovaladas, bien delimitadas y homogéneas (fig. 2).
Lipomas miocárdicos. Numerosos nódulos intramiocárdicos (flechas) hiperintensos respecto al miocardio en T1 (A) e isointensos con la sangre en la imagen de cine-RM. (B) En la secuencia potenciada en T1 con contraste y supresión grasa (C) los nódulos son hipointensos ya que su señal se anula con la supresión grasa y no realzan tras la administración de gadolinio intravenoso.
En la resonancia magnética cardiaca son hiperintensos en secuencias potenciadas en T1-TSE e hipointensos en secuencias de supresión específica de la grasa, y suelen presentar una cápsula hipointensa.
El liposarcoma es una tumoración de estirpe lipomatosa con atenuación e intensidad de señal heterogénea que se realza tras la administración de contraste y que puede infiltrar estructuras adyacentes. La resección quirúrgica dependerá de su tamaño, localización y repercusión funcional19.
RabdomiomaEs el tumor cardiaco más frecuente en edad pediátrica. Suele diagnosticarse en el periodo neonatal, aislado o asociado a esclerosis tuberosa; la mayoría regresan espontáneamente. Habitualmente son asintomáticos, pero pueden provocar obstrucción del tracto de salida de los ventrículos o arritmias18.
Los rabdomiomas suelen ser múltiples (90%) e intramiocárdicos. En la resonancia magnética cardiaca son isointensos en secuencias potenciadas en T1 y ligeramente hiperintensos en las potenciadas en T2. Con contraste intravenoso el realce es mínimo o ausente18.
FibromaEs el segundo tumor benigno cardiaco más frecuente en niños. Puede ser asintomático o presentarse con arritmia o muerte súbita. Existe una prevalencia aumentada en los síndromes de Gorlin y de Gardner15,18.
Suelen ser tumores únicos y bien delimitados, habitualmente localizados en el septo interventricular y en la pared lateral del ventrículo izquierdo18. Son de señal heterogénea, hipointensa o hiperintensa en las secuencias potenciadas en T1 y T2. En la perfusión de primer paso son de señal hipointensa e hiperintensa en las secuencias de realce tardío, en ocasiones con hipointensidad central.
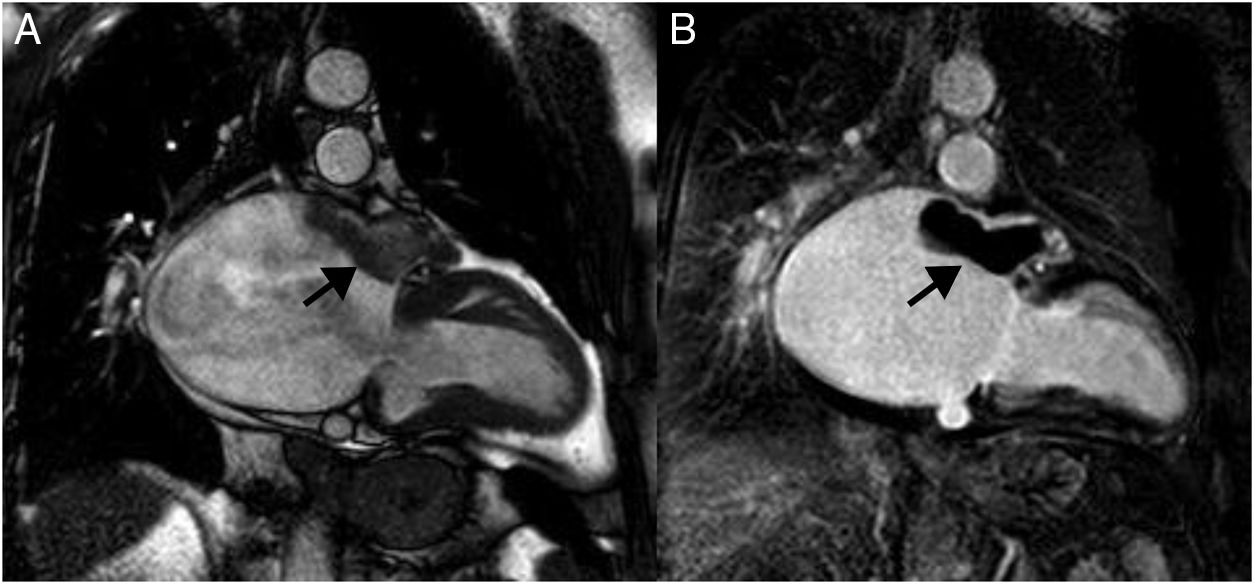
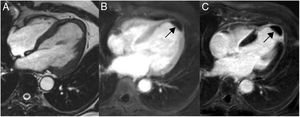
ParagangliomaSon neoplasias neuroendocrinas que se originan de las células cromafines, infrecuentes en la población general, con una prevalencia de 1,5-1,6 por 10.000/personas. Su prevalencia incrementa de 20 a 60 por 10.000/personas en población hipertensa15,20. Se pueden localizar a lo largo de todo el cuerpo, el 10% se localiza a nivel mediastinal, aunque raras veces pueden encontrarse a nivel pericárdico. Los paragangliomas familiares constituyen el 10% de los casos, y 35 a 50% de los casos familiares presentan tumores multicéntricos. El 90% de los pacientes presenta síntomas, que pueden ser diarios o paroxísticos (cada semana/meses), desencadenados espontáneamente o por situaciones de estrés físico/farmacológico (anestesia, toma de medicamentos)15,20.
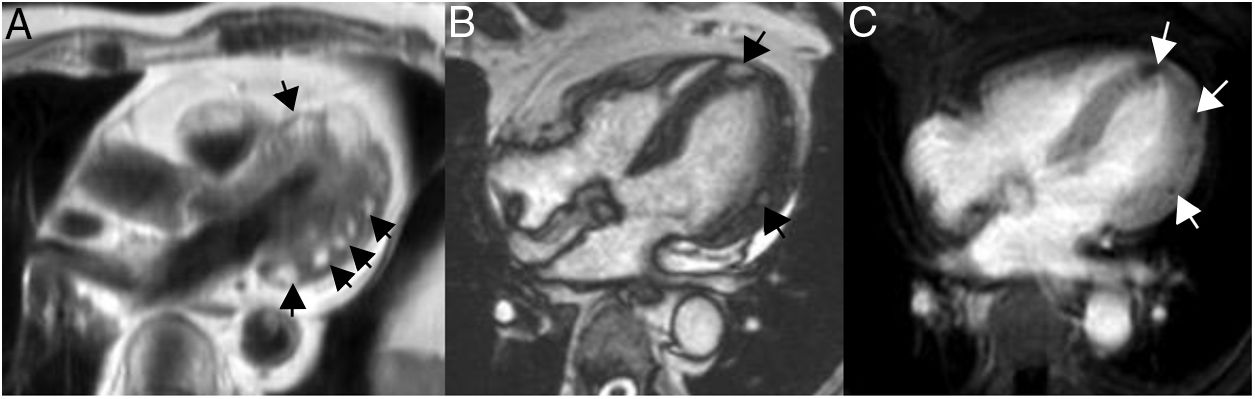
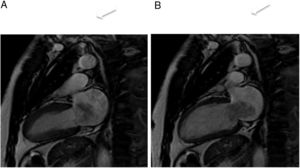
En la resonancia magnética cardiaca suelen ser iso-/hipointensos en secuencias potenciadas en T1 e hiperintensos en las potenciadas en T2 (fig. 3). En ocasiones son hiperintensos en T1 por sangrado intratumoral. Con contraste intravenoso suelen tener realce intenso de predominio periférico15,20.
Mujer 22 años, hipertensa en tratamiento. Imágenes de resonancia magnética cardiaca en plano sagital oblícuo, que muestran una masa en el surco auriculoventricular ligeramente heterogénea e hiperintensa tanto en T1 (A) como en T2 (B). En la secuencia de realce tardío (C), se aprecia un realce intenso periférico. Paraganglioma.
Son tumores vasculares que representan menos del 10% de todas las neoplasias primarias de este órgano, y pueden comprometer endocardio, miocardio o epicardio3. Habitualmente son pequeños, su tamaño varía entre 2 y 3,5cm de diámetro; pueden ser masas sésiles o polipoides y usualmente únicas. Son más frecuentes entre la tercera y quinta décadas, con un ligero predominio del sexo femenino. Desde el punto de vista histológico, los hemangiomas cardiacos se clasifican como cavernosos, capilares, arteriovenosos, hemangioendoteliomas y hemangiomas con hiperplasia papilar endotelial. La mayoría de pacientes portadores de hemangiomas cardiacos son asintomáticos y el tumor se descubre accidentalmente.
En las imágenes de resonancia magnética cardiaca, los hemangiomas suelen ser heterogéneos e hiperintensos en las imágenes potenciadas en T1 y T2 debido al flujo sanguíneo lento (fig. 4). Durante y después de la administración del agente de contraste, son intensamente hiperintensas debido a su contenido vascular, pero puede haber regiones de heterogeneidad que crecen en la calcificación o tabiques fibrosos3,21.
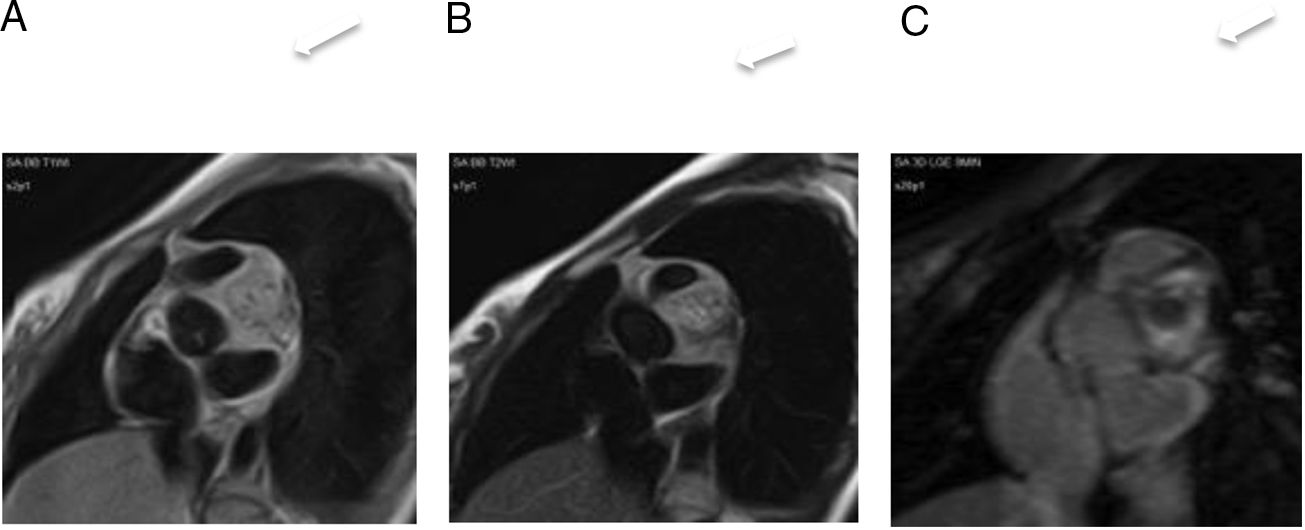
Hemangioma pericárdico. A. Imagen coronal cine-RM que muestra una masa (asterisco) en el surco auriculoventricular, entre la salida de los grandes vasos. La masa es isointensa con el miocardio en T1 (B), hiperintensa en T2 con supresión grasa (C) y muestra un realce intenso y homogéneo tras la administración de gadolinio intravenoso (D).
Predominan en las cámaras derechas y se caracterizan por ser masas heterogéneas, de tamaño mayor a los 5cm, con un comportamiento infiltrante y asociación frecuente con derrame pericárdico o pleural. Pueden dividirse en tres grandes grupos: sarcomas, linfomas y mesoteliomas.
En cuanto a la caracterización tisular mediante la resonancia magnética cardiaca, la presencia de una señal heterogénea de la masa, que indica necrosis o hemorragia focal, es un hallazgo reconocido para sospechar malignidad. Igualmente, si en las secuencias de perfusión de primer paso se evidencia alta vascularización, se debe sospechar malignidad. En un estudio reciente, en los tumores malignos se observó mayor captación patológica difusa en secuencias de realce tardío tras la administración de gadolinio (92 vs. 41%)22.
SarcomasSon las neoplasias primarias malignas más frecuentes del corazón, el pericardio y los grandes vasos. Existen diferentes tipos que pueden afectar el corazón: angiosarcomas (sarcomas más frecuentes que afectan el corazón), sarcomas indiferenciados, leiomiosarcomas, rabdomiosarcomas, fibrosarcomas, liposarcomas y osteosarcomas extraesqueléticos.
AngiosarcomaEs el tumor primitivo maligno más frecuente del corazón en los adultos; representa aproximadamente a un tercio de los tumores primitivos malignos23. Suelen encontrarse en varones de mediana edad y se localizan casi exclusivamente en la aurícula derecha, siendo muy frecuente la afectación pericárdica. Se describen dos tipos morfológicos: el primero corresponde a una masa bien definida que protruye en la aurícula derecha, respetando el septo interventricular, y el segundo corresponde a una masa difusamente infiltrativa que se extiende al ventrículo derecho y al pericardio. Debido a su localización, los pacientes presentan a menudo síntomas secundarios a insuficiencia cardiaca derecha o a taponamiento por invasión pericárdica. Un alto porcentaje tiene metástasis en el momento del diagnóstico24.
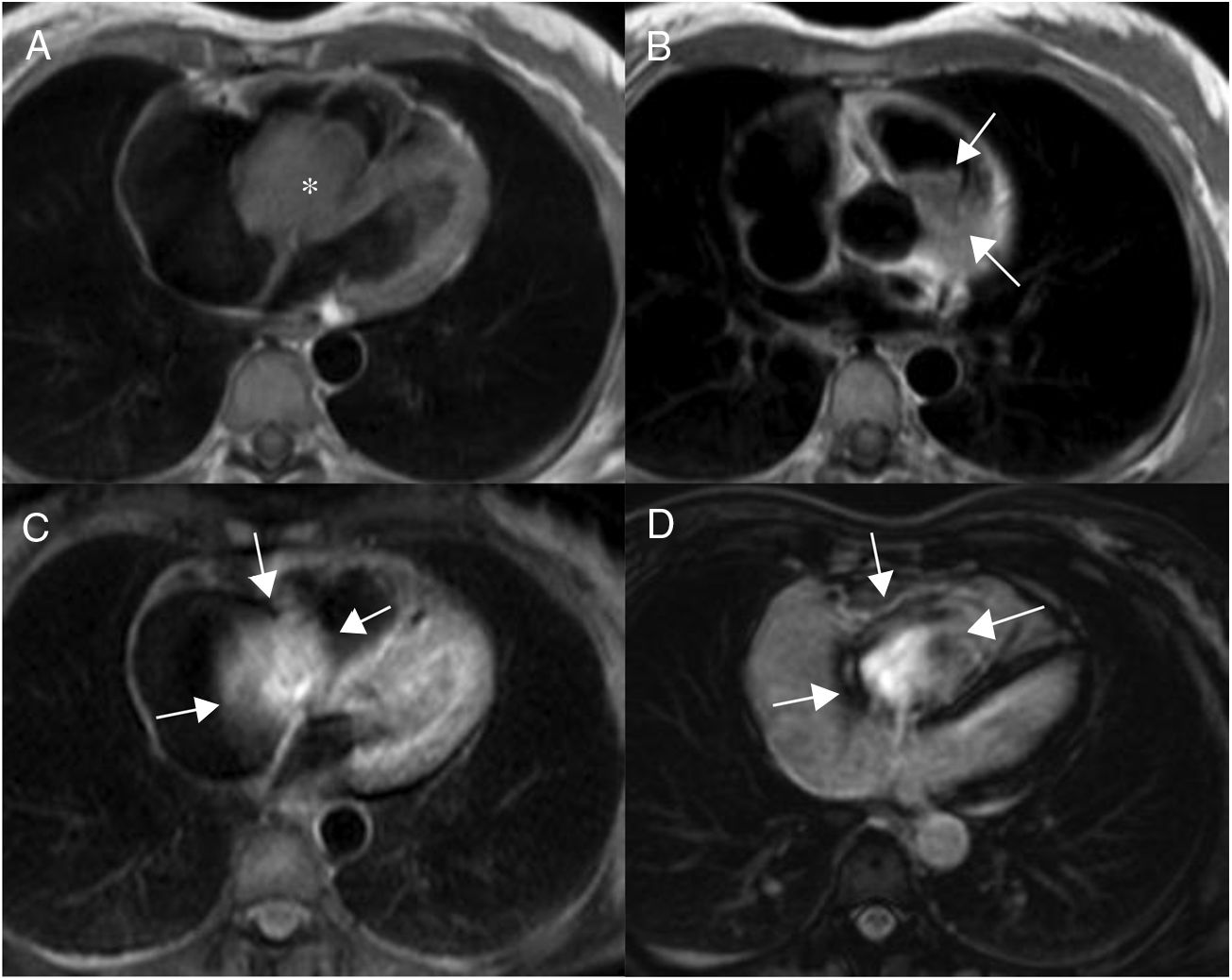
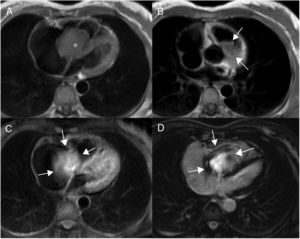
En resonancia magnética cardiaca se caracterizan por ser masas grandes y heterogéneas localizadas en la aurícula derecha, que pueden invadir el pericardio, dando lugar a derrame hemorrágico, engrosamiento y/o nodularidad de la superficie pericárdica. El tumor tiene una apariencia heterogénea en T1 con áreas de señal intermedia, hipo e hiperseñal, que reflejan el componente tumoral, la necrosis y la hemorragia respectivamente. En T2 son también heterogéneos, aunque predominantemente hiperintensos (fig. 5). Tras la administración de gadolinio intrevenoso muestran un realce intenso y heterogéneo que en ocasiones adopta un aspecto “en rayo de sol” por el realce lineal de las áreas vasculares25,26.
Paciente de 32 años con angiosarcoma. Masa en cavidades derechas (asterisco en A), adherida al septo, con extensión al tracto de salida del ventrículo derecho (flechas en B). La masa muestra una señal isointensa con el miocardio en T1 (A y B), es heterogénea aunque predominantemente hiperintensa en T2 con supresión grasa (C) y muestra realce heterogéneo tras la administración de gadolinio intravenoso (D).
Representa el segundo tumor primario maligno más frecuente. Son tumores de adultos, típicamente en la cuarta a quinta década. Su pronóstico es malo, como en los angiosarcomas.
La mayoría se localizan en la aurícula izquierda y suelen ser masas isointensas irregulares que infiltran el miocardio.
Otros sarcomas cardiacosLeiomiosarcomasSon más frecuentes en la tercera a cuarta décadas de la vida y tienen predilección por la aurícula izquierda (pared posterior). En la resonancia magnética cardiaca suelen mostrar señal isointensa en T1, hiperintensa en T2 y marcado realce tras la administración de gadolinio intravenoso27. Son frecuentes las metástasis pulmonares y el derrame pericárdico metastásico. Pueden ser múltiples en el 30% de los casos.
RabdomiosarcomasRepresentan el tumor maligno primitivo cardiaco más frecuente en la infancia. Aunque no tienen predilección por ninguna localización en particular, tienen mayor tendencia que otros sarcomas a invadir las válvulas y pueden ser multifocales.
OsteosarcomasSe localizan preferentemente en la aurícula izquierda. Presentan con frecuencia calcificaciones en su interior, que constituyen su rasgo de imagen más distintivo.
LinfomaEn general, la afectación cardiaca por linfoma es secundaria. El linfoma cardiaco primario es muy poco frecuente y suele ocurrir en pacientes inmunodeprimidos. El tumor se origina con frecuencia en el surco aurículo-ventricular derecho y se extiende a aurícula derecha, ventrículo derecho y pericardio. En ocasiones el único hallazgo es el derrame pericárdico. En resonancia magnética cardiaca es iso o hipointensa en T1 y T2 y muestra realce heterogéneo tras la administración de gadolinio itravenoso28.
Mesotelioma pericárdicoRepresenta aproximadamente la mitad de los tumores primarios del pericardio. A diferencia del mesotelioma pleural no se ha demostrado una asociación con la exposición al asbesto. El mesotelioma afecta de forma difusa el pericardio parietal y visceral, habitualmente sin invadir el corazón. La resonancia magnética cardiaca es útil para delimitar la extensión de la afectación, que suele ser isointensa en T1, hiperintensa en T2 y con realce marcado tras la administración de gadolinio intravenoso29.
Tumores cardiacos malignos secundariosLas metástasis son los tumores cardiacos más frecuentes; se calcula que entre 20 y 40 veces más frecuentes que los tumores primarios30. Las neoplasias que con mayor frecuencia metastatizan en el corazón son las de pulmón y mama, seguidas del melanoma, linfoma y leucemia.
La afectación cardiaca puede producirse por extensión directa, por vía hematógena, linfática o por extensión venosa. La extensión directa se observa en casos de neoplasias de pulmón, mama, esófago u otros tumores malignos del mediastino y el sitio más frecuente de afectación es el pericardio. La diseminación hematógena suele observarse en pacientes que tienen una neoplasia diseminada, en cuyo caso el melanoma muestra predilección especial por esta vía de diseminación. La diseminación linfática retrógrada se produce cuando existen adenopatías mediastínicas malignas y una invasión de los vasos linfáticos, retrógradamente, hacia el corazón. Esta vía es habitual en los linfomas, aunque también se observa en neoplasias de pulmón y mama. Por último, la extensión vía venosa puede verse en casos de neoplasias torácicas (fundamentalmente carcinoma de pulmón) que se extienden a través de la vena cava superior o de una vena pulmonar o en neoplasias abdominales (más frecuente el carcinoma renal) que se extienden a través de la vena cava inferior hasta el corazón derecho.
Las metástasis pueden ser pericárdicas, miocárdicas o intracavitarias. La mayoría son asintomáticas, pero pueden provocar taponamiento cardiaco, arritmias, insuficiencia cardiaca o incluso la muerte por invasión de las arterias coronarias.
La afectación metastásica del pericardio se manifiesta en forma de derrame (manifestación más frecuente), masas, engrosamiento nodular del pericardio, o una combinación de estos hallazgos. En el estudio de resonancia magnética cardiaca el comportamiento de las lesiones y del derrame es inespecífico, salvo si el derrame es hemorrágico, en cuyo caso mostrará hiperintensidad de señal en las secuencias potenciadas en T1.
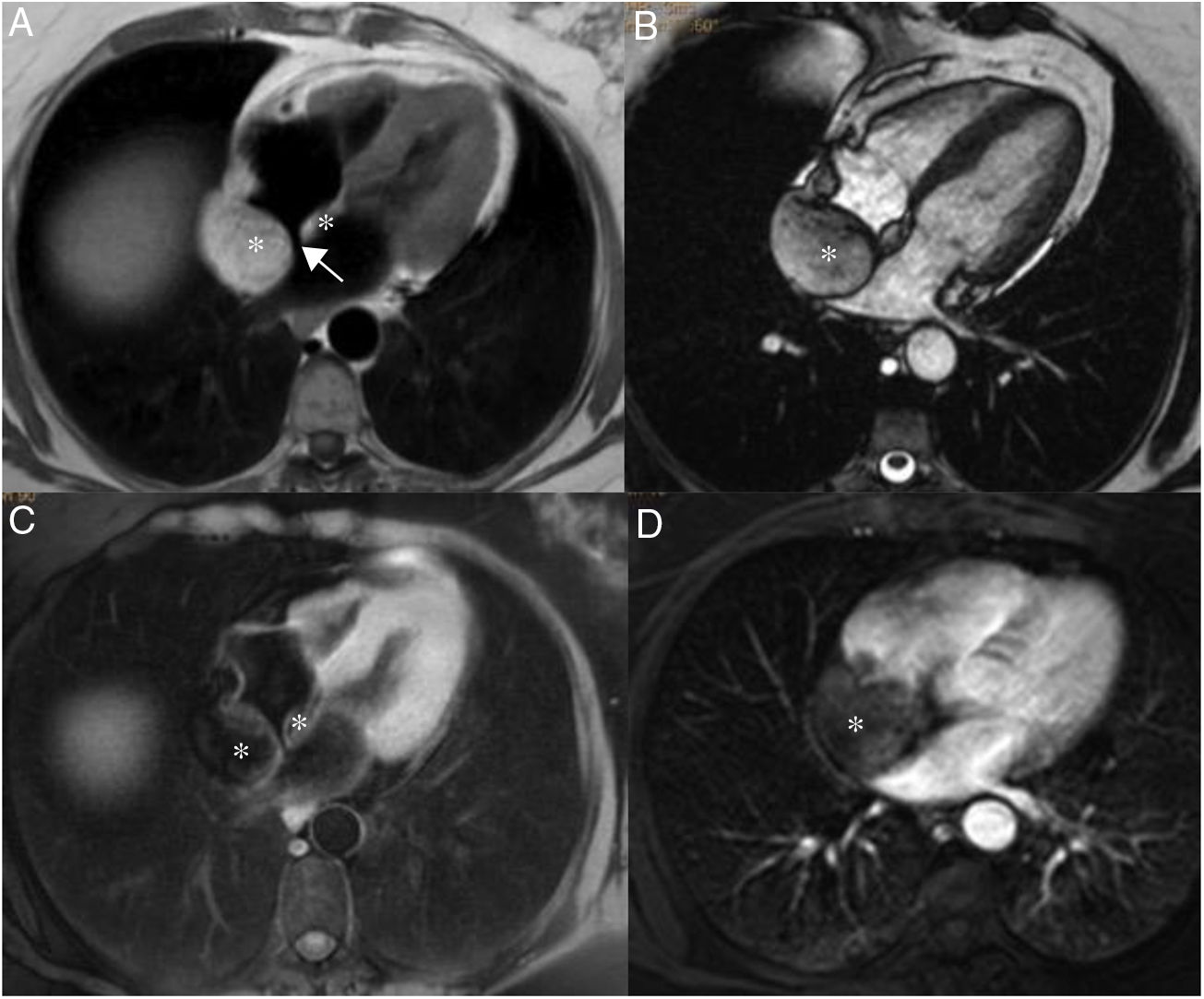
Las metástasis miocárdicas suelen localizarse en la pared lateral del ventrículo izquierdo y en el septo interventricular. En resonancia magnética cardiaca muestran un comportamiento de señal inespecífico (hipointensas en secuencias potenciadas en T1 e hiperintensas en T2) (figs. 6 a 8), a excepción de las metástasis de melanoma, que son hiperintensas en T1 (este comportamiento también puede observarse en metástasis que hayan sangrado). Tras la administración de gadolinio muestran realce heterogéneo31. Las metástasis endocavitarias son raras y se producen en casos de tumores que han alcanzado el corazón por vía venosa en forma de trombo tumoral, a través de las venas cavas o de las venas pulmonares. Al igual que las metástasis miocárdicas muestran en general un comportamiento de señal inespecífico y un realce heterogéneo tras la administración de gadolinio intravenoso. Este último dato es de gran utilidad para diferenciar el trombo tumoral del no tumoral (no capta), ya que ambos pueden coexistir32.
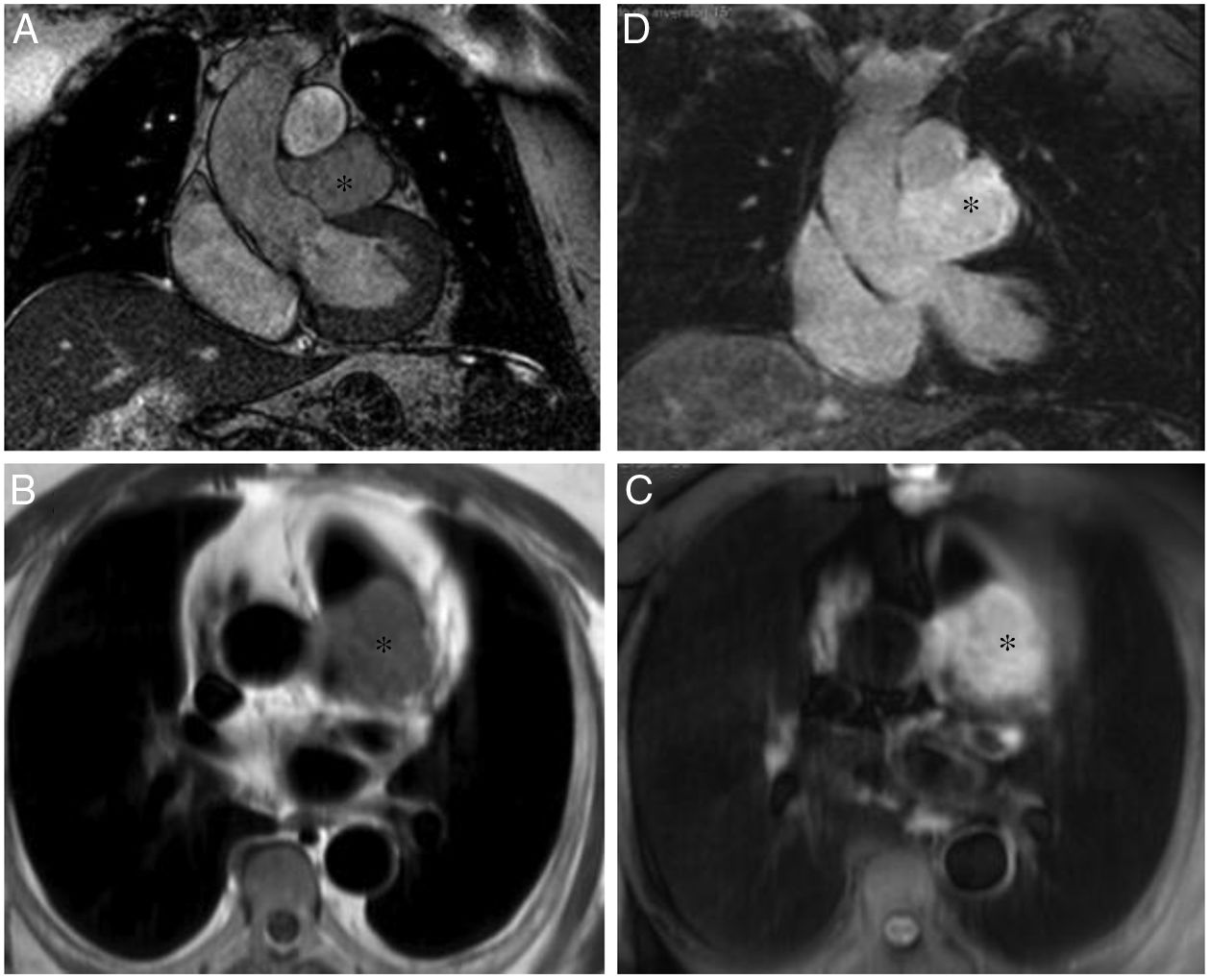
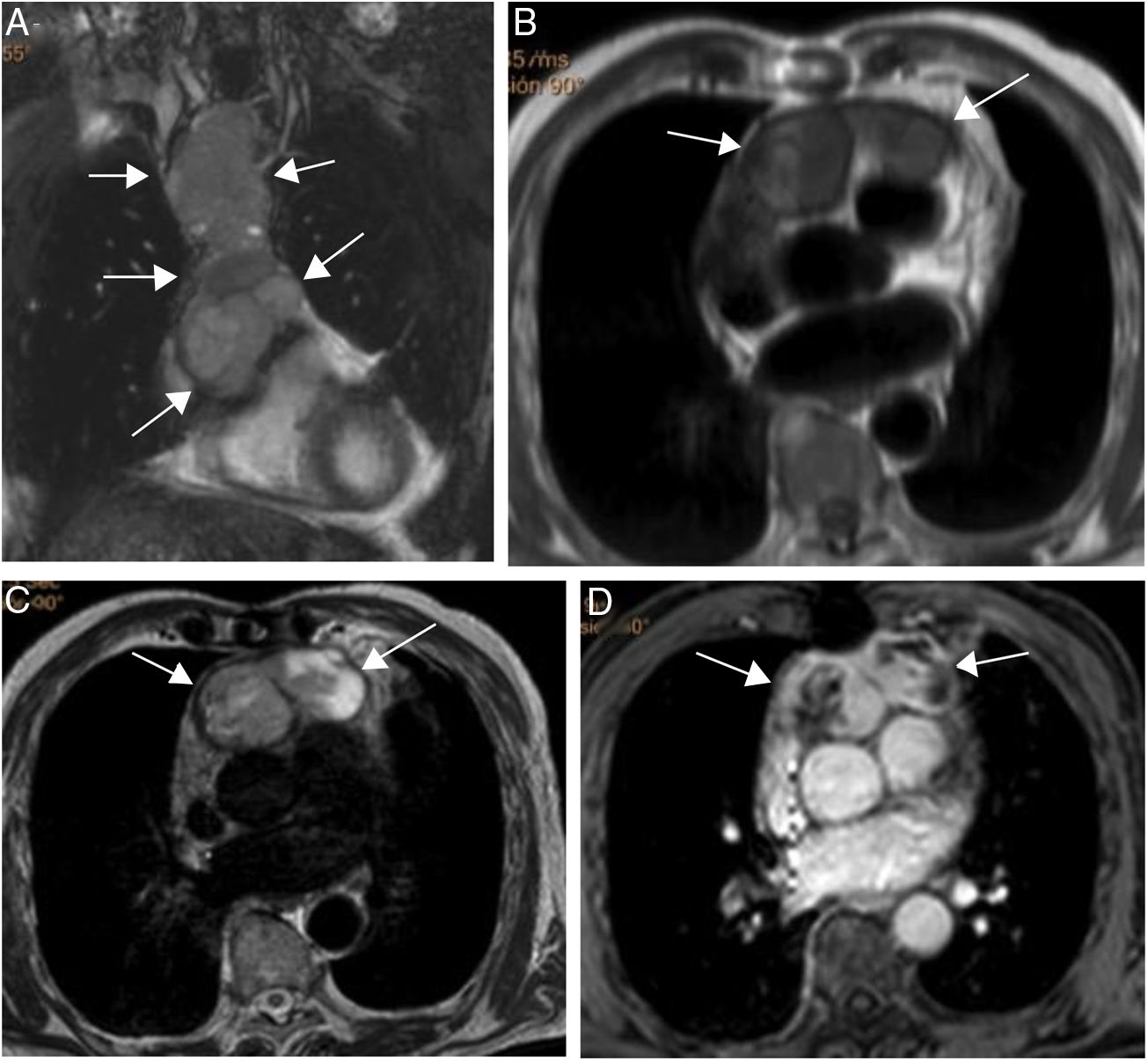
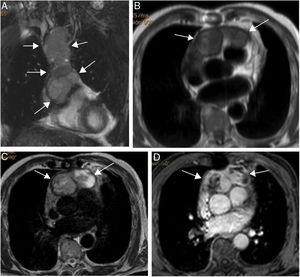
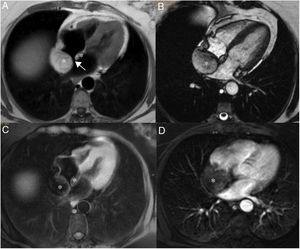
Paciente varón de 64 años con recidiva de timoma invasivo (estadio IV).
A. Imagen coronal de cine-RM que muestra una masa mediastínica anterior con extensión intrapericárdica (flechas). La masa es ligeramente hipointensa en T1 (B), heterogénea con áreas iso e hiperintensas en T2 (C) y muestra un realce intenso pero heterogéneo tras la administración de gadolinio intravenoso (D).
Varón de 28 años con metástasis cardiaca de tumor de Askin. Se objetiva una masa intracavitaria (asterisco en A) localizada en la aurícula derecha, con extensión al ventrículo derecho. La masa es hipointensa en la imagen de cine-RM (A), isointensa con el miocardio en T1 (B), hiperintensa en T2 con saturación grasa (C) y muestra un realce heterogéneo tras la administración de gadolinio intravenoso (D).
Los trombos cardiacos son las masas intracardiacas más frecuentes y pueden localizarse en cualquier cámara cardiaca, siendo la aurícula izquierda la localización más frecuente. Suelen producirse en pacientes con alteraciones de la contractilidad global (miocardiopatía dilatada) o segmentaria (post-infarto) o en pacientes con fibrilación auricular, especialmente si existe enfermedad valvular mitral. Se presentan como masas polipoideas móviles o adheridas a la pared del ventrículo izquierdo (en caso de disfunción ventricular) (fig. 9) o en la orejuela izquierda (en caso de fibrilación auricular y valvulopatía mitral) (fig. 10). Los trombos en las cavidades derechas se observan generalmente en pacientes portadores de una vía central o provienen de trombos venosos que se han desplazado desde las extremidades.
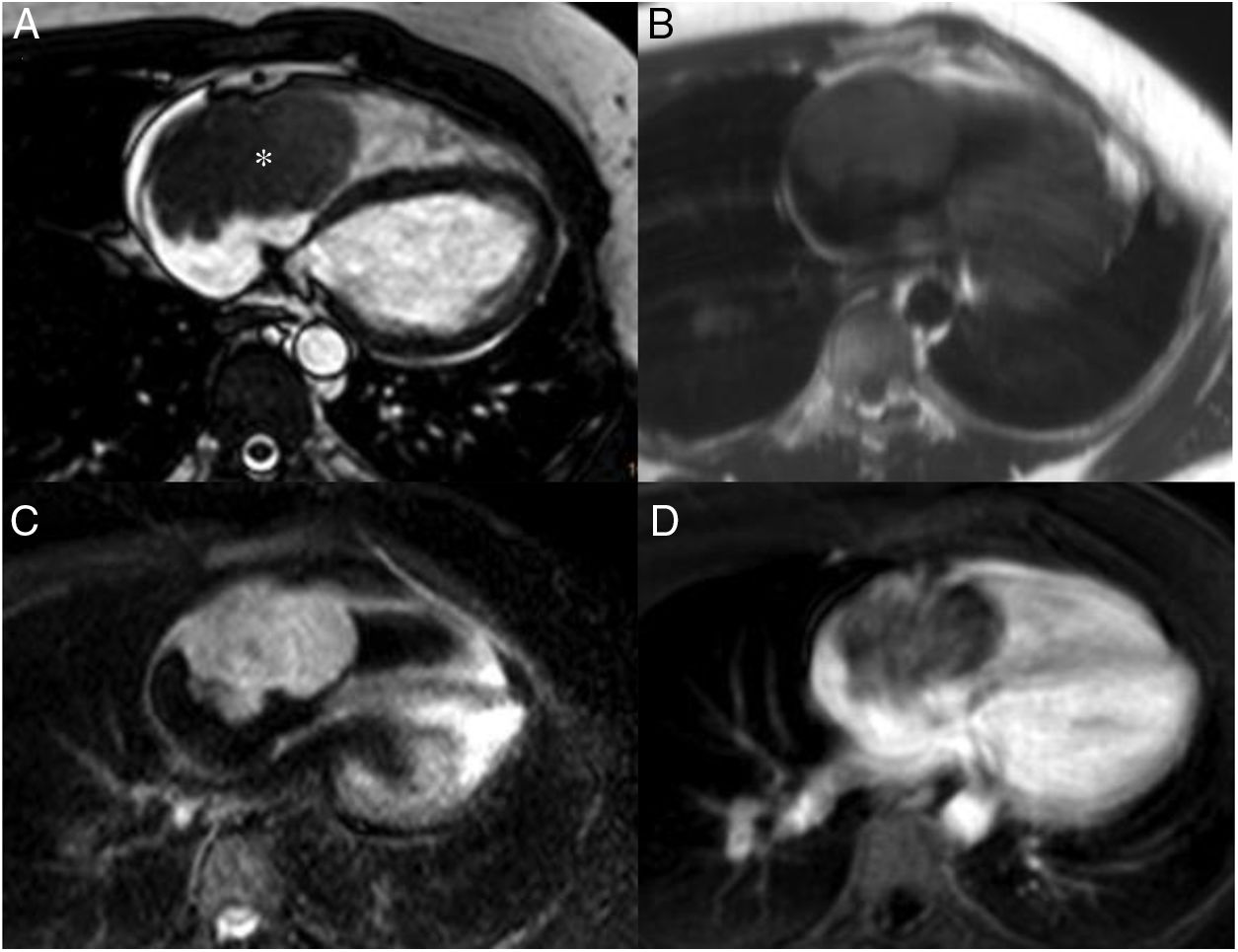
Trombo localizado en ápex del ventrículo izquierdo en paciente con enfermedad coronaria crónica (infarto anterior). A. Imagen cine-RM (SSFP) en plano 4 cámaras. Se observa trombo isointenso con el miocardio. B. Secuencia de realce tardío precoz en plano 4 cámaras, a los 2 minutos de la administración de gadolinio intravenoso, con TI de 500ms. C. Secuencia de realce tardío, a los 10 minutos de la administración de gadolinio intravenoso, con TI de 285ms. Se observa realce transmural del segmento apical del septo y ápex.
Trombo en orejuela de aurícula izquierda en paciente de 56 años con miocardiopatía hipertrófica. A. Imagen cine-RM en plano 2 cámaras, se observa masa isointensa con respecto al miocardio, con señal homogénea, en orejuela izquierda, que se extiende hacia la pared anterior de la aurícula. B. Secuencia de realce tardío, se observa ausencia de captación de contraste.
En resonancia magnética cardiaca presentan un tamaño habitualmente menor de 2cm, y un comportamiento de la intensidad de señal variable en función del tiempo de evolución. Los trombos agudos son hiperintensos en T1 y T2, mientras que los subagudos son hiperintensos en T1 y muestran áreas de baja señal en T2. Los trombos crónicos muestran baja señal tanto en T1 como en T233. En las secuencias cine (SSFP) el trombo suele ser hipointenso respecto al miocardio y con una señal mucho más baja que la sangre blanca de las cavidades. A diferencia de los tumores, los trombos no presentan vascularización en la secuencia de perfusión de primer paso, ni realzan tras la administración de gadolinio intravenoso, si bien en ocasiones pueden mostrar un fino realce periférico que corresponde a una pseudocápsula fibrinosa. Las secuencias más útiles para su detección y caracterización son las de realce tardío, especialmente las adquiridas precozmente (a los 2-3 minutos de la inyección del gadolinio) utilizando tiempos de inversión del orden de 500ms (en equipos de 1,5 T)34. Con ello se evita anular la señal del miocardio (no se observa negro), lo que facilita la detección del trombo (especialmente en los casos en que se encuentra adherido a la pared ventricular), el cual aparece como una lesión intracavitaria de muy baja señal, que contrasta con la mayor señal del miocardio y de la sangre de la cavidad ventricular.
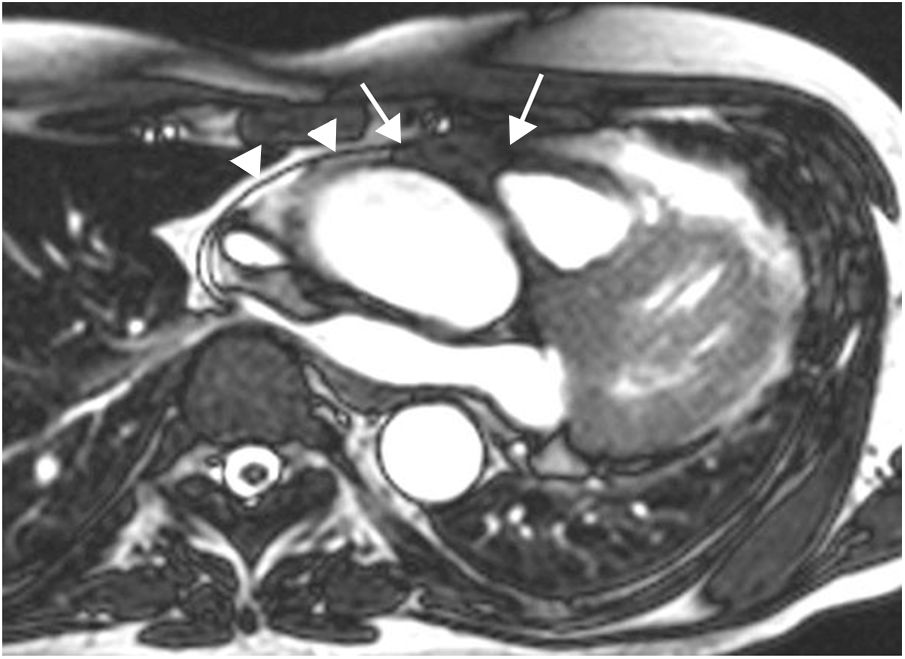
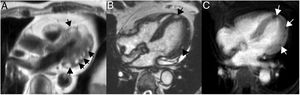
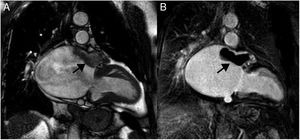
Hipertrofia lipomatosa del septo interauricularEs una entidad benigna, generalmente asintomática, caracterizada por acumulación de grasa en el septo interauricular, en continuidad con la grasa epicárdica, sin encapsulamiento, a diferencia del lipoma. Es más frecuente en mujeres de edad avanzada, en pacientes obesos y en la toma crónica de corticoides orales. El diagnóstico se establece cuando el septo infiltrado por grasa, que de forma característica respeta la fosa oval, tiene un grosor mayor de 2 cm35. En ocasiones el cúmulo graso puede extenderse cranealmente hacia la entrada de la vena cava superior o hacia la pared de la aurícula derecha, provocando compresión extrínseca de estas estructuras. Como el tejido adiposo tiene un tiempo de relajación T1 corto, los lipomas tienen una alta intensidad de señal en imágenes potenciadas en T1, que se pueden suprimir con secuencias de pulsos que saturan la grasa (fig. 11). Estas secuencias son muy específicas para llegar al diagnóstico definitivo, y característicamente el comportamiento de la masa es idéntico a la grasa subcutánea, sin observarse realce tras la administración de gadolinio intravenoso. En general, tienen una intensidad de señal homogénea, aunque pueden existir tabicaciones. Debido a su apariencia típica no presenta problema de diagnóstico diferencial con el lipoma. Un dato a tener en cuenta es que debido a que contiene grasa parda, puede mostrar aumento de captación en la tomografía por emisión de positrones36.
Paciente de 54 años con neoplasia de mama, en estudio por masa cardiaca. A. Imagen axial potenciada en T1 que muestra una masa en la región craneal del septo interauricular (*). La masa respeta la fosa oval (flecha) y ocupa parte de la cavidad auricular derecha. B. Aspecto de la masa en la imagen de cine-RM (SSFP) en plano 4 cámaras. La masa es hiperintensa respecto al miocardio en la secuencia potenciada en T1 (A), hiperintensa con anillo hipointenso en la secuencia de cine-RM (B), característicamente suprime su señal en la secuencia de supresión grasa (C) y no realza tras la administración de gadolinio intravenoso (D). Las características morfológicas y el comportamiento de señal es típico de la hipertrofia lipomatosa del septo interauricular.
Es una rara variante de calcificación del anillo, habitualmente asintomática, que suele afectar a mujeres de edad avanzada con factores de riesgo cardiovascular, fundamentalmente hipertensión, insuficiencia renal crónica o alteraciones del metabolismo del calcio. Se manifiesta como una masa bien delimitada, de bordes calcificados, en la parte posterior-lateral del anillo mitral. Aunque el diagnóstico ecocardiográfico no suele ser complejo, dada la presencia de calcio y las características típicas de la masa (circular, bordes lisos, baja movilidad, calcificación), en ocasiones alcanza un gran tamaño, que obliga a un estudio pormenorizado con cardiorresonancia. Se describe de forma característica hipointensidad de señal respecto al miocardio en todas las secuencias, ausencia de perfusión y realce patológico periférico rodeando la masa en las secuencias de realce tardío37.
Variantes anatómicas que pueden simular un tumorLa crista terminalis es una estructura fibromuscular vertical que se extiende desde la vena cava inferior a la vena cava superior, separando la pared posterior de la aurícula derecha de su pared externa. Es importante conocer y saber detectar esta estructura ya que en el plano axial suele mostrar una morfología nodular y puede ser confundida con una pequeña masa en la pared posterior de la aurícula derecha. La válvula de Eustaquio o la red de Chiari prominentes, a nivel de la desembocadura de la vena cava inferior, también pueden confundirse con trombos móviles, y se debe conocer sus variantes de la normalidad.
Otra estructura anatómica que puede confundirse con una pequeña masa o trombo es la cresta de Coumadin (signo del Q-tip), que corresponde a una banda prominente de tejido auricular en la unión de la orejuela izquierda con la vena pulmonar superior izquierda.
QuistesLos quistes pericárdicos son entidades benignas, generalmente asintomáticas. El 70% están localizados en el ángulo cardiofrénico derecho, el 22% en el izquierdo, y el resto en localización posterior o mediastínica anterosuperior. La localización, los bordes bien delimitados, la homogeneidad del contenido, la alta intensidad de señal en las imágenes potenciadas en T2 y la ausencia de perfusión tras la administración del contraste, son claves en el diagnóstico.
Los quistes intramiocárdicos son extremadamente raros y habitualmente se deben a quistes hidatídicos, que se asientan más comúnmente en el septo interventricular. La imagen ecocardiográfica inicial suele sugerir contenido líquido, y la resonancia magnética cardiaca mostrará una señal de alta intensidad en las secuencias potenciadas en T2, similar a la descrita para los quistes pericárdicos, aunque pueden ser visibles tabicaciones.
Otras lesiones que pueden simular una masa cardiacaEntre las lesiones que pueden simular una masa cardiaca se encuentran el derrame pericárdico loculado y pseudotumores de origen vascular como los aneurismas coronarios y del seno de Valsalva.