La miocardiopatía restrictiva es una presentación infrecuente de la amiloidosis y la forma más rara de las miocardiopatías. Hay depósito del amiloide en las paredes del corazón que limita su llenado y contribuye a largo plazo, a la insuficiencia cardiaca. Se presenta un caso, análisis de la fisiopatología, los métodos diagnósticos y su tratamiento.
Restrictive cardiomyopathy is an uncommon presentation of amyloidosis and the rarest form of cadiomyopathies. There is amyloid deposition on the heart walls that limit its filling and is a long-term contributing factor to heart failure. A case where pathophysiology analysis, diagnostic and treatments methods are analyzed is presented.
La amiloidosis es una patología asociada a muchos trastornos de etiología hereditaria e inflamatoria, en la cual los depósitos extracelulares de las proteínas fibrilares son los causantes del daño tisular y del compromiso funcional y hemodinámico1–3.
La amiloidosis tiene una incidencia anual de 6 a 10 casos por millón de habitantes en el Reino Unido y Estados Unidos1. Se cree que la forma sistémica es la diagnosticada con más frecuencia. La amiloidosis debido al depósito de transtiretina (TTR), principalmente en el corazón, es muy común en autopsias de personas ancianas1. Aunque el síndrome clínico asociado conocido como amiloidosis sistémica senil, poco se diagnóstica en la vida, cada vez hay más pruebas que este trastorno es subdiagnosticado1,2.
Presentación del casoPaciente masculino de 90 años de edad, con antecedentes de: hipertensión arterial diagnosticada hace 10 años, insuficiencia cardiaca e hipotiroidismo desde hace 3 años, quien consultó por síntomas de 3 meses de evolución, consistentes en aumento progresivo del perímetro abdominal y edema en miembros inferiores, asociado a disnea de medianos a pequeños esfuerzos.
En el examen físico el paciente presenta: presión arterial de 120/70mmHg, frecuencia cardiaca (FC) 80 lpm, frecuencia respiratoria 24rpm, temperatura 36.5° C, SaO2 96%. Peso 80kg, talla 178cm, IMC 25.5 kg/m2. Consciente, orientado en persona, tiempo y espacio; regular estado músculo nutricional, exoftalmos, tinte ictérico en la piel y las conjuntivas, tolera la posición decúbito supino, ingurgitación yugular moderada a 45°, soplo sistólico grado II/VI mitral, no irradiado; murmullo vesicular normal con estertores crepitantes escasos; abdomen globoso, distendido, hepatomegalia leve con reflejo hepatoyugular positivo y onda ascítica; miembros inferiores con edema grado III, fóvea positiva y dermatitis ocre.
Un ecocardiograma 5 meses antes, había informado: hipertrofia concéntrica severa ventricular izquierda con disfunción diastólica restrictiva e hipoquinesia global moderada con disfunción sistólica moderada y FE 36%, insuficiencia mitral moderada e insuficiencias aórtica y tricúspide de grado leve, hipertensión arterial pulmonar moderada, derrame pericárdico leve (150 ml). Un nuevo ecocardiograma confirmó los datos anteriores, agregando: dilatación biauricular severa, insuficiencia tricúspide severa y enfermedad miocárdica infiltrativa.
El electrocardiograma (EKG) resultó con bajo voltaje generalizado y la radiografía de tórax resultó con AP cardiomegalia grado I.
El Holter cardiaco registró: fibrilación auricular con FC 76 a 130 lpm, sin pausas significativas; 3 episodios de taquicardia ventricular monomorfa no sostenida. QTc normal.
La ecografía abdominal total y el Doppler documentaron: ascitis masiva, nefropatía crónica no obstructiva, quistes renales simples pequeños; además, signos de hipertensión portal.
La ecografía de la glándula tiroides reveló: bocio e ingurgitación de vasos venosos del cuello. Se solicitaron pruebas de TSH 11μU/mL, T3 2.94μU/mL, T4 19.3μU/mL, fosfatasa alcalina 154 UI/L.
Analítica: creatinina sérica 1.5 mg/dL, BUN 34 mg/dL, bilirrubina total 2.63 mg/dL, bilirrubina directa 2.23 mg/dL, bilirrubina indirecta 0.4 mg/dL; proteínas séricas, hemograma e índices globulares, electrolitos séricos, pruebas de coagulación, glucemia y transaminasas normales.
El estudio de líquido ascítico resultó ser trasudado.
La biopsia de grasa periumbilical describió: cortes de piel con ortoqueratosis, epidermis de características usuales y dermis papilar con material fibrilar positivo para amiloide con la coloración de rojo Congo. Dermis media y profunda de aspecto usual. Biopsia compatible con la amiloidosis.
Se optimizó el manejo de la falla cardiaca y al décimo día de estancia hospitalaria, el paciente se encontró estable, con disminución del edema en miembros inferiores y de la ascitis, sintiéndose mucho mejor; fue egresado con control por consulta externa para estudios de inmunohistoquímica y tipificación de la amiloidosis. No obstante, varias semanas después falleció.
DiscusiónRudolph Virchow en el año 1854, adoptó el término “amiloide”, introducido por Schneider en el año 1838 para describir una sustancia semejante a la celulosa cuando se expone al yodo4–6. Hoy sabemos que el almidón no está relacionado con esta patología7.
La amiloidosis es un trastorno infrecuente caracterizado por el mal plegamiento de las proteínas que tienden a depositarse como fibrillas en el espacio extracelular; dichos depósitos pueden presentarse en un órgano, o en forma sistémica, siendo más frecuentes en el riñón (∼80%), el corazón, el tracto gastrointestinal, la lengua, la piel, el sistema nervioso y el músculo-esquelético7–9. Más de 24 proteínas anormales han sido documentadas en humanos. Esta patología se caracteriza por un fallo en el sistema ubiquitina-proteosoma y/o en el mecanismo de degradación por macrófago. La clasificación de la amiloidosis se basa en el precursor de fibrillas de amiloide implicado, siendo las más comunes la AL (cadena ligera de inmunoglobulina) y la transtiretina (TTR)8 normal o mutante (proteína intermediaria en el transporte de las hormonas tiroideas y retinol).
La amiloidosis cardiaca, es una entidad poco conocida y la miocardiopatía restrictiva es la forma menos frecuente de las miocardiopatías y la única sin criterios diagnósticos específicos según la WHO/ISFC Task Force4. Es necesario aclarar su origen debido a las múltiples causas e implicaciones en su manejo y pronóstico, porque esta no solo es una miocardiopatía infiltrativa, sino un fenómeno sistémico inflamatorio infiltrante con efecto tóxico para los órganos, incluyendo al corazón4,7. La amiloidosis secundaria (AA) por el amiloide A sérico afecta el corazón en el 5%, la amiloidosis primaria (AL) lo hace en el 50% y la amiloidosis senil TTR en el 100%. Otros subtipos como los hereditarios TTR, Apo-A1 y fibrinógeno A comprometen al corazón en forma variable según la mutación de la proteína, y en estos pacientes el trasplante cardiaco podría ser una opción. Así, cada una tiene un curso, pronóstico y tratamiento diferentes.
La fisiopatología se caracteriza por la infiltración progresiva del amiloide extracelular en todo el corazón, en forma de nódulos con ramificaciones que van envolviendo y separando los miocitos, produciendo el engrosamiento de las paredes de ambos ventrículos4 sin generar dilatación de los mismos, pero alterando de manera gradual y consistente los mecanismos de la función diastólica, iniciando por la relajación (disfunción diastólica (DD) tipo I). A medida que avanza la infiltración, se compromete la distensibilidad (DD tipo II) y después se dificulta más el llenado ventricular elevándose la presión de fin de diástole (DD tipo III-IV o patrón restrictivo), con la consiguiente elevación retrógrada de las presiones de los circuitos, que produce la dilatación biauricular7, el aumento de la presión arterial pulmonar y la congestión del retorno venoso sistémico. La acumulación de proteínas anormales ejerce también un efecto tóxico directo sobre los cardiomiocitos estimulando la respuesta de estrés del retículo endoplásmico (RE), con transducción de señales agresoras mediante 3 vías: PERK (protein kinase R like endoplasmic reticulum kinase), IRE1 (inositol-requiring kinase 1)10 y ATF6 (activating transcription factor 6), los cuales son receptores transmembrana residentes en el RE, induciendo autofosforilación y apoptosis por activación de caspasas y proteínas homólogas C/BEP (CHOP)10. Además, el amiloide al infiltrar la microvasculatura ocasiona la isquemia miocárdica difusa y los múltiples microinfartos con necrosis de los miocitos, el desarrollo de la fibrosis y la disfunción sistólica en las fases avanzadas, explicando el aumento de troponinas y NT-proBNP. La isquemia difusa microvascular puede ser la causa del daño al nodo sinusal y al sistema de conducción eléctrica His-Purkinje. Las coronarias epicárdicas en cambio, no sufren infiltración ni lesiones significativas.
Las manifestaciones clínicas son inespecíficas y las cardiacas son las primeras en aparecer, pero al principio suelen ser inexplicables. Los médicos clínicos debemos estar alertas, en especial en pacientes con la falla cardiaca derecha y la disfunción diastólica con función sistólica preservada, en los pacientes con el mieloma múltiple (MM) o enfermedades crónicas. Se debe realizar evaluación tanto cardiaca como extra cardiaca7. Si la sospecha persiste, hacer biopsia de grasa periumbilical, mucosa rectal, glándula salival, corazón o riñón. Si la biopsia es positiva para la amiloidosis, proceder a la inmunohistoquímica para identificar el tipo de proteínas implicadas7. Cuando comienzan los síntomas de falla cardiaca, esta progresa en forma rápida tornándose sombrío el pronóstico a corto plazo, si no se inicia en forma precoz el tratamiento específico para el subtipo, puesto que el tratamiento convencional solo para la falla cardiaca es poco efectivo.
La disnea progresiva, el edema periférico, la ortopnea, la pérdida de peso, el malestar torácico, el derrame pleural bilateral7, la ascitis, las arritmias por fibrilación auricular y las extrasístoles ventriculares, los síncopes recurrentes por disfunción autonómica y las arritmias, y el desenlace fatal con muerte súbita por disociación electromecánica, es lo habitual.
Los estudios diagnósticos disponibles para determinar el compromiso cardiaco son: el EKG, el ecocardiograma, la biopsia endomiocárdica (gold standard), la gammagrafía cardiaca y la cardiorresonancia.
En el EKG, el hallazgo más frecuente es el bajo voltaje generalizado (46%)2, en su mayoría asociado a la desviación del eje eléctrico, la imagen de infarto (seudoinfarto) en el 47%, puede haber criterios para la hipertrofia ventricular izquierda (16%), los bloqueos de rama del haz de His en el 14,5%, siendo más usual el de rama derecha7 en el 9%, muy raras veces se describen bloqueos A-V de segundo y tercer grado (3%) y de primer grado en el 21% de los pacientes. Fibrilación o flutter auricular en el 10 a 15% de los casos.
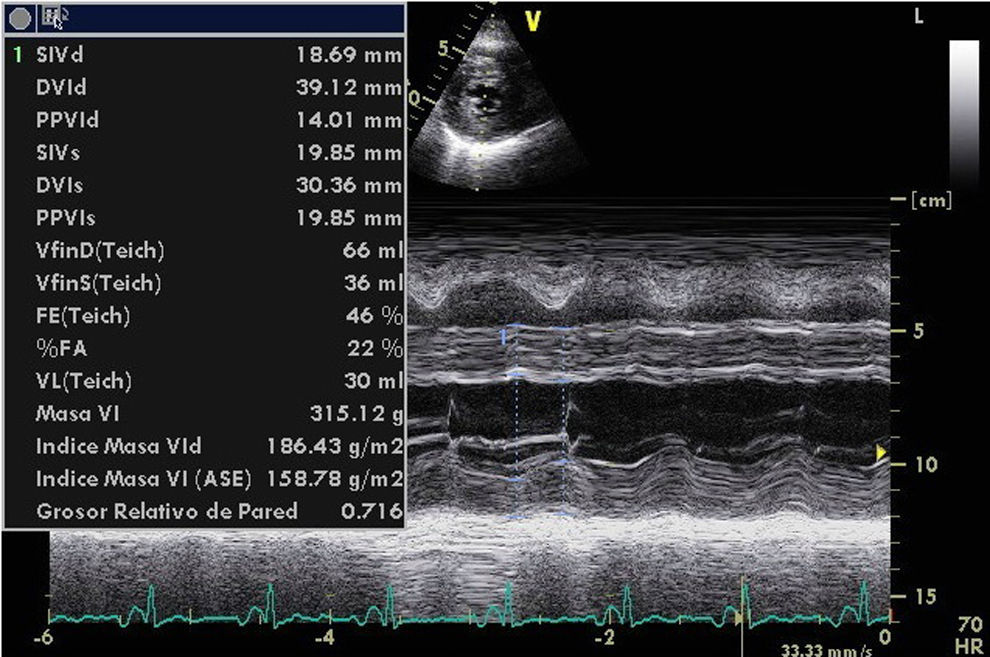
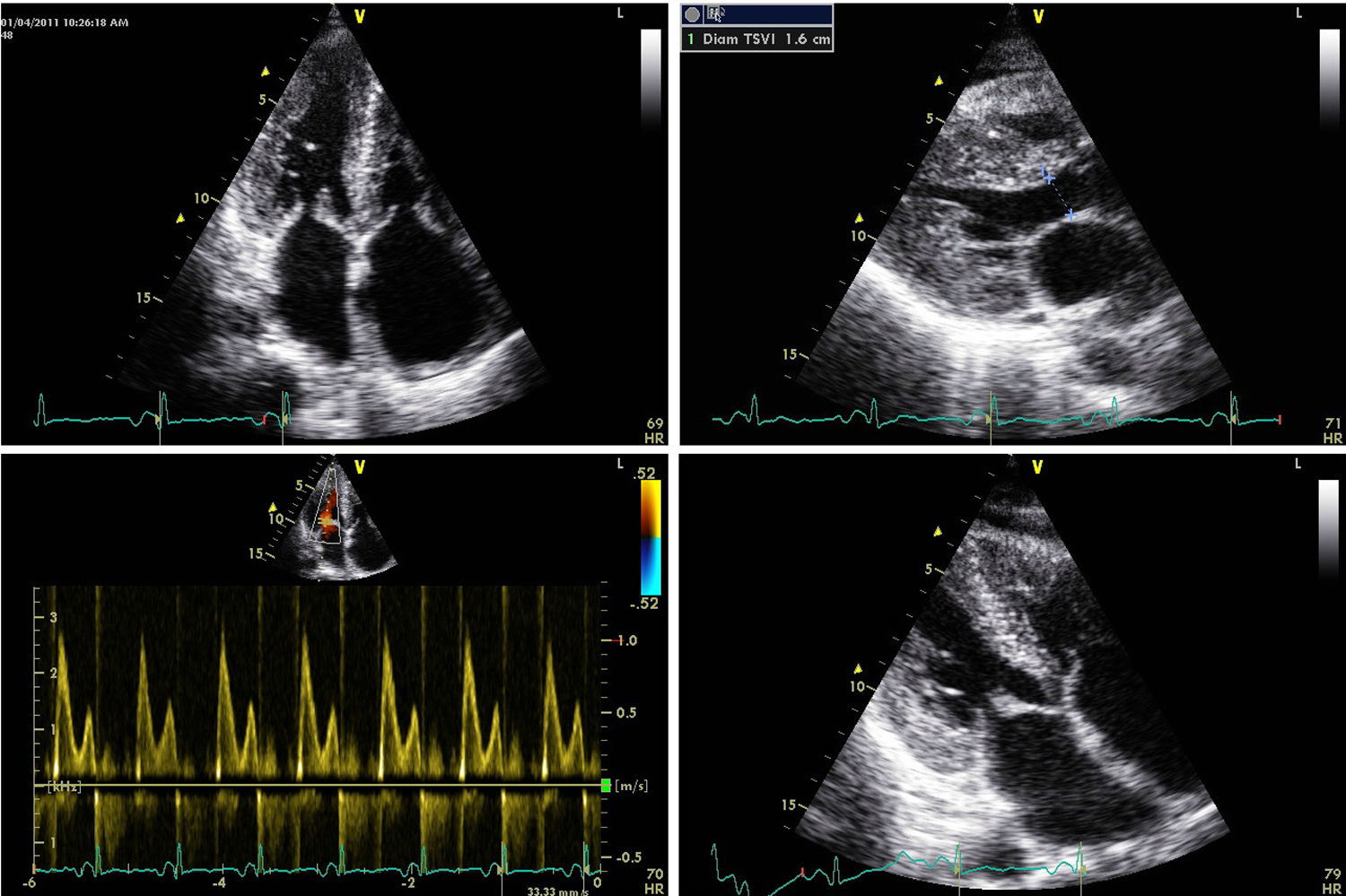
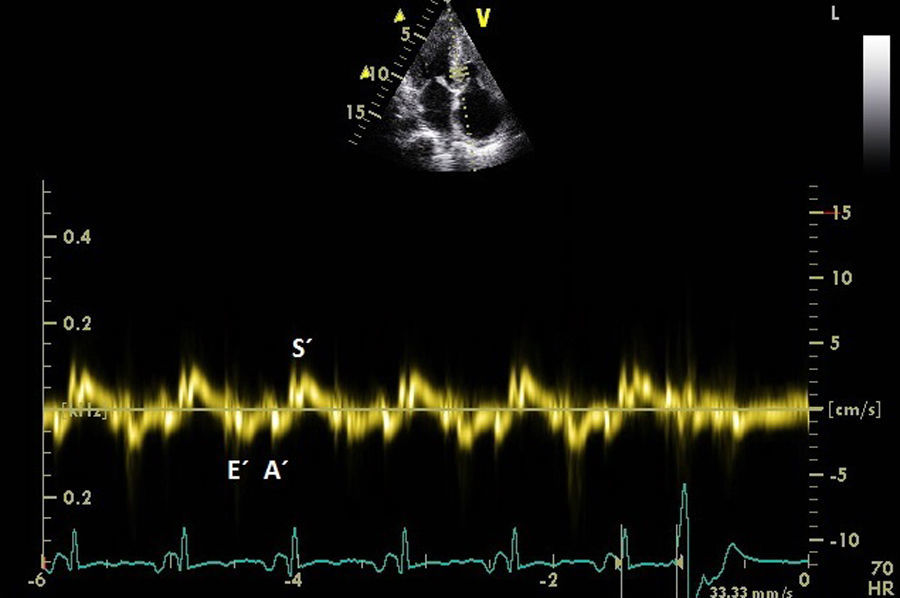
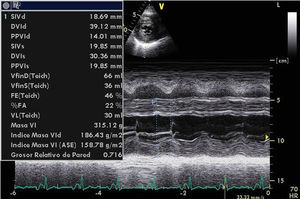
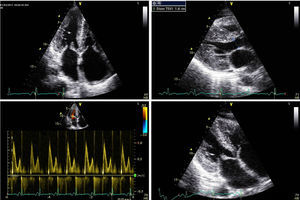
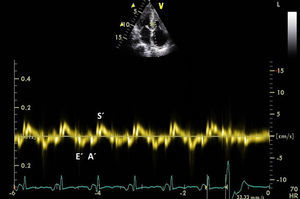
El ecocardiograma mostrará alteraciones según la magnitud de la infiltración amiloide y de la respuesta inflamatoria. Las imágenes de nuestro archivo (Figs. 1, 2 y 3), corresponden a una mujer de 62 años de edad, con extrasístoles ventriculares y disnea de esfuerzos. Son evidentes el engrosamiento de las paredes ventriculares con textura “granular” y cavidades pequeñas, prominencias valvulares, dilatación de ambas aurículas, engrosamiento del septum interauricular y derrame pericárdico leve; el Doppler PW registró patrón de llenado restrictivo de ambos ventrículos3. Otros datos fueron: la disfunción sistólica leve con FE 48%, insuficiencia mitral leve e hipertensión arterial pulmonar leve. El Doppler tisular (Fig. 3) y el strain rate pueden ser muy útiles al documentar la disminución de las velocidades de relajación y de contracción longitudinal desde etapas tempranas, incluso antes de producirse la hipertrofia ventricular. A esta paciente se le confirmaron los diagnósticos de miocardiopatía restrictiva por la amiloidosis AL y MM, con excelente respuesta a la quimioterapia y sobrevida actual de 56 meses, confirmada mediante contacto telefónico.
Ecocardiograma modo M de paciente con miocardiopatía restrictiva por amiloidosis AL asociada a mieloma múltiple. Las paredes de ambos ventrículos están engrosadas en grado severo con aumento de la ecorrefringencia en especial de la pared libre del ventrículo derecho. Foto de archivo. Navarro-Ulloa, OD. Instituto de Cardiología del Caribe, Cartagena, 2011.
Ecocardiograma de paciente femenino de 62 años de edad a quien se le diagnosticó miocardiopatía restrictiva por amiloidosis AL asociada a mieloma múltiple. Observe el engrosamiento de las paredes ventriculares con textura granular incluso en el ventrículo derecho, la disminución de la cavidad ventricular izquierda, las prominencias valvulares mitral y tricúspide, el engrosamiento del septum interauricular, el patrón restrictivo por Doppler y la dilatación biauricular. Además, derrame pericárdico leve. La paciente recibió quimioterapia con éxito. Foto archivo. Navarro-Ulloa, OD. Instituto de Cardiología del Caribe. 2011.
La gammagrafía cardiaca con 99mTc-ácido 3,3-difosfono-1,2-propanodicarboxílico (99mTc-DPD), ha comprobado su capacidad para diferenciar entre la amiloidosis cardiaca TTR de la forma amiloidosis AL y de otras miocardiopatías hipertróficas. Las amiloidosis TTR captan 99mTc-DPD y registran un depósito intenso biventricular de este radio trazador2,3, mientras que las amiloidosis AL no suelen captarlo.
En la cardiorresonancia con la técnica de realce tardío, el gadolinio es captado en forma muy rápida por el amiloide y acorta la fase T1 realzando el subendocardio en forma circunferencial biventricular; en casos más avanzados el realce puede ser transmural. En algunas ocasiones se describen realces parcheados o moteados y existen algunos subtipos donde el amiloide no capta el gadolinio. Este estudio permite caracterizar la morfología, el tejido y la función de maneras muy precisas
El tratamiento debe contemplar tanto la insuficiencia cardiaca como la amiloidosis. Para la primera se prefieren los diuréticos, pero pueden necesitarse dosis más altas de lo previsto, cuando hay hipoalbuminemia por síndrome nefrótico asociado7. Respecto al tratamiento de la amiloidosis, desde el estudio de Kyle en el año 1985, se propuso como tratamiento la asociación melfalan-prednisona7, ahora con nivel de evidencia IB y la recomendación A. Para la amiloidosis AL son útiles los tratamientos que son eficaces para MM, debido a que ambas provienen de células plasmáticas anormales de la médula ósea. Estos son melfalan-dexametasona (alquilante y corticoide) (IIa-B), vincristina-adriamicina-dexametasona (IIb-B), dosis altas de melfalan-trasplante autólogo de células madre (IIa-B), talidomida-dexametasona (IIa-B), ciclofosfamida-talidomida-prednisolona, lenalidomida y polalidomida (inmunomoduladores análogos de talidomida), bortezomib (inhibidor proteosómico) y pulsos de corticoides, lográndose ahora supervivencias que superan 45 a 60 meses.
Un estudio en la fase III con ixazomib o MLN9708 (inhibidor oral experimental del proteosoma)+dexametasona, podría determinar su eficacia en el tratamiento de amiloidosis AL.
ConclusionesLa miocardiopatía restrictiva por la amiloidosis es una enfermedad inflamatoria infiltrativa que con frecuencia no es sospechada, a pesar de los síntomas iniciales. El ecocardiograma nos permite identificar el clásico patrón infiltrativo restrictivo y algunas otras alteraciones, para avanzar hacia otros estudios que nos permitan comprobar el diagnóstico y precisar el subtipo, como la biopsia endomiocárdica y el estudio inmunohistoquímico, para decidir el tratamiento específico e iniciarlo en forma oportuna, por ser el compromiso cardiaco la causa principal de muerte de los pacientes con amiloidosis.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesNinguno.