Identificar drogas de abuso, sustancias químicas o venenos de origen animal asociados a cardiopatía de takotsubo.
MétodoRevisión estructurada en Pubmed/Medline, para la que se utilizaron los términos: Takotsubo cardiomyopathy, Tako-tsubo cardiomyopathy, stress cardiomyopathy, transient-left-ventricular ballooning syndrome, ampulla cardiomyopathy, apical ballooning syndrome, OR broken heart syndrome; together with “drugs abuse”, “chemistry substance.” “iatrogenic”, “drug-induced” OR “induced by”. Se seleccionaron artículos publicados entre el 01/01/1990 y 31/10/2015, en inglés, francés o español, con acceso a texto completo. Se incluyeron los artículos con reportes de drogas de abuso, sustancias químicas o venenos de origen animal, como posibles desencadenantes de la miocardiopatía. Adicionalmente, se incluyeron las referencias de los artículos seleccionados, valoradas como relevantes.
ResultadoSe recuperaron 852 artículos diferentes y se seleccionaron 23, más 4 referencias relevantes, en las cuales se identificaron 38 casos de miocardiopatía de takotsubo, posiblemente asociados al uso o exposición a drogas de abuso, sustancias químicas o venenos de animales, especialmente, monóxido de carbono (n=13; 34,2%), cocaína o crack (n=5, 13,2%), abstinencia al alcohol (n=5; 13,2%), venenos de origen animal (n=5; 13,2%) y anfetaminas (n=4; 10,5%). En total se identificaron 14 sustancias diferentes como posibles desencadenantes de la miocardiopatía en mención.
ConclusiónLa miocardiopatía de takotsubo podría ser desencadenada por el uso o la exposición a 14 drogas de abuso, sustancias químicas o venenos de origen animal, las cuales, en la mayoría de los casos, generan sobreestimulación simpática. Por ello se recomienda considerar este tipo de situación en pacientes que presenten este tipo de miocardiopatía, especialmente en quienes no se identifique un desencadenante físico o emocional.
To identify drugs of abuse, chemical substances or animal poisons associated to takotsubo cardiomyopathy.
MethodsStructured review of Pubmed/Medline, where the following search terms were used: Takotsubo cardiomyopathy, Tako-tsubo cardiomyopathy, stress cardiomyopathy, transient-left-ventricular ballooning syndrome, ampulla cardiomyopathy, apical ballooning syndrome, OR broken heart syndrome; together with “drugs abuse”, “chemistry substance.” “iatrogenic”, “drug-induced” OR “induced by”. Articles in English, French or Spanish published between January 1st 1990 and October 31st 2015 and with access to the full text were selected. Articles reporting drugs of abuse, chemical substances or animal poisons as possible triggers of this cardiomyopathy were included. Additionally, references of those selected articles were included, valued as relevant.
Results852 different articles were found, 23 were selected as well as 4 relevant references, where 38 takotsubo cardiomyopathy were identified, possibly associated to the use or exposure to drugs of abuse, chemical substances or animal poisons, especially carbon monoxide (n=13; 34.2%), cocaine or crack (n=5, 13.2%), alcohol withdrawal (n=5; 13.2%), animal poison (n=5; 13.2%) and amphetamines (n=4; 10.5%). Overall 14 different substances were identified as possible triggers of this cardiomyopathy.
ConclusionTakotsubo cardiomyopathy could be triggered by the use or exposure to 14 drugs of abuse, chemical substances or animal poisons, which in most cases generate a sympathetic overstimulation. Thus it is recommended to consider this type of situation in patients presenting this kind of cardiomyopathy, especially in those where a physical or emotional trigger cannot be identified.
El corazón puede sufrir alteraciones asociadas a la utilización de fármacos y otras sustancias, entre ellas, la miocardiopatía por estrés o miocardiopatía de takotsubo. La denominación de miocardiopatía por estrés se debe a que, usualmente, el desencadenante es un suceso o una sustancia que, por diferentes vías, genera estrés físico y/o psicológico. Por su parte, la denominación de miocardiopatía de takotsubo, se refiere a que, en su etapa aguda, el ventrículo izquierdo adopta una forma similar al instrumento usado por los japoneses para atrapar pulpos, conocido como takotsubo1
En general, este tipo de cardiopatía se caracteriza por: morfología del ventrículo izquierdo, tiempo de curso transitorio, con recuperación completa en días a semanas, cambios en el electrocardiograma, aumento de los biomarcadores cardiacos y ausencia de estenosis, miocarditis e hipertrofia del miocardio, al igual que de otras condiciones patológicas que pueden explicar la disfunción regional2, como enfermedad cerebrovascular o feocromocitoma. Sin embargo, debido a que la miocardiopatía de takotsubo se presenta principalmente en pacientes de edad avanzada y con otros factores de riesgo, en algunos casos, puede coexistir con enfermedad coronaria3.
La importancia de identificar de forma acertada esta miocardiopatía se debe a que, en la mayoría de los casos, la recuperación se da por completo sin necesidad de tratamiento farmacológico1, pero en otros casos, puede requerirse la utilización de diuréticos, betabloqueadores, inhibidores de la enzima convertidora de angiotensina, bloqueadores de los receptores de la angiotensina-II, estatinas y ácido acetil salicílico4. Por su parte, el soporte inotrópico puede agravar la condición del paciente, causando hipotensión marcada, aumento de la probabilidad de utilizar mayor dosis de catecolaminas y, con ello, mayor intensidad de la miocardiopatía. Esta situación se explica por la asociación existente entre el aumento en los niveles de estas sustancias con dicha cardiopatía5. En este sentido, la miocardiopatía de takotsubo es más frecuente en mujeres posmenopáusicas, en quienes los niveles normales de catecolaminas se ven notoriamente aumentados por situaciones de estrés emocional6.
Algunas revisiones estructuradas han mostrado que la utilización de medicamentos con la capacidad de generar, de forma directa o indirecta, un aumento en los niveles de catecolaminas, podrían desencadenar CTT7. En este sentido, desde el punto de vista farmacológico, es posible que el uso o exposición a ciertas drogas de abuso, sustancias químicas y venenos de origen animal que causen aumento en los niveles de catecolaminas, también puedan desencadenar miocardiopatía de takotsubo; sin embargo, no se dispone de una revisión estructurada orientada a identificar casos de miocardiopatía de takotsubo asociados a dichos productos. Por ello, el objetivo de este trabajo fue identificar drogas de abuso, sustancias químicas o venenos de origen animal asociados a la cardiopatía de takotsubo.
Materiales y métodosSe hizo una revisión estructurada en la base de datos Medline/PubMed, usando los términos: stress cardiomyopathy AND induced by; takotsubo cardiomyopathy AND induced by; tako-tsubo cardiomyopathy AND induced by; Apical ballooning syndrome AND induced by; transient-left-ventricular ballooning syndrome AND induced by; Broken heart syndrome AND induced by; ampulla cardiomyopathy AND induced by; stress cardiomyopathy AND iatrogenic; Stress cardiomyopathy AND drug-induced; takotsubo cardiomyopathy AND iatrogenic; tako-tsubo cardiomyopathy AND iatrogenic; Broken heart syndrome AND iatrogenic; takotsubo cardiomyopathy AND drug-induced; takotsubo cardiomyopathy AND drugs abuse; stress cardiomyopathy AND drugs abuse; stress cardiomyopathy AND chemistry substance. Los artículos publicados entre el 01/01/1990 y el 31/10/2015, en inglés, francés o español, con acceso a texto completo. En la revisión se incluyeron los artículos con reportes de drogas de abuso y sustancias químicas o venenos de origen animal (mordeduras o picaduras) como posibles desencadenantes de miocardiopatía de takotsubo. Adicionalmente, se incluyeron las referencias de los artículos seleccionados, valoradas como relevantes. Por su parte, se excluyeron los artículos sin una descripción clara de una sustancia como desencadenante de miocardiopatía de takotsubo y las cartas con comentarios de casos ya identificados. De cada caso se recopiló la edad, género del paciente y la sustancia desencadenante o asociada a la miocardiopatía de takotsubo.
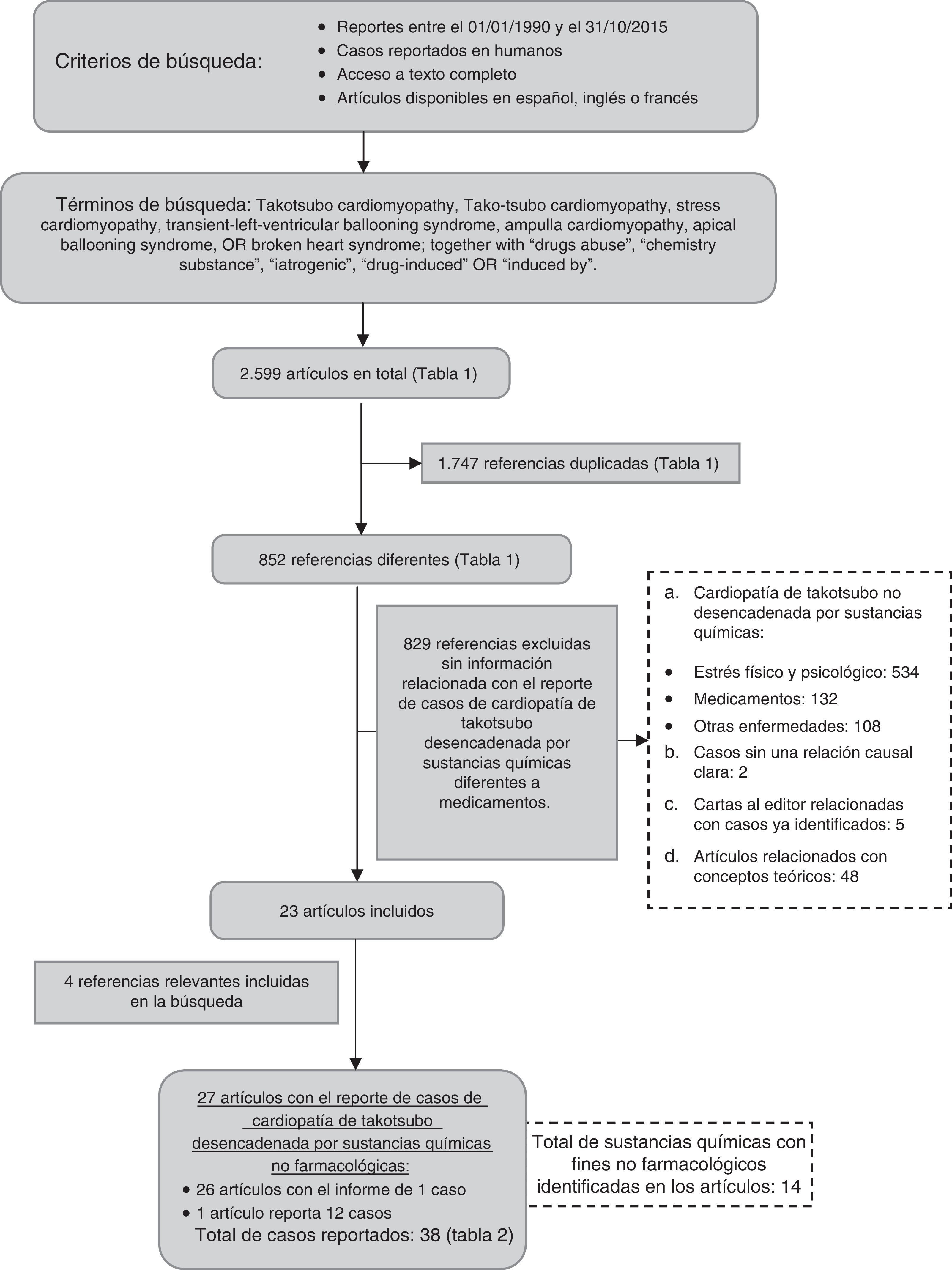
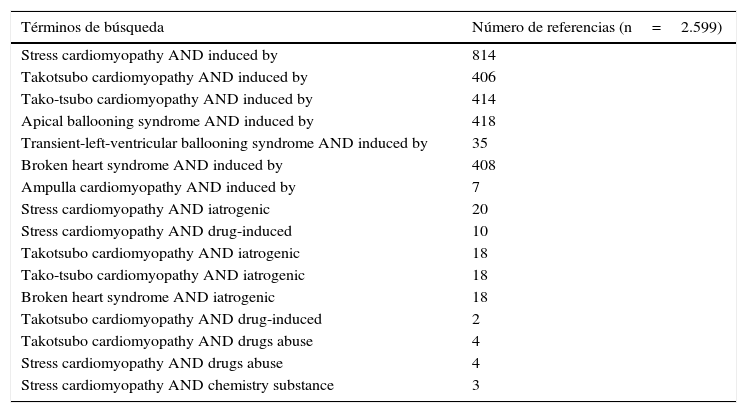
ResultadosEn la búsqueda en la base de datos Medline/PubMed se identificaron en total 2.599 artículos, de los cuales 1.747 referencias se repiten (tabla 1). De las 852 referencias diferentes, se excluyeron 829; 2 por no presentar una relación de causalidad clara entre la sustancia y el desarrollo de miocardiopatía de takotsubo (uso de suplemento dietario8, y picadura de avispa9) y 5 cartas al editor con comentarios de casos ya reportados10–14. Adicionalmente, se excluyeron 48 artículos con conceptos teóricos relacionados con la miocardiopatía de takotsubo (fig. 1). Por tanto, para este trabajo se seleccionaron y revisaron 23 referencias con reportes de casos. Adicionalmente, de las referencias de los artículos incluidos se identificaron 4 relevantes para la revisión, para un total de 27 referencias incluidas. De este grupo, un artículo reporta 12 casos15 y 26 artículos reportan un caso16–41 (fig. 1).
Número de referencias recuperadas por la combinación de términos de búsqueda
| Términos de búsqueda | Número de referencias (n=2.599) |
|---|---|
| Stress cardiomyopathy AND induced by | 814 |
| Takotsubo cardiomyopathy AND induced by | 406 |
| Tako-tsubo cardiomyopathy AND induced by | 414 |
| Apical ballooning syndrome AND induced by | 418 |
| Transient-left-ventricular ballooning syndrome AND induced by | 35 |
| Broken heart syndrome AND induced by | 408 |
| Ampulla cardiomyopathy AND induced by | 7 |
| Stress cardiomyopathy AND iatrogenic | 20 |
| Stress cardiomyopathy AND drug-induced | 10 |
| Takotsubo cardiomyopathy AND iatrogenic | 18 |
| Tako-tsubo cardiomyopathy AND iatrogenic | 18 |
| Broken heart syndrome AND iatrogenic | 18 |
| Takotsubo cardiomyopathy AND drug-induced | 2 |
| Takotsubo cardiomyopathy AND drugs abuse | 4 |
| Stress cardiomyopathy AND drugs abuse | 4 |
| Stress cardiomyopathy AND chemistry substance | 3 |
En los 27 artículos incluidos, se identificaron 38 casos de miocardiopatía de takotsubo en pacientes con una edad media de 43 años (rango de 4 a 83 años), y 24 (63,2%) de ellos en mujeres (tabla 2). En los 38 casos se identificaron 14 tipos de sustancias diferentes que, por su uso o por retiro repentino, se asociaron con la aparición de miocardiopatía de takotsubo (tabla 2):
- •
Intoxicación por monóxido de carbono (n=13 casos, 34,2%)15,16.
- •
Consumo de cocaína o crack (n=5 casos, 13,2%)17–21.
- •
Abstinencia al alcohol (n=5 casos, 13,2%)22–26.
- •
Venenos de origen animal (n=5 casos, 13,2%): picadura de medusa (n=2)27,28, picadura de araña “viuda negra” (n=1)29, mordedura de serpiente (n=1)30 y picadura de escorpión (n=1)31.
- •
Consumo de anfetaminas (n=4 casos, 10,5%)32–35.
- •
Consumo de sustancias naturales (n=2 casos, 5,2%): hongo Psilocybe semilanceata (n=1)36 y marihuana (n=1)37.
- •
Abstinencia a la heroína (n=1; 2,6%)38.
- •
Veneno sintético compuesto por carbamatos/piretroides (n=1; 2,6%)39.
- •
Intoxicación con cloroquina (n=1; 2,6%)40 y
- •
Consumo de bebida energizante (n=1; 2,6%)41.
Reporte de 38 casos de cardiopatía de takotsubo asociados a la utilización o exposición de drogas de abuso, sustancias químicas o venenos de origen animal
| Ref. | Título | Sexo | Edad | Sustancia | Información adicional |
|---|---|---|---|---|---|
| 15 | Monóxido de carbono induce miocardiopatía | F | 18 | Monóxido de carbono | Estudio retrospectivo que concluye que 12 personas presentaron miocardiopatía de takotsubo asociada a intoxicación con monóxido de carbono |
| F | 26 | ||||
| F | 37 | ||||
| F | 33 | ||||
| F | 75 | ||||
| F | 36 | ||||
| M | 42 | ||||
| M | 22 | ||||
| F | 83 | ||||
| M | 69 | ||||
| F | 43 | ||||
| M | 79 | ||||
| 16 | Miocardiopatía transitoria secundaria a intoxicación con monóxido de carbono | M | 4 | Monóxido de carbono | Cardiopatía asociada a convulsiones tónico-clónicas de corta duración y de resolución espontánea |
| 17 | “Balonamiento” apical transitorio del ventrículo izquierdo después del consumo excesivo de cocaína | F | 56 | Cocaína | Presentes opresión en el pecho y falta de aliento, horas después de consumir cocaína |
| 18 | Miocardiopatía de takotsubo presentada como infarto de miocardio sin elevación del segmento ST y exacerbación del asma debido al consumo de cocaína | M | 53 | Cocaína | Exacerbación grave de asma. Tiene un consumo pesado de cocaína |
| 19 | Discinesia apical transitoria después del consumo de cocaína: relación entre la cardiotoxicidad por catecolaminas y la patología | F | 54 | Cocaína (“crack”) | Dolor en el pecho. Ha aumentado la ingesta de “crack” en los últimos meses. El último consumo ocurrió 2 a 3 horas previas a los síntomas |
| 20 | *Miocardiopatía de takotsubo posiblemente por cocaína | F | 58 | Cocaína (“crack”) | Dolor severo del lado izquierdo del pecho. Es consumidora regular de “crack”. La última ingesta fue a menos de 24 horas de los síntomas |
| 21 | Miocardiopatía reversible asociada a consumo por cocaína | F | 34 | Cocaína (“crack”) | El paciente fumó “crack” durante todo un día, previo a los síntomas. Aunque en 1989 aún no se conocía la cardiopatía de takotsubo, la descripción y clínica del caso fue muy compatible con este tipo de alteración |
| 22 | MIocardiopatía takotsubo desencadenada por abstinencia de alcohol | M | 56 | Abstinencia de alcohol | Confusión, astenia severa, anorexia y temblor de las manos. 5 días antes dejó de consumir alcohol |
| 23 | Miocardiopatía de takotsubo relacionada con la abstinencia de alcohol | F | 41 | Abstinencia de alcohol | Dolor epigástrico, náusea y vómito 24-48 horas después de interrumpir el consumo de alcohol |
| 24 | Abstinencia de alcohol induce miocardiopatía de takotsubo | F | 57 | Abstinencia de alcohol | Agitación, bradipnea e hipoxia. Por motivo de intervención quirúrgica suspende el consumo de alcohol |
| 25 | Un caso atípico de “miocardiopatía takotsubo” durante la abstinencia de alcohol: anomalía transitoria en el movimiento de la pared ventricular izquierda y elevación notable en el segmento ST | M | 64 | Abstinencia de alcohol | Cinco días después de suspender el consumo de alcohol experimenta paro cardiorrespiratorio |
| 26 | Dos casos de síndrome de discinesia apical oculta en una miocardiopatía hipertrófica apical | F | 46 | Abstinencia de alcohol | Confusión, agitación y falta de aire. 3 días antes había suspendido el consumo de alcohol |
| 27 | Picadura de medusa mediterránea induce miocardiopatía takotsubo | F | 53 | Medusa-malva rosa mediterránea (Pelagia noctiluca) | Intensa sensación de picazón y posterior pérdida el conocimiento |
| 28 | Síndrome Irukandji, catecolaminas y miocardiopatía por estrés medio ventricular | M | 26 | Medusa (Carukia barnesi) | Dolor, agitación y palpitaciones 2 horas después de ser picado por una medusa Carukia barnesi |
| 29 | Miocardiopatía transitoria inversa (takotsubo) después de la picadura de araña en Grecia | F | 64 | Picadura de araña viuda negra (Latrodectus tredecimguttatus) | Una hora y media después de la picadura de araña, el pacientes experimentó náusea, temblor generalizado, sudoración y calambres en las extremidades inferiores |
| 30 | Miocardiopatía takotsubo en una víctima de picadura de serpiente: reporte de caso | F | 56 | Mordedura de serpiente | Anomalías en el electrocardiograma cuatro días después de la mordedura de serpiente |
| 31 | Primera descripción de un caso de envenenamiento grave por picadura de escorpión: posible miocardiopatía de takotsubo | M | 7 | Veneno de escorpión (Tityus serrulatus) | Dos horas después de la picadura del escorpión Tityus serrulatus, la pacientes presentó vómito, sudoración profusa y dificultad respiratoria |
| 32 | Shock cardiogénico después del uso de fluoro anfetamina confirmado por su presencia en sangre y orina | M | 18 | 4-Fluoroanfetamina (4-FA) | Vómitos, dificultad para respirar, opresión en el pecho, y estado mental alterado. Un examen de orina y sangre demostró la presencia de la anfetamina |
| 33 | *Miocardiopatía basal por estrés inducida por catecolaminas exógenas en adultos jóvenes | F | 36 | Metanfetamina oral | Disnea. Dos horas antes ingirió 0,2g de metanfetamina oral |
| 34 | Metanfetamina asociada a disfunción aguda del ventrículo izquierdo (variación de miocardiopatía inducida por estrés) | F | 42 | Metanfetamina | Considerado como el primer caso reportado de cardiopatía de takotsubo asociado al abuso de metanfetamina |
| 35 | Síndrome del “balonamiento” apical invertido del ventrículo izquierdo (miocardiopatía takotsubo) en una mujer joven en el ajuste del uso de anfetamina | F | 25 | Anfetaminas | La paciente manifiesta “falta de aliento” horas después de inhalar anfetaminas |
| 36 | Alteraciones de la contractilidad regional apical que evoca a la miocardiopatía takotsubo seguido del consumo de hongos psicoactivos | M | 17 | Hongo Psilocybe semilanceata | Dolor en el pecho y disnea luego de la ingesta del hongo Psilocybe semilanceata |
| 37 | Mioardiopatía ventricular como una variante de takotsubo asociada con el síndrome de hiperémesis cannabinoide: reporte de un caso | F | 32 | Marihuana | Después de un período de abstinencia experimenta dolor epigástrico, náusea y vómito al consumir marihuana |
| 38 | Caso de abstinencia de heroína que termina en miocardiopatía takotsubo | M | 40 | Abstinencia a la heroína | Náuseas, vómitos, nerviosismo y palpitaciones. Está en proceso de desintoxicación de heroína |
| 39 | Miocardiopatía takotsubo relacionada con intoxicación por carbamato y piretroide | F | 80 | Veneno químico (insecticida) | En un intento de suicidio ingiere un pesticida que contiene 12% de metomilo, 1,5% de alfa-cipermetrina y 86,5% de otros disolventes |
| 40 | Cardiomiopatía reversible takotsubo asociada a la intoxicación por cloroquina | F | 35 | Cloroquina | La paciente ingirió 7 gramos de cloroquina y murió |
| 41 | Miocardiopatía takotsubo reversible asociada con el consumo de una bebida energética | M | 24 | Bebida energética | Palpitaciones y dolor en el pecho que se experimentan poco tiempo después de ingerir una bebida energética. |
En esta revisión se identificaron 38 casos de miocardiopatía de takotsubo asociados al uso o exposición a 15 drogas de abuso, sustancias químicas o venenos de origen animal, en los cuales se descartó como desencadenante el estado de estrés emocional. En la mayoría se estableció una relación entre la miocardiopatía de takotsubo y los efectos de dichas sustancias, la respuesta física (en casos de abstinencia) y los niveles de catecolaminas presentes en la circulación, hecho que refuerza la hipótesis sobre el efecto del aumento, directo o indirecto, de los niveles de catecolaminas7.
El uso de sustancias psicoactivas ha hecho parte de la historia del hombre, quien las ha asociado a diversas prácticas, desde religiosas y curativas hasta de defensa y supervivencia. Sin embargo, el uso y abuso de dichos productos es un problema de salud pública principalmente para la población adulta-joven, en quienes su consumo es mayor. En este contexto, es importante destacar, además de las consecuencias sociales, los efectos cardiacos de algunas de estas sustancias, asociadas a la generación de estados hiperadrenérgicos42.
En general, la información generada con diversos casos de miocardiopatía de takotsubo ha permitido establecer el papel fisiopatológico relevante del aumento de los niveles catecolaminas presentes en la circulación. Así, el incremento de estas sustancias puede causar daño directo al miocardio por la activación de los receptores beta-1 y beta-2, mediada por la estimulación de la proteína G (Gs), fenómeno que puede generar estrés oxidativo cardiotóxico a través del adenosín monofosfato cíclico (cAMP) dependiente de la proteína quinasa A (PKA), sobrecarga de calcio y, finalmente, muerte celular. Esta alteración inotrópica se evidencia más en el miocardio apical, debido a que en esta zona hay mayor densidad de receptores beta43.
En este trabajo, similar a lo que se estableció en revisiones estructuradas de casos de miocardiopatía de takotsubo por medicamentos7, en la mayoría de los 38 casos, el uso o exposición a drogas de abuso, sustancias químicas o venenos de origen animal y la presentación de miocardiopatía de takotsubo, podría explicarse por un aumento en los niveles de catecolaminas, tal como se comenta a continuación:
- •
Cardiopatía de takotsubo por monóxido de carbono (CO) (13/38 casos, equivalente al 34,2%)15,16: aunque, el mecanismo principal de toxicidad por CO se atribuye a la hipoxia isquémica secundaria a la hipoxemia, se han identificado otras posibles explicaciones, entre ellas: a) Aumento en la producción neuronal en el sistema nervioso simpático y, con ello, incremento en los niveles de las catecolaminas epinefrina y norepinefrina; b) Estimulación de la actividad del sistema nervioso simpático y, con ello, aumento del gasto cardiaco y de la presión arterial; c) Producción de radicales libres en la lesión por isquemia-reperfusión; y d) Aturdimiento miocárdico, posiblemente por el aumento de catecolaminas15,16.
- •
Cardiopatía de takotsubo por cocaína (5/38 casos equivalente al 13,2%)17–21: la cocaína bloquea la recaptación presináptica de dopamina y norepinefrina, aumentando la concentración de estas aminas en la hendidura sináptica. En general, los efectos psico-estimulantes de la cocaína se atribuyen a un aumento en la neurotransmisión de dopamina; mientras que los efectos cardiovasculares se deben a un mayor estado simpaticomimético. La cocaína tiene acción directa o indirecta sobre el corazón y los vasos sanguíneos, mediada por estimulación de receptores alfa y beta. La estimulación de los receptores alfa-1 adrenérgicos causa vasoconstricción arterial, seguida de la elevación en la presión arterial; por su parte, la estimulación de los receptores beta-adrenérgicos genera un aumento en la frecuencia, contractilidad y demanda de oxígeno por el corazón. La vasoconstricción se amplifica por la inhibición de la síntesis de óxido nítrico y por el aumento de la formación de endotelina-1. Por otra parte, la cocaína induce un estado protrombótico mediante la estimulación de plaquetas y de la coagulación; con el tiempo, estos diversos efectos promueven aterosclerosis y disfunción endotelial, que aumentan aún más el riesgo de eventos cardiovasculares en los consumidores crónicos de cocaína44; adicionalmente, esta bloquea los canales de Na+ en las membranas, cambiando el potencial de acción asociado a su efecto anestésico local44,45.
- •
Cardiopatía de takotsubo por alcohol (5/38 casos equivalente al 13,2%)22–26: la abstinencia alcohólica aguda puede causar un estado hiperadrenérgico durante 48 a 96 horas, lo que puede desencadenar temblor, ansiedad, náuseas, vómitos, diarrea, taquicardia e hipertensión23. Adicionalmente, existen varias explicaciones para la disminución de la contractilidad y la función ventricular causada por el alcohol: a) Daño mitocondrial, directamente por el alcohol o por la ausencia de la enzima alcohol deshidrogenasa en los cardiomiocitos; b) Lesión de los cardiomiocitos, reducción de la síntesis proteica e inhibición de la ATPasa miofibrilar, atribuidas al acetaldehído (metabolito del metabolismo del alcohol); c) Alteración de enzimas del ciclo del ácido tricarboxílico (ciclo de Krebs) y, con ello, inhibición de la cadena respiratoria; y d) Deterioro de la absorción y unión del calcio en la mitocondria45–49.
- •
Cardiopatía de takotsubo por venenos de origen animal (5/38 casos equivalente al 13,2%)27–31: los casos de miocardiopatía de takotsubo asociados a la picadura de un animal podrían ser explicados desde dos perspectivas. La primera supone que una exposición accidental es por sí misma un evento estresante; y la segunda sugiere que hay evidencia de que algunos de los venenos son estimulantes químicos directos que causan disfunción cardiaca, como es el caso del veneno de la araña viuda negra, que contiene alfa-latrotoxina, la cual induce la liberación de neurotransmisores desde las terminales nerviosas29; el veneno del escorpión, que contiene varias toxinas, en especial alfa-toxinas, las cuales tienen la propiedad de inducir una estimulación neuronal, principalmente en el centro autonómico, provocando la liberación de catecolaminas hacia la circulación10,11,31; y el veneno de medusa, que causa daño cardiaco, el cual hace parte de los síntomas del “síndrome Irukandji”’, que está asociado a un exceso de liberación de catecolaminas endógenas27,28.
- •
Cardiopatía de takotsubo por anfetaminas (4/38 casos equivalente al 10,5%)32–35: la 4-fluoroanfetamina (4-FA) inhibe la recaptación y estimula la liberación de dopamina, serotonina y norepinefrina. En comparación con otras anfetaminas halogenadas, 4-FA tiene un efecto más débil, de corta duración y reversible en la disminución de serotonina y en la inhibición de la monoamina oxidasa32.
- •
Cardiopatía de takotsubo por el hongoPsilocybe semilanceata (1/38 casos equivalente al 2,6%)36: este hongo posee un metabolito que interactúa con receptores dopaminérgicos, adrenérgicos y serotoninérgicos, causando disfunción contráctil del miocardio. Los hongos de este tipo contienen triptamina, profármaco de la psilocina, una sustancia que, además de sus efectos simpaticomiméticos deletéreos sobre el miocárdico36, se comporta como un agonista parcial de los receptores serotoninérgicos 5-HT1A y 5-HT2A, lo que puede desencadenar un espasmo de la arteria coronaria.
- •
Cardiopatía de takotsubo por marihuana (1/38 casos equivalente al 2,6%)37: los endocannabinoides pueden causar una disminución de la contractilidad y aturdimiento miocárdico debido a su capacidad de estimular receptores CB-1. Un mecanismo similar podría aplicarse a los cannabinoides exógenos, tales como la marihuana, cuyo consumo agudo causa un aumento de la actividad del sistema nervioso simpático.
- •
Cardiopatía de takotsubo por abstinencia de heroína (1/38 casos equivalente al 2,6%)38: aunque la heroína aumenta la actividad parasimpática y disminuye la simpática, en los casos se abstinencia a la droga se produce un estado hiperadrenérgico y de irritabilidad del sistema nervioso central, lo que puede explicar el aumento en los niveles de catecolaminas y sus efectos a nivel cardiaco50.
- •
Cardiopatía de takotsubo por insecticida (1/38 casos equivalente al 2,6%)39: la exposición a carbamatos y piretroides puede causar daños cardiacos por su toxicidad; además estos productos aumentan los niveles de acetilcolina y, con ello, sus efectos colinérgicos y muscarínicos39.
- •
Cardiopatía de takotsubo por cloroquina (1/38 casos equivalente al 2,6%)40:la dosis excesiva de cloroquina provoca una liberación adrenérgica endógena intensa en respuesta al bloqueo de la conducción ventricular40.
- •
Cardiopatía de takotsubo por bebidas energéticas (1/38 casos equivalente al 2,6%)41: este tipo de bebidas contiene sustancias simpaticomiméticas, tales como cafeína y 1,3-dimetilamilamina (DMAA). La cafeína es un agonista competitivo de los receptores de adenosina A1 y A2, tanto del sistema nervioso central como del miocardio, que altera la liberación de neurotransmisores y la frecuencia cardiaca. Adicionalmente, provoca un aumento de calcio intracelular en los miocitos y, con ello, posibles alteraciones en el ritmo cardiaco. Por su parte, la DMAA, sustancia psicoactiva no aprobada por la Administración de Drogas y Alimentos (FDA, su sigla en inglés), puede causar un aumento de los niveles de adrenalina41.
Con relación a la miocardiopatía de takotsubo es importante mencionar que, en 1991, Kounis et al.51 describieron el síndrome de la angina alérgica, en el cual la exposición a venenos de origen animal, químicos, factores ambientales, entre otros, se asocia con la aparición de eventos coronarios, acompañados de reacciones anafilácticas y anafilactoides. Los autores sugieren que la histamina, liberada durante las reacciones alérgicas, puede producir espasmo arterial coronario y, con ello, angina de pecho debido a la estimulación de receptores H1 y H2 cardiacos y coronarios. En este sentido, se debe tener presente que algunos de los síntomas como la angina y la disnea, también se presentan en la miocardiopatía de takotsubo, lo que podría llevar a confusiones diagnósticas. Por ello, es necesario que el médico identifique y diferencie de manera correcta esta entidad de otros eventos coronarios y, con ello, prevenga a los pacientes de la exposición a posibles efectos adversos de las medidas terapéuticas utilizadas en el tratamiento de los eventos coronarios agudos. Resulta clave, así mismo, la identificación y caracterización de posibles desencadenantes, diferentes a los estados de estrés físico o emocional. En este contexto, esta revisión se convierte en un aporte relevante, debido a que identificó de forma estructurada, casos de miocardiopatía de takotsubo asociados con el uso o exposición de 14 drogas de abuso, sustancias químicas o venenos de origen animal. Ante la sospecha de un evento coronario agudo, el clínico debería indagar por el consumo o exposición a estos 14 productos, especialmente en quienes sea más probable dicha característica. De igual forma, los resultados de la revisión se convierten en un argumento a favor de la hipótesis del estado hiperadrenérgico directo o indirecto como mecanismo fisiopatológico de la miocardiopatía de takotsubo, tal como se aprecia en la mayoría de los 38 casos identificados.
LimitacionesLos resultados de esta revisión deben interpretarse con cautela debido a algunas limitaciones. En primer lugar, la información sólo fue obtenida de los casos reportados, en los que no siempre se establece la existencia de una relación causal; y en segundo lugar, en la búsqueda solo se usó la base de datos PubMed/Medline, si bien, en general, en este tipo de trabajos se recomienda realizar la búsqueda en dos o más bases de datos. Sin embargo, esta limitación pudo ser disminuida debido a la búsqueda de otros reportes en las referencias de los artículos seleccionados. Adicionalmente, aunque la hipótesis planteada sobre la aparición de miocardiopatía de takotsubo es apoyada por el mecanismo farmacológico y biológico de las sustancias en estudio, clínicamente las pruebas son limitadas. En consecuencia, los resultados actuales requieren más investigaciones diseñadas para evaluar el riesgo real de miocardiopatía de takotsubo inducida por drogas y mejorar el conocimiento de la fisiopatología de este tipo de miocardiopatía.
ConclusionesLa miocardiopatía de takotsubo podría ser desencadena por la utilización o exposición de 14 drogas de abuso, sustancias químicas o venenos de origen animal, las cuales por su mecanismo de acción, o por la respuesta física en asuntos de abstinencia, en la mayoría de los casos, generan de forma directa o indirecta una sobreestimulación simpática. Por ello, se recomienda considerar este tipo de situación en pacientes que presenten miocardiopatía, especialmente en quienes no se identifique de forma precisa un desencadenante físico o emocional, en quienes exista sospecha o certeza del consumo de drogas de abuso como cocaína, heroína y anfetaminas, y en quienes se ha reportado exposición a venenos de origen animal o al monóxido de carbono.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflictos de interésLos autores declaran no tener conflictos de interés.
Al Comité para el Desarrollo de la Investigación (CODI) de la Universidad de Antioquia, por su apoyo económico en la convocatoria sostenibilidad (2014 a 2015), al grupo Promoción y Prevención Farmacéutica y al Programa Joven Investigador Colciencias-Universidad de Antioquia, que posibilita la participación y formación de la química farmacéutica Laura Cifuentes.