La fibrilación auricular es la arritmia cardiaca más común y se asocia con un riesgo significativo de ataque cerebrovascular isquémico, embolia sistémica, falla cardiaca, alteración de la calidad de vida y hospitalizaciones prolongadas1. La ecocardiografía es una técnica versátil, ampliamente utilizada, que puede dar información extensa en pacientes con fibrilación auricular.
En este capítulo se revisarán los parámetros ecocardiográficos que desempeñan un rol en pacientes con fibrilación auricular en diferentes escenarios: evaluación inicial luego del diagnóstico de fibrilación auricular, evaluación antes de cardioversión o ablación, predicción de la presencia de trombos en el apéndice auricular izquierdo (apéndice auricular izquierdo) en el ecocardiograma transesofágico, estratificación del riesgo embólico para seleccionar la estrategia apropiada y evaluación de pacientes para exclusión percutánea del apéndice auricular izquierdo. También se mencionarán los avances más recientes en nuevas técnicas ecocardiográficas (strain y strain rate) para la valoración del riesgo tromboembólico de pacientes con fibrilación auricular no valvular.
Ecocardiograma transtorácicoUtilidad del ecocardiograma transtorácico en la evaluación inicialLa fibrilación auricular puede ser la manifestación inicial de cualquier cardiopatía; por tanto, como parte de la evaluación inicial todo paciente con fibrilación auricular debe ser sometido a un ecocardiograma transtorácico bidimensional para detectar enfermedad estructural de base, valorar la función cardiaca y evaluar el tamaño atrial2.
RecomendacionesClase I
- •
El ecocardiograma transtorácico como parte de la evaluación inicial está indicado en todo paciente con fibrilación auricular (nivel de evidencia C).
Aunque el ecocardiograma transesofágico es la herramienta principal para prevenir la tromboembolia asociada a cardioversión y ablación con catéter, se ha subvalorado el rol potencial del ecocardiograma transtorácico en la estratificación de riesgo de pacientes con fibrilación auricular y en la toma de decisiones respecto a la profilaxis de tromboembolia a largo término. Investigaciones recientes han mostrado que pese al uso generalizado de escalas de estratificación de riesgo clínicas basadas únicamente en el score de CHADS2 o CHA2DS2-VASc (medidas que tienen una capacidad de discriminación modesta, C-estadística de 0,54 a 0,651)3, la ecocardiografía puede dar más precisión a estas escalas. La mayor atención entre los parámetros del ecocardiograma transtorácico como predictores de embolia en fibrilación auricular se le ha dado casi exclusivamente a la fracción de eyección del ventrículo izquierdo (FEVI) disminuida.
Los investigadores del estudio SPAF (Stroke Prevention in Atrial Fibrillation)4,5 y del Atrial Fibrillation6,7 encontraron que la disfunción sistólica del ventrículo izquierdo moderada a severa, era el único predictor ecocardiográfico independiente de ataque cerebrovascular en pacientes con fibrilación auricular.
En el esquema de clasificación más reciente, el CHA2DS2-VASc, se incluyó una FEVI <40% como un subrogado de falla cardiaca congestiva3. Una FEVI normal se ha asociado con ausencia de trombos en el apéndice auricular izquierdo en pacientes con fibrilación auricular que van para ecocardiograma transesofágico8. En este estudio, Ayirala et al., notaron que no se encontraban trombos en el apéndice auricular izquierdo con puntaje de CHADS2 ≤1, FEVI >55% y volumen indexado de la aurícula izquierda<28mL/m2; además, un índice FEVI a volumen indexado de la aurícula izquierda ≤ 1,5 tuvo una sensibilidad del 100% para la presencia de trombos en el apéndice auricular izquierdo.
Algunos parámetros de disfunción diastólica también se han asociado con riesgo tromboembólico en fibrilación auricular. La relación E/e’ (relación de la velocidad de llenado diastólico temprano del Doppler transmitral a la velocidad diastólica temprana del Doppler tisular del anillo mitral) fue un determinante significativo de ataque cerebrovascular isquémico en pacientes con fibrilación auricular9,10.
En más del 75% de los pacientes con fibrilación auricular que presentan un ataque cerebrovascular el culpable es el trombo de la aurícula izquierda11. No obstante, lejos de la inclusión en todos los esquemas de predicción, incluyendo el CHADS2 y el CHA2DS2-VASc, está cualquier parámetro de tamaño o función de la aurícula izquierda para predecir los eventos embólicos que finalmente, como se mencionó, en su mayoría se originan de esta estructura.
Los intentos iniciales para valorar el papel del tamaño de la aurícula izquierda en la predicción del riesgo tromboembólico en estudios de fibrilación auricular usaron el diámetro anteroposterior medido por ecocardiografía modo-M. Un análisis inicial del SPAF encontró que el diámetro de la aurícula izquierda era un predictor independiente de tromboembolia y adicionaba valor predictivo incremental a los factores de riesgo clínicos4; sin embargo, un análisis subsecuente de este estudio no pudo confirmar esta asociación5.
Un análisis más extenso de datos de tres ensayos clínicos aleatorizados mayores en fibrilación auricular (Boston Area Anticoagulation Trial for Atrial Fibrillation, Stroke Prevention in Atrial Fibrillation I study y Veterans Affairs Prevention in Atrial Fibrillation study), concluyó que el diámetro de la aurícula izquierda medido por modo-M, no predice ataque cerebrovascular6. Ahora se reconoce que hay limitaciones de uso del diámetro anteroposterior para valorar el tamaño de la aurícula izquierda, para lo cual las guías de la Sociedad Americana de Ecocardiografía recomiendan y prefieren el volumen biplano indexado12.
RecomendacionesClase I
- •
Se recomienda el volumen biplano indexado como el método preferido para evaluar el tamaño de la aurícula izquierda por ecocardiograma transtorácico (nivel de evidencia C)
Sin embargo, cuando se evalúan estudios más recientes, la evidencia favorable respecto a parámetros como el volumen indexado de la aurícula izquierda resulta de estudios pequeños13 y algunos han fallado en confirmar una asociación entre el volumen de la aurícula izquierda y eventos tromboembólicos14.
El papel del tamaño de la aurícula izquierda en la predicción del riesgo embólico, parece obvio, pero puede no ser tan consistente como se pensaba inicialmente. Claramente, la dilatación de la aurícula izquierda se asocia con muchos factores de riesgo de ataque cerebrovascular, como hipertensión arterial, falla cardiaca y edad, y una aurícula dilatada puede permitir mayor estasis sanguínea y subsecuente formación de trombos. Sin embargo, en la fibrilación auricular no valvular, la mayoría de trombos de la aurícula izquierda (91% en un estudio)15 se originan en el apéndice auricular izquierdo. Esta estructura varía en forma y en tamaño y lo puede hacer independiente de las características morfológicas de la cámara atrial principal.
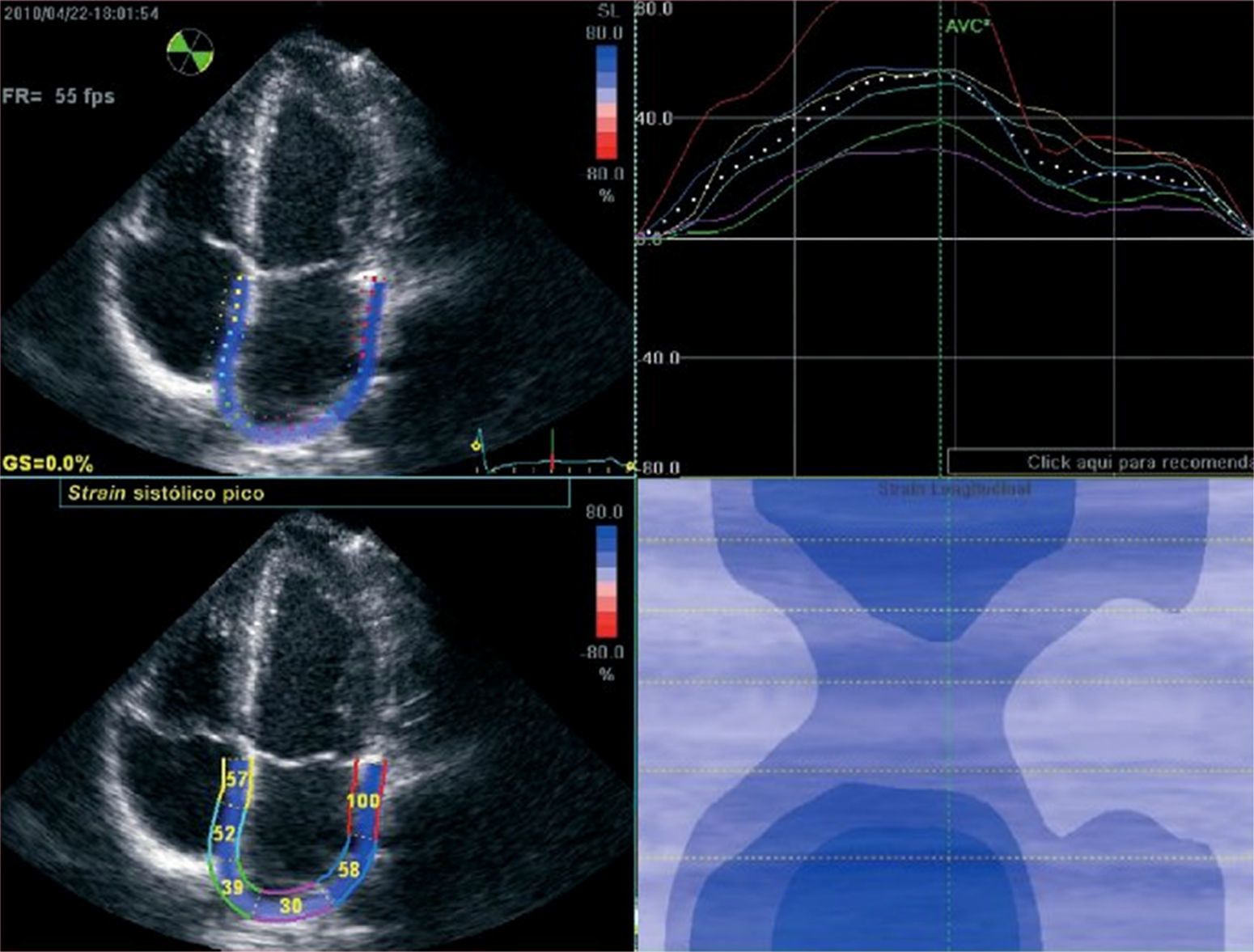
Las características del apéndice auricular izquierdo se evalúan mejor con ecocardiograma transesofágico y menos confiablemente mediante ecocardiograma transtorácico. Ya que el primero es un procedimiento semiinvasivo que no está exento de riesgos, en los últimos años se le ha prestado considerable atención a encontrar medidas alternativas por ecocardiograma transtorácico que puedan ser clínicamente útiles para separar los pacientes con fibrilación auricular de acuerdo con el riesgo de tener trombos en el apéndice auricular izquierdo, en grupos de muy bajo riesgo (en quienes se puede obviar la necesidad de ecocardiograma transesofágico) y de moderado o alto riesgo (en quienes se debe realizar ecocardiograma transesofágico). Una de estas medidas es el strain y el strain rate de la aurícula izquierda (fig. 1). La relación entre el strain y el strain rate de la aurícula izquierda y las escalas de riesgo clínicos (CHADS2 y CHA2DS2-VASc) se ha demostrado en diferentes estudios16,17. En el de Saha et al.16 la incorporación del strain longitudinal de la aurícula izquierda y el volumen indexado al puntaje de CHADS2 aportó valor para predecir muerte y/o admisión hospitalaria/año.
Strain longitudinal de las paredes de la aurícula izquierda durante la sístole ventricular en un paciente normal. Como es lógico, la aurícula se expande en sístole y las paredes se distienden y crean un strain positivo. Puede observarse que el strain de los segmentos más cercanos al anillo aurículo-ventricular es mayor que los segmentos medios, y estos, a su vez, son mayores que los segmentos más posteriores, que corresponden al techo de la aurícula.
Un estudio reciente en 66 pacientes con fibrilación auricular permanente encontró que el strain longitudinal pico y el strain rate pico de la aurícula izquierda eran significativamente menores en pacientes con ataque cerebrovascular previo en comparación con aquellos sin historia de ataque cerebrovascular18.
El volumen de la aurícula izquierda es una medida estática, mientras que el strain longitudinal es un parámetro dinámico que refleja el cambio en la longitud de la aurícula izquierda durante el llenado. Tal vez, más que el tamaño atrial aislado, esta naturaleza dinámica de la aurícula izquierda puede influir en la estasis sanguínea y por lo tanto en la tendencia a la trombosis atrial. Otro mecanismo por el cual el strain longitudinal de la aurícula izquierda puede aportar información adicional, puede ser su relación con la fibrosis miocárdica. Una reducción en el strain longitudinal de la aurícula izquierda se ha asociado con la presencia de fibrosis miocárdica, y a su vez, la fibrosis por resonancia magnética con realce tardío se ha asociado con riesgo de ataque cerebrovascular en pacientes con fibrilación auricular19,20. El strain y el strain rate medidos en el atrio se corelacionan con la función en el apéndice auricular izquierdo aún no está claro y se necesitan más trabajos. Se han hecho intentos de evaluar y adquirir índices de la función del apéndice auricular izquierdo usando ecocardiograma transtorácico 2D. Esto puede lograrse usando las vistas paraesternal eje corto o apical dos cámaras. En un estudio pequeño que comparó ecocardiograma transtorácico 2D con ecocardiograma transesofágico 2D, la visualización del apéndice auricular izquierdo medicante ecocardiograma transtorácico 2D, fue posible en 75% de los pacientes, a expensas de una menor sensibilidad para la detección de trombos que el ecocardiograma transesofágico 2D21. También se ha descrito buena correlación entre las velocidades pico del apéndice auricular izquierdo medidas por ecocardiograma transtorácico 2D y ecocardiograma transesofágico 2D22.
El Doppler tisular del apéndice auricular izquierdo se ha realizado por ecocardiograma transtorácico 2D observándose buena correlación con los valores adquiridos mediante ecocardiograma transesofágico 2D. Este parámetro parece estar comprometido en pacientes con fibrilación auricular con alto riesgo embólico23. Sin embargo, a pesar de estos resultados prometedores, la imagen del apéndice auricular izquierdo por ecocardiograma transtorácico 2D es operador dependiente y tiene una curva de aprendizaje. Algunos estudios han reportado que el ecocardiograma transtorácico 3D puede ser tan preciso como el ecocardiograma transesofágico 2D para evaluar el apéndice auricular izquierdo si la ventana acústica es adecuada, pero en la actualidad aun no se puede considerar como un sustituto del ecocardiograma transesofágico24–26.
La capacidad de reclasificar pacientes respecto a la necesidad de terapia anticoagulante de acuerdo con las guías actuales, es interesante. Muchos pacientes con fibrilación auricular de larga duración que califican para anticoagulación nunca presentan ataque cerebrovascular, y también aplica lo contrario, puede haber ataque cerebrovascular en pacientes de bajo riesgo. Kleemann et al.27,28 describieron pacientes clasificados como de bajo riesgo tromboembólico por el puntaje CHADS2 que de hecho tenían un riesgo mayor que el esperado. En estos pacientes con CHADS2 de 0 o 1, el 3% tenían trombos en la aurícula izquierda y 5% contraste espontáneo. Con los avances en ecocardiografía, tal vez ha llegado el momento de identificar la aplicación clínica de los mecanismos en lugar de los predictores clínicos de formación de trombo atrial y embolización en fibrilación auricular.
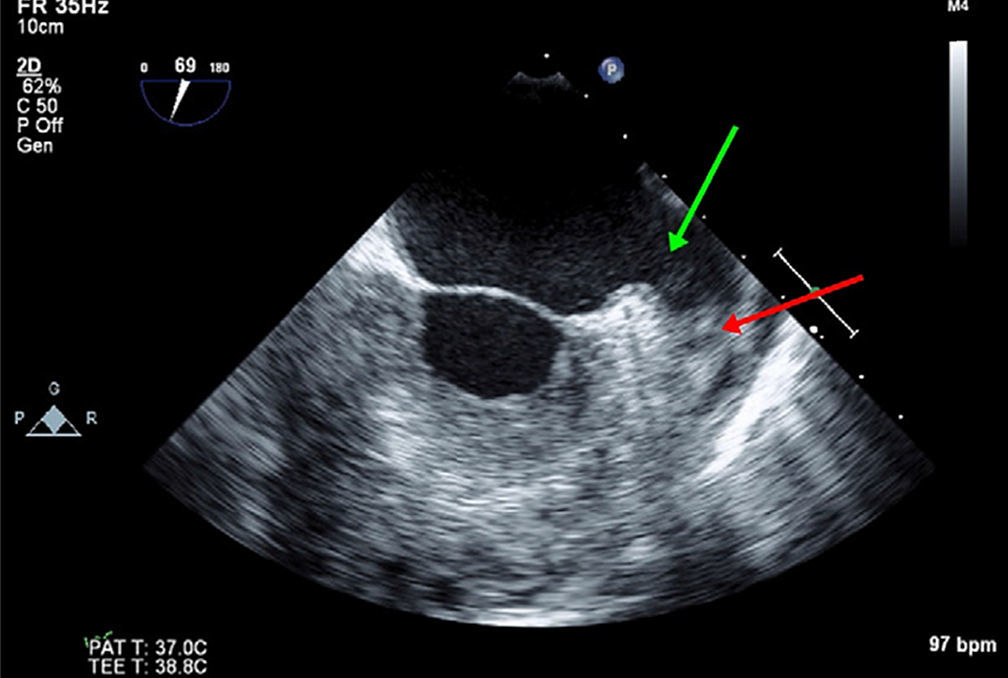
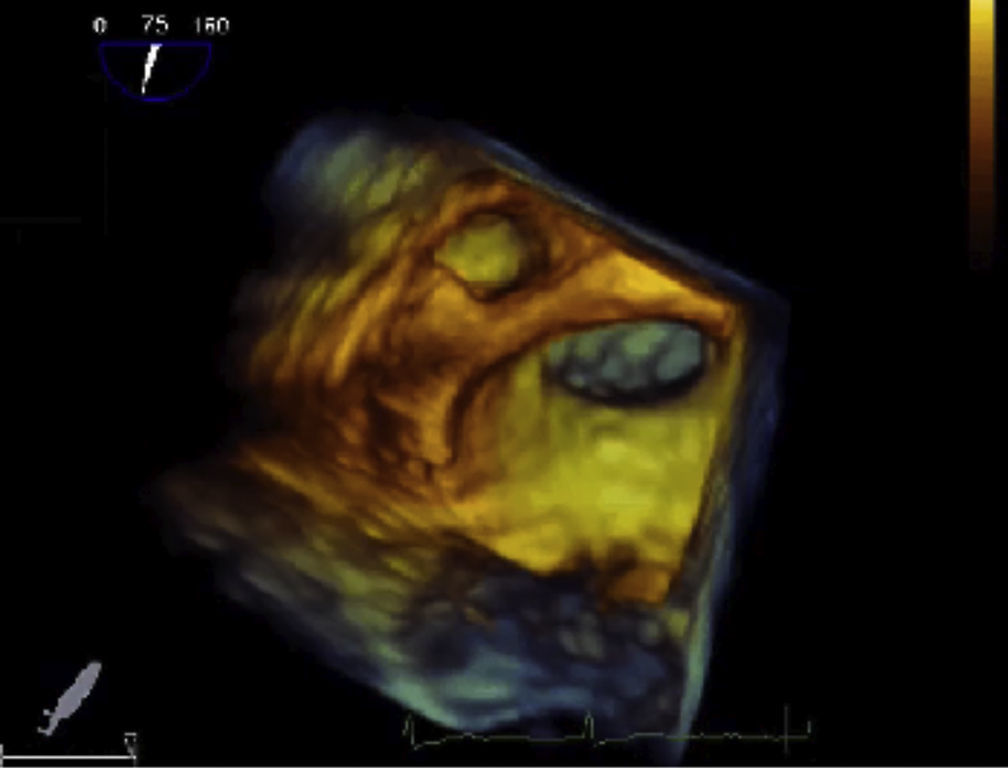
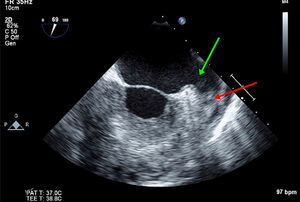
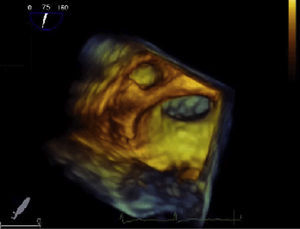
Ecocardiograma transesofágicoEcocardiograma transesofágico en la evaluación del apéndice auricular izquierdo y predicción de riesgo tromboembólicoEl ecocardiograma transesofágico 2D da una visualización excelente del apéndice auricular izquierdo por la proximidad de esta estructura con el esófago. A pesar de que esta estructura tiene una anatomía compleja, los trombos en el apéndice auricular izquierdo se pueden identificar con ecocardiograma transesofágico 2D, con sensibilidad y especificidad cercana al 99%29. Sin embargo, se requiere experiencia para escanear toda la estructura y evitar falsos negativos y para no confundir estructuras anatómicas como los músculos pectíneos con trombos (fig. 2). El ecocardiograma transesofágico 3D permite valorar con más precisión la geometría y el tamaño del apéndice auricular izquierdo (tamaño del orificio, profundidad, número de lóbulos), diferenciar mejor entre músculos pectíneos y trombos y obtener mayor definición de las relaciones anatómicas30 (fig. 3). Un epifenómeno del trombo intracardiaco es la presencia de contraste espontáneo, que se asocia con bajas velocidades del flujo sanguíneo y se ha relacionado con disminución de las velocidades del apéndice auricular izquierdo y aumento del tamaño de la aurícula izquierda. Se ha determinado que la disminución de las velocidades en el apéndice auricular izquierdo es un importante factor de riesgo para la formación de trombos. En el subestudio de ecocardiograma transesofágico del estudio SPAF III de pacientes con riesgo embólico moderado, la presencia de trombos en la aurícula izquierda, contraste denso espontáneo en la aurícula izquierda, baja velocidad pico del apéndice auricular izquierdo (≤ 20cm/s) y placas ateromatosas complejas en la aorta, fueron predictores de un aumento del riesgo de eventos tromboembólicos31. Cabe resaltar que el área transversal del apéndice auricular izquierdo no se asoció con riesgo de ataque cerebrovascular, hecho que sugiere que los parámetros funcionales pueden ser más importantes que el tamaño para predecir la tendencia trombótica.
De otra parte, el papel de las velocidades del apéndice auricular izquierdo en la predicción de ataque cerebrovascular ha sido bien corroborado. En un estudio de 500 pacientes con ataque cerebrovascular en ritmo sinusal o fibrilación auricular, el riesgo de trombos en el apéndice auricular izquierdo o contraste espontáneo aumentaba cuando las velocidades del apéndice auricular izquierdo eran menores a 55cm/s, independiente del ritmo. Cuando las velocidades del apéndice auricular izquierdo eran mayores o iguales a 55cm/s había solo un mínimo riesgo de trombos o contraste denso espontáneo (valor predictivo negativo de 99 y 100%, respectivamente)32. La presencia de trombos en el apéndice auricular izquierdo y el contraste denso espontáneo son predictores importantes de muerte cardiovascular independiente de otros factores de riesgo clínicos conocidos, incluyendo falla cardiaca, diabetes mellitus, hipertensión y enfermedad vascular33,34.
RecomendacionesClase I
- •
El ecocardiograma transesofágico es el método ecocardiográfico de elección para evaluar el apéndice auricular izquierdo (nivel de evidencia B).
- •
Por ecocardiograma transesofágico se evalúan la presencia de trombos en la aurícula izquierda, contraste denso espontáneo y bajas velocidades del apéndice auricular izquierdo (≤ 20cm/s) como predictores de riesgo tromboembólico en pacientes con fibrilación auricular (nivel de evidencia B)
Clase IIB
- •
El ecocardiograma transesofágico puede ser considerado en la evaluación del riesgo embólico de pacientes con fibrilación auricular que no serán llevados a cardioversión (nivel de evidencia C).
La presencia de trombos en el apéndice auricular izquierdo es una contraindicación para realizar cardioversión debido al riesgo de ataque cerebrovascular asociado. Por tanto, cuando se elige una estrategia de control de ritmo en un paciente con fibrilación auricular de más de 48 horas o más de duración o de duración desconocida, las guías recomiendan realizar ecocardiograma transesofágico para excluir trombos como una alternativa a las tres semanas de anticoagulación efectiva preprocedimiento2.
RecomendacionesClase IIa
- •
Para pacientes con fibrilación auricular de 48 horas de duración o más o de duración desconocida que no han estado anticoagulados por las últimas tres semanas, es razonable realizar ecocardiograma transesofágico antes de la cardioversión y proceder con esta si no se identifican trombos en la aurícula izquierda, incluyendo el apéndice auricular izquierdo, siempre que se logre anticoagulación antes del ecocardiograma transesofágico y se mantenga luego de la cardioversión por lo menos por cuatro semanas (nivel de evidencia B).
La ausencia de trombos en el ecocardiograma transesofágico no excluye la necesidad de anticoagulación durante y después de la cardioversión35. Si se identifican trombos en el ecocardiograma transesofágico la cardioversión debe ser aplazada, seguido por ≥ 3 a 4 semanas de anticoagulación. Se sugiere repetir luego un ecocardiograma transesofágico para garantizar la resolución del trombo antes de intentar nuevamente cardioversión. Si persiste el trombo en el ecocardiograma transesofágico de control, se debe considerar una estrategia alterna como control de frecuencia junto con anticoagulación apropiada.
Ecocardiograma transesofágico en la evaluación previa a ablación quirúrgica o con catéterDe acuerdo con el consenso de expertos de ablación con catéter y quirúrgica de fibrilación auricular de 2012, el ecocardiograma transesofágico preprocedimiento está indicado en todos los pacientes con fibrilación auricular de más de 48 horas de duración y sin anticoagulación en rango terapéutico en las últimas tres semanas36. Sin embargo, en muchos centros del mundo, todos los pacientes que van para ablación de fibrilación auricular, incluso aquellos que están en ritmo sinusal y efectivamente están anticoagulados, son sometidos a ecocardiograma transesofágico preprocedimiento. Este plan de tratamiento se deriva del hecho de que pacientes con puntajes de CHADS2 o CHA2DS2-VASc de 0 y una minoría de pacientes anticoagulados en rango terapéutico (1,6-2,1%) pueden aun desarrollar trombos en el apéndice auricular izquierdo. Sin embargo, algunos estudios sugieren que pacientes bajo anticoagulación efectiva y con un puntaje de CHADS2 y CHA2DS2-VASc menor a 2 (valor predictivo negativo de casi 100%) pueden evitarse el ecocardiograma transesofágico antes de la ablación con catéter de fibrilación auricular37.
RecomendacionesClase I
- •
Previo a un procedimiento de ablación de fibrilación auricular se debe realizar ecocardiograma transesofágico en todos los pacientes con fibrilación auricular de más de 48 horas de duración o de duración desconocida si la anticoagulación sistémica adecuada no se ha mantenido por lo menos por tres semanas previo al procedimiento (nivel de evidencia A).
Clase II
- •
Se puede considerar la realización de ecocardiograma transesofágico en pacientes que están en ritmo sinusal en el momento de la ablación o que han estado en fibrilación auricular por menos de 48 horas antes de la ablación (nivel de evidencia B).
Clase III
- •
La presencia de trombo en la aurícula izquierda es una contraindicación para ablación con catéter de fibrilación auricular (nivel de evidencia A).
El ecocardiograma transesofágico se ha utilizado, además, para el diagnóstico de estenosis de venas pulmonares, una de las complicaciones de la ablación de la fibrilación auricular.
RecomendacionesClase IIB
- •
El ecocardiograma transesofágico puede ser considerado para la evaluación de estenosis de las venas pulmonares (nivel de evidencia C).
En la última década el aumento significativo de cateterismos transeptales ha estado en relación con el aumento de procedimientos de ablación de fibrilación auricular. Convencionalmente, el procedimiento se realiza bajo guía fluoroscópica y monitorización de presiones. La punción transeptal es usualmente segura en manos experimentadas, sin embargo, en algunos casos puede asociarse con complicaciones serias como taponamiento cardiaco (1,31%) o perforación aórtica, que pueden llevar a la muerte (0,15%)38,39. Para reducir la incidencia de complicaciones la punción transeptal puede realizarse bajo guía con ecocardiograma transesofágico o ecocardiografía intracardiaca (ICE)40,41, la cual requiere entrenamiento adicional. El uso de ecocardiograma transesofágico para guiar la punción transeptal permite la visualización directa de la punta de la aguja en la fosa ovalis y por lo tanto una punción segura. En un estudio reciente la guía con ecocardiograma transesofágico se asoció con menor tiempo de fluoroscopia y del procedimiento. Aunque por el tamaño del estudio no fue posible demostrar una reducción estadísticamente significativa en las complicaciones usando la guía con ecocardiograma transesofágico durante el procedimiento, sí se encontró una tendencia hacia mayores tasas de complicaciones (20,6 vs. 31,6%, p=0,37) y tasas de recurrencia (11,8 vs. 20,1% p=0,26) en el grupo guiado por fluoroscopia42.
Recomendaciones- •
La ecocardiografía ofrece el potencial de mejorar la seguridad de la punción transeptal, y aunque no es obligatorio en todos los procedimientos, se recomienda su uso.
La exclusión percutánea del apéndice auricular izquierdo es un tratamiento en evolución para prevenir eventos embólicos en pacientes con fibrilación auricular no valvular. En los últimos años se han desarrollado múltiples dispositivos percutáneos para excluir el apéndice auricular izquierdo del cuerpo de la aurícula izquierda y por lo tanto de la circulación sistémica. El ecocardiograma transesofágico 2D y 3D se usa para evaluar la anatomía y la pertinencia del cierre percutáneo, para seleccionar el tipo y tamaño del dispositivo, para guiar el procedimiento en conjunto con la fluoroscopia y para detectar complicaciones o cualquier interferencia con estructuras vecinas, como la válvula mitral, la vena pulmonar superior izquierda y la arteria coronaria circunfleja. Por las variaciones sustanciales en la anatomía del apéndice auricular izquierdo que influyen en la selección y eficacia del dispositivo, es crucial una valoración precisa de las características anatómicas del apéndice auricular izquierdo antes del procedimiento de cierre. Previo a este procedimiento se utiliza ecocardiograma transtorácico para evaluar las dimensiones y el volumen de la aurícula izquierda, la función ventricular (factor de riesgo para embolia) y para excluir contraindicaciones para el cierre percutáneo del apéndice auricular izquierdo (ej; fibrilación auricular valvular o una valvulopatía significativa que requiera cirugía, o pacientes con trombo en el ventrículo izquierdo o una prótesis valvular mecánica que requieran anticoagulación crónica).
Las modalidades de imagen del apéndice auricular izquierdo usadas incluyen ecocardiograma transtorácico, ecocardiograma transesofágico, tomografía computarizada multidetectora y resonancia magnética cardiaca. La ecocardiograma transesofágico es la modalidad de imagen más utilizada para evaluar el apéndice auricular izquierdo. Un análisis multiplanar cuidadoso por ecocardiograma transesofágico 2D (de 0° a 180°) mejora el entendimiento de la morfología compleja del apéndice auricular izquierdo. El ecocardiograma transesofágico 3D brinda una valoración más detallada y un análisis cuantitativo del área del orificio del apéndice auricular izquierdo. El ecocardiograma transesofágico a menudo se utiliza para seguimiento ecocardiográfico estándar. El tiempo del ecocardiograma transesofágico de seguimiento varía entre las instituciones. En el estudio PROTECT AF (Watchman Left Atrial Appendage System for Embolic Protection in Patients with Atrial Fibrillation), el seguimiento con ecocardiograma transesofágico se hizo a los 45 días, 6 meses y un año después del implante. Luego de un año en ausencia de complicaciones (específicamente fugas y trombos en el dispositivo) la vigilancia subsecuente puede hacerse cada año con ecocardiograma transtorácico.
Recomendaciones- •
Se recomienda realizar un ecocardiograma transtorácico antes del procedimiento de cierre para evaluar las dimensiones y el volumen de la aurícula izquierda, así como su función y para excluir contraindicaciones para el cierre percutáneo del apéndice auricular izquierdo.
- •
Se recomienda realizar un ecocardiograma transtorácico luego de la intervención antes del alta para confirmar que no ha ocurrido migración del dispositivo y para excluir el desarrollo de derrame pericárdico.
- •
El ecocardiograma transesofágico es actualmente la técnica de imagen estándar en la selección de pacientes para cierre percutáneo del apéndice auricular izquierdo, en la selección del tamaño y tipo de dispositivo, en la guía del procedimiento como un complemento a la fluoroscopia y en el seguimiento.
- •
El principal propósito del ecocardiograma transesofágico de seguimiento es detectar fugas y trombos en el dispositivo.
- •
Se sugiere realizar ecocardiograma transesofágico de seguimiento a los 45 días, 6 meses y un año después del implante. Luego de un año en ausencia de complicaciones, la vigilancia subsecuente se puede hacer cada mediante ecocardiograma transtorácico.
Los autores declaran no tener conflicto de intereses.