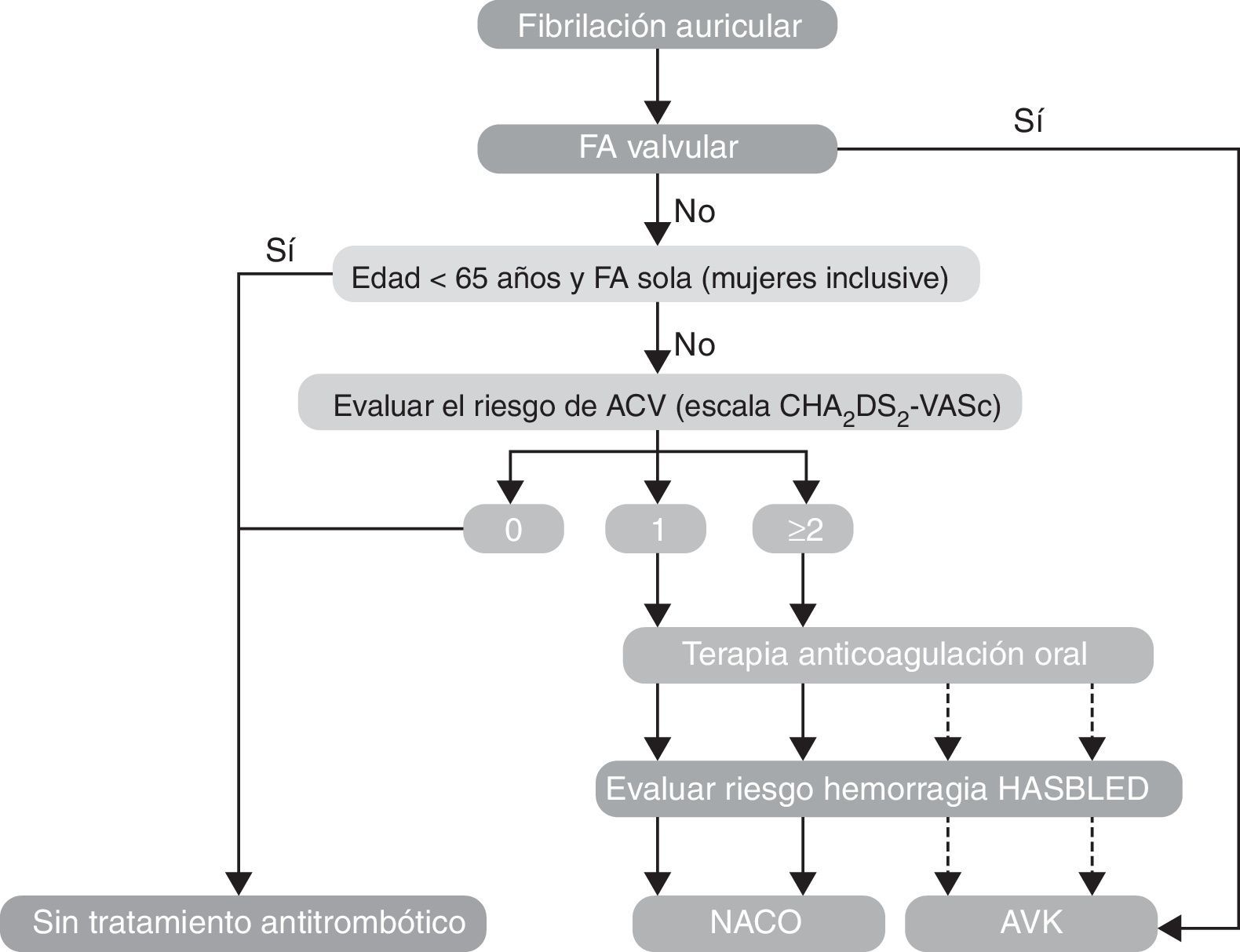
Acorde con las Guías Europeas de fibrilación auricular de la Sociedad Europea de Cardiología –actualización 20121, el término “fibrilación atrial valvular” se usa para determinar aquella que está correlacionada con enfermedad reumática valvular (predominantemente estenosis mitral modera a severa) y las válvulas protésicas mecánicas.
Escalas de riesgo de emboliaLa fibrilación auricular se conoce como la arritmia del siglo xxi debido a su creciente prevalencia e incidencia, simplemente por aumento de la supervivencia y disminución de la mortalidad por causas cardiovasculares en la especie humana. Como consecuencia, en el mundo hoy existen más personas de edad avanzada que hace 50 años y por consiguiente más casos de enfermedad hipertensiva o coronaria, que a su vez son causas preponderantes para fibrilación auricular por mecanismos de aumento de la presión intraatrial, fibrosis o dilatación por sobrecarga de presión o de volumen. Aunado a lo anterior, la fibrilación auricular es la arritmia –y la entidad- más generadora de cardioembolia, de ahí que todas las guías coincidan en que el manejo fundamental, el pivote de la terapéutica –independientemente de la restauración del ritmo o del control de la frecuencia cardíaca- debe ser la anticoagulación para prevenirla.
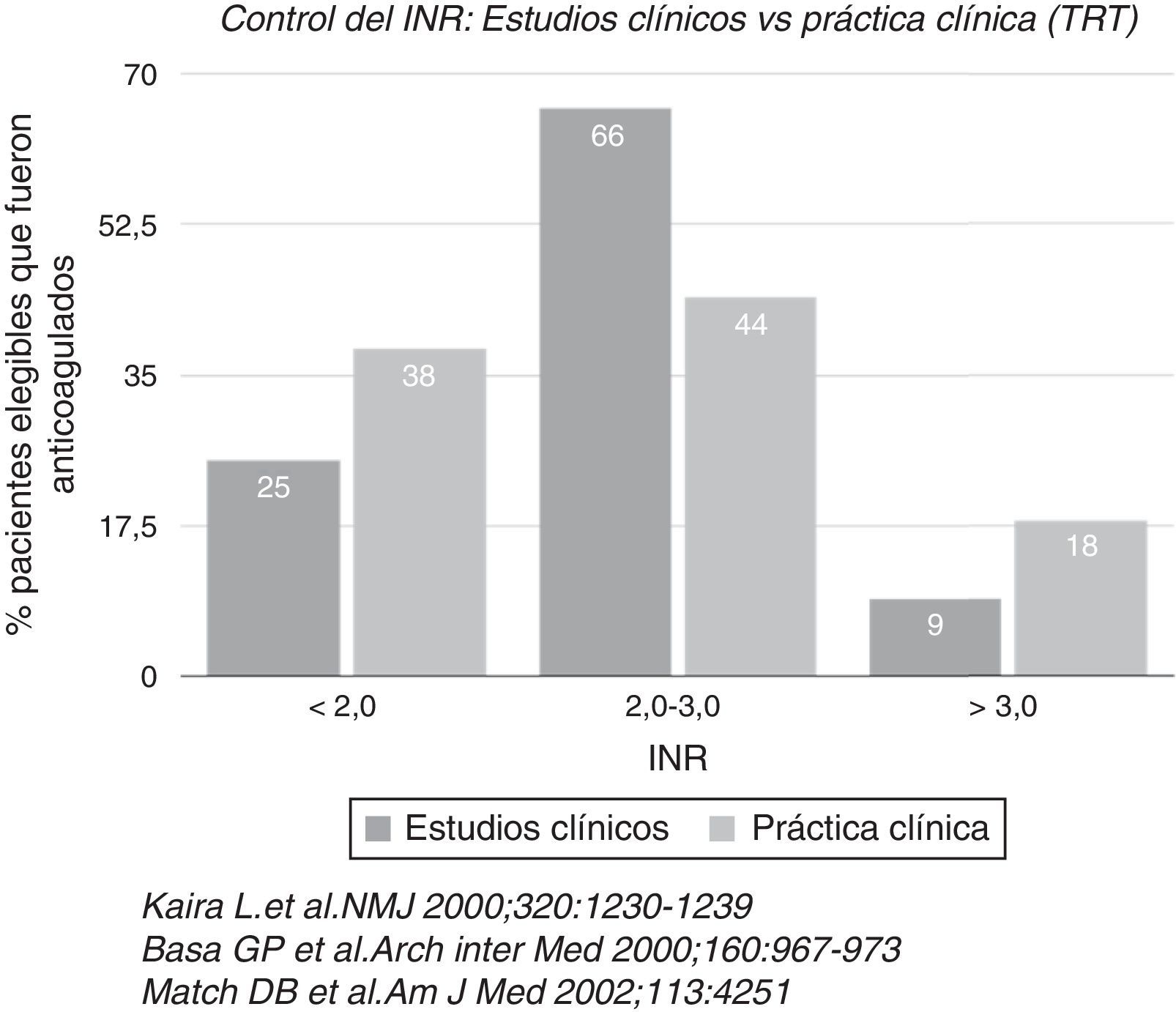
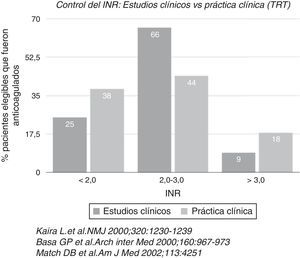
Desde hace 62 años la única alternativa para tal fin era la warfarina, con sus riesgos y complicaciones, a pesar de su efectividad. Dentro de sus inconvenientes está el temido ataque cerebro-vascular hemorrágico, lo cual creó la cultura de anticoagular con cierto “temor”, y/o utilizar antiplaquetarios con el fin de “hacer algo” en lugar de nada. La warfarina –como se verá más adelante-, inhibe tres factores de coagulación simultáneamente, que la hacen muy eficaz pero a su vez causante de mayor riesgo de sangrado y no siempre es fácil controlar su estrecho rango terapéutico, aunado a la necesidad de controles casi semanales del INR con los costos e interferencia en la calidad de vida que esto implica. En estudios controlados en los cuales hay un seguimiento estricto de los enfermos medicados con warfarina para el control óptimo del INR, el porcentaje de pacientes dentro del rango terapéutico adecuado (entre 2 y 3 del INR) se obtuvo en un 66%, pero en la vida real, se llegó escasamente a un 44% (fig. 1) y comparativamente, hay mayor tendencia a estar en el rango subterapéutico (riesgo de cardioembolia) que en el de sobreanticoagulación (riesgo de hemorragia). Esta es la incertidumbre de anticoagular.
Los hechos han cambiado en los últimos ocho años; ahora se cuenta con nuevos anticoagulantes no vitamina K dependientes (los denominados DOAC, su sigla en inglés por Direct Oral Anti-Coagulants) y con escalas de riesgo para tratar de predecir cardioembolia en fibrilación auricular o para calcular el riesgo de sangrado por anticoagulación, elementos que han facilitado el control de estas variables con menos incertidumbre.
Escalas de riesgo para ataque cerebro-vascular en pacientes con fibrilación auricular no valvularPara la mayoría de quienes padecen fibrilación auricular, actualmente existen múltiples guías (europeas, NICE, canadienses, AHA/ACC, Chest Physicians, regionales y locales), que aplicadas en la vida cotidiana, todas, sin excepción, recomiendan anticoagular, pero también establecen cuando no hacerlo, como es el caso de enfermos con fibrilación auricular aislada -un evento de fibrilación auricular paroxística- en menores de 65 años, puesto que la evidencia ha mostrado “riesgo muy bajo”. No obstante, existe una diferencia entre sexo y pronóstico: una mujer de 65 años o más con un factor de riesgo1, deberá recibir anticoagulación, incluso si tiene fibrilación auricular aislada2,3. Entre las escalas, a la fecha existen dos validadas: la CHADS2 y la CHA2DS2-VASc.
Escala CHADS2Esta tiene en consideración la falla cardíaca congestiva, la hipertensión, la edad ≥75, la diabetes y el ataque cerebro-vascular (doble valor) (tabla 1). Es simple, pero no incluye otros factores de riesgo para ataque cerebro-vascular y su limitación ya ha sido cuestionada y discutida, tema al cual se suma el que su antigüedad ya tiene dos décadas y fue aplicada en los estudios iniciales con DOAC. En estos ensayos no se consideró el impacto progresivo de la edad, y hoy día se sabe que el riesgo para ataque cerebro-vascular es más alto en la población mayor de 65 años e incrementa progresivamente a medida que lo hace la edad; adicionalmente, tampoco se tuvo en cuenta el antecedente de cualquier enfermedad vascular, que también eleva el riesgo de embolia. Así mismo, la función renal queda en el vacío ya que a mayor deterioro, mayor aumento del riesgo de sangrado4.
Puntaje de CHADS2 y valor predictivo de acuerdo con puntaje obtenido
| Pacientes (n=1.733) | Tasa ajustada de ataque cerebro-vascular %/año. IC 95% | CHADS2 |
|---|---|---|
| 120 | 1,9 (1,2-3,0) | 0 |
| 463 | 2,8 (2,0-3,8) | 1 |
| 523 | 4,0 (3,1-5,1) | 2 |
| 337 | 5,9 (4,6-7,3) | 3 |
| 220 | 8,5 (6,3-11,1) | 4 |
| 65 | 12,5 (8,2-17,5) | 5 |
| 5 | 18,2 (10,5-27,4) | 6 |
| Puntaje CHADS2 | |
|---|---|
| Ataque cerebro-vascular previo o ataque isquémico transitorio | 2 |
| Edad > 75 años | 1 |
| Hipertensión | 1 |
| Diabetes | 1 |
| Falla cardíaca | 1 |
Pero obsérvese (tabla 1) que muchos enfermos clasificados como de “bajo riesgo” con el CHADS2 (score=0) tienen una tasa de eventos de ataque cerebro-vascular de 1,9%/año, con intervalos de confianza de 1,2-3,0, es decir, hay un “gap”, que puede ser importante para esa población subestimada5,6. La tendencia actual es identificar enfermos de bajo riesgo real más que los de alto riesgo. Se debe ser más inclusivos que exclusivos con los factores de riesgo para ataque cerebro-vascular, si bien todo paciente con un valor de 1 o mayor deberá ser anticoagulado, principalmente con DOAC7.
Escala CHA2DS2-VAScEsta es la escala más recomendada por todas las guías actuales, aunque ha habido propuestas de nuevos scores, como por ejemplo el SAMe-TT2R2, que tiene la ventaja de tomar en consideración el tiempo dentro del rango terapéutico del INR8. La escala CHA2DS2-VASc ha sido validada en múltiples estudios y tiene la fortaleza de incluir otros factores de riesgo determinantes de riesgo para ataque cerebro-vascular9. En la tabla 2 se comparan las diferencias entre estas dos escalas.
Diferencias entre las escalas CHADS2 y CHA2DS2-VASc
| Escala CHADS2 | |
|---|---|
| Ataque cerebro-vascular previo o ataque isquémico transitorio | 2 |
| Edad>75 años | 1 |
| Hipertensión | 1 |
| Diabetes | 1 |
| Falla cardíaca | 1 |
| 0=1,9%, 1=2,8%, 2=4%, 3=5,9%, 4=8,5%, 5=12,5%, 6=18% | |
| CHA2DS2-VASc | |
|---|---|
| Falla cardíaca/disfunción ventricular izquierda | 1 |
| Hipertensión | 1 |
| Edad ≥ 75 años | 2 |
| Diabetes mellitus | 1 |
| Ataque cerebro-vascular/accidente isquémico transitorio/tromboembolia | 2 |
| Enfermedad vascular (C, Car, P, Ao) | 1 |
| Edad 65 – 74 | 1 |
| Sexo femenino | 1 |
| 0=0%, 1=1,3%, 2=2,2%, 3=3,2%, 4=4%, 5=6,7%, 6=9,8%, 7=9,6%, 8=6,7%, 9=15,2% | |
El CHA2DS2-VASc ya ha evidenciado ser una herramienta superior para identificar “verdaderos casos de bajo riesgo”10–13 (tabla 3). Es, además, más sensible con relación a la CHADS26,14,15.
En la población china, el riesgo de ataque cerebro-vascular con valor de 0 es extremadamente alto (para Taiwán es de 1,06% y para Hong Kong de 2,41%). Aun no es claro si se trata de un problema esencialmente étnico o genético que deba ser extrapolado a la población china en general, pero amerita tenerlo en consideración16. El CHA2DS2-VASc también ayuda a definir el riesgo de ataque cerebro-vascular en enfermos después de ablación y deberá aplicarse, pues persiste el riesgo de cardioembolia17. Un hecho para tener en cuenta son los pacientes con alteración de la función renal, ya que este es un proceso dinámico y progresivo que en algunos casos puede ser reversible (uso de AINE o fibratos o uso prolongado de inhibidores de la bomba de protones, entre otros); están en mayor riesgo para ataque cerebro-vascular y para mortalidad por eventos coronarios e incluso poseen mayor riesgo de sangrado. En consecuencia, deberán evaluarse estos cambios de riesgo en forma periódica mediante el CHA2DS2-VASc, para así determinar cambio de terapia (si progresa a falla renal severa con TFG por debajo de 30, se opta por la warfarina).
¿Cuándo usar CHA2DS2-VASc?- •
En todo tipo de fibrilación auricular o flutter atrial.
- •
Cuando existe riesgo de recurrencia después de cardioversión.
- •
Una vez establecido el riesgo y la decisión de anticoagular, se deberá evaluar el riesgo de sangrado mediante la escala de HAS-BLED (ver más adelante), para establecer la relación beneficio de prevenir ataque cerebro-vascular embólico, vs. sangrado mayor como complicación. De manera concomitante se hace necesario modificar los siguientes factores de riesgo: hipertensión arterial no controlada, uso de Aspirina y AINE -deberán suspenderse-, control de alcoholismo y obesidad, si se tiene INR lábil –riesgos de supra o infraanticoagulación, mayor riesgo de embolia o de hemorragia respectivamente–, será preferible el uso de DOAC.
- •
Deberá tenerse en cuenta si es un anciano frágil y lábil, con tendencia a caídas o demencia, antes de iniciar anticoagulación, y más si vive solo.
- •
Establecer el estado cognitivo como elemento de precaución y tener mayor control en estos pacientes, tanto por la parte médica y como la de los familiares..
- •
Explicarle al paciente los riesgos y beneficios de la anticoagulación, haciéndole saber que en la mayoría de los casos son mayores los beneficios –especialmente con los DOAC- que el riesgo de sangrado. Si el riesgo de sangrado es alto, se requerirá un monitorización estrecha. Por fortuna ya existe y pronto estarán en el mercado los reversores de los DOAC.
- •
Como ya se mencionó, evaluar periódicamente la función renal (cada 6 meses) en pacientes añosos y/o con función renal comprometida que reciben DOAC.
- •
Si el CHA2DS2-VASc. es igual o mayor a 1, se recomienda el uso de anticoagulantes principalmente el de DOAC.
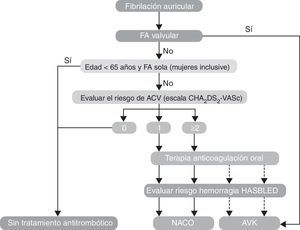
Recomendaciones para la prevención de tromboembolias en la fibrilación auricular no valvular (fig. 2) (tabla 4).
Modificada de: Recomendaciones Guías Europeas de Cardiología 20121.
Recomendaciones y nivel de evidencia de las Guías europeas de cardiología 2012 con base en las escalas CHA2DS2-VASc y HAS-BLED1
| Recomendaciones | Clase |
|---|---|
| Recomendaciones para la prevención de tromboembolias en la fibrilación auricular no valvular: general | |
| Se recomienda tratamiento antitrombótico para prevenir tromboembolias para todos los pacientes con fibrilación auricular, excepto en aquellos (tanto varones como mujeres) en riesgo bajo (edad<65 años y fibrilación auricular sola) o con contraindicaciones. | I |
| La elección del tratamiento antitrombótico debe basarse en los riesgos absolutos de ataque cerebro-vascular/tromboembolia y hemorragia y en el beneficio clínico neto para el paciente concreto. | I |
| La escala CHA2DS2-VASc.=se recomienda como medio para evaluar el riesgo de ataque cerebro-vascular en la fibrilación auricular no valvular. | I |
| Para los pacientes con CHA2DS2-VASc igual a 0 (es decir, edad<65 años con fibrilación auricular sola), riesgo bajo y ningún factor de riesgo, no se recomienda ningún tratamiento antitrombótico. | I |
| Para los pacientes con CHA2DS2-VASc ≥ 2, a menos que esté contraindicado, se recomienda el tratamiento anticoagulante con: – AVK con ajuste de dosis (INR 2-3) o – Un inhibidor directo de la trombina (dabigatrán) o – Un inhibidor oral del factor Xa (p. ej. rivaroxabán, apixabán). | I |
| Para los pacientes con CHA2DS2-VASc igual a 1, basándose en una evaluación del riesgo de complicaciones hemorrágicas y las preferencias del paciente, se debe considerar el tratamiento anticoagulante con: – AVK con ajuste de dosis (INR 2-3) o – Un inhibidor directo de la trombina (dabigatrán) o – Un inhibidor oral del factor Xa (p. ej. rivaroxabán, apixabán) | IIa |
| Las mujeres de edad<65 años y con fibrilación auricular sola (pero con CHA2DS2-VASc igual a 1 en virtud de su sexo) tienen riesgo bajo y no se debe considerar el tratamiento antitrombótico | IIa |
| Si el paciente se niega a tomar cualquier tipo de anticoagulante (ya sea AVK o NACO), se debe considerar tratamiento antiplaquetario mediante terapia combinada con 75-100mg de AAS más 75 mg/día de clopidogrel (con lo que hay bajo riesgo hemorrágico) o, menos eficazmente, AAS 75-325 mg/día. | IIa |
| Recomendaciones para la prevención de tromboembolias en la fibrilación auricular no valvular: NACO | |
| Cuando un paciente con fibrilación auricular para el que se recomiendan anitcoagulación no puede utilizar un AVK con ajuste de dosis (INR 2-3) debido a problemas para mantener la anticoagulación terapéutica, efectos secundarios con los AVK o imposibilidad de acudir a la monitorización y el control del INR, se recomienda un NACO: – Un inhibidor directo de la trombina (dabigatrán) o – Un inhibidor oral del factor Xa (p. ej. rivaroxabán, apixabán) | I |
| En los casos que se recomienda anticoagulación, en lugar de un AVK con ajuste de dosis (INR 2-3) para la mayoría de los pacientes con fibrilación auricular no valvular, según su beneficio clínico neto, se debe considerar un NACO: – Un inhibidor directo de la trombina (dabigatrán) o – Un inhibidor oral del factor Xa (p. ej. rivaroxabán, apixabán) | IIa |
| Para los casos que se prescribe dabigatrán, se debe considerar una dosis de 150mg dos veces al día para la mayoría de los pacientes en lugar de 110mg dos veces al día, y se recomienda una segunda en caso de: – Ancianos de edad ≥80 años – Uso concomitante de fármacos con interacciones (p. ej. verapamilo) – Riesgo hemorrágico elevado (HAS-BLED ≥3) – Deterioro renal moderado (CrCl 30-49 ml/min) | IIa |
| En el caso de rivaroxabán, se debe considerar una dosis de 20mg una vez al día para la mayoría de los pacientes en lugar de 15mg una vez al día, y se recomienda una segunda en caso de: – Riesgo hemorrágico elevado (HAS-BLED ≥ 3) – Deterioro renal moderado (CrCl 30-49 ml/min) | IIa |
| Se recomienda una evaluación basal, y regularmente después, de la función renal (mediante CrCl) en pacientes que estén iniciando tratamiento con algún NACO; debe realizarse anualmente, pero con mayor frecuencia en pacientes con deterioro renal moderado, cuyo CrCl se debe evaluar dos a tres veces al año. | IIa |
| Los NACO (dabigatrán, rivaroxabán y apixabán) no están recomendados para pacientes con deterioro renal grave (CrCl<30 ml/min) | III |
| Recomendaciones para la prevención de tromboembolias en la fibrilación auricular no valvular: hemorragia | |
| Se recomienda evaluar el riesgo hemorrágico al prescribir tratamiento antitrombótico (ya sea con AVK, NACO, AAS/clopidogrel o AAS solo). | I |
| Se debe considerar la escala HAS-BLED como una estimación para evaluar el riesgo hemorrágico, de modo que una puntuación ≥ 3 indica “alto riesgo” y hace necesaria cierta preocupación y revisiones regulares tras iniciar el tratamiento antitrombótico, ya sea con anticoagulación o terapia antiplaquetaria (nivel de evidencia A); se deben abordar los factores de riesgo hemorrágico corregibles (p. ej., presión arterial no controlada, INR lábil si el paciente recibe tratamiento con un AVK, fármacos concomitantes [AAS, AINE, etc.], alcohol, etc.) (nivel de evidencia B); se debe utilizar la escala HAS-BLED para identificar los factores de riesgo hemorrágico modificables que deban tratarse, pero no se debe utilizar por sí sola para excluir a los pacientes del tratamiento con anticoagulantes (nivel de evidencia B). | IIa |
| El riesgo de hemorragia grave con terapia antiplaquetaria (con terapia combinada de AAS y clopidogrel y, especialmente en ancianos, también con AAS en monoterapia) se debe considerar similar al riesgo con anticoagulación. | IIa |
| Recomendaciones para la prevención de tromboembolias en fibrilación auricular no valvular: pericardioversión | |
| Para los pacientes con fibrilación auricular ≥ 48 h o cuando se desconoce la duración de la fibrilación auricular, se recomienda el tratamiento con anticoagulantes (p.ej. AVK con INR 2-3 o dabigatrán) durante al menos tres semanas antes y al menos cuatro semanas después de la cardioversión, independiente del método (eléctrico o con fármacos orales/IV). | I |
| Para los pacientes con factores de riesgo de recurrencia de ataque cerebro-vascular o fibrilación auricular, el tratamiento con anticoagulantes, ya sea con AVK con ajuste de dosis (INR 2-3) o un NACO, se debería continuar de por vida independiente del mantenimiento aparente del ritmo sinusal tras la cardioversión. | I |
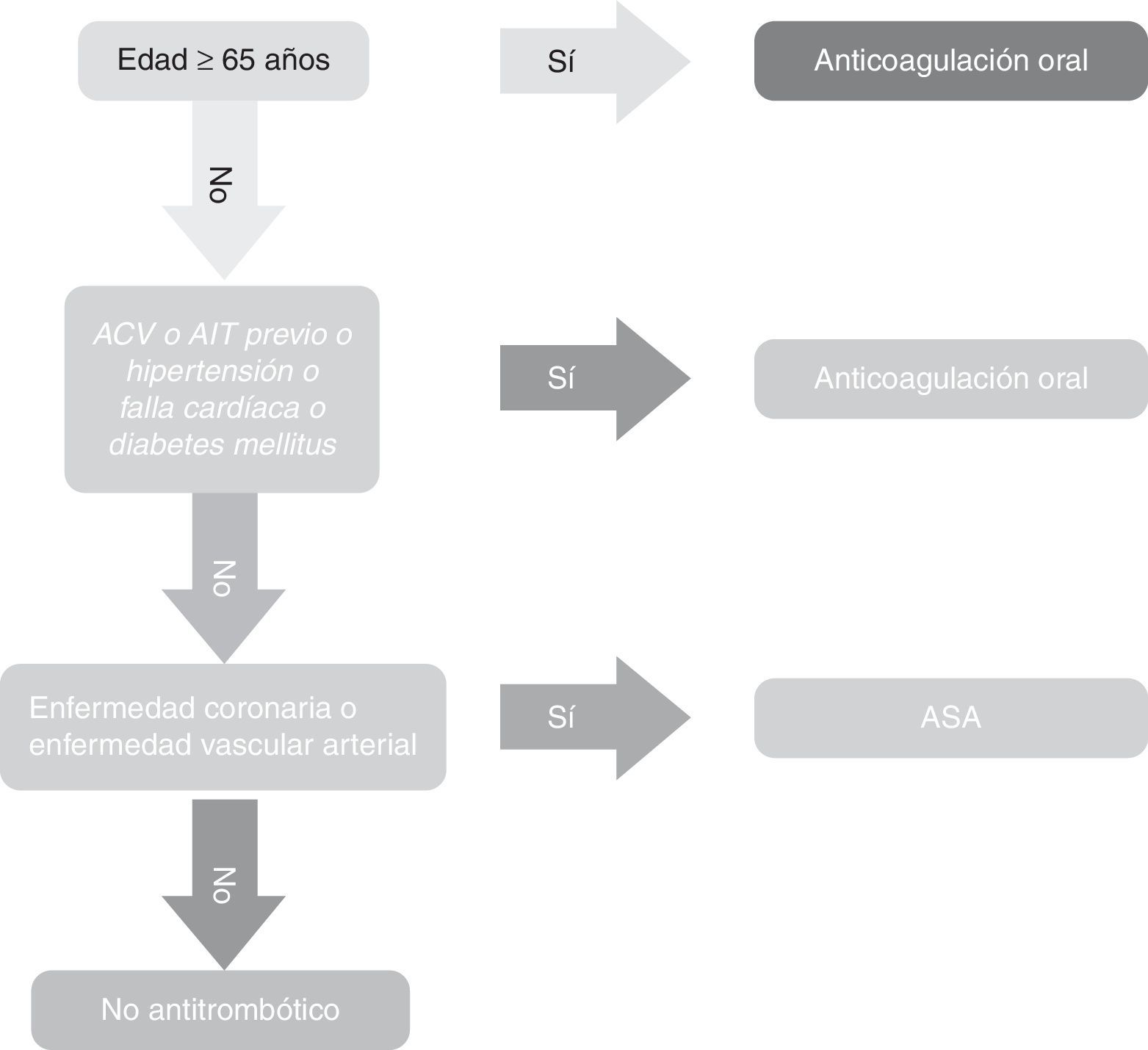
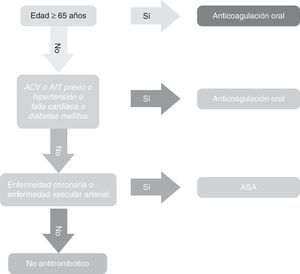
Las Guías AHA-ACC de 2014 en lo referente a escalas, recomiendan la CHA2DS2-VASc.-VASc como única para establecer el riego de ataque cerebro-vascular isquémico o cardioembolia (recomendación I, nivel de evidencia B7). Las Guías NICE, por su parte, recomiendan el uso del CHA2DS2-VASc y coinciden en gran parte con las europeas, salvo que recomiendan anticoagulación a partir de un puntaje CHA2DS2-VASc de 2 o superior. No recomiendan uso de Aspirina en ninguna circunstancia18. Las Guías canadienses19 (CCS) tienen un esquema que difieren un tanto del de las europeas y las americanas. Afirman que la CHADS2 es más fácil y propenden por el uso del algoritmo (fig. 3).
En síntesis, las guías canadienses recomiendan lo siguiente:
- 1.
Todos los pacientes con fibrilación auricular o flutter atrial, sea paroxística o persistente, deben ser estratificados usando un índice predictivo para riesgo de ataque cerebro-vascular (el “algoritmo CCS”) basado en el modelo CHADS2 (fuerte recomendación, evidencia de alta calidad).
- 2.
Que la terapia con DOAC sea prescrita para la mayoría de pacientes de o mayores a 65 años o CHADS2 con puntaje 1 (recomendación fuerte, evidencia calidad moderada).
- 3.
Que el ASA (81mg/d) sea prescrita para pacientes con ninguno de los riesgos resaltados en el algoritmo CCS (edad< 65 años y no CHADS2 y sin factores de riesgo para quienes tienen enfermedad arterial (coronaria, aórtica, o periférica) (recomendaciones condicionales, evidencia moderada).
- 4.
No prescribir terapia antitrombótica para pacientes con ninguno de los riesgos resaltados en el algoritmo CCS (edad< 65 y no factores de riesgo del CHADS2, y libres de enfermedad vascular arterial (coronaria, aórtica, periférica) (evidencia de baja calidad).
Como se aprecia, aun no hay consenso universal para el uso de las escalas, pero la más recomendada actualmente para tomar decisiones es la CHA2DS2-VASc.
Escalas de riesgo para sangradoExisten varias escalas para estimar el riesgo de sangrado en enfermos con fibrilación auricular que requieran anticoagulación.
La de mayor disponibilidad es la HEMORR2HAGES [Enfermedad Hepática o renal, abuso de Etanol, Malignidad, Older (edad) ≥75 años), Recuento de plaquetas reducido o su función, riesgo de hemorragia (Bleeding risk), Hipertensión (no controlada), Anemia, Factores Genéticos, Exceso riesgo para caídas y Stroke]20.
y le sigue otra de uso mayor y más fácil: HAS-BLED [Hipertensión, función renal/hepática Anormal, Stroke, Historia de sangrado o predisposición (Bleeding), INR Lábil, Edad (mayor de 65), Drogas (alcohol, psicotrópicos, etc.)21.
También existe la escala ATRIA (AnTicoagulación and Risk factors In AF.22
Los diferentes Consensos o Guías referentes a Riesgo de Sangrado de la EHRA, NICE y ESC Working Group on Thrombosis23, recomiendan el uso de HAS-BLED, más que otras un tanto complicadas y con menor peso de evidencia24,25. El HAS-BLED ha sido valioso en diferentes cohortes independientes14,21,26,27 e incluso ha mostrado igual capacidad pronóstica con los enfermos que toman Aspirina o warfarina14. De esta manera, se recomienda utilizar simultáneamente CHA2DS2-VASc y HAS- BLED en todos los enfermos con fibrilación auricular. Un puntaje HAS-BLED ≥ 3, debe poner en alerta para riesgo de hemorragia, además de corregir factores de riesgo potenciales y reversibles para sangrado. El HAS-BLED por sí mismo no debe usarse para excluir pacientes para anticoagulación sino como una herramienta para establecer el riesgo y buscar causas corregibles o un estrecho control del paciente, además de la relación riesgo/beneficio (ataque cerebro-vascular vs. hemorragia intracerebral); Olesen et al28 corroboran su utilidad.
Otros estudios observacionales29 con mayor número de casos favoreció el uso de warfarina a pesar de existir riesgo de sangrado, a excepción de la población de muy bajo riesgo para ataque cerebro-vascular isquémico con un CHA2DS2-VASc de 0 y riesgo moderado a alto para sangrado. Sin embargo, se prefiere el uso de DOAC, al tener menor riesgo de sangrado mayor frente a la warfarina. Solo en los enfermos con riesgo alto de sangrado estaría contraindicado anticoagular.
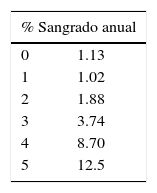
En conclusión, a la luz de la evidencia actual deberá utilizarse siempre la CHA2DS2-VASc con el HAS-BLED para determinar riesgo/beneficio de anticoagular enfermos con fibrilación auricular; no obstante, HAS-BLED no debe tomarse como una contraindicación para establecer riesgos y modificarlos. En la tabla 5 se muestran los niveles de evidencia y recomendaciones para HAS-BLED.
Escala HAS-BLED
| % Sangrado anual | |
|---|---|
| 0 | 1.13 |
| 1 | 1.02 |
| 2 | 1.88 |
| 3 | 3.74 |
| 4 | 8.70 |
| 5 | 12.5 |
| HASBLED: riesgo de sangrado | |
| Hipertensión >160mm Hg | 1 |
| Función renal y/o hepática anormal: Dx, Tx, Cr>2.3 / Bil >2X, TA – fibrilación auricular >3X | 1 ó 2 |
| Ataque cerebro-vascular | 1 |
| Historia de sangrado | 1 |
| INR Lábil (<60% del rango terapéutico) | 1 |
| Edad >65 años | 1 |
| Drogas (antiplaquetarios y AINE) o abuso de alcohol | 1 ó 2 |
| Puntaje ≥ 3: alto riesgo de sangrado | |
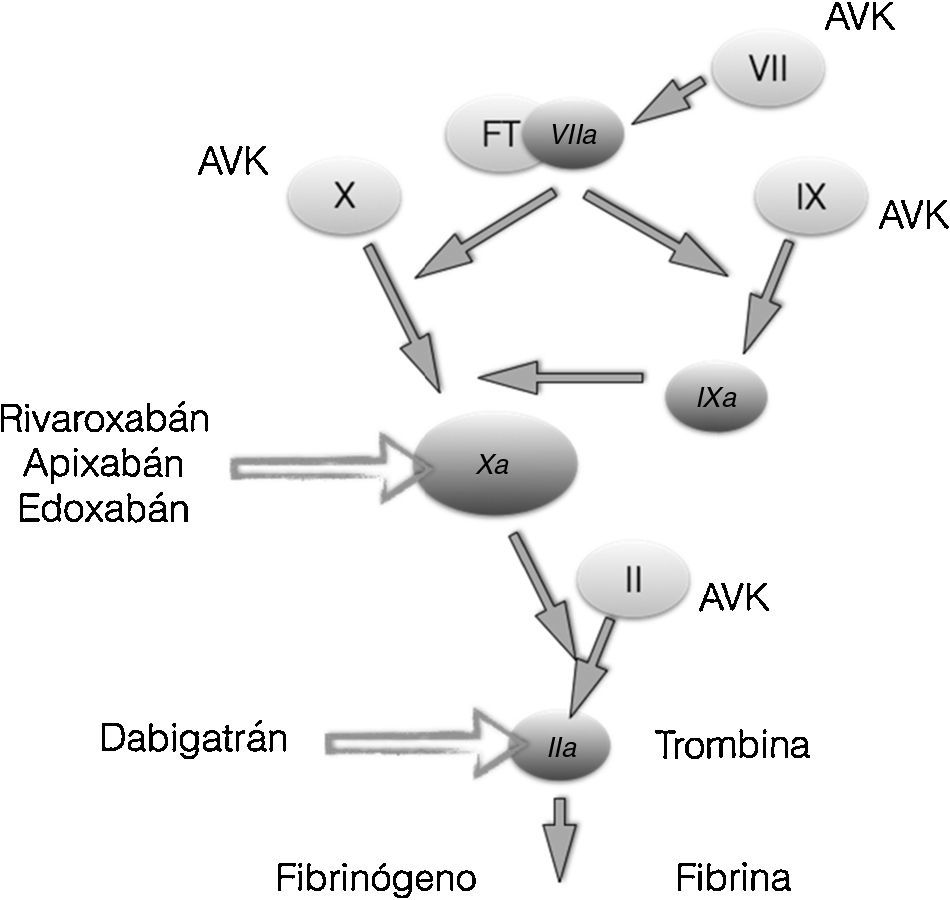
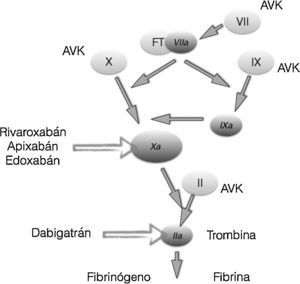
Es un derivado sintético de la cumarina, una sustancia natural que se encuentra en muchas plantas, en particular en la Asperula adorata. En 1950 fue aprobada como medicamento anticoagulante. Su mecanismo de acción se logra al inhibir la vitamina K epóxido-reductasa, una enzima que recicla la vitamina K a su forma reducida. Actúa inhibiendo simultáneamente los factores de coagulación IX, Xa y trombina. (fig. 4). A diferencia de los DOAC o los anticoagulantes selectivos que actúan en tan solo un factor de coagulación, se explica de esta manera su menor riesgo para sangrado frente a la warfarina.
Según las Guías de la AHA/ACC del 2007 para terapia con warfarina30, la dosis se establece en dos etapas: inicial y de mantenimiento. Después de iniciar el tratamiento, el valor INR se monitoriza con frecuencia hasta obtener una respuesta de dosis estable; después la frecuencia del test de INR se puede reducir a uno cada mes. El efecto anticoagulante se observa entre el segundo al séptimo día después de iniciar su administración. Cuando se requiere un efecto inmediato, se administra heparina concomitantemente por ≥ 4 días. La práctica común de administrar una dosis de carga con warfarina generalmente es innecesaria, y hay razones teóricas para comenzar tratamiento con dosis promedio de 5mg diarios, que realmente resulta en un INR de ≥ 2,0 después del tercer día. La heparina normalmente puede suspenderse una vez que el INR ha logrado el rango terapéutico. Cuando la anticoagulación no es urgente (ej., fibrilación atrial permanente), se puede comenzar fuera del hospital, con una dosis de 5mg/d, que usualmente produce un efecto satisfactorio en seis días. En ancianos y/o en aquellos con alto riesgo de sangrado puede iniciarse con una dosis menor. Si no se logran cifras estables, se chequea el uso excesivo o no regularizado de vegetales (ricos en vitamina K) o de alcohol, además de la adherencia y persistencia. Por otro lado, es preciso tener en mente los siguientes tópicos:
- -
La warfarina incrementa el riesgo de ataque cerebro-vascular en los pacientes de fibrilación atrial y durante los primeros 30 días de uso.
- -
El riesgo es particularmente alto durante la primera semana después de que los pacientes empiezan a tomar el medicamento.
- -
Los pacientes con fibrilación auricular con respuesta ventricular lenta tienen doble riesgo de sufrir ataque cerebro-vascular en los primeros 30 días después de empezar a tomar warfarina, en comparación con quienes no la toman, de acuerdo con un estudio de más de 70.000 pacientes31.
- -
La warfarina está indicada en enfermedad valvular tipo estenosis mitral moderada o severa, y especialmente si existe prótesis mecánica.
- -
Es preferible frente a los DOAC en caso de falla renal avanzada (TFG menor de 30 y puede emplearse aun si la tasa de filtración glomerular es de 15).
Si el INR es muy inestable (60% de las veces por debajo del rango terapéutico), usarán los NOAC.
Existe una falsa creencia –y muy arraigada- que la warfarina tiene antídoto, lo cual ha hecho pensar que es más segura que los DOAC. Esto es una falacia, pues la acción como antídoto de la vitamina K empieza a las 24 horas de administrada. No es inmediata. Si se requiere revertir su efecto de urgencia, se debe utilizar concentrado complejo de protombina, poco accesible32–34.
En pacientes tratados con warfarina, el INR debe ser determinado al menos semanalmente durante la iniciación de la terapia antitrombótica y mínimo mensualmente cuando la anticoagulación es estable (INR en rango) (nivel de evidencia A).
En pacientes con fibrilación auricular no valvular en quienes no se logre mantener un nivel de INR terapéutico con warfarina, se empleará un NOAC (nivel de evidencia C).
AspirinaLa evidencia de prevención efectiva de ataque cerebro-vascular con Aspirina es débil o casi nula y conlleva riesgo potencial de sangrado. Los datos muestran que el riesgo de sangrado mayor o hemorragia intracerebral no se diferencia con los DOAC, especialmente en el anciano14,35. Desde el advenimiento de los DOAC el uso de antiplaquetarios (Aspirina o clopidogrel), o la terapia de combinación para la prevención del ataque cerebro-vascular se limita solo para aquellos enfermos que no acepten terapia con DOAC. La combinación es mejor que el ASA, pero el riesgo de sangrado aumenta. El uso de ASA como monoterapia preventiva del ataque cerebro-vascular en pacientes con fibrilación auricular prácticamente está proscrito por todas las Guías.
Aspirina más clopidogrelEn la actualidad ninguna Guía establece esta combinación como sustituto a la warfarina o a los DOAC en enfermos con fibrilación auricular. El estudio ACTIVE36, comparó warfarina vs. Aspirina-clopidogrel en enfermos con fibrilación auricular y concluyó que el tratamiento con clopidogrel más aspirina comparado con aspirina sola, redujo la tasa de eventos vasculares mayores en enfermos de alto riego para ataque cerebro-vascular pero en quienes no se eligió la warfarina. La combinación fue igual a Aspirina sola (con base en datos de metaanálisis previos), pero fue inferior que la warfarina para ataque cerebro-vascular, y el riesgo de sangrado mayor fue más alto. Así, ni el ASA solo ni la combinación ASA más clopidogrel han demostrado beneficio igual o superior a la warfarina o los DOAC.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.