En 2014, Colombia publicó una guía para el diagnóstico y tratamiento de las dislipidemias en adultos, la cual fue similar a la del Colegio Americano de Cardiología/Asociación Americana del Corazón (ACC/AHA) en lo referente a la rigidez en la revisión sistemática de la evidencia con los inhibidores de la hidroxi-metil-glutaril coenzima A (estatinas). El resultado de la revisión fue no utilizar metas en el colesterol contenido en la lipoproteína de muy baja densidad (cLDL por su sigla en inglés), sino porcentaje en la reducción del cLDL basal, empleándose para su logro las dosis más altas de las estatinas de alta intensidad. El planteamiento creó controversia y a pesar de reconocerse la evidencia, se argumentó que el concepto de metas se podría deducir de los experimentos clínicos y facilitaría a médicos y pacientes su aplicación en la práctica clínica. En los últimos años, las guías internacionales sobre dislipidemia enfatizan en las metas en el cLDL, se han publicado nuevos experimentos clínicos y han entrado al mercado novedosos fármacos hipolipemiantes, hallazgos que justifican actualizar el tratamiento de la hipercolesterolemia en Colombia, y para ello, se hace una propuesta personal, y se reconoce que requiere ser consensada. De otra parte, los recientes hallazgos confirman aún más la importancia del colesterol como factor de riesgo para enfermedad cardiovascular y reafirman el concepto que cuanto más bajo tenga un individuo el colesterol, menor probabilidad de eventos cardiovasculares.
In 2014, Colombia published guidelines for the diagnosis and treatment of dyslipidemias in adults, which were similar to those published by the American College of Cardiology/American Heart Association (ACC/AHA) with regard to their rigidity in the systematic review of the evidence in hydroxymethylglutaryl coenzyme A inhibitors (statins). The result of the review was to not set goals for the cholesterol contained in very low density lipoproteins (LDLc), but rather a percentage reduction in basal LDLc, using the highest doses of high-intensity statins to accomplish this. This proposal created controversy, and in spite of recognizing the evidence, it was argued that the concept of goals could be deduced from the clinical studies, and would make application to clinical practice easier for physicians and patients. In the last few years, international guidelines on dyslipidemias have emphasized LDLc goals, new clinical studies have been published, and novel hypolipidemic medications have appeared on the market. These findings warrant updating hypercholesterolemia treatment in Colombia, and a personal proposal is presented for this purpose, recognizing that a consensus must be reached. Additionally, the recent findings further confirm the importance of cholesterol as a risk factor for cardiovascular disease, and reaffirm that the lower an individual's cholesterol, the lower the probability of cardiovascular events.
Hay consenso en considerar el cLDL como el principal objetivo terapéutico para reducir eventos cardiovasculares, y que cuanto más se reduzca, menor número de eventos se presentarán, criterio conocido como “cuanto más bajo el cLDL, mejor”. Al respecto surgen varias preguntas:
- 1)
¿Cuál es la evidencia?
- 2)
¿Cuál es la meta en el cLDL y en qué población?
- 3)
¿Con cuál o cuáles fármacos se lograría?
- 4)
¿Cuál es la seguridad, la adherencia a las estatinas y el porcentaje de pacientes que llegan a metas?
- 5)
¿Cuál es la variabilidad individual de la respuesta en el cLDL con estatinas?
- 6)
¿Reducen los nuevos hipolipemiantes significativamente los eventos cardiovasculares (ECV) y son seguros?
- 7)
¿Son deletéreos los niveles muy bajos en el cLDL?
- 8)
¿Cuál es la importancia clínica de la regresión de la placa aterosclerótica?
- 9)
¿Cuánto más temprano y prolongado el tratamiento, mejor?
Estas preguntas se resolverán de manera extractada y con base en las respuestas se hará una propuesta personal para el tratamiento de la hipercolesterolemia, aplicable a Colombia, aceptando que se debe discutir.
El cLDL, los eventos cardiovasculares y el concepto de “no metas” en el cLDLLos metanálisis que han comparado estatinas versus placebo, enseñan que reducir el cLDL en 40mg/dL, disminuye aproximadamente en un 22% la aparición de ECV1–3 y que extrapolar la reducción del cLDL en 80mg/dl, se traduce en un descenso de estos eventos en un 40%1. El metanálisis de estudios de prevención secundaria, que comparó altas dosis de estatinas con dosis bajas, encontró que alcanzar cifras promedio de 70mg/dl en el cLDL, reduce más ECV comparado con cifras promedio de 100mg/dl4.
Los estudios correspondientes a estos metaanálisis1–4, no fueron diseñados para buscar metas sino porcentaje en la reducción del cLDL con estatinas, y es de acuerdo con esta rigurosa revisión sistemática, que nace la propuesta de reducir más del 50% del cLDL basal y no metas, y explica la posición de la guía del ACC/AHA5 y de la guía colombiana6. La Asociación Americana de Diabetes (ADA), se alinea con este concepto7 y la guía de la Sociedad de Cardiología de Canadá8, acepta reducir el cLDL basal más del 50% o metas en el cLDL.
De los metanálisis mencionados1–4, se puede deducir, aunque sin la rigurosidad de la evidencia, metas en el cLDL. Las siguientes guías aceptan este criterio.
La Asociación Nacional de Lípidos de los Estados Unidos (NLA), considera un cLDL menor de 70mg/dl en muy alto riesgo y menor de 100mg/dl en otros riesgos9.
La Sociedad Europea de Cardiología/Sociedad Europea de Aterosclerosis10, también busca una meta menor de 70mg/dl en muy alto riesgo (enfermedad cardiovascular documentada, diabetes mellitus-DM- con compromiso de órgano blanco u otro factor de riesgo asociado, y la enfermedad renal crónica –ERC- con eTFG menor de 30ml/min/1,73 m2). Plantea una meta menor de 100mg/dl en riesgo alto (hipercolesterolemia familiar –HF-), factor de riesgo no controlado, DM sin las condiciones anteriores y ERC con eTFG entre 30-59ml/min/1,73 m2; y finalmente, sugiere una meta menor de 115mg/dl en riesgo bajo a moderado (SCORE menor del 5%).
El Colegio Americano de Cardiología (ACC), en su documento sobre las no-estatinas en pacientes con enfermedad cardiovascular aterosclerótica (ECVA)11, propone metas menores de 100mg/dl en las personas con ECVA no complicada y menor de 70mg/dl cuando la ECVA se asocia a DM o HF. El ACC deja a consideración el uso de los anticuerpos monoclonales o inhibidores de la proproteína convertasa subtilisina/kexina tipo 9 (i PCSK9), cuando no se logran las metas mencionadas y considera como segunda línea a los secuestrantes de ácidos biliares (SAB)11.
La Asociación Americana de Endocrinólogos Clínicos/Colegio Americano de Endocrinólogos (AACE/ACE)12, adiciona el “riesgo extremo” (enfermedad aterosclerótica cardiovascular progresiva, enfermedad cardiovascular más DM o ERC estados 3 y 4 y a las personas con HF heterocigota –HFHe- más historia de enfermedad coronaria prematura) y formulan para este grupo un cLDL menor de 55mg/dl. Para riesgos muy altos y altos, el objetivo son cifras menores de 70 y 100mg/dl, respectivamente.
A la fecha, se acepta más el criterio de metas en el cLDL por la facilidad y entendimiento entre médicos y pacientes respecto al tratamiento y para aprovechar que este concepto se conocía desde el ATP III13.
Seguridad, adherencia a las estatinas y logro de metasA pesar de la eficacia de las estatinas en la reducción de eventos cardiovasculares y su relevante relación beneficio-riesgo, se les ha imputado una baja seguridad errónea. La evidencia sobre este tópico demuestra que son fármacos con pocos efectos colaterales, si se utilizan de manera adecuada14. Infortunadamente, su seguridad es mal interpretada por médicos y pacientes y agravada por la desinformación del periodismo, lo cual explica la adherencia reducida15. El evento adverso más sobre-diagnosticado de manera errónea son los síntomas musculares asociados a las estatinas (su prevalencia real está cerca al 5%)16. El logro de meta en el cLDL menor de 70mg/dl en personas de alto riesgo, suele estar entre el 20% y 40%14,15. Un estudio llevado a cabo en una institución médica de Bogotá, encontró en pacientes con enfermedad coronaria, que un 22% tenían un cLDL menor de 70mg/dl17.
La variabilidad individual de la respuesta sobre el cLDL con estatinasLa alta variabilidad de las estatinas sobre el cLDL se observa en el subanálisis del estudio Júpiter18, el cual es un experimento en personas de prevención primaria, que recibieron rosuvastatina 20mg/día versus placebo; su subanálisis19 mostró que en 46% de los pacientes se redujo el cLDL en más del 50%, 43% entre el 0 y el 50% y en 11% no cambió o aumentó. Lo anterior muestra la respuesta interindividual e inesperada del cLDL con el uso de estatinas y resalta la importancia de medir el cLDL a los dos o tres meses de iniciarlas, con el objetivo de ajustar las metas.
El cLDL y los eventos cardiovasculares con hipolipemiantes no-estatinasSe aceptan como hipolipemiantes no-estatinas a los secuestrantes de ácidos biliares (SAB), el ácido nicotínico-niacina (AN), los fibratos, los ácidos grasos omega-3 (AGO-3), el ezetimibe, los i PCSK9, el lomitapide y el mipomersen; estos dos últimos se utilizan en hipercolesterolemia familiar homocigota y no se analizarán en esta revisión.
Cuando a pesar de dosis altas de estatinas de alta efectividad (atorvastatina, rosuvastatina), no se llega a metas en el cLDL (de acuerdo con el riesgo de ECV de un individuo), se requiere asociar a la estatina un hipolipemiante no-estatina que reduzca aún más el colesterol. El AN20–22 unido a estatinas reduce el cLDL en 19%22 mientras que los SAB lo reducen aproximadamente en 10-15%. Los fibratos20,23 y los AGO-320, asociados a estatinas, tienen repercusión nula sobre el cLDL. Estos cuatro hipolipemiantes tienen evidencia reducida y controversial sobre la disminución de ECV, en parte por el momento histórico en que se realizaron los estudios, tiempo en el que no se utilizaban rutinariamente las estatinas ni otros fármacos cardiovasculares10–12,20; son interesantes los resultados de un metanálisis con AN en el cual se demuestra reducción significativa de ECV en monoterapia o en conjunto con estatinas29. La tolerancia y adherencia del AN y los SAB es muy baja, debido a sus efectos gastrointestinales, especialmente con la colestiramina, que es la resina disponible en Colombia10–12,20 y por los eventos adversos sobre piel y sistema digestivo con el AN20–22. El colesevelan, disponible en otros países, es mejor tolerado y reduce el cLDL 15-20%, pero no tiene estudios que demuestren reducción de ECV; se propone como tercera línea en las guías europea10, del ACC11 y de la AACE/ACE12.
Dentro de los hipolipemiantes no-estatinas, los que tienen alto impacto sobre el cLDL, buena tolerancia y adherencia, bajos efectos colaterales y reducción significativa de ECV, son el ezetimibe y los i PCSK9, fármacos que se estudiarán a continuación.
cLDL, eventos cardiovasculares y ezetimibeEl ezetimibe como monoterapia disminuye el cLDL en aproximadamente 20% y asociado a estatinas logra una reducción adicional del 19-24%24,25. El estudio IMPROVE-IT25, hecho en pacientes de prevención secundaria, demostró que la simvastatina asociada a ezetimibe alcanzó un cLDL de 53mg/dl mientras que la simvastatina como monoterapia, logró reducirlo en 69mg/dl; esta diferencia, dio como resultado una reducción pequeña pero significativa en ECV del 7%. El hallazgo apoya el criterio de cifras de cLDL menores de 70mg/dl para reducir dichos eventos en personas de alto riesgo (cercano a 50mg/dl) y posiciona al ezetimibe como el primer hipolipemiante no-estatina en demostrar tal beneficio. Combinado con altas dosis de las estatinas más efectivas, es una alternativa para el logro de una mayor reducción en el cLDL o en pacientes que no toleraran altas dosis de estatinas.
El cLDL, los eventos cardiovasculares y los inhibidores de la PCSK9En los últimos años, dentro del armamentario de los hipolipemiantes aparecen los i PCSK9, moléculas que corresponden al grupo de los anticuerpos monoclonales (ACsM). De forma resumida, a nivel hepático, la PCSK9 se adhiere a los receptores de la LDL (RLDL) y los lleva a su degradación. Los i PCSK9 se unen a la PCSK9 sérica y evitan la degradación en mención, lográndose más RLDL disponibles, que captarán más cLDL y así disminuirán los niveles plasmáticos de cLDL26–28. Los dos ACsM aprobados por las agencias internacionales de salud (FDA y EMA, entre otras, y colombiana -INVIMA), son el evolocumab y el alirocumab, ambos para uso subcutáneo quincenal (dosis aprobada en Colombia) o mensual.
El estudio FOURIER (Further cardiovascular OUtcomes Research with PCSK9 Inhibition in subjects with Elevated Risk), es el primero en dar a conocer la eficacia del evolocumab en puntos duros30. Ingresaron al estudio 27.500 personas con antecedente de infarto miocárdico, ataque cerebrovascular isquémico (ACV) y enfermedad arterial periférica, quienes a pesar del tratamiento con estatinas/ezetimibe persistían con cLDL mayor de 70mg/dl. Se analizó la respuesta cardiovascular de evolocumab versus placebo de evolocumab, y la continuación con el tratamiento hipolipemiante inicial para ambos brazos. El grupo con evolocumab logró una reducción del cLDL respecto al basal del 59% (de una mediana de 92mg/dl a una mediana de 30mg/dl). La reducción del riesgo relativo (RRR) del punto final primario (muerte cardiovascular, infarto de miocardio, ACV, hospitalización por angina inestable y revascularización miocárdica) fue significativa en 15%, con una significativa RRR de infarto de miocardio en 27%, ACV en 25% y RVM en 22%. Es importante anotar que la población del FOURIER tenía un alto porcentaje de personas con hipertensión, diabetes y tabaquismo. Se esperan los desenlaces del estudio ODYSSEY OUTCOMES, que analizará al alirocumab en 18.000 pacientes, también de alto riesgo (posterior a síndrome coronario agudo)31.
La seguridad en relación con eventos adversos serios, es para evolocumab a 2.2 años con los estudios FOURIER30, OSLER-1 a 4 años de seguimiento32 y EBBINGHAUS a 2.2 años el cual no reportó compromiso neurocognitivo33; los estudios de seguridad con alirocumab son similares34. De otra parte, los valores muy bajos en el cLDL no se asocian con eventos adversos como se observa con evolocumab30 y alirocumab35. De manera similar, este último reduce el cLDL en 60%34.
A partir de los estudios realizados con evolocumab y alirocumab se puede deducir que:
- 1.
Son una opción para pacientes de alto riesgo que no llegan a metas en el cLDL a pesar de dosis altas de estatinas de alta intensidad, asociadas a ezetimibe, estrictos cambios en el estilo de vida (CEV) y adherencia estricta con lo mencionado.
- 2.
En muy alto riesgo, la reducción de ECV se logra con niveles bastante inferiores a los 70mg/dl que habitualmente se recomiendan.
- 3.
La seguridad con los i PCSK9, al menos a 4 años, es alta.
- 4.
Los niveles muy bajos de cLDL igualmente son seguros para el paciente.
Los estudios de regresión de la placa aterosclerótica, mediante ultrasonido intravascular (IVUS)36–39, demuestran que la regresión se logra con el uso de estatinas36–38 o estatina asociada a ezetimibe39, toda vez que el cLDL esté por debajo de 60mg/dl; respuesta similar arroja el estudio GLAGOV con evolocumab40. De otra parte, la regresión de la placa impacta sobre los ECV, de acuerdo con un subanálisis del estudio SATURN41, hallazgos que apoyan el concepto de metas en el cLDL menores de 70mg/dl.
Posición de las guías con la incorporación de los i PCSK9Las guías recientemente publicadas sobre dislipidemia consideran a los i PCSK9 como una alternativa a considerar en determinada población8–11. Específicamente, se han publicado cuatro documentos que analizan y consideran el uso de los i PCSK911,42–44.
Respecto al uso de los i PCSK9, el ACC11 propone dos grupos: 1) EACV con comorbilidades [DM, síndrome coronario agudo (SCA) menor de tres meses, HF, evento coronario recidivante mientras se toma una estatina, factor de riesgo mal controlado, Lp(a) mayor de 50mg/dl y ERC] y 2) EACV sin las comorbilidades mencionadas.
Para el primer grupo proponen una meta en el cDL menor de 70mg/dl y en el segundo grupo menor de 100mg/dl. Si no se logran estas metas con altas dosis de estatinas de alta intensidad, ezetimibe, CEV, SAB y supervisión de la adherencia, consideran la asociación de los i PCSK9.
La Sociedad Europea de Cardiología/Sociedad Europea de Aterosclerosis, presentan cuatro grupos42: 1) muy alto riesgo (EACV, DM con daño de órgano blanco u otro factor de riesgo asociado, rápida progresión de la EACV), 2) HFHe, 3) Hipercolesterolemia familiar homocigota (HFHo) y 4) Intolerantes a las estatinas que correspondan a los tres grupos antes mencionados. En los casos en que el cLDL persista mayor de 140mg/dl a pesar de las medidas mencionadas (exceptuando SAB), o de 100mg/dl para los casos de EACV de rápida progresión, consideran iniciar i PCSK9. En HF si no llegan a metas menores de 175mg/dl, proponen los i PCSK942.
La Sociedad Canadiense de Cardiología43, revisa los estudios con i PCSK9 y plantea sus indicaciones, que son similares a las otras propuestas.
Las recomendaciones más recientes sobre el uso de los i PCSK9, corresponden a la Asociación Nacional de Lípidos (NLA) de Estados Unidos44, que tiene la particularidad de considerar los resultados del estudio FOURIER30. La NLA contempla tres grupos para utilizar i PCSK9: 1) EACV, 2) HF, 3) intolerantes a las estatinas, y propone metas en el cLDL de manera similar a las otras propuestas, con asociación de i PCSK9 si no se llega a las metas.
Cuanto más temprano y prolongado el tratamiento, mejorA excepción de los pacientes con HF45, reducir eventos cardiovasculares con la administración de hipolipemiantes desde temprana edad, no es claro; sin embargo, un cLDL bajo de forma natural, por polimorfismo o mutaciones, impacta en la disminución de ECV, comparado con el grupo control sin mutaciones y con cLDL más altos46. Se acepta que los bajos niveles plasmáticos de cLDL desde temprana edad, disminuyen la carga aterogénica durante toda la vida46. De otra parte, la reducción de eventos será mayor con el transcurso del tiempo, por su efecto acumulativo (no solo a 5 años, sino a 40 años) y dependerá del riesgo del individuo al inicio de la terapia, al nivel basal del cLDL al iniciar el hipolipemiante, la magnitud en la reducción del cLDL y la duración sin interrupción del tratamiento47.
Propuesta para metas en el cLDL según el riesgo cardiovascularParcialmente, con base en la guía colombiana sobre dislipidemia6, la revisión colombiana sobre HF45, el resultado del IMPROVE-IT21, estudios de regresión de placa36–40, resultados del experimento clínico con i PCSK930, las propuestas que consideran metas bajas en el cLDL9–12, las recomendaciones que hacen las diferentes sociedades científicas sobre el uso de los i PCSK911,42–44 y la deducción de metas en HF basadas en el registro SAFEHEART48, se hace una propuesta para las metas en el cLDL de acuerdo con el riesgo cardiovascular, la cual requiere ser sometida a consenso (tabla 1).
Categorías de riesgo cardiovascular y metas en el cLDL (mg/dl)
| Categoría de riesgo cardiovascular | Meta cLDL |
|---|---|
| Riesgo muy alto (“riesgo extremo”) | <50 |
| - EACV (IM, SCA, RVM, EAP, EAC, AA, ACV isquémico) asociada a comorbilidades: DM, HF, evento coronario recidivante a pesar de altas dosis de estatinas efectivas y cLDL<70 mg/dl | |
| Riesgo alto | <70 |
| - EACV no complicada, es decir, sin las comorbilidades anteriores | |
| - HFHe asociada a DM o a varios factores de riesgo (HTA, obesidad, | |
| tabaquismo)45,48 | |
| - HFHo45 | |
| - DM en mayores de 40 años más otro factor de riesgo y cLDL>de | |
| 70 mg/dl6 | |
| - Prevención primaria con cálculo de riesgo a 10 años>del 10% utilizando las tablas de Framingham, modificadas para Colombia6 | |
| Riesgo moderado | <100 |
| - HFHe sin EACV, ni DM ni otro factor de riesgo45,48 | |
| - ERC con eTFG menor de 60 ml/min/1,73 m2 (no diálisis) | |
| - cLDL mayor de 160 mg/dl, persistente a pesar de CEV | |
| - SM u obesidad más un factor de riesgo cardiovascular mayor | |
| - Historia familiar de enfermedad coronaria prematura | |
| - Lupus o artritis reumatoide | |
| - Factor de riesgo no controlado (tabaquismo, hipertensión arterial) | |
| - DM en menores de 40 años, sin otro factor de riesgo o daño de | |
| órgano blanco | |
| Riesgo bajo | <130 |
| - Personas que no reúnan las condiciones anteriores |
EACV: enfermedad aterosclerótica cardiovascular. IM: infarto de miocardio. SCA: síndrome coronario agudo. RVM: revascularización miocárdica. EAP: enfermedad arterial periférica. EAC: enfermedad arterial carotídea. AA: aneurisma aórtico. ACV: ataque cerebrovascular. DM: diabetes mellitus, HF: hipercolesterolemia familiar. HFHe: hipercolesterolemia familiar heterocigota. HFHo: hipercolesterolemia familiar homocigota. ERC: enfermedad renal crónica. CEV: cambios en el estilo de vida.
Para la consecución de las metas mencionadas en la tabla 1, inicialmente se deben reunir las siguientes condiciones:
- a)
Utilizar las dosis más altas de las estatinas más efectivas (atorvastatina o rosuvastatina).
- b)
Si no se llega a metas, asociar ezetimibe 10mg/día (existen asociaciones fijas de estos dos hipolipemiantes).
- c)
Hacer cambios estrictos en cuanto a estilo de vida.
- d)
Asegurarse de que haya adherencia a las anteriores recomendaciones.
Si con lo anterior no se logran las metas, se considera la prescripción de los i PCSK9, previa verificación de la existencia de evidencia clínica para usarlos, el grupo de riesgo cardiovascular al que pertenecen los pacientes, el criterio médico, las condiciones clínicas, la expectativa de vida del individuo, el costo-beneficio de la terapia y las preferencias del paciente (tabla 2).
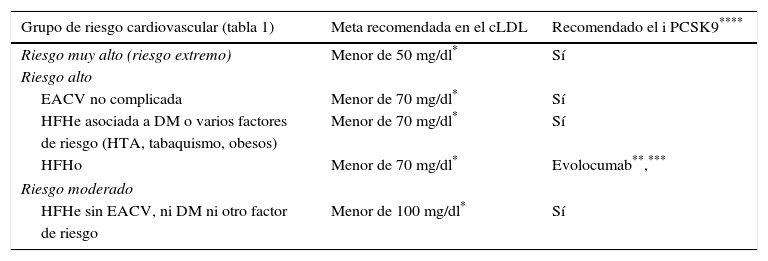
Indicaciones actuales de los i PCSK9 para lograr metas en cLDL, según el riesgo cardiovascular
| Grupo de riesgo cardiovascular (tabla 1) | Meta recomendada en el cLDL | Recomendado el i PCSK9**** |
|---|---|---|
| Riesgo muy alto (riesgo extremo) | Menor de 50 mg/dl* | Sí |
| Riesgo alto | ||
| EACV no complicada | Menor de 70 mg/dl* | Sí |
| HFHe asociada a DM o varios factores | Menor de 70 mg/dl* | Sí |
| de riesgo (HTA, tabaquismo, obesos) | ||
| HFHo | Menor de 70 mg/dl* | Evolocumab**,*** |
| Riesgo moderado | ||
| HFHe sin EACV, ni DM ni otro factor | Menor de 100 mg/dl* | Sí |
| de riesgo | ||
Los resultados favorables de los experimentos clínicos recientes, la evidencia en la reducción de ECV con i PCSK9, lo estricto respecto a metas bajas en el cLDL y las últimas recomendaciones para la prescripción de i PCSK9, hacen razonable que se considere actualizar el tratamiento de la hipercolesterolemia para Colombia. A la fecha, las metas en el cLDL en personas de alto riesgo son más bajas que lo propuesto en años anteriores y para su logro, además de las altas dosis de estatinas de alta efectividad, el ezetimibe y los CEV, aparece la opción de los ACsM (i PCSK9, hipolipemiante que se utiliza en una población determinada). La evidencia es suficiente para enfatizar en el axioma, “cuanto más bajo el cLDL mejor”, sin olvidar el otro axioma, y “cuanto más temprano y más prolongado el tratamiento, mejor”. De otra parte, los estudios recientes mencionados confirman aún más la importancia del colesterol como factor de riesgo para enfermedad cardiovascular y reafirman el concepto que cuanto más bajo tenga un individuo el colesterol, menor probabilidad de eventos cardiovasculares.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.