El síndrome de Brugada (SB) es una enfermedad arritmogénica caracterizada por un patrón electrocardiográfico en el que hay una elevación del segmento ST en las derivaciones V1 a V3, y un patrón de bloqueo de la rama derecha. Es una patología poco frecuente en nuestro medio, con mayor prevalencia en países como: el Japón y en el suroeste de Asia. Su etiología es multifactorial y aún es tema de debate. Los diagnósticos diferenciales abarcan: el síndrome coronario agudo, el bloqueo de rama derecha y la pericarditis. A continuación se describe el caso con un patrón electrocardiográfico típico que se manifiesta con síncope y fibrilación auricular.
Brugada syndrome (BS) is an arrhythmogenic condition characterised by an electrocardiographic pattern where there is an elevation of the ST segment in leads V1 to V3, and a right bundle branch block. It is an uncommon condition in our environment, being more prevalent in other areas such as Japan and southwest Asia. Its aetiology is multifactorial and is still under discussion. Differential diagnoses cover acute coronary syndrome, right bundle branch block and pericarditis. We describe a case with a typical electrocardiographic pattern manifesting with syncope and atrial fibrillation.
En el año 1992, Pedro y Josep Brugada1, describieron un patrón electrocardiográfico en un grupo de 8 pacientes que presentaban episodios de muerte súbita debida a arritmias ventriculares malignas sin enfermedad estructural cardiaca aparente. El electrocardiograma (EKG) basal mostraba una elevación del segmento ST en las derivaciones V1–V3 asociado a patrón de bloqueo de la rama derecha, los cuales eran susceptibles de arritmias ventriculares y muerte súbita. A pesar de ser una entidad poco frecuente se describen unas prevalencias del 0.04% en Europa, el 0.5% en países como el Japón y hasta el 1% en el suroeste de Asia. En la actualidad se han logrado identificar mutaciones implicadas en la aparición de su fenotipo característico y las determinantes en el pronóstico a largo plazo2.
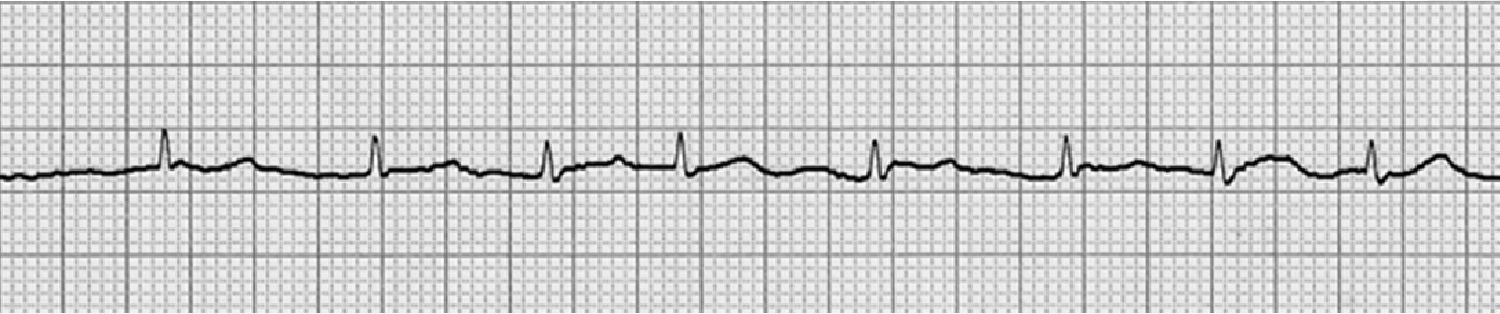
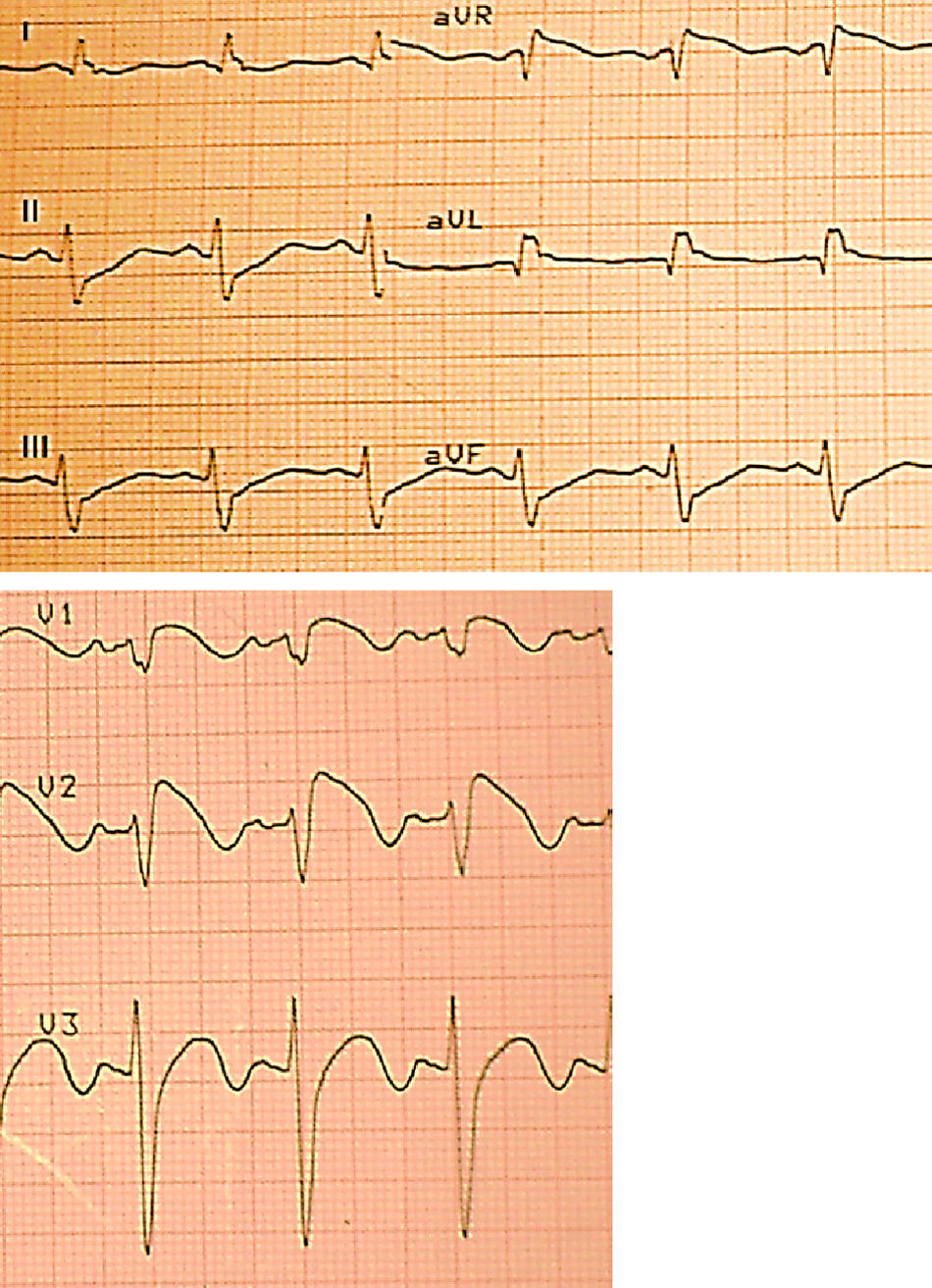
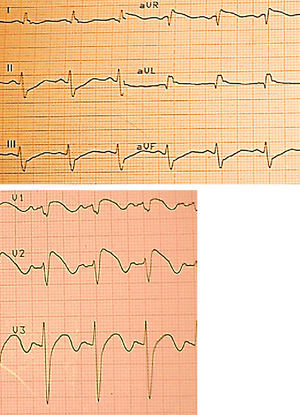
Caso clínicoPaciente masculino de 50 años de edad, afrodescendiente y procedente del área rural, sin antecedentes personales o familiares relevantes ni muerte súbita en familiares, quien mientras conducía un tractor presenta dolor torácico opresivo no irradiado, de intensidad 5/10 de 10 segundos de duración aproximadamente, asociado a diaforesis, con posterior síncope y relajación de esfínter vesical. Por percepción de palpitaciones decide acudir al servicio de urgencias de una clínica de nivel II, donde se documenta taquicardia de complejos estrechos y RR variable a una frecuencia de 150 latidos por minuto (lpm), compatible con fibrilación auricular (trazado de monitor en imagen No. 1), recibe amiodarona 150mg endovenosos (EV) en 10 minutos, seguido de infusión a dosis de 1mg/kg/min con lo cual se disminuye progresivamente la frecuencia cardiaca hasta 90 lpm y retorna a ritmo sinusal. Ingresa a un centro hospitalario de nivel III donde se documenta tensión arterial de 90/60, frecuencia cardiaca de 96 lpm con extrasístoles ocasionales transmitidas al pulso. Sin hallazgos clínicos relevantes de disfunción ventricular o crépitos. El EKG (trazado No. 2) muestra: ritmo sinusal, FC 95 lpm, PR normal, QRS de 115ms y trastorno inespecífico de conducción intraventricular, QTc 590ms y patrón de Brugada tipo I caracterizado por elevación del ST de 0.4mV principalmente en V2 con T negativa. Mostrando una prolongación llamativa del QT corregido, hallazgo que se ha identificado como factor de pronóstico en estos pacientes (fig. 1).
Por la presencia de troponina positiva, se consideró infarto de miocardio posiblemente tipo 2 (clasificación de Thygessen), siendo, inicialmente, manejado con antiagregación y anticoagulación, posteriormente se realiza una arteriografía coronaria con documentación de las coronarias epicárdicas sin lesiones angiográficas significativas. El ecocardiograma transtorácico mostró una fracción de eyección preservada (FE 64%) por el método de Simpson modificado, sin trastornos de contractilidad, hipertrofia ventricular izquierda (espesor relativo de la pared de 0.47, índice de masa 118g/m2), disfunción diastólica por trastorno de relajación, aurícula izquierda con moderado crecimiento y cavidades derechas normales.
Basado en el EKG que mostraba el patrón característico de Brigada con elevación del segmento ST en las derivaciones V1–V3 se establecen diagnósticos diferenciales como: bloqueo de la rama derecha atípico, infarto agudo de miocardio, pericarditis/miopericarditis aguda, derrame pericárdico. No obstante, la presencia de síncope cardiogénico, fibrilación auricular en la presentación inicial y patrón electrocardiográfico tipo I de Brugada, lleva al diagnóstico más probable de síndrome de Brugada. La elevación de las troponinas se consideró secundaria al evento arrítmico (coronarias sin lesiones y ECO normal) (fig. 2).
Independientemente de la indicación de implante de desfibrilador (CDI), fue llevado a un estudio electrofisiológico (EEF) con prueba con isoproterenol en función de valorar: la función sinusal, la conducción atrioventricular, encontrar la localización y mecanismo de la arritmia, sin olvidar que el test positivo aumenta 8 veces el riesgo de la aparición de nuevos eventos. El resultado de este no logró desencadenar arritmias ni cambios en el patrón de Brugada (tipo I). Es implantado un CDI, dejando manejo farmacológico con quinidina a dosis de 600mg vía oral (VO) al día y posterior aumento a 900mg al día, dosis que ha tolerado el paciente sin nuevos episodios sincopales ni descargas, al menos en los primeros 6 meses de tratamiento.
DiscusiónEl SB descrito por primera vez en el año 1992, se caracteriza por un patrón electrocardiográfico particular en las precordiales derechas y la predisposición genética a presentar arritmias ventriculares y muerte súbita. Es un síndrome poco frecuente y está incluido entre: las canalopatías, y trastornos eléctricos primarios que característicamente no tienen una cardiopatía estructural concomitante1,2. Algunas estadísticas indican que el SB es causa de hasta el 20% de las muertes súbitas con corazón estructuralmente sano3, con una prevalencia de 5/10.000 habitantes en países occidentales, y de hasta 1/2.500 habitantes en países orientales, siendo más frecuente en los hombres de 30 a 40 años de edad4,5.
En Colombia existen dos reportes de casos publicados sobre SB: Jaramillo C. et al., describen el caso de un paciente con síncope cardiogénico desde la infancia en el que se encuentra: el patrón electrocardiográfico de Brugada tipo II y el síncope neuromediado asociado5. Otra publicación por Contreras E. et al., donde describen a un paciente de 43 años de edad, con antecedente familiar de muerte súbita a los 23 años de edad, el EKG con patrón de Brugada tipo I y una prueba de estimulación que indujo fibrilación ventricular motivo por el cual se le realizó implante de cardiodesfibrilador6.
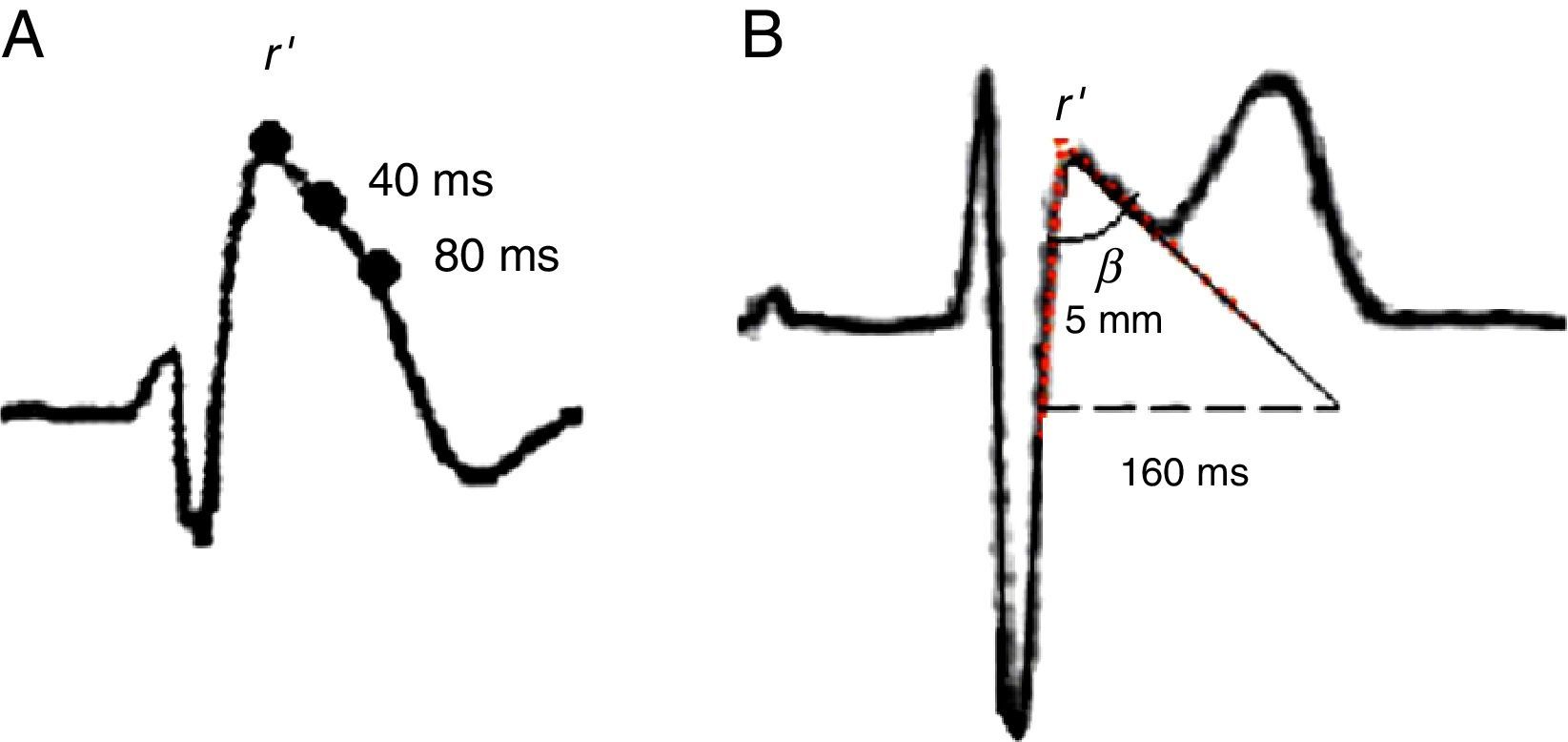
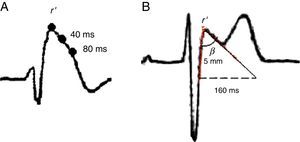
Se describen dos patrones electrocardiográficos distintos: a) El patrón tipo I, caracterizado por una elevación con pendiente descendente del segmento ST ≥ 2mm en más de una derivación precordial derecha (V1-V3), seguida de ondas T negativas en precordiales derechas; b) El patrón tipo II, caracterizado por r¿ ≥ 2 mm que usualmente no coincide con el punto j, elevación del segmento ST ≥ 0.5mm seguido de onda T positiva picuda en V2 y morfología variable en V1, las características del triángulo formado por la r’ permiten definir diferentes criterios para el diagnóstico: angulo β mayor a 36.8° (sensibilidad del 79% y especificidad del 84%), duración de la base del triángulo a 5mm de la onda r ≥ 160ms (4mm), este último con una sensibilidad que alcanza el 81% y una especificidad del 82% (fig. 3)3. Por último en la publicación de Serra et al., describen la duración de la base del triángulo a nivel de la línea isoeléctrica ≥ 60ms (1.5mm) con una sensibilidad del 94% y una especificidad del 78%. Estos tres últimos criterios permiten diferenciar las r’ en pacientes atletas sanos de pacientes con SB7,8.
Aunque se describe que pueden coexistir los dos patrones en un mismo paciente, el patrón tipo I hace el diagnóstico. El patrón electrocardiográfico, sin embargo, puede aparecer de forma intermitente y ser observado en situaciones como: fiebre, intoxicaciones y estimulación vagal, y ser inducido por medicamentos bloqueadores de los canales de sodio. Además, el patrón electrocardiográfico puede surgir en desórdenes metabólicos, electrofulguración e isquemia, el cual tiende a desaparecer posteriormente a la resolución de la injuria, a esto se le ha denominado fenocopia de Brugada3.
Como hallazgo importante con este paciente quien concomitantemente presenta prolongación del intervalo QTc, debe mencionarse que este descubrimiento se ha relacionado con el SB y fue descrito inicialmente por Pitzalis et al.4, en las precordiales derechas pero no en las izquierdas, la cual se presentaba especialmente, tras la administración de bloqueadores de sodio. No obstante, más adelante se pudo identificar que el intervalo QTc ≥ 460ms en la derivación V2 se correlacionaba con un peor pronóstico en estos pacientes5.
Estas dos manifestaciones (QTc largo y SB) que pueden coincidir, se relacionan con la mutación del gen SCN5A que puede estar presente en ambas enfermedades, lo que genera una alteración en el canal de sodio llevando a que se puedan presentar síndromes de sobreposición que ocasionan cambios electrocardiográficos como los descritos en este caso9,10.
El patrón electrocardiográfico tipo I asociado a un cuadro sincopal en un paciente joven con positivización de las troponinas, de entrada debe hacer pensar como primera medida en una patología cardiaca de etiología isquémica, la cual se estudió con el cateterismo cardiaco.
A. El típico patrón en V1 y V2 se produce una rápida pendiente ascendente ≥ 2mm al final del QRS seguido por una caída cóncava o rectilínea del ST, en el cual el punto más alto es mayor que el que se encuentra a 40ms y este a su vez es mayor que el encontrado a 80ms. B. El típico patrón en silla de montar se caracteriza por r¿ ≥ 2mm en V1 y V2, la rama descendente de r’ coincide con el inicio del ST, el ángulo beta se mide a partir del triángulo formado por la r; desde el inicio del punto más alto de la r¿ y se miden 5mm sobre la rama de la onda s, donde se traza una perpendicular para formar el triángulo, punto desde donde se mide la base de este, la cual debe ser mayor a 160ms.
En el presente caso, basado en el patrón electrocardiográfico característico y la presencia del síncope, se pudo hacer el diagnóstico de SB el cual es avalado por el European Heart Rhythm Association (EHRA), en el año 2013 donde se afirma la sensibilidad que tiene el criterio electrocardiográfico para el diagnóstico, a pesar de no haber logrado inducir arritmias cardiacas en el estudio electrofisiológico (EEF) 1,9. No obstante, debe tenerse en cuenta que a pesar de que la inducibilidad de arritmias en el EEF es mayor en los pacientes con muerte súbita o síncope, en contraste con los resultados del estudio de Brugada et al., la realización de este EEF, tiene un papel controvertido como marcador pronóstico en SB2.
El diagnóstico definitivo solo debe establecerse cuando el patrón EKG tipo I se documenta en presencia o ausencia de fármaco bloqueante de sodio junto a uno de los siguientes criterios clínicos11:
- •
Fibrilación ventricular (FV) documentada, taquicardia ventricular (TV) polimórfica documentada.
- •
Inducibilidad de arritmias ventriculares durante el EEF.
- •
Síncope.
- •
Respiración agónica nocturna.
- •
Historia familiar de MS en edad previa a los 45 años.
- •
Patrón EKG tipo I en familiares de primer grado.
Adicionalmente, la asociación de SB con la presencia de episodios de fibrilación auricular (FA), que es lo más característico de este caso, se describe tan solo en el 20% de los casos y confiere un pronóstico ominoso debido a un gran aumento en el riesgo de muerte súbita, pues se ha descrito la relación de FA y fragmentación de los complejos QRS con un mayor riesgo de fibrilación ventricular (FV) espontánea12. Se cree que el aumento de la vulnerabilidad del atrio para desencadenar arritmias en el SB puede ser secundario a un aumento concomitante en la dispersión de la repolarización y la refractariedad, al igual que como ocurre en el miocardio ventricular13. En un estudio realizado por Rodríguez Madroñero M. et al., donde se evaluó la presencia de fibrilación auricular en pacientes previamente diagnosticados de SB, se obtuvo que 35 de 611 pacientes evaluados, presentaban fibrilación auricular documentada. Esto muestra que probablemente los miocitos atriales puedan ser sustrato de taquiarritmias por reentrada y una alta vulnerabilidad para el desarrollo de estas14.
Se han estudiado marcadores de pronósticos para el desarrollo de la fibrilación ventricular dentro de los cuales se incluyen como se mencionó, episodios de FA paroxística, historia familiar de muerte súbita, síncope sin prodromos y patrón electrocardiográfico de SB tipo I, entre otros13.
Por otra parte, los pacientes que tienen SB y requieren implante de cardiodesfibrilador por el alto riego de muerte súbita, tienen alta incidencia de arritmias atriales, lo cual sugiere que estas podrían ser consideradas como un indicador de enfermedad más severa15.
La decisión de implante de cardiodesfibrilador está basada en las recomendaciones del European Heart Rhythm Association (EHRA), en el año 2013, donde se sugiere su implante en sobrevivientes a una parada cardiaca y/o aquellos que hayan tenido una taquicardia ventricular sostenida documentada con o sin síncope (recomendación I nivel de evidencia A) y en pacientes con patrón electrocardiográfico tipo I con diagnóstico espontáneo que tienen una historia de síncope o que probablemente ha sido causado por arritmias ventriculares9.
No obstante, el implante de CDI en pacientes con SB y arritmias, trae consigo un aumento en el riesgo de las descargas inapropiadas descritas en un 20 a 36%, siendo las taquicardias sinusales y las arritmias supraventriculares las causas más frecuentes 16. En estudios como el de Park E. et al., las descargas inapropiadas superaron las apropiadas siendo el 14% vs. el 10.5%, respectivamente, de igual foma Kharazy et al., reportan que el 41% presentaron descargas inapropiadas y el 17% apropiadas, siendo el 40% pacientes con FA12.
ConclusionesEl sustrato arritmogénico del SB favorece la generación de arritmias atriales y ventriculares, aunque no es muy frecuente la presencia de fibrilación auricular, como manifestación inicial le imprime un riesgo adicional de arritmias fatales que debe tenerse en cuenta a la hora de enfocar estos pacientes. Adicionalmente, debe considerarse que el estudio electrofisiológico tiene un papel discutido en la inducción de arritmias, la sola presencia de síncope no explicado y patrón de SB tipo I, hace que la intervención con prevención primaria mediante el implante de CDI.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.