El Síndrome de apnea - hipopnea obstructiva del sueño es una enfermedad con compromiso multisistémico, con especial repercusión en el sistema cardiovascular y por tanto con alto impacto en la morbimortalidad general. Se han demostrado múltiples mecanismos fisiopatológicos que explican y sugieren una asociación directa y proporcional al daño generado por esta entidad, en especial para las taquiarritmias, específicamente para fibrilación auricular y también para las bradiarrimias, con mejoría demostrada tras el tratamiento con presión positiva continua de la vía aérea.
La asociación con aleteo auricular y arritmias ventriculares ha mostrado resultados contradictorios en algunos estudios, por lo que aún no es tan clara.
Obstructive sleep apnoea / hypopnoea syndrome is a disease of multisystemic involvement, with particular repercussions on the cardiovascular system, and thus a high impact on morbidity and mortality. Several pathophysiological mechanisms have been demonstrated that explain and suggest a direct and proportional relationship to the damaged caused by the condition, especially for tachyarrhythmias, specifically for atrial fibrillation, and also for bradyarrhythmias, with a demonstrated improvement with continuous positive airway pressure.
As the association with atrial flutter and ventricular arrhythmias has shown contradictory results in some studies, the relationship is still not clear.
El síndrome de apnea-hipopnea obstructiva del sueño (SAHOS) es un trastorno caracterizado por episodios de apnea e hipopnea que ocurren durante el sueño y de acuerdo con el grado de compromiso se producen una serie de síntomas y alteraciones funcionales en diferentes sistemas, entre ellos, el cardiovascular. Las hipopneas se definen como una reducción del flujo de aire entre el 30 al 90%, con disminución de al menos 3% en la saturación de oxígeno. Las apneas son la reducción del flujo de aire a menos del 10% del nivel basal, por lo menos por diez segundos1.
Las apneas e hipopneas son producto de la oclusión de la vía aérea, favorecida por alteración anatómica de la vía aérea superior o por pérdida del tono de los músculos faríngeos, hecho que genera desaturación, esfuerzos respiratorios persistentes contra la vía aérea ocluida y fragmentación del sueño por microdespertares múltiples. Como factores de riesgo para SAHOS se reconocen: edad mayor de 65 años, obesidad, sexo masculino y circunferencia del cuello aumentada2–5. Como comorbilidades frecuentes se han descrito falla cardíaca, diabetes mellitus, cardiopatía isquémica, enfermedad cerebrovascular e hipertensión arterial (HTA)6.
El diagnóstico y la aproximación a la gravedad de la enfermedad se hace mediante el polisomnograma (PSG), de acuerdo con el índice de apnea hipopnea (IAH), que se obtiene dividiendo los episodios de apnea-hipopnea entre el tiempo total de sueño; así, se clasifica como normal un IAH entre 0 y 5, leve de 5 a 15, moderado 16 a 30 y grave> 301.
El SAHOS es una entidad que viene cobrando cada día más importancia, con una prevalencia estimada del 5 al 15% en la población general2,3; se estima que afecta de 10 a 15 millones de personas en el mundo, permaneciendo aún sin diagnóstico cerca del 24% de hombres y 9% de mujeres entre los 30 y 60 años7,8. En Estados Unidos se estima que 12 millones de personas entre los 30-60 años y 7.5 millones mayores de 65 años sufren de esta enfermedad. Cada año 38.000 individuos mueren por enfermedades cardiovasculares generadas por trastornos del sueño, cifra que evidencia el impacto que estas enfermedades tienen en la salud pública4.
Diferentes estudios en los últimos años han demostrado la naturaleza y el compromiso multisistémico del SAHOS, su relación con varias entidades médicas y el incremento en la morbimortalidad cardiovascular asociada a arritmias, falla cardíaca, HTA, enfermedad coronaria y enfermedad cerebrovascular, como se demostró en la revisión sistemática de la literatura realizada por Loke et al.9
Esta enfermedad se asocia con alteraciones en el sistema de conducción cardíaco y por tanto, con diferentes tipos de arritmias, como lo muestran múltiples investigaciones10,11. Desde 1983, Guilleminault et al. demostraron mayor prevalencia de arritmias en pacientes con SAHOS, cifra que llegó hasta 48% en el grupo catalogado como más grave12. Esta relación directamente proporcional entre la gravedad del SAHOS y la frecuencia de arritmias ha sido reforzada por varios estudios posteriores13–15.
La piedra angular para el manejo del SAHOS ha sido la intervención con presión positiva continua en la vía aérea o CPAP, que ha mostrado disminuir la prevalencia y recurrencia de arritmias, y constituye una prueba más de la relación causa-efecto entre el SAHOS y las arritmias cardíacas16.
MétodoSe realizó una búsqueda de la literatura en las bases de datos Cochrane, PubMed, Embase y LILIACS, utilizando los términos MeSH: “arritmia” o “arrythmia” o “atrial fibrillation” o “arrhythmias” enlazados con: “síndrome de apnea hipopnea obstructiva del sueño” o “obstructive sleep apnea hypopnea syndrome” o “sleep apnea” o “OSAHS” o “SAHS” o “SAS” o “SAHOS” o “AHOS” o “OSA” o “OSAS”, así como los términos libres, para aumentar la sensibilidad de la búsqueda. Así mismo, esta abarcó desde 1983, fecha de la primera publicación12 sobre la asociación entre SAHOS y arritmias, hasta el 2017. Se incluyeron artículos generales, todos los diseños de estudios clínicos, cohortes y revisiones de la literatura, en idiomas inglés y español.
HistoriaEn 1983, Guilleminault et al., fueron los primeros en realizar un estudio observacional a gran escala que incluyó 400 pacientes y usó monitorización electrocardiográfica de 24 horas y polisomnografía; encontraron una prevalencia de arritmias en pacientes con SAHOS del 43%, que sobrepasaba la de la población general. Adicionalmente, se halló mayor prevalencia de fibrilación auricular: 3% en SAHOS vs. 0,4 - 1% en la población general; 10% de paro auricular, 7% de bloqueo aurículoventricular (BAV) de segundo grado y 20% de extrasistolia ventricular12.
Posteriormente, un estudio publicado en 2005, derivado de la cohorte del Sleep Heart Health Study (SHHS), uno de los estudios más representativos del SAHOS en el mundo, con 3.295 pacientes, mostró de nuevo mayor frecuencia de arritmias cardíacas en la población con trastornos respiratorios relacionados con el sueño; se halló, además, un riesgo elevado para desarrollo de fibrilación auricular, con riesgo relativo indirecto (OR) de 4,02 (IC95% 1,03 – 15,74), OR de 3,4 para taquicardia ventricular no sostenida (TVNS) (IC95% 1,03–11,20) y casi el doble de riesgo para extrasistolia ventricular compleja en pacientes con SAHOS. Así, el riesgo de presentar una arritmia compleja fue dos a cuatro veces mayor en pacientes con SAHOS, en comparación con controles sanos y esta asociación se mantuvo después del ajuste de factores de confusión13. Otro estudio llevado a cabo en Brasil en el que se hizo PSG y monitorización de electrocardiograma a 767 voluntarios (61% hombres), encontró que el 62,7% presentó algún tipo de arritmia nocturna, cifra que fue mayor en aquellos con SAHOS grave (92%), comparado con los que no padecían la enfermedad (53,3%). Estas proporciones se mantuvieron incluso después de controlar factores de confusión como edad, sexo, peso y tabaquismo14. Recientemente, otros estudios realizados también en contexto clínico, indican que aquellos pacientes con trastornos respiratorios del sueño muestran un OR=2,94 (IC 95%, 2,01–4,30) de tener cualquier arritmia cardíaca, OR=2,01(IC 95% 1,36–2,96) para presentar cualquier taquiarritmia y OR=2,5 (IC 95%, 1,58–3,95) para cualquier alteración en la conducción intraventricular. Después de ajustar por variables de confusión, aquellos con trastorno del sueño moderado a grave tenían un OR de 2,2 (IC 95%,1,48–3,39) de presentar cualquier arritmia cardíaca nocturna15.
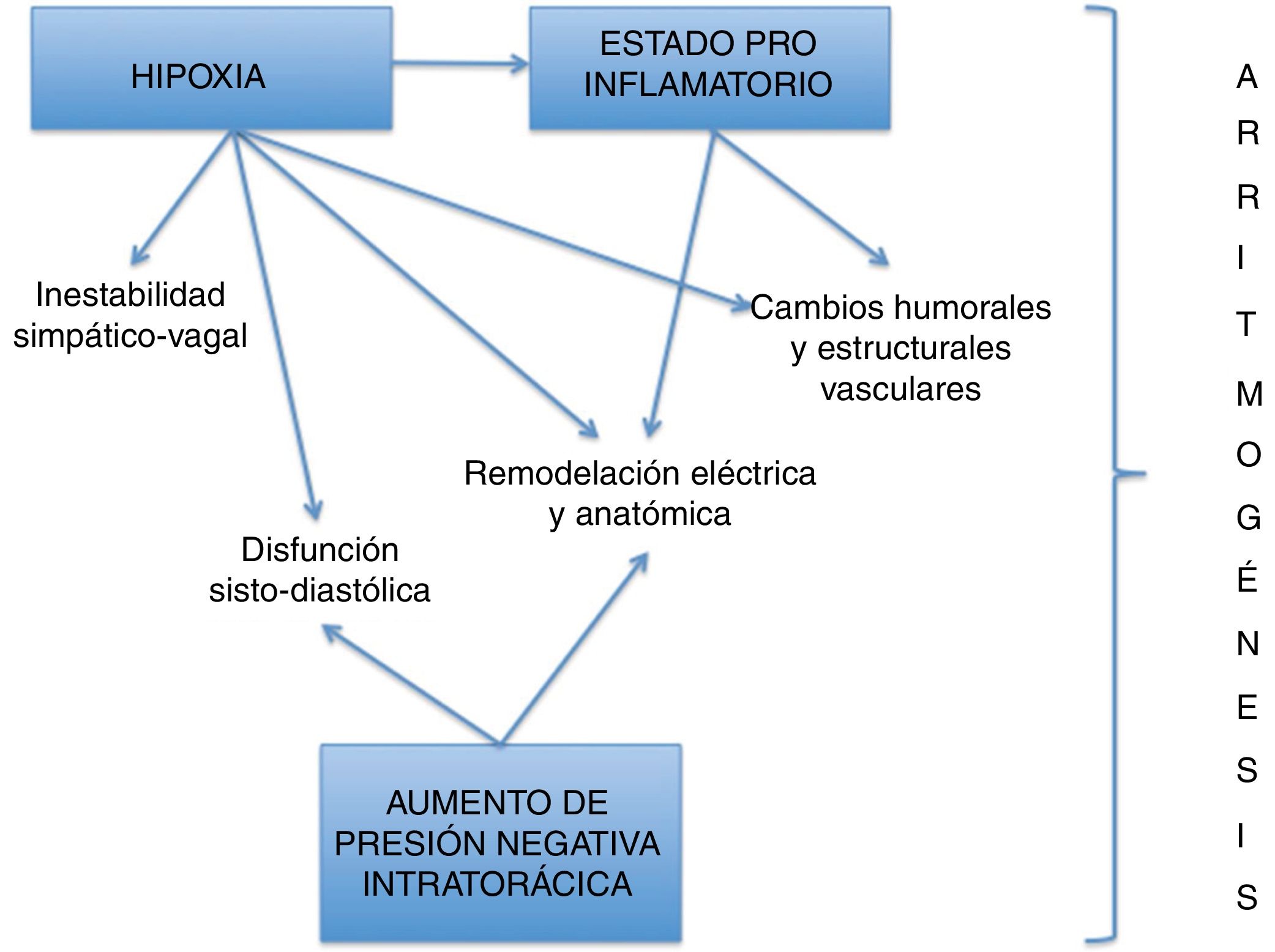
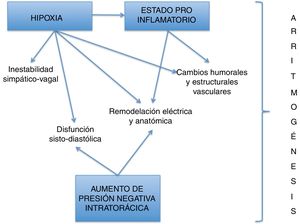
FisiopatologíaEn condiciones normales la respiración genera fluctuaciones sobre el sistema nervioso autónomo mediante diferentes mecanismos, como el aumento en la presión intratorácica, la actividad de los mecanorreceptores generada por el estiramiento de las aurículas, venas cavas y pulmonares; la activación de barorreceptores del seno carotídeo y el arco aórtico, y, así mismo en el caso del SAHOS, por esfuerzos inspiratorios contra la vía aérea ocluida y estimulación de los quimiorreceptores por hipoxia.
Estos mecanismos también son responsables tanto de las oscilaciones de la frecuencia cardíaca durante los periodos de apnea-hipopnea como de los cambios agudos hemodinámicos, humorales y estructurales4,17. Entre estos se describen incremento del 30 al 40% de la precarga y de la interdependencia ventricular y aumento de la poscarga, que se traducen en disfunción sisto-diastólica ventricular, hipertrofia ventricular izquierda (HVI), aún en ausencia de HTA, que a su vez se asocia con infartos multifocales y apoptosis de los miocitos que derivan en mayor disfunción ventricular y, finalmente, deterioro de la fracción de eyección del ventrículo izquierdo (FEVI).
Otros fenómenos consecuentes son el estiramiento repetitivo de la aurícula izquierda (AI), el aumento en los niveles de péptido natriurético auricular, la vasoconstricción con hipertensión pulmonar y sistémica, el desequilibrio en la homeostasia vascular, la disfunción endotelial y el aumento de oxidación de lipoproteínas de baja densidad con los consecuentes cambios estructurales vasculares10,17–21.
La hipoxia intermitente y la hipercapnia que acompañan al SAHOS, también generan aumento en la susceptibilidad miocárdica al estrés oxidativo, lo que conlleva alteración de los tiempos de conducción eléctrica y periodos refractarios17,22.
Así, en el paciente con SAHOS hay pérdida del balance autonómico; por un lado puede existir aumento del tono simpático y disminución del parasimpático especialmente al final de las apneas, lo que se refleja en aumento de la frecuencia cardiaca con disminución de su variabilidad (fenómeno directamente proporcional a la gravedad del SAHOS)10 y también en disminución de período refractario auricular, facilitando el desarrollo de fibrilación auricular por mecanismo de reentrada19. Otros escenarios, por el contrario, se caracterizan por predominio de una profunda actividad vagal que ocasiona bradiarrtimias, más pronunciadas en la fase REM del sueño6,10,19,23.
El SAHOS se ha identificado también como un estado proinflamatorio caracterizado por la activación de factores de transcripción que originan aumento de los niveles de interleucina 6, factor de necrosis tumoral, proteína C reactiva (PCR)7,10 y factor de crecimiento endotelial vascular, que repercuten sobre los canales iónicos y generan vías metabólicas causantes de disfunción endotelial y fibrosis. La remodelación eléctrica y anatómica de la aurícula opera como factor perpetuador de las arritmias (particularmente de la fibrilación auricular), ya que los tractos fibrosos actúan como obstáculos de conducción o fragmentadores de los frentes de onda de activación auricular, con la aparición de múltiples ondas activadoras18. La fibrosis también genera aumento en la duración y dispersión de la onda P, fenómeno de bloqueo interauricular, demostrado por una onda P> 120ms10,24 (fig. 1).
Se ha demostrado que el tratamiento con CPAP revierte la hipoxia y, en consecuencia, disminuye los niveles de catecolaminas y marcadores inflamatorios en orina16,25-27.
Arritmias asociadas con SAHOSFibrilación auricularEn diferentes estudios en pacientes con fibrilación auricular (FA) crónica se describe una frecuencia de SAHOS que varía entre el 32 y el 82% y, por otro lado, un riesgo 6,7 veces mayor de padecer FA paroxística en aquellos con SAHOS establecido5. Esto ha sido demostrado aun en ausencia de enfermedad cardiovascular asociada, con estudios que reportan una incidencia de FA de 1,38 por 1.000 personas/año en pacientes con trastornos respiratorios del sueño vs. 0,76 en los que no28. Así, se convierte en un factor de riesgo independiente para FA, riesgo que aumenta a medida que se incrementa su gravedad y ha sido evaluado tanto en el contexto ambulatorio como en pacientes posquirúrgicos de revascularización miocárdica29.
También se ha demostrado que el SAHOS es un factor pronóstico de progresión y recurrencia de FA tras cardioversión eléctrica. Un metaanálisis publicado en 2011, con 3.995 pacientes, evaluó la presencia de SAHOS como predictor de recurrencia de FA tras ablación (aislamiento de venas pulmonares) y concluyó que los pacientes con SAHOS tienen un 25% más riesgo de recurrencia de FA tras la intervención, riesgo que se mantuvo tras ajustar por tamaño auricular e índice de masa corporal30,31.
El tratamiento con CPAP nuevamente ha mostrado que previene significativamente los episodios de FA paroxística en pacientes con SAHOS moderado a grave; un meta análisis mostró un 42% menos de riesgo de desarrollar FA en aquellos tratados, y así mismo otros estudios han hallado dos veces menos riesgo de recurrencia posterior a cardioversión eléctrica y tratamiento con CPAP32,33 y que pacientes con SAHOS tratados con CPAP tenían el mismo riesgo de recurrencia después de ablación con catéter que aquellos sin SAHOS también sometidos al procedimiento34.
Flutter auricularNo es clara la prevalencia de SAHOS en pacientes con flutter auricular típico; no obstante, en un estudio publicado por Bazan et al. con 56 pacientes sometidos a ablación con catéter de itsmo cavotricuspídeo se documentó una frecuencia de 82% de SAHOS y 45% de SAHOS grave; se observó menor riesgo de FA de novo post procedimiento en el seguimiento a un año, sugiriendo también la necesidad de tamizaje de SAHOS en este grupo de pacientes35.
Arritmias ventriculares y falla cardíacaSe conoce que las arritmias ventriculares ocurren predominantemente durante los periodos de apnea-hipopnea18. Guilleminault et al. reportaron una incidencia del 5 al 60% de arritmias ventriculares en pacientes con SAHOS, incluso en pacientes con FEVI conservada12. En el SHHS, el 76% de las arritmias ventriculares fueron TVNS (la mayoría en fase no-REM)13, extrasístoles ventriculares bigeminadas, trigeminadas y cuadrigeminadas con una prevalencia de 4,8 vs. 0,9% en controles (OR 1,74; 95% IC 1,11–2,74), predominando en SAHOS grave. Otro estudio derivado de esta cohorte determinó que hay tres veces más riesgo de TVNS y dos veces más de extrasistolia ventricular compleja en pacientes con SAHOS. Sin embargo, otro metaanálisis publicado en 2014, encontró que los estudios hasta la fecha eran demasiado heterogéneos para poder establecer una relación de causalidad entre el SAHOS y las arritmias ventriculares36.
Por otro lado, es importante tener en cuenta la alta frecuencia de SAHOS en pacientes con falla cardiaca (hasta el 80%) debido a sus diversos mecanismos fisiopatológicos37 y que el tratamiento del SAHOS en esta población se ha asociado con mejorías en la tensión arterial, FEVI, calidad de vida y también en la frecuencia de arritmias cardíacas38–40. En aquellos con falla cardíaca portadores de dispositivos implantables también hay datos que muestran que el SAHOS es predictor independiente de arritmias ventriculares nocturnas y de administración de descargas apropiadas del CDI durante el sueño41.
Arritmias por alteración en el intervalo QTEn pacientes con SAHOS moderado a grave, el intervalo QT corregido, así como su grado de dispersión (diferencia entre QTc mayor y QTc menor) se incrementan conforme aumenta el IAH; esto refleja un alza en la heterogeneidad de la repolarización ventricular, que predispone a la aparición de potenciales tardíos y de taquicardia ventricular polimórfica, sobre todo entre las 10 pm y 6 am. Algunos estudios muestran mejoría notable en la dispersión del QTc y en la variabilidad de la frecuencia cardíaca tras tratamiento con CPAP20,42–44.
BradiarritmiasLa prevalencia de BAV de segundo y tercer grado, el paro sinusal y el bloqueo sinoatrial, varía ampliamente, con cifras que van del 5 al 50% y nuevamente se encuentra una relación directamente proporcional a la gravedad de la enfermedad12,45,46.
Este tipo de arritmia es más frecuente en la fase REM del sueño, ocurre casi exclusivamente durante los episodios de apnea o hipopnea y a mayor hipoxia existe mayor desinhibición vagal, pausas sinusales más prolongadas y bradiarritmias más severas32,47,48. Para reforzar la relación causa-efecto entre el SAHOS y las bradiarritmias, algunos estudios han mostrado reducciones hasta del 80 al 90% con el uso del CPAP por pocas noches, con mayor beneficio con uso a largo plazo, efecto que se pierde tras la suspensión del tratamiento46.
Mortalidad y SAHOSEs claro que los pacientes con SAHOS no tratado tienen mayor prevalencia de arritmias y eventos cardiovasculares fatales y no fatales en comparación con pacientes sanos, desenlaces que concuerdan con la gravedad de la enfermedad9. El riesgo relativo de muerte súbita en pacientes con SAHOS incrementa 2,57 veces desde las 12 am hasta las 6 am (RR 2,57; 95% IC 1,87–3,52)24, período que coincide con la transición entre sueño y vigilia, en el que hay aumento de la actividad simpática. Gami et al. encontraron que el 46% de los pacientes con SAHOS que murieron por causa cardiovascular lo hicieron en ese lapso49; no obstante un estudio del mismo autor, que evaluó los factores asociados con muerte súbita en 10.701 pacientes, mostró que dentro de los factores de riesgo que mejor predecían la muerte súbita en los pacientes con SAHOS se encontraban la enfermedad coronaria (HR=5,88, IC 95% 3,64-9,48), la miocardiopatía o la falla cardíaca (HR=7,2, IC 95% 4,71-11) y las ectopias ventriculares/ TVNS (HR=4,08, IC 95% 1,64-10,14)50.
ConclusionesEl SAHOS es una enfermedad con repercusiones multisistémicas, con afección especial en el sistema cardiovascular, tanto en su estructura anatómica como electrofisiológica, lo que condiciona y explica su relación con diferentes tipos de arritmias cardíacas, las cuales aumentan considerablemente la morbilidad y deterioran la calidad de vida del paciente. En vista de lo anterior es claro que es necesario identificar y tratar de forma óptima estos pacientes, teniendo en cuenta la mejoría en el control arrítmico demostrada en varios estudios, en especial para fibrilación auricular. Adicionalmente, se requieren más estudios que exploren de manera directa la asociación entre el SAHOS y las arritmias ventriculares, que permitan esclarecer los hallazgos en estudios previos respecto a otras arrtimias ventriculares.
FinanciaciónNinguna
Conflictos de interésNinguno.